Abridged version
In a context of global atmospheric changes, the knowledge of plant responses to climate-dependent factors such as temperature or water availability gains a new interest. Besides regional factors such as temperature and rainfall, local variables such as topography or soil properties may alter temperature and water availability at a finest scale and then drive species responses and distribution. At that local scale, plant community composition locally matters due to the biotic interactions occurring between a focal species and the vegetation that cover the most area in this community. Dominant vegetation can cause microclimatic improvement or water resource variation, increasing or buffering heat waves effects for subordinate species, and can release allelopathic compounds in the surrounding environment from above and below the ground parts.
Although modelling investigations have shown a strong decrease of the distribution area for mesophilous tree species such as Fagus sylvatica at the global scale, the impacts of local-dependant factors on Fagus are still questionable. The stage of plant recruitment is of primary importance to warrant the persistence of trees over decades in ecosystems. This dynamic of germination success and of seedling growth may have strong consequences at the warm margin of species distribution area, where changes in climate may induce various species responses. Our objectives were to test the effects of climate-driven factors on germination and seedling growth of Fagus, and to assess whether the dominant vegetation around may alter recruitment processes through chemical interaction. To our knowledge, allelopathic effects in interaction with climate change have poorly been investigated, whereas it has been shown that a plant in stressful environments may be more susceptible to chemical compounds.
In a controlled experiment, we tested the influence of temperature constraint (temperate or warm), of soil water availability, and of allelopathic chemical interactions from different forest species on the germination and early growth of Fagus sylvatica.
One hundred and twenty-eight Fagus vernalized seeds were sown in 432 pots (four seeds per pot) filled with a substrate constituted from 50% natural sandy soil from Ciron Valley (Gironde, Nouvelle-Aquitaine, France) were Fagus trees can be found, and 50% from commercial river sand. Three experimental treatments with 18 replications for each modality were applied to the pots. Two contexts of temperature were simulated: one temperate (Tpr) experiencing a daily maximal temperature of 15 to 20 °C, and one warm (“chaud”, Chd) experiencing a daily maximal temperature of 20 to 27 °C during a simulation of an extreme event. Two levels of watering were applied twice a week, to simulate a drought effect (simple watering = 20 mL) or a wet condition (double watering = 40 mL). Six modalities of foliar extract were done: five with foliar extracts from different forest species (Fagus sylvatica, Hedera helix, Pinus pinaster, Quercus robur, Ruscus aculeatus) and one control with water only. Extracts were prepared from a 48-h maceration of leaves from each of the different species and were applied twice a week on the pots.
During a period of 3–19 days after hydration of the Fagus seeds, the germination rates were first improved by relatively warm temperatures (TChd; Tmax = 20 °C). When temperatures became hot (Tmax = 27 °C) in that temperature context (TChd), germinations were inhibited during this period of 13 days. This inhibition was reversible since germination rates increased again when temperature returns to a Tmax of 20 °C and was comparable to germination rates in temperate conditions of germination (TTpr). Overall, the cumulated germination rates were more important in temperate conditions (TTpr), where the temperature was more stable and moderate than in warm conditions (Tchd). Inhibition of germination occurred in warm conditions only. Germinations rates of Fagus seeds watered by Hedera helix foliar extracts were always lower than those of the control or of the ones watered by Quercus robur extracts.
Fagus seedling survival decreases under warm and dry climatic constraints. For seedlings growth, a complex three-way interaction occurred between the ecological factors tested. In temperate conditions, seedlings were slightly affected by foliar extracts: the foliar extract of Hedera helix in double-watering conditions increased significantly the growth of Fagus seedling growth, compared to the foliar extract of Quercus robur provided in dry conditions (simple watering). Under heat constraint, the positive effect of double-watering conditions on Fagus seedling growth exposed to foliar extract of Hedera helix disappeared; the foliar extract of Pinus pinaster in double-watering conditions increased significantly the growth of Fagus seedlings compared to the foliar extract of Quercus robur and Ruscus aculeatus experiencing water shortage (simple watering).
Our results suggest that both climatic and chemical interactions act on Fagus recruitment, but not at the same age of development. The identity of plant extract matters, suggesting the importance of local plant community types in the early stage recruitment dynamic of Fagus. Temperature and allelopathy are important at the germination stage (germination and growth of seedlings), whereas temperature and water availability regulated Fagus sylvatica seedling survival and growth. Allelopathy does not induce mortality, conversely to the conjunction of warm temperature and drought conditions. The foliar extract of Hedera helix showed the highest allelopathic effect on Fagus recruitment. Climate-driven factors interplay with chemical interactions when plants are stressed by abiotic factors.
1 Introduction
La compréhension de l’impact des changements climatiques sur la régénération des essences forestières est un enjeu majeur pour appréhender la dynamique des écosystèmes forestiers peu anthropisés. À l’échelle biogéographique, l’effet des changements climatiques se traduit à large échelle, notamment par une « thermophilisation » de la végétation en montagne qui favorise les plantes des milieux les plus bas en altitude [1]. Des variables plus locales telles que la sécheresse édaphique et les interactions biotiques restent insuffisamment prises en compte, malgré leur importance bien identifiée pour prédire la distribution fine des espèces végétales [2]. À l’échelle biogéographique, la sécheresse édaphique et les interactions biotiques peuvent même expliquer une grande part de la persistance des plantes pérennes en marge arrière d’aire de distribution [3]. Un défi important dans la compréhension du rôle des changements climatiques réside donc dans une meilleure intégration des facteurs locaux (à l’échelle des communautés végétales) par rapport à des processus globaux tels que les gradients thermiques aux échelles latitudinales ou altitudinales. La confrontation de l’effet de ces différents facteurs et de leurs interactions est particulièrement pertinente pour les essences forestières qui structurent l’habitat pour de nombreuses espèces associées.
Les interactions entre végétaux par modification de l’habitat ou de la disponibilité en eau sont susceptibles, par exemple, d’augmenter les effets des vagues extrêmes de chaleur ou de les tamponner [4]. Bien que moins étudiées, les interactions par libération de substances biochimiques dans l’environnement (allélopathie) peuvent également jouer un rôle important, notamment dans les écosystèmes forestiers [5], où des quantités importantes de composés phénoliques issus du feuillage et de la décomposition de la litière peuvent être libérées [5,6]. Ainsi, des composés libérés par des espèces arborées ou du sous-bois peuvent modifier la germination et l’installation des espèces ligneuses, et orienter la régénération forestière de manière différente des réponses attendues au réchauffement climatique [6].
Parmi les essences forestières européennes, le hêtre (Fagus sylvatica) occupe 11 % du volume du parc forestier français, derrière les chênes [7]. En France, il est présent dans les zones montagneuses jusqu’à 1700 m d’altitude, où il caractérise notamment l’étage montagnard [8]. En basse altitude (< 350 m), il se trouve essentiellement dans le Nord et l’Est de la France, montrant ainsi deux marges d’aires de répartition : le Sud-Est méditerranéen, d’une part, et une frange sud-ouest correspondant au Bassin aquitain et au piémont méridional du Massif central [9].
Fagus sylvatica est particulièrement sensible à la température [10,11] et aux ressources en eau [11]. Essence mésophile, son optimum climatique se situe alors au milieu d’un gradient sécheresse–humidité et sa sensibilité à la sécheresse est le facteur limitant son aire de répartition dans le Sud-Ouest et le Sud-Est de l’Europe [12]. Par conséquent, il serait l’une des essences forestières les plus touchées par le réchauffement climatique [10] et par la réduction des précipitations attendues, bien que les différents types de modèles soient relativement peu concordants dans leur prédiction [2].
En ce qui concerne la température, une température annuelle de 4,5–6 °C est idéale pour le bon développement de l’espèce avec une moyenne du mois le plus chaud qui peut être de l’ordre de 13 à 20 °C [13]. Selon Rameau et al. [14], cette essence nécessite des précipitions annuelles supérieures à 750 mm et est favorisée par une humidité atmosphérique élevée. D’autres auteurs donnent des valeurs similaires et définissent des précipitations de l’ordre de 600–1000 mm comme minimales pour cette espèce [13]. En termes de croissance, une réduction de l’humidité relative de 40 % a entraîné une réduction de la croissance de la biomasse de 60 % des jeunes plantules en chambre climatique [12]. Aussi, lors de leur expérimentation in situ, Lendizion et Leuschner [12] ont mesuré une diminution de 30 % de la croissance en biomasse des jeunes plants âgés de deux mois pour une réduction de l’humidité de l’air de 15 %. Topoliantz et al. [15] ont confirmé l’importance de la sécheresse comme facteur important dans la mortalité des plantules lors de la régénération du hêtre. En revanche, même si très peu d’études montrent un effet direct des températures sur la germination et la croissance des plantules de hêtre, l’augmentation des températures prédites devraient amplifier la sécheresse notamment lorsqu’elles ne seront pas accompagnées par une augmentation des précipitations [16].
À l’échelle des communautés végétales, les forêts planitiaires à hêtre de la frange sud-ouest se rattachent, notamment aux hêtraies-chênaies atlantiques acidiphiles à houx, ainsi qu’aux hêtraies-chênaies atlantiques à mélique uniflore et aspérule odorante [14]. Plus localement, des peuplements à hêtres isolés jouxtent l’immense forêt à pin maritime (Pinus pinaster) du plateau landais [17]. Au niveau floristique, ces forêts sont notamment caractérisées et dominées par le hêtre, le chêne pédonculé (Quercus robur), et en sous-bois par le fragon petit-houx (Ruscus aculeatus) et le lierre grimpant (Hedera helix). Les températures hivernales relativement douces, le déficit hydrique et les températures élevées estivales qui prévalent dans le Sud-Ouest atlantique ne semblent pas optimales pour le hêtre et sont susceptibles d’engendrer sa régression.
L’objectif de cette étude est de tester en conditions contrôlées l’effet de deux facteurs climatiques (température, précipitations) et des interactions allélopathiques des espèces forestières ligneuses principales (Fagus sylvatica, Pinus pinaster, Quercus robur, Hedera helix et Ruscus aculeatus) sur la régénération précoce du hêtre, aux stades de germination et de croissance post-germinative à 40 jours. Plus particulièrement, l’étude consiste à évaluer (a) dans quelle mesure les contraintes physiques liées au stress hydrique et aux températures extrêmes altèrent la germination et la croissance des plantules de hêtre et (b) si le potentiel allélopathique de certaines plantes dominantes dans les écosystèmes peut modifier la réponse du hêtre à ces contraintes climatiques.
2 Matériel et méthodes
2.1 Système d’étude
2.1.1 Matériel biologique
Les faînes de hêtre (Fagus sylvatica L.) proviennent d’un lot de graines récoltées en octobre 2014 par l’Office national des forêts (ONF) dans la forêt de Faye (Jura), c’est-à-dire en cœur d’aire de répartition biogéographique du hêtre. La levée de dormance a été accomplie par la sécherie de la Joux (Jura) et les faînes ont été stockées à −5 °C. La viabilité du lot a été estimée à 74 % par un test au tétrazolium. Avant le début de la manipulation, le substrat de culture a été saturé en eau par capillarité pour permettre l’imbibition des faînes nécessaire au démarrage de la germination. La réhydratation a été effectuée à température ambiante pendant trois jours, et a conduit à un début précoce de germination avant l’application des différentes modalités expérimentales sur 39 % des faînes.
Le potentiel allélopathique de quatre espèces structurantes des forêts de marge arrière de distribution du hêtre a été testé sur la germination des faînes de hêtre, de même que la toxicité du hêtre sur sa propre germination. Des feuilles de cinq espèces : hêtre (Fagus sylvatica [Fs]), pin maritime (Pinus pinaster [Pp]), chêne pédonculé (Quercus robur [Qr]), lierre grimpant (Hedera helix [Hh]) et fragon petit-houx (Ruscus aculeatus [Ra]) ont été récoltées en mars 2015 dans un peuplement à hêtre de la vallée du Ciron et sa pinède maritime adjacente (site de « Cazeneuve sud », département de la Gironde ; 44,381006°/−0,3092291° ; altitude = 60 m). L’abondance relative (coefficient d’abondance-dominance de Braun–Blanquet) de ces espèces dans le site « donneur » est la suivante : Fs = 4 ; Pp = 4, Qr = 1 ; Hh = 2 ; Ra = +. Ces espèces ont été testées du fait de leurs types biologiques contrastés, de leur fréquence d’association et de leur abondance potentielle dans les forêts à hêtre de marge arrière de distribution (observations personnelles et analyse de groupement réalisée sur 43 relevés phytosociologiques du sud-ouest de la France ; Tableau 1). Les extraits foliaires des espèces caducifoliées (Fs, Qr) ont été réalisés à partir de feuilles faiblement dégradées issues de la litière nouvelle (horizon OLn, [18]), prélevées sur au moins trois microsites différents distant d’au moins 20 m. Pour les espèces sempervirentes (Hh, Ps, Ra), les extraits ont été préparés à partir de feuilles échantillonnées sur au moins trois individus différents distants d’au moins 20 m puis séchées pendant 7 jours à 60 °C. Les extraits ont été préparés par macération de 50 g de matière biologique sèche dans 500 mL d’eau distillée, (et renouvelés tous les 15 jours au maximum à partir de la même source de matériel végétal). La solution obtenue après macération pendant 48 h à l’obscurité et à température ambiante a été filtrée par un entonnoir muni d’un filtre de maille 1 mm, puis stockée à 4 °C entre chaque utilisation.
Principales caractéristiques des espèces testées pour leurs interactions allélopathiques avec les faînes de hêtre (Fagus sylvatica) : nomenclature et types biologiques des espèces (Tela Botanica 2018).
| Hedera helix Hh | Fagus sylvatica Fs | Pinus pinaster Pp | Quercus robur Qr | Ruscus aculeatus Ra | |
| Famille | Araliaceae | Fagaceae | Pinaceae | Fagaceae | Asparagaceae |
| Type biologique | Liane | Arbre | Arbre | Arbre | Sous-arbrisseau |
| Type de canopée | Sempervirent | Caducifolié | Sempervirent | Caducifolié | Sempervirent |
| Fréquence d’association avec Fagus sylvatica | 0,98 | 1,00 | 0,00 | 0,35 | 0,83 |
| Caractéristiques biogéographiques | Collinéen, subméditerranéen et subatlantique | Collinéen subatlantique et montagnard | Méditerranéo-atlantique | Collinéen subatlantique | Méditerranéo-atlantique |
2.1.2 Traitements expérimentaux
Les contraintes climatiques testées ont été thermiques (augmentation de température en enceinte climatique) et hydriques (sécheresse par déficit d’arrosage).
Deux situations climatiques ont été recréées dans des enceintes thermostatées (Snijders LABS, Microclimat-Series) pour lesquelles températures, hygrométrie, photopériode et intensité lumineuse ont été contrôlées. Les paramètres thermiques ont été définis sur la base des données de Météo France des mois de mars et avril 2000–2010 à Besançon (cœur de l’aire de distribution du hêtre) et Bordeaux (marge d’aire de distribution du hêtre), de manière à simuler, d’une part, une situation d’optimum climatique avec augmentation progressive de la température de 10,4 à 18 °C diurne (contexte thermique tempérée) et, d’autre part, une situation plus chaude de 12,4 °C à 21 °C combinée à une montée importante et temporaire de température à 27 °C pendant 3 jours (contexte thermique chaud). Les durées quotidiennes d’éclairement ont été fixées à 12 h en mars et 13 h en avril de façon à correspondre aux photopériodes moyennes des deux mois d’expérimentation. Le degré d’hygrométrie des enceintes climatiques était de 60 %.
L’influence de la pluviométrie a été testée au sein de chaque condition climatique en utilisant deux modalités d’arrosage appliquées deux fois par semaine. Une modalité « double », correspondant à un niveau relativement important d’arrosage, et une modalité « simple » qui vise à simuler une situation de stress hydrique. Les quantités d’eau initialement fixées à 20 et 10 mL ont ensuite été ajustées au cours de la manipulation en fonction de l’humidité du sol observée afin de conserver la différence hydrique souhaitée. Cette proportion d’arrosage du simple au double est cohérente avec la variation de pluviométrie annuelle observées dans les hêtraies du dispositif de suivi national forestier « Renécofor », entre la zone biogéographique la plus sèche (Nord de la France, 662 mm/an) et la plus humide (Sud-Ouest de la France, 1242 mm/an ; [19]).
Les effets allélopathiques comportent six modalités expérimentales, correspondant aux cinq extraits foliaires préparés (Fs, Hh, Pp, Qr, Ra) ainsi qu’une modalité témoin (TE) contenant de l’eau distillée. Un millilitre d’extrait a été appliqué sur chaque faîne deux fois après le traitement d’arrosage.
2.2 Dispositif expérimental
Les faînes (n = 1728) ont été numérotées, pesées puis disposées par quatre dans des pots de 769,5 cm3 (n = 432 unités expérimentales). Les 432 pots ont été remplis d’un même mélange de 50 % de sable de rivière et de 50 % de sol non autoclavé pour conserver mycorhizes et microorganismes du sol, prélevé dans le site de Cazeneuve sud.
Une modalité pour chaque traitement (climat, arrosage, extrait) a été attribuée aléatoirement à chacun des pots (18 répétitions pour chaque modalité). Pour chaque situation climatique, nous avons conditionné trois plateaux de douze pots par extrait, dont six pots pour chaque modalité d’arrosage.
L’observation de chaque faîne ainsi que l’arrosage suivi de l’application de l’extrait ont été réalisés deux fois par semaine. Quarante jours après l’observation de la percée du germe (± deux jours en cas de week-end), faînes et plantules ont été prélevées, séchées (3 jours à 60 °C), puis pesées. La manipulation s’est déroulée du 30 mars [jour julien 89] au 30 juin [jour julien 181], soit une durée totale de 92 jours.
2.3 Variables et traitements statistiques
2.3.1 Variables
Avant la disposition des pots dans les enceintes climatiques, 143 faînes ont germé pendant la réhydratation. Ces faînes ont été retirées du calcul du taux de germination (1), mais ont été utilisées pour le calcul du taux relatif de croissance (2), car le stade de germination observé n’induisait pas encore de croissance de la plantule, mais seulement la percée du tégument de la faîne.
Le taux de germination par pot a été calculé :
| (1) |
Le calcul du taux de croissance relatif (RGR) à 40 jours est réalisé pour chaque faîne ayant germé :
| (2) |
Toutes les faînes ayant germé ont été utilisées pour le calcul du taux de survie. Les graines ont été considérées comme survivantes lorsqu’elles avaient un RGR positif. Les tests statistiques sur la croissance ont été effectués uniquement sur les graines survivantes.
2.3.2 Analyse des données
L’intégralité des analyses statistiques a été effectuée à l’aide du logiciel R version 3.2.2.
Les valeurs de taux de germination étant exprimées par des pourcentages, les conditions de normalité et d’homoscédasticité ne pouvaient être respectées, une régression linéaire généralisée (fonction glm) de la loi de Poisson a donc été utilisée pour tester l’effet de chaque facteur (température, arrosage et extrait) et leurs interactions.
Afin de vérifier si la masse initiale contrôle la capacité germinative, une analyse de variance (Anova) à un facteur a été réalisée sur la masse initiale entre les graines ayant germé et les graines n’ayant pas germé. On observe un effet de la masse initiale sur la germination (moyennes graines germé et non germé respectives totales : 224,0 mg et 212,9 mg, P < 0,001). Une Anova a été réalisée pour vérifier l’absence de différence de masse initiale entre les différentes modalités expérimentales (p = 0,136).
Le taux de survie des individus a été analysé à l’aide de régressions linéaires généralisées de loi binomiale (0 pour les individus morts et 1 pour les individus survivants).
Puis, afin de hiérarchiser l’importance relative de chacun des facteurs responsables de la masse finale du matériel végétal (faînes ayant germé mais sans croissance, ou plantules), des régressions linéaires ont été réalisées pour chaque facteur et leurs interactions en complément de l’application du meilleur modèle par la fonction AIC. Les valeurs de RGR ont été analysées à l’aide de régressions linéaires généralisées de loi gaussienne.
Des tests de comparaisons multiples ont été réalisés pour identifier les différences entre modalités des facteurs lorsqu’un effet était significatif. Lorsque l’interaction à trois voies était significative, les tests de comparaisons multiples ont été réalisés sur une nouvelle variable de type facteur (24 modalités) correspondant à chaque modalité de la triple interaction.
3 Résultats
3.1 Germination
L’observation des pourcentages cumulés de germination des graines de hêtre en fonction des jours indiquent des cinétiques de germination différentes selon le contexte thermique (Fig. 1). Entre le premier et le troisième jour, la germination est très rapide, les deux pentes sont très prononcées et les courbes sont superposées. La diminution de températures opérée dans la chambre tempérée se traduit par un plus faible taux de germination de hêtre alors que la chambre chaude permet un nombre de germinations assez régulier, avec un pourcentage cumulé supérieur (respectivement 21,1 % contre 26,8 % à J12, (Fig. 1)). Entre le 19e et 32e jour, la germination est nulle dans la chambre chaude qui a connu un pic de température, puis de nouvelles germinations sont observées au retour des conditions de départ. Pour la chambre tempérée, la cinétique de germination est homogène durant l’ensemble de l’expérimentation. Au total, 226 germinations, soit 45,6 % dans la chambre chaude contre 268 germinations soit 54,4 % dans la chambre tempérée, ont été dénombrées (Fig. 1). Des températures modérées sont donc significativement plus favorables à la germination que des températures chaudes (p = 0,046 ; Fig. 2 et Tableau 2).
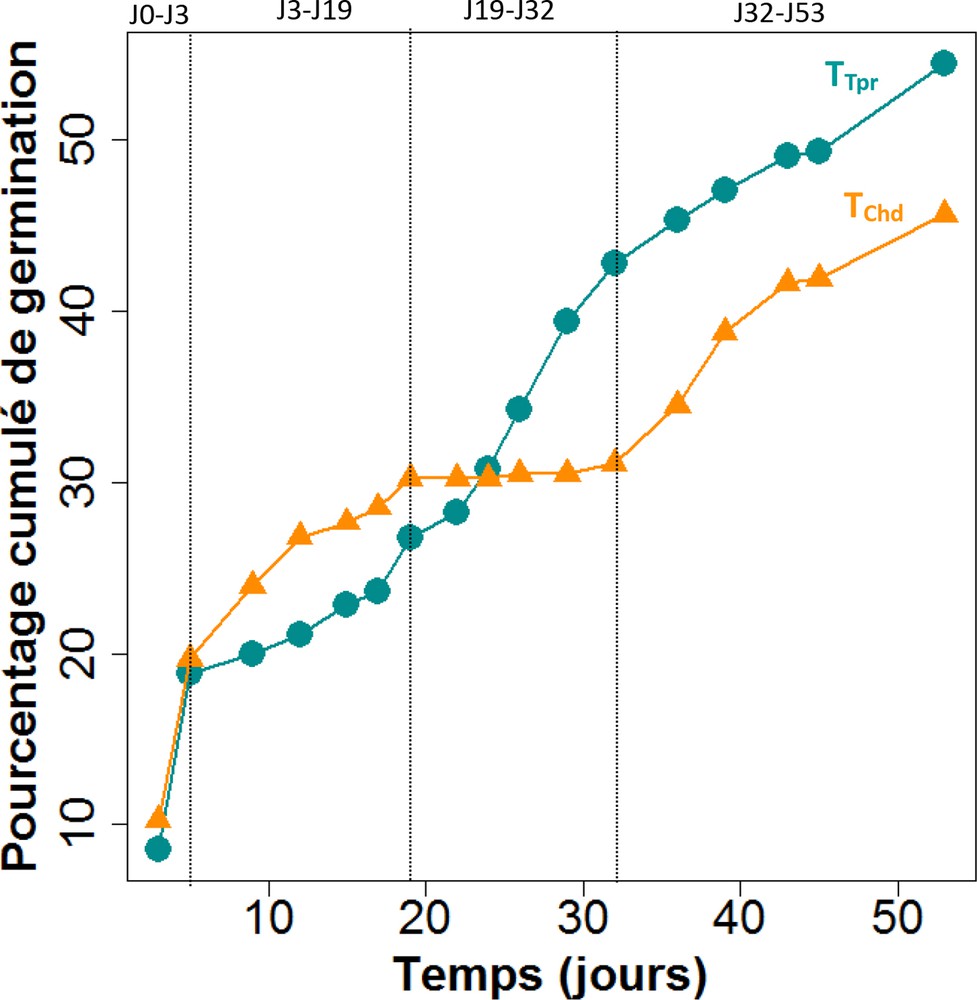
Cinétique de germination cumulée de faînes de hêtre en fonction de la température (T) en laboratoire. Ronds bleus : conditions tempérées (TTpr ; n = 864 faînes). Triangles orange : conditions chaudes (TChd ; n = 864 faînes). Jours 0–3 : T = 20 °C pour les deux lots. Jours 3–19 : TTpr = 14,6 °C max ; TChd = 20,4 °C max. Jours 19–32 : TTpr = 15,5 °C max ; TChd = 27 °C max. Jours 32–53 : TTpr= TChd = 20 °C.
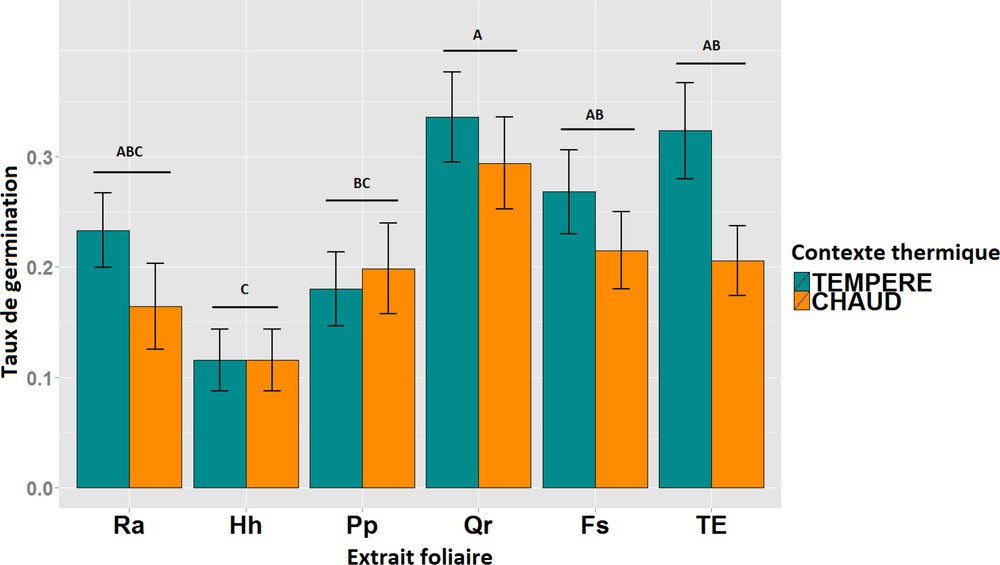
Moyenne et écart-type du taux de germination des graines de hêtre pour deux conditions thermiques et soumis à des extraits foliaires de cinq espèces : (Ra : Ruscus aculeatus, Hh : Hedera helix, Pp : Pinus pinaster, Qr : Quercus robur, Fs : Fagus sylvatica et TE : témoin). Des lettres différentes indiquent des moyennes significativement différentes (p < 0,05) entre les modalités du facteur « extrait foliaire ».
Résultats des analyses de variances à trois voies (« température », « arrosage », « extrait foliaire »).
| Taux de germination | Mortalité | Croissance | |||||||
| dL | Chisq | p value | dL | Chisq | p value | dL | Chisq | p value | |
| Anovas trois voies | |||||||||
| Température | 1 | 3,98 | 0,046* | 1 | 58,03 | < 0,001* | 1 | 0,01 | 0,216 |
| Arrosage | 1 | 1,45 | 0,229 | 1 | 0,36 | 0,547 | 1 | 12,31 | 0,005* |
| Extrait foliaire | 5 | 30,95 | < 0,001*** | 5 | 4,75 | 0,447 | 5 | 2,05 | < 0,001* |
| Température × Arrosage | 1 | 1,82 | 0,111 | 1 | 4,78 | 0,028* | 1 | 0,84 | 0,897 |
| Température × Extrait foliaire | 5 | 3,61 | 0,608 | 5 | 4,63 | 0,463 | 5 | 7,72 | < 0,001*** |
| Arrosage × Extrait foliaire | 5 | 8,96 | 0,178 | 5 | 5,67 | 0,339 | 5 | 1,38 | 0,304 |
| Température × Arrosage × Extrait foliaire | 5 | 1,53 | 0,909 | 5 | 3,65 | 0,600 | 5 | 1,13 | 0,005** |
L’application des extraits foliaires influence le taux de germination (p < 0,001 ; Tableau 2) du hêtre, mais seul un extrait le diminue significativement par rapport au témoin (TE). L’extrait d’Hedera helix est le plus inhibiteur avec une réduction de moitié du taux de germination. Un taux similaire à celui du témoin est obtenu avec la préparation de Quercus robur (Qr), taux significativement plus élevé que ceux obtenus avec le lierre (Hh) et le pin maritime (Pp ; Fig. 2).
3.2 Mortalité
La mortalité des faînes augmente significativement avec la température (p < 0,001 ; Tableaux 2 et 3). À arrosage similaire normal (arrosage double), le taux de survie des faînes ayant germé est deux fois plus important en chambre tempérée (82,0 %) qu’en chambre chaude (42,0 %). En outre, on observe une action négative conjointe de la chaleur et de la sécheresse (p = 0,028 ; Tableaux 2 et 3) : le taux de survie des graines après germination est largement supérieur en chambre tempérée avec un arrosage double (82,0 %) comparé à la chambre chaude en situation de stress hydrique (29,0 %). En proportions totales, 38,3 % (arrosage double) et 36,2 % (arrosage simple) des faînes survivent en conditions tempérées contre 16,1 % (arrosage double) et 9,4 % (arrosage simple) en conditions chaudes (Tableau 3).
Effet de l’interaction entre « température » et « arrosage » sur les effectifs (N) et les taux de survie des graines ayant germé.
| Température × Arrosage | ||||||||
| Température | Tempérée | Chaude | ||||||
| Double (× 1) | Simple (× 0,5) | Double (× 1) | Simple (× 0,5) | |||||
| Effectif | Taux de survie | Effectif | Taux de survie | Effectif | Taux de survie | Effectif | Taux de survie | |
| Survie | 114/139 | 108/125 | 28/98 | |||||
| (Nsurvie/Ngermées) | 82,0 % | (Nsurvie/Ngermées) | 86,0 % | (Nsurvie/Ngermées) | 42,0 % | (Nsurvie/Ngermées) | 29,0 % | |
| 114/298 | 108/298 | 28/298 | ||||||
| (Nsurvie/Nsurvie TOT) | 38,3 % | (Nsurvie/Nsurvie TOT) | 36,2 % | (Nsurvie/Nsurvie TOT) | 16,1 % | (Nsurvie/Nsurvie TOT) | 9,4 % |
3.3 Croissance
La régression linéaire sur l’ensemble des facteurs et leurs interactions avec choix du meilleur modèle (AIC) nous permet de confirmer que la disponibilité en eau accroît significativement la croissance et explique la masse finale en plus de la masse initiale (p < 0,001, R2 = 0,95).
En ce qui concerne les taux de croissance relatifs des plantules, un effet interactif à trois voies température × arrosage × extrait foliaire est significatif (p = 0,005, Tableau 2). Sans addition d’extrait foliaire, l’augmentation de la température n’a pas d’effet sur la croissance, car aucune différence de croissance n’est observée entre les situations témoin (TE ; Fig. 3). En conditions chaudes, l’effet positif de l’exposition à l’extrait de pin maritime (Pp) n’est cependant pas significatif, en comparaison des témoins (TE), à cause de la très forte variabilité de la réponse.
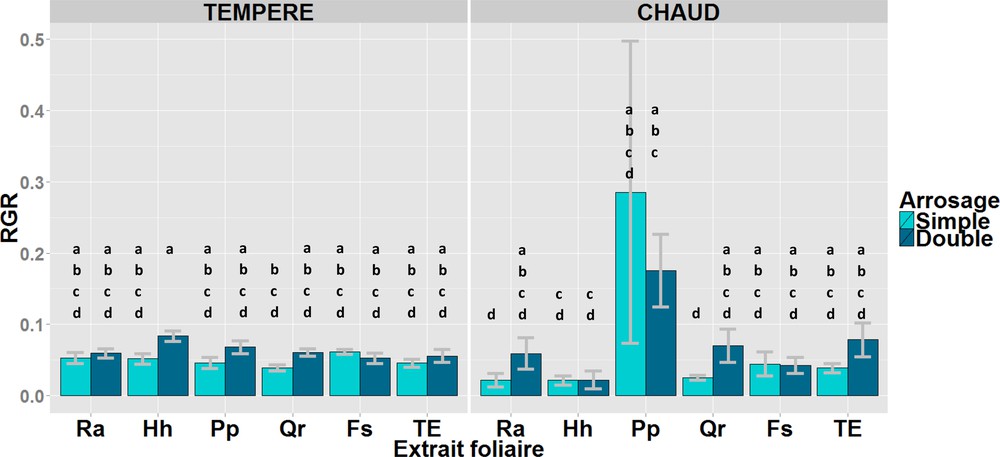
Moyenne et écart-type du taux relatif de croissance (RGR) des plantules de hêtre pour deux conditions thermiques et soumis aux extraits foliaires de cinq espèces (Ra : Ruscus aculeatus, Hh : Hedera helix, Pp : Pinus pinaster, Qr : Quercus robur, Fs : Fagus sylvatica et TE : témoin) et « arrosage ». Des lettres différentes indiquent des moyennes significativement différentes (p < 0,05) entre les modalités du facteur « extrait foliaire ».
En chambre tempérée, le taux de croissance relatif des plantules de hêtre est significativement supérieur pour un arrosage double et un extrait de Hedera helix (Hh, RGRmoyen = 0,08) par rapport à un arrosage simple et un extrait de Quercus robur (Qr, RGRmoyen = 0,04 ; Fig. 3).
En chambre chaude, le taux de croissance relatif des plantules de hêtre pour un arrosage simple et un extrait de Quercus robur (Qr) est toujours significativement inférieur à un arrosage double, mais cette fois-ci par rapport à l’extrait de Pinus pinaster (Pp ; Fig. 3). On retrouve le même résultat pour une conjugaison d’un arrosage simple et d’un extrait de Ruscus aculeatus (Ra) par rapport à un arrosage double et l’extrait de Pinus pinaster (Pp ; Fig. 3). Les taux de croissances relatifs des plantules de hêtre arrosées par des extraits de Hedera helix (Hh), quel que soit le niveau d’arrosage, restent particulièrement faibles (Fig. 3).
4 Discussion
4.1 Prééminence des facteurs d’ordre climatique sur la germination et la croissance du hêtre
Les facteurs d’ordre climatique restent une composante majeure du succès de la régénération (germination, survie et croissance) pour le hêtre : limité par des températures peu élevées, le succès de la régénération est également particulièrement sensible aux fortes températures pouvant induire des épisodes de sécheresse intense.
Des températures relativement chaudes (de l’ordre de 20 °C) améliorent sensiblement la régénération du hêtre, et notamment sa germination, par rapport à des températures inférieures de 2 à 3 °C seulement. Ceci est cohérent avec les résultats obtenus par E Silva et al. [11], qui montrent une augmentation de la régénération du hêtre le long de gradients de températures croissantes dans le Sud-Ouest de la France. L’impact de températures caniculaires, de l’ordre de 30 °C et plus, reste peu documenté. Dans notre étude, la température élevée (27 °C) a entraîné un assèchement rapide du substrat, ce qui confirme le lien indissociable entre température extrême et sécheresse. Le blocage de la germination pendant cette période extrême est cependant réversible et ne semble pas altérer la capacité germinative, puisque de nouvelles germinations ont été observées dans la chambre chaude après le retour à des températures plus modérées. Les faînes de hêtre montrent donc une capacité de résistance aux fortes températures, au moins à court terme, même si la capacité de germination se dégrade sensiblement à partir de 30 °C [20].
De nombreuses germinations ont été observées à température ambiante sur un substrat saturé en eau lors de la réhydratation, suivies d’un ralentissement progressif lors de la mise en chambre à une température inférieure. Lorsque l’humidité du sol est convenable, c’est la condition chaude qui est la plus favorable, avec un temps moyen de germination plus court. Il semble que ce soit davantage la disponibilité en eau que la température qui impacte négativement l’initiation de la germination pour des graines déjà vernalisées. Cependant, une exposition préliminaire des faînes de hêtre au froid (5 à 10 °C) pendant 45 à 90 jours en conditions humides reste nécessaire pour lever la dormance embryonnaire physiologique [20].
Il est possible que les augmentations de température prévues dans les années à venir n’affectent que peu la germination si les précipitations du printemps demeurent suffisantes [21]. Néanmoins, la diminution prévue des précipitations en été après la germination des faînes risque d’avoir un fort impact sur les juvéniles, très sensibles à une trop forte sécheresse [22]. Cette disparition pourrait être principalement causée par une sécheresse importante ou des gelées tardives ainsi que par des prédateurs de différents taxons, pouvant causer de lourds dégâts aussi bien sur les graines qu’à tous les stades de développement [13,23].
L’effet des facteurs climatiques (température et arrosage) est différent selon le stade de développement du hêtre. La température affecte le taux de germination et la survie des faînes, et son influence sur la croissance est modulée par l’arrosage et la nature de l’extrait foliaire. La disponibilité en eau n’influence pas directement le taux final de germination, et la réduction observée de la germination aux hautes températures pourrait donc s’expliquer par l’aridité édaphique et atmosphérique induite et/ou accentuée par ces fortes températures. Ensuite, la plus forte mortalité des juvéniles est observée pour les graines soumises à une température élevée et un déficit hydrique. Des limitations en eau inhibent toute germination en situation très chaude uniquement et augmentent fortement la mortalité des plantules de hêtre.
Les analyses sur la masse initiale permettent de mettre en évidence le rôle de celle-ci sur la réussite de la germination. Les faînes qui ont germé avaient une masse initiale significativement plus importante que les faînes n’ayant pas germé. Plus une faîne est grosse, plus elle possède de réserves nécessaires à son métabolisme lui permettant de résister aux stress. À la fin de la manipulation, la croissance des plantules, sensible aux températures élevées et aux sécheresses prolongées [22,24] est très souvent nulle ou négative dans la chambre chaude, toutes les réserves ont été utilisées et les plantules n’ayant pas réussi à se développer. En effet, la percée de la radicule observée pour de nombreuses faînes n’a pas été suivie par le développement d’un plant, car ces graines se sont, pour la plupart, desséchées. Au contraire, une meilleure croissance des plantules est observée en chambre froide, probablement liée à une disponibilité en eau satisfaisante. La disponibilité en eau est donc le facteur le plus déterminant dans la croissance des jeunes plantules de hêtre, et va également interagir avec la température et la présence de composés allélopathiques à ce stade de développement.
4.2 L’allélopathie, facteur local additif ?
Des facteurs locaux tels que les interactions chimiques avec les espèces dominantes des communautés végétales peuvent moduler de manière significative la germination et la croissance des plantules, mais, dans aucun des cas étudiés, ici ne provoquent leur mortalité. Des espèces comme le lierre (Hedera helix) ont un impact très négatif sur la régénération du hêtre, alors que d’autres, comme le chêne pédonculé (Quercus robur), tendent à la favoriser.
Le pH des solutions a été régulièrement mesuré tout au long de l’expérimentation ; le pH de la solution obtenue avec le lierre présente une valeur intermédiaire entre le plus acide (pH = 3,93 pour les aiguilles de pin) et le moins acide (pH = 5,91 pour les feuilles de hêtre). Il paraît donc peu probable que le pH participe aux effets inhibiteurs observés.
Le taux de germination des faînes arrosées avec des extraits de feuilles de lierre et de pin, inférieur à celui constaté sur les graines arrosées avec des extraits de feuilles de chêne ou avec le témoin, met en évidence un effet négatif des composés allélopathiques sur la germination du hêtre. L’effet allélopathique dépend de l’espèce. Alors que les deux espèces à feuilles caduques (chêne et hêtre) ne modifient pas la germination par rapport aux témoins, les deux espèces sempervirentes (lierre et pin) la diminuent. Dans notre expérimentation, le chêne et le hêtre espèces dominantes de la canopée forestière de nos peuplements ne libèrent pas de composés allélopathiques hydrosolubles. En particulier, pour le chêne, ce résultat est contradictoire avec d’autres études mettant en évidence sa capacité à exercer un effet négatif sur la germination du fait de sa richesse en polyphénols et notamment en tanins [25]. Néanmoins, Souto et al. [25] ne montre pas non plus d’effet négatif du chêne pédonculé sur la germination d’une autre espèce, Lactuca sativa. En revanche, l’effet négatif du pin est en accord avec les observations de Gallet et Pellissier [26], qui identifient les conifères comme libérateurs de certains polyphénols inhibiteurs de la germination et de l’élongation racinaire, potentiellement par un mécanisme d’augmentation de la perméabilité membranaire [27].
Il est intéressant de noter que l’effet allélopathique ne se manifeste pas par la mortalité des jeunes plants. Il est possible que la disponibilité en eau soit tellement limitante pour la survie des juvéniles que l’effet phytotoxique demeure bien moindre en comparaison du stress climatique trop intense pour ce stade de développement. Alors que nous ne mettons pas en évidence d’effet allélopathique marqué sur la survie des plantules, l’impact phytotoxique du voisinage n’est tout de même pas à négliger en milieu naturel, car la régénération naturelle du hêtre peut être inhibée par les espèces du sous-bois, surtout en période de sécheresse [28,29]. En effet, Fotelli [28,29] a montré que, sous irrigation régulière, la ronce (Rubus fruticosus) ne provoquait pas de réduction de la croissance des plantules, alors que sous stress hydrique leur croissance était inhibée. Ainsi, les interactions avec la végétation voisine intensifient les effets de la sécheresse sur les plantules de hêtre.
Alors que la disponibilité en eau joue un rôle important dans la croissance, l’interaction entre la température, l’exposition à des composés phytotoxiques et l’arrosage souligne que le potentiel allélopathique peut être modulé par les facteurs climatiques, notamment en conditions stressantes. En effet, certains auteurs mettent en évidence une plus grande libération de composés allélopathiques en cas de stress, notamment de stress hydrique [30].
L’effet du chêne pédonculé dépend fortement du stade de régénération du hêtre. L’extrait de chêne favorise la germination du hêtre par rapport au pin maritime et au lierre. En revanche, lorsque la germination a eu lieu, l’extrait de chêne diminue significativement la croissance des plantules de hêtre en condition de contrainte climatique (arrosage simple, conditions chaudes) par rapport à l’extrait de pin maritime appliqué en conditions humides (arrosage double) qui stimule cette croissance. Le contraste d’effet des deux essences forestières (chêne et pin) sur la croissance des germinations de hêtre est ainsi accentué par la dilution des composés allélopathiques. Dans notre expérimentation, le lierre présente le plus fort effet allélopathique, et ses feuilles contiennent, entre autres, 12 composés phénoliques toxiques [31] ; le potentiel allélopathique de sa litière a déjà été documenté [32]. Ici, cet effet varie en fonction du stade de développement de la plante cible (graine, plantule), mais également en fonction du contexte thermique.
La plasticité en réponse aux environnements locaux peut générer une variabilité dans les interactions allélopathiques [33]. Différents facteurs peuvent influencer la production et la toxicité des composés allélopathiques comme la disponibilité en nutriments, l’humidité du sol, la texture, la radiation lumineuse et la température. Certaines espèces peuvent également générer plus d’exsudats racinaires sous stress hydrique, et des concentrations en composés allélopathiques plus élevées ont été observées dans les feuilles d’arbustes méditerranéens en été. Compte tenu du fait que le stress est une condition environnementale qui limite la disponibilité des ressources, une relation positive entre l’intensité du stress et la production allélochimique semble logique [30]. En outre, la température du sol joue un rôle important dans la dégradation des composés allélopathiques issus de la décomposition de la litière [34]. La forte croissance des plantules en présence d’extraits d’aiguilles du pin maritime n’est pas significativement différente des autres traitements (hors Ra et Qr) probablement en raison de la très forte mortalité pour cette espèce. Les effectifs sont fortement réduits et l’hétérogénéité des réponses est très importante. On s’attendait plutôt à avoir une croissance diminuée par la présence d’extrait de pin maritime, comme l’ont montré Bolte et al. [35]. Ils expliquent la diminution de la croissance par l’allélopathie ou l’acidification du sol. En outre, dans leur expérimentation, la sécheresse a minoré l’importance des interactions négatives entre les plantules, et une interaction positive a eu lieu entre le hêtre et le chêne. Avec le changement climatique, le hêtre serait favorisé lorsqu’il est en mélange avec du chêne et désavantagé en mélange avec du pin [35].
Dans le Sud-Ouest de la France, la grande diversité des peuplements à hêtre générée par le mélange d’essences pourrait favoriser la dilution des composés allélopathiques du pin ou du chêne, par exemple, et en diminuer leurs effets. Souto et al. [25] ont montré que la diversité végétale et la richesse spécifique trouvées sous des arbres à potentiel allélopathique avéré sont significativement plus faibles que dans des parcelles adjacentes sans canopée forestière. Néanmoins, l’allélopathie pourrait aussi avoir un effet positif et expliquer en partie la persistance de certaines espèces, particulièrement en marge de distribution, où des assemblages particuliers sont observés et où un compromis entre une moins bonne survie, mais une meilleure croissance des juvéniles, peut potentiellement contrebalancer l’effet négatif du changement climatique [36]. Nous pouvons, en outre, considérer dans notre étude que les effets potentiels allélopathiques ont été sous-estimés, puisque seuls les composés hydrosolubles libérés par le feuillage ont été pris en compte. Or, les exsudats racinaires représentent l’un des plus importants apports directs de composés chimiques, et donc, probablement, la plus grande source d’intrants allélochimiques dans le sol. Par exemple, la quantité des composés allélopathiques issus des racines peut être considérée comme la plus élevée parmi toutes les parties de Juglans nigra [37] Ces composés racinaires peuvent avoir une influence directe sur la germination des graines et la croissance des semis [37–39]. Dans notre étude, Hedera helix présente la plus forte influence allélochimique sur le hêtre, mais sa biomasse aérienne et surtout racinaire étant relativement peu importante, son impact sur le hêtre en conditions naturelles restera probablement limité, comparé aux influences du pin maritime et du chêne pédonculé, caractérisés par d’importantes biomasses aériennes et souterraines.
5 Conclusion
Dans un contexte de changements climatiques, des épisodes de canicules couplés à de fortes sécheresses sont donc susceptibles d’altérer fortement la régénération du hêtre en provoquant un blocage des germinations et une mortalité importante. Cependant, les facteurs locaux à l’échelle des communautés végétales sont à même de moduler fortement la réponse de la régénération en hêtre aux facteurs d’ordre climatique, notamment via les interactions chimiques avec les espèces voisines dominantes.
Remerciements
Les auteurs remercient Édith Reuzeau et Raphaël Kubatt pour leur travail technique indispensable à la réalisation de ces expérimentations. Ce travail a été réalisé avec le soutien financier de la région Aquitaine (programme CLIMBEECH), de l’université de Bordeaux et du Labex COTE dans le cadre des Investissements d’avenir, convention attributive d’aide EquipEx Xyloforest ANR-10-EQPX-16-01.


