Abridged English version
In response to water deficit in the root area, plants react by lowering leaf water potential permitting water absorption. In general, the majority of studies using chlorophyll fluorescence are based on the Kautsky effect that occurs when the leaves are illuminated following darkness; many changes in fluorescence intensity occur in response to stress. Analysis of chlorophyll fluorescence and of photochemical as well as non-photochemical components under water deficit shows disruptions in photochemical reactions where electron transfer is blocked between Light Harvesting Complex II and PSII.
The experiment was carried out with a completely randomized plan in hydroponic culture under greenhouse controlled conditions with three treatments [control (CM0 & CT0), and two water stress levels (CM1 & CT1) and (CM2 & CT2)].
The Chemlali variety showed changes in leaf water potential () between before installation of water deficit and after 25 days of the first level of water stress (CM1), while for the second level of water deficit (CM2) varied between before and after 25 days of treatment. During the experiment, we noted a leaf water potential decrease of 21% for CM1 and 65% for CM2.
For the Chetoui variety, was before water deficit, and it decreased by 30.35 and 46.15% during CT1 and CT2, respectively.
The control values of ΦPSII of the Chemlali and Chetoui varieties were between 0.57 and 0.71 and 0.74 and 0.78, respectively.
With the Chemlali variety, we noted a high reduction of ΦPSII. At the first stress level CM1, ΦPSII decreased by 58%. For the CM2 treatment, ΦPSII was reduced by 80%. With the Chetoui variety, ΦPSII for the CT1 treatment varied from 0.74 to 0.63, and the second stress level CT2 by 21%. Thus, in both varieties the water stress caused a huge reduction in ΦPSII. Nevertheless, this reduction was bigger for the Chemlali variety.
The control values of PSII in the Chemlali variety were between 0.63 and 0.85. On the other hand, for the Chetoui variety, PSII was about 0.84. For both varieties, we note that water deficit generated an increase in PSII. For the Chetoui variety, PSII showed a low increase of 2.20% and 1.25% during CT1 and CT2, respectively, while for the Chemlali variety, the increase was 10.66 and 27.69% in the first and the second stress levels, respectively.
In the control plants, was between 30 and 35 μmol m−2 s−1 for the Chemlali variety and 42 and 49 μmol m−2 s−1 for the Chetoui variety. Under the effect of water deficit, we noticed an increase of . In the first level of water stress, increased by 65 and 55% for the Chemlali and the Chetoui varieties, respectively. In the second level of water stress, the increase reached 57 and 71% for Chemlali and Chetoui, respectively.
The qP controls varied from 0.65 to 0.69 and from 0.66 to 0.68, respectively, for the Chemlali and Chetoui varieties. During the experiment, we noted that water stress provoked an increase in photochemical quenching. In the first level of water stress, qP is increased by 16 and 11% for Chemlali and Chetoui, respectively, while in the second level of water stress, the increase reached 26 and 16% for Chemlali and Chetoui, respectively.
1 Introduction
D'une manière pratique, la majorité des études utilisant la fluorescence chlorophyllienne se basent sur l' « effet Kautsky », qui survient lorsque des feuilles actives vis-à-vis de la photosynthèse sont placées à l'obscurité, puis illuminées. Des changements dans l'intensité de la fluorescence interviennent dans le temps.
L'analyse de la fluorescence chlorophyllienne et ces composantes photochimiques et non photochimiques (rendement quantique photochimique du PSII : ΦPSII, efficience photochimique maximale du PSII : PSII, taux du transport des électrons du PSII : , quenching photochimique : qP et quenching non photochimique : qNP), sous contrainte hydrique, montre une perturbation au niveau des réactions photochimiques de la photosynthèse, avec un blocage du transfert d'électrons entre LHC II et PSII [1]. Angelopoulos et al. [2] ont démontré que la fluorescence chlorophyllienne chez l'olivier augmente à midi, spécialement pour les plantes sous contrainte hydrique.
La diminution du taux d'assimilation du CO2 dans les feuilles est associée à une inhibition de la photosynthèse, ce qui provoque une augmentation de la dissipation de l'énergie d'excitation du PSII, entraînant des photo-endommagements des centres réactionnels du PSII [3–7]. Un manque d'eau sévère provoque une légère baisse du qP et une diminution inférieure à 20% du ΦPSII [8].
Pour estimer l'efficience photochimique maximale du PSII, Jagtap et al. [9] ont montré que le déficit hydrique engendre une diminution importante du PSII chez cinq variétés de Sorghum bicolor L. Moench. En revanche, Lu et Zhang [10] n'ont observé aucun changement au niveau du PSII mesuré après une adaptation des feuilles de blé à l'obscurité sous des déficits hydriques modérés et sévères. Par ailleurs, après une adaptation à la lumière, la privation hydrique a engendré une diminution du et de l'efficience de capture des excitations photoniques au niveau des centres réactionnels ouverts du PSII, et une augmentation au niveau du PSII, du qP et du qNP.
Chez les plantes C3, quand les stomates sont fermés sous l'effet d'une contrainte hydrique et l'assimilation du CO2 réduite, la réduction photosynthétique de l'oxygène par la photorespiration augmente et sert comme consommateur de l'excès d'excitation énergétique de l'appareil photosynthétique [11]. En revanche, la réduction photosynthétique du dioxygène s'est avérée insuffisante pour la dissipation de l'excès de l'excitation lumineuse interceptée par les antennes collectrices du PSII. Sous un stress hydrique sévère, le transport des électrons du dioxygène et la diminution du quenching photochimique sont incapables de dissiper l'excès de l'énergie d'excitation, causant ainsi des photo-détériorations au niveau du PSII [12].
En étudiant le comportement de trois espèces différentes (Olea europaea L., Rosmarinus officinalis L. et Lavandula stoechas L.), Nogués et Baker [12] ont noté qu'au cours d'un stress hydrique les PSII, et qP des différentes espèces ont marqué d'importantes diminutions. De même, un stress hydrique appliqué sur des plantes CAM (Clusia minor L.) provoque une diminution de 34% du ΦPSII et une augmentation de 42% du qNP [13].
Dans ce contexte, le présent travail se focalise sur l'étude du comportement du photosystème II chez deux variétés d'olivier à huile Chetoui et Chemlali soumises à une contrainte hydrique. En effet, la connaissance parfaite de l'attitude physiologique de la plante sous des conditions hydriques déficitaires est primordiale pour tester son adaptabilité, gérer sa culture et entreprendre son amélioration génétique.
2 Matériels et méthodes
2.1 Matériel végétal et milieu de culture
L'expérimentation a été menée sous serre vitrée installée au complexe de l'Institut national polytechnique de Toulouse, à l'École nationale supérieure agronomique (France). La serre est équipée d'un système électronique informatisé contrôlant les conditions micro-climatiques. La température est réglée à 25 °C, l'humidité relative de l'air est de l'ordre de 50%, l'éclairement dans la serre est fixé à un . La photopériode est programmée à .
L'essai a été réalisé en culture hydroponique sur deux variétés d'olivier à huile (Olea europaea L. var. Chetoui et Chemlali). Les plants d'oliviers sont issus de boutures herbacées et âgées de 18 mois. Les boutures ont été enracinées sous nébulisation (à la station de Bejaoua, Tunisie). Placées sous serre, elles continuaient à croître sans problèmes particuliers moyennant des soins courants ; toutefois, trois semaines avant l'expérimentation, le substratum initial est éliminé et les plantes sont placées en culture hydroponique. Après habillage des racines, les oliviers sont placés dans des pots en plastique d'une contenance de 5 l. Chacune des deux variétés a reçu une solution nutritive standardisée et équilibrée dont la composition était la suivante : en macro-éléments (en méquiv l−1) (NO−3 : 23,96 ; SO2−4 : 11,09 ; H2PO−4 : 4,93 ; K+ : 18,62 ; Ca2+ : 10,27 et Mg2+ : 11,09) et en micro-éléments (en mg l−1) : (Fe : 5,7 ; Mn : 0,5 ; Zn : 0,06 ; Cu : 0,03 ; B : 0,54 et Mo : 0,186). Pour une bonne aération de la solution nutritive, chaque pot était muni de deux tubes de bullage, permettant une aération à une fréquence de .
On a appliqué le dispositif expérimental aléatoire complètement randomisé avec quatre répétitions. Au cours de cette expérimentation, on a entrepris trois traitements : le témoin, le niveau 1 de stress à et le niveau 2 de stress à . L'induction du déficit hydrique est réalisée par adjonction d'une quantité de polyéthylène glycol (PEG 10000) à la solution nutritive. Cette quantité est calculée à partir de la courbe tracée par Bogaert [14].
2.2 Méthodologie de travail
2.2.1 Potentiel hydrique foliaire de base
L'indicateur actuellement employé pour le diagnostique du stress hydrique est le potentiel hydrique foliaire de base (). Cette mesure représente la force avec laquelle l'eau est retenue dans la plante. Le potentiel hydrique foliaire de base est mesuré tous les cinq jours avant le lever du soleil selon la méthode de Scholander [15]. Les mesures sont effectuées avec quatre répétitions pour chaque traitement.
2.2.2 Fluorescence chlorophyllienne
Lorsqu'une feuille est mise à l'obscurité, le système photosynthétique se met au repos après quelques minutes. Si cette feuille est exposée à un flash lumineux, le système photosynthétique répond par un signal de fluorescence comportant deux phases : une phase d'augmentation très rapide de l'intensité de fluorescence d'une valeur initiale à une valeur maximale . Une deuxième phase lente et descendante de l'intensité vers un état stationnaire .
Dans les conditions ambiantes et en présence de la lumière, les centres réactionnels des photosystèmes sont fermés. Pour déterminer les niveaux d'excitation de ces photosystèmes, on mesure la fluorescence chlorophyllienne sous une lumière actinique. Cette étape nous permet d'obtenir les niveaux d'excitation minimale et maximale, dont les valeurs correspondant sont (fluorescence stationnaire) et (fluorescence maximale en présence de la lumière).
Dans le but de déterminer le quenching photochimique, la détermination du niveau d'excitation du système photosynthétique après une minute d'obscurité est nécessaire. Pour cela, on place le clip sur la surface de la feuille, pour permettre à celle-ci de s'adapter à l'obscurité. Après une minute, on excite la feuille par des photons et on mesure la fluorescence. La valeur de cette fluorescence est notée . Après avoir mesuré tous les niveaux d'excitation (, , , et ), nous avons déterminé les paramètres suivants :
- – rendement photosynthétique du PSII :
- – rendement photosynthétique maximal du PSII :
- – taux de transfert des électrons :
- – quenching photochimique :
Les mesures de la fluorescence chlorophyllienne ont été réalisées à une fréquence de 7 j. Pour chaque traitement, nous avons effectué quatre répétitions. Tout le long de l'essai, les mesures de la fluorescence ont été faites sur les mêmes feuilles, moyennant un fluorimètre du type Hansatech FMS2.
2.3 Analyses statistiques
Les données ont été traitées par le logiciel Sigma Statistical Software (Stat32.exe) Version 2.0, par l'analyse de la variance et l'analyse de la comparaison des moyennes par la méthode SNK (Student–Newman–Keuls).
3 Résultats et discussion
3.1 Évolution du potentiel hydrique foliaire de base ()
La variété Chemlali a enregistré des potentiels hydriques foliaires variant entre avant l'installation du déficit hydrique et après 25 j au premier niveau du stress hydrique CM1 (Fig. 1), alors que, pour le déficit du second degré CM2, le a varié entre avant le déficit hydrique et après 25 j de traitement. Au cours de l'essai, nous avons remarqué une baisse du de 21% pour le stress du premier niveau CM1 et de 65% pour le stress du deuxième niveau CM2. Les différences observées entre les traitements sont significatives au seuil .
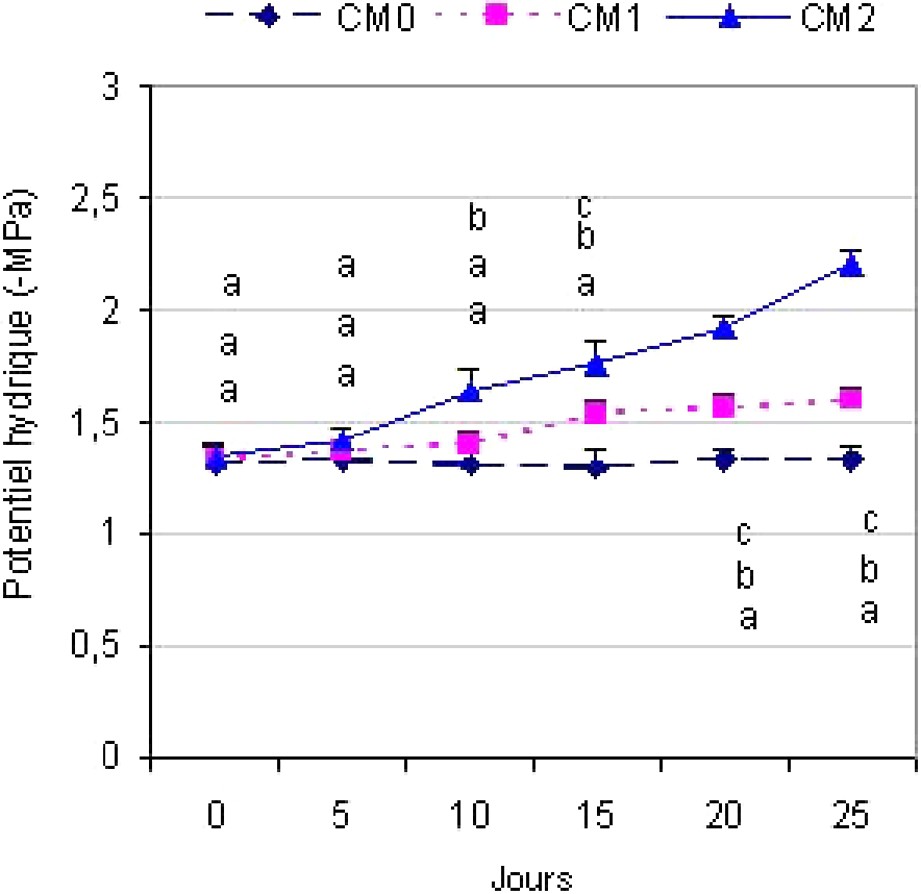
Évolution du potentiel hydrique chez la variété Chemlali. PEG0 : avant traitement par le polyéthylène glycol ; PEG5 : 5 j après le traitement ; PEG10 : 10 j après le traitement ; PEG15 : 15 j après le traitement ; PEG20 : 20 j après le traitement ; PEG25 : 25 j après le traitement. Les différences sont significatives lorsque toutes les lettres (indiquées sur les figures) qui leurs correspondent sont différentes (α=5%).
Pour la variété Chetoui, le avant l'installation de la contrainte hydrique était de l'ordre de . Après, il a marqué une diminution significative (). Concernant le stress du premier niveau CT1, le était avant et après 25 j de stress respectivement de et . Pour CT2, le était de avant la phase de déficit hydrique et a atteint une valeur de après 25 j de stress. À partir du dixième jour de déficit hydrique, les différences entre les traitements sont significatives au seuil (Fig. 2).

Évolution du potentiel hydrique chez la variété Chetoui. Légende : voir Fig. 1.
Pour répondre à un manque d'eau dans la zone racinaire, les plantes réagissent par un abaissement du potentiel hydrique des feuilles permettant l'absorption de l'eau ; c'est le phénomène d'ajustement osmotique. Le mécanisme diffère selon les espèces et les variétés au cours des périodes de stress hydrique ou salin [16,17]. Braham [18] rapporte que l'olivier abaisse son potentiel hydrique afin de surmonter une période de stress hydrique. Chartzoulakis et al. [19] ont trouvé chez des oliviers stressés une diminution du potentiel hydrique jusqu'à .
3.2 Évolution du rendement quantique du PSII (ΦPSII)
Le ΦPSII du témoin de la variété Chemlali est compris dans l'intervalle [0,57–0,71] (Fig. 3), alors que celui de la variété Chetoui est compris dans l'intervalle [0,74–0,78] (Fig. 4).

Évolution du ΦPSII chez la variété Chemlali. PEG0 : avant traitement par le polyéthylène glycol ; PEG7 : 7 j après le traitement ; PEG14 : 14 j après le traitement ; PEG21 : 21 j après le traitement ; PEG28 : 28 j après le traitement. Les différences sont significatives lorsque toutes les lettres (indiquées sur les figures) qui leurs correspondent sont différentes (α=5%). ∗ : Différences significatives (α=5%), NS : différences non significatives (α=5%).

Évolution du ΦPSII chez la variété Chetoui. Légende : voir Fig. 3.
Chez la variété Chemlali, nous avons constaté une importante réduction du ΦPSII. Au niveau du stress du premier degré CM1, le ΦPSII a chuté de 58%. Avant l'installation de la contrainte hydrique, le ΦPSII était de l'ordre de 0,73 et il a chuté après 28 jours à 0,31. Pour le traitement CM2, le ΦPSII a été réduit de 80%. Le rendement était de 0,74 avant le stress et a atteint après 28 j de contrainte une valeur de 0,15. Cette variation de ΦPSII est significative au seuil (Fig. 3).
Chez la variété Chetoui, le ΦPSII pour le traitement CT1 a varié de 0,74 avant le stress à 0,63 à la fin de l'essai. Pour CT2, le ΦPSII a diminué de 21%. La diminution du ΦPSII au cours du deuxième traitement est significative au seuil (Fig. 4).
Pour les deux variétés, le stress hydrique a causé une diminution importante au niveau du rendement quantique du PSII. Toute fois, cette réduction est plus importante chez la Chemlali. Ce même phénomène a été observé dans les travaux menés chez la vigne par Iacono et Sommer [20].
3.3 Évolution du rendement quantique maximal du PSII (Φmax PSII)
Au niveau des témoins de la variété Chemlali, les PSII sont compris dans l'intervalle [0,63–0,85] (Fig. 5). En revanche, pour la variété Chetoui, le PSII est d'environ 0,84 (Fig. 6). Pour les deux variétés, nous constatons que le déficit hydrique a engendré une augmentation significative (α = 5%) du PSII. Chez les plantes de la variété Chemlali conduits sous stress hydrique, PSII a augmenté de 10,66% et de 27,69% pour respectivement CM1 et CM2, alors que, pour la variété Chetoui, le PSII a enregistré une faible augmentation de 2,20% et de 1,25% pour respectivement CT1 et CT2. Après 28 j de stress, nous avons constaté une diminution du PSII de 8% et 26% pour respectivement CM1 et CM2 (Fig. 5).
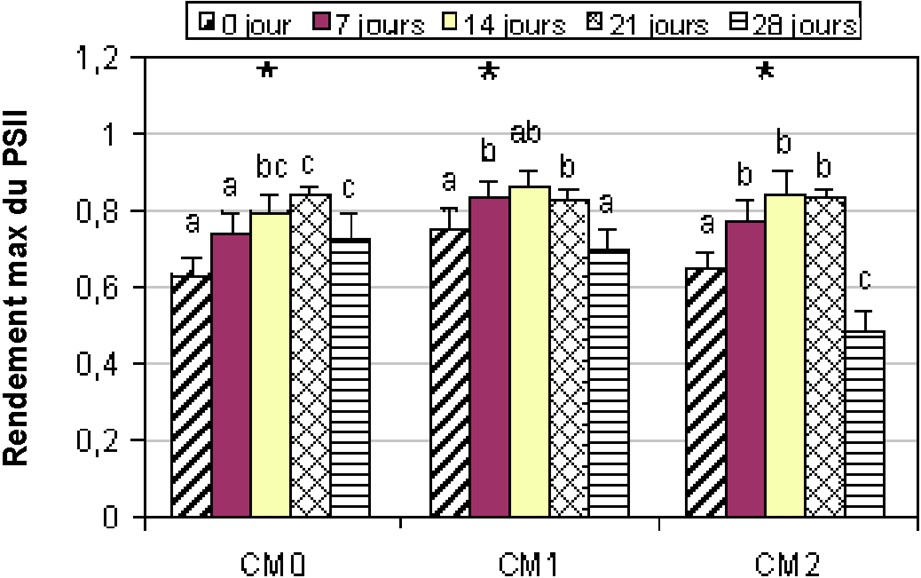
Évolution du PSII chez la variété Chemlali. Légende : voir Fig. 3.
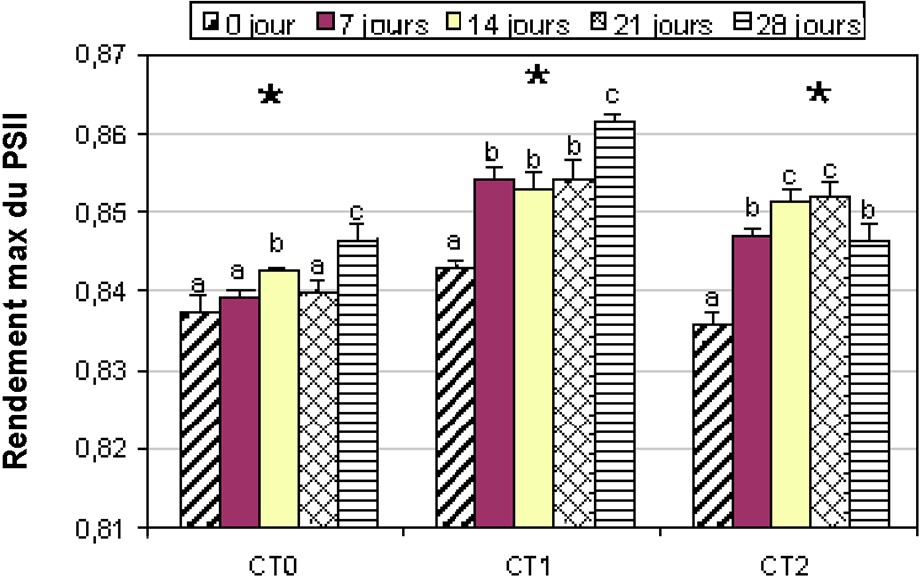
Évolution du PSII chez la variété Chetoui. Légende : voir Fig. 3.
3.4 Évolution du taux de transfert des électrons ()
Au niveau des témoins, le se situe dans l'intervalle 30–35 μmol m−2 s−1 pour la variété Chemlali et dans l'intervalle 42–49 μmol m−2 s−1. Sous l'effet du stress hydrique, nous avons remarqué une augmentation de suite à la contrainte hydrique. Au niveau du stress CM1, le a passé de 30,40 μmol m−2 s−1 avant l'installation de la contrainte hydrique à 50,09 μmol m−2 s−1 après 28 j. Et concernant le stress CM2, le a augmenté significativement () de 57%. Au début de l'essai, le était de l'ordre de 33,86 μmol m−2 s−1 et a atteint une valeur de 53,12 μmol m−2 s−1 après 28 j de la contrainte hydrique (Fig. 7).
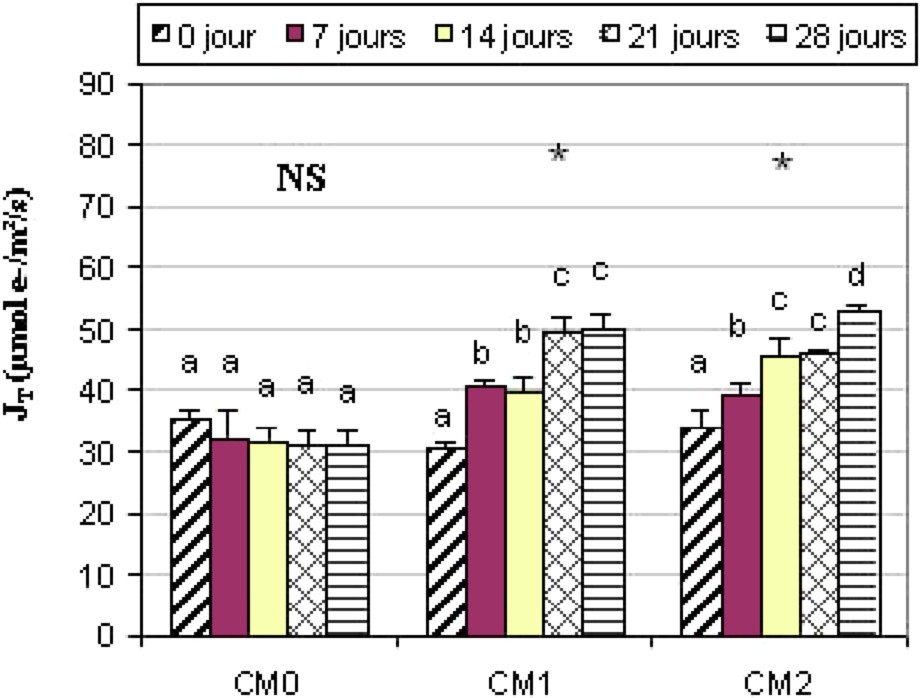
Évolution du chez la variété Chemlali. Légende : voir Fig. 3.
Pour la variété Chetoui, le a évolué de la même façon que celui chez la variété Chemlali. Pour le traitement CT1, le a passé de 35,90 μmol m−2 s−1 avant l'installation de la contrainte hydrique à 55,49 μmol m−2 s−1 après 28 j de stress. Au cours du CT2, le a augmenté de 71%. Les valeurs enregistrées sont 40,08 et 68,82 μmol m−2 s−1 respectivement avant l'installation de la contrainte hydrique et 28 j après. L'évolution de est significative au seuil (Fig. 8).
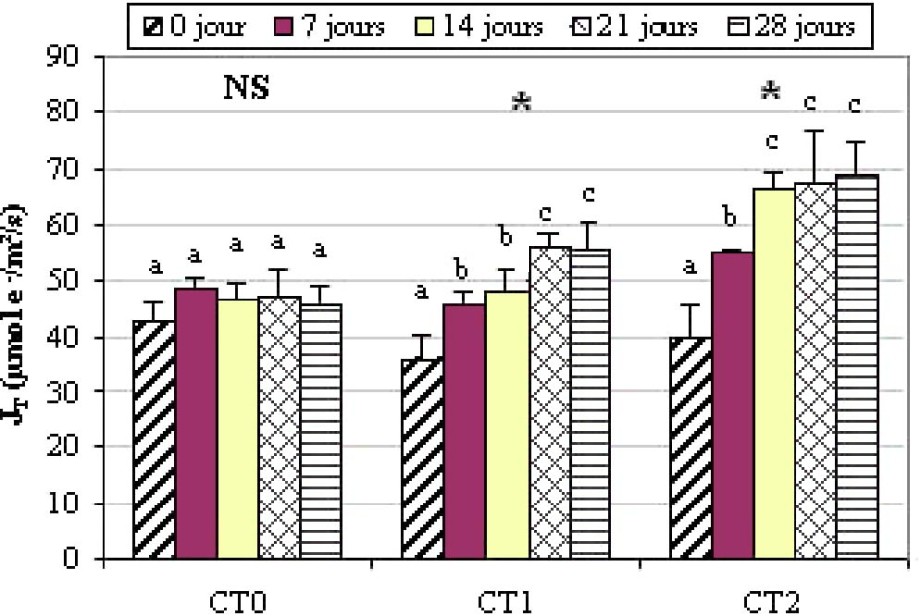
Évolution du chez la variété Chetoui. Légende : voir Fig. 3.
3.5 Évolution du quenching photochimique du PSII (qP)
Au niveau du témoin le qP a varié de 0,65 à 0,69 et de 0,66 à 0,68 respectivement pour les variétés Chemlali et Chetoui. Au niveau des deux niveaux de stress ( et ), nous remarquons que la contrainte hydrique a provoqué une augmentation du quenching photochimique.
Chez la variété Chemlali, au niveau de CM1, le qP est compris entre 0,65 avant le stress et 0,75 après 28 j de contrainte hydrique. Au cours de ce traitement le qP a augmenté de 16%. Durant le second degré CM2, le qP a enregistré une augmentation de 26%. Avant l'installation de la contrainte, le qP était de 0,64. Après 28 j de stress, le qP a atteint 0,81. Les différences observées sont significatives au seuil (Fig. 9).

Évolution de qP chez la variété Chemlali. Légende : voir Fig. 3.
Chez la variété Chetoui, au cours du premier niveau de stress CM1, le qP a augmenté de 11%. Alors qu'au cours du deuxième niveau, le qP a augmenté de 16%. Avant l'installation du stress, le qP était 0,68 et a atteint 0,76 et 0,78 pour respectivement le traitement CT1 et CT2. Les différences observées sont significatives au seuil (Fig. 10).

Évolution de qP chez la variété Chetoui. Légende : voir Fig. 3.
4 Conclusion
Pour répondre à un manque d'eau dans la zone radiculaire, les plantes réagissent par un abaissement du potentiel hydrique foliaire, permettant l'ajustement osmotique. Le mécanisme diffère selon les espèces et les variétés au cours de la contrainte hydrique [16,17]. En étudiant le statut hydrique de la plante, nous avons pu observer une différence du potentiel hydrique foliaire de base en fonction de la variété, de l'ordre de pour la variété Chemlali et pour la variété Chetoui. Pour les deux variétés, le stress hydrique a également causé une réduction de l'efficience quantique du PSII. De plus, nous constatons une augmentation du taux de transfert des électrons (). Ce phénomène s'est accompagné par une augmentation du quenching photochimique de 26% pour la variété Chemlali et de 16% pour la variété Chetoui.


