Abridged English version
Cadmium (Cd) is a non-essential element and ranks as one of the most hazardous heavy metals. One recognized explanation of the impact of heavy metals on the plant physiology is that it results in several nutritional disturbances. In this study, the effects of 10-day exposure of tomato plants to increasing Cd concentrations were described, with special attention given to both nutrient contents and hypocotyle structure changes. The relationship between cadmium and calcium accumulations in plant tissues and some related physiological and structural disturbances was emphasized. In Cd-treated plants, the metal was mainly accumulated in roots (91% of total plant content) and there was a positive correlation between metal concentration in nutrient solutions and metal content in roots and leaves.
The presence of cadmium in the culture medium inhibited whole plant growth. The growth inhibition was accompanied by an important decline in nutrient contents in plant tissues. Indeed, (Fe2+), (Mn2+), (Ca2+), and (Mg2+) accumulation in root and shoot-leaf displayed a gradual decrease with increasing Cd in the nutrient solution. The most-visible negative correlation of metals to Cd toxicity was observed at 50 and 100 μM CdCl2. Simultaneously, chlorophyll contents were found to decrease in the leaves of Cd2+-treated plants. Compared to the control, total chlorophyll a and b contents decreased up to 60% in plants grown on 100 μM CdCl2.
To investigate the protective effects of calcium against cadmium toxicities, a concentration of 20 μM CdCl2 was used in the culture medium supplied with increasing amounts of CaCl2. Cadmium accumulation in the different plant organs showed a gradual decrease with increasing calcium concentrations in plant and nutrient solution. This effect was more pronounced in shoots than in roots. Increasing calcium concentration in nutrient solution stimulated the root and the shoot-leaf weight growth, with an optimum at 5 mM CaCl2. At this calcium concentration, we recorded a significant enhancement of the leaf chlorophyll contents.
In order to study the effects of cadmium on plant structure and the protective role of calcium, histological investigations were performed at the hypocotyle level. Cd-Treatment combined with low or optimal calcium concentrations (0.1–2.5 mM) in culture medium induce a pronounced restriction in tissue territories and a reduction of the parenchyma cell size. Meristem formations were also observed. Some formed meristems differentiated into well-developed root structures, likely giving rise to adventitious roots. At high calcium concentrations, meristem formations differentiating into adventitious roots disappeared. These results, together, are discussed in relation with protective effects of calcium on plant growth and structure against cadmium toxicities.
1 Introduction
Le cadmium est un métal lourd relativement rare dans l'écosysphère [1]. Il fait partie des polluants les plus toxiques et les plus mobiles dans le système sol–plante. Par conséquent, son assimilation et son accumulation dans les tissus des végétaux peuvent constituer des vecteurs de contamination en cas de consommation animale ou humaine [2].
Plusieurs études ont montré que la présence du cadmium dans le milieu de culture peut se traduire, au-delà d'une certaine limite, par l'apparition de symptômes d'intoxication, accompagnés d'une inhibition de la croissance pondérale des plantes [3,4]. Cette inhibition affecte beaucoup plus les organes aériens que racinaires [5]. En outre, le cadmium est susceptible de perturber la nutrition minérale des plantes en interférant avec le prélèvement de certains éléments essentiels (fer, cuivre, manganèse, magnésium, calcium), soit par substitution, soit par compétition au niveau des sites d'absorption membranaire [6]. Le déséquilibre de la balance ionique induit par le cadmium affecte directement et/ou indirectement plusieurs processus métaboliques se traduisant à l'échelle phénologique par des signes de carence et des troubles de croissance. Cependant, d'autres travaux ont montré que le calcium exerce un effet protecteur contre l'incidence phytotoxique du cadmium chez des espèces comme le maïs [7], la laitue [8], l'orge [9], Peltigro membranacea [10] et Tamarix aphylla [11]. Le calcium est un élément indispensable aux processus de croissance et de survie des plantes en conditions de stress [12]. Son rôle dans la transduction des signaux endocellulaires permet aux plantes de moduler leurs réponses vis-à-vis de divers stimuli biotique et abiotique [13]. Le calcium joue également un rôle important dans le maintien de l'intégrité et de la sélectivité membranaire [14]. Par conséquent, son introduction dans le milieu de culture permet un meilleur contrôle des propriétés membranaires et assure un rôle protecteur lorsque les conditions du milieu sont défavorables [11,15]. L'objectif du présent travail consiste à explorer les effets d'un apport croissant en calcium dans le milieu de culture sur la toxicité du cadmium chez la tomate (Lycopersicon esculentum). Un intérêt particulier est porté à l'étude de l'interaction cadmium–calcium et ses conséquences sur la croissance, la nutrition minérale et la structure de l'hypocotyle et de la partie supérieure de la racine.
2 Matériel et méthodes
2.1 Conditions de culture
Les graines de tomate (Lycopersicon esculentum, var. Ibiza F1) sont désinfectées par une solution d'eau oxygénée à 10% (v/v), rincées abondamment à l'eau distillée, puis mises à germer dans des boites de Pétri tapissées de papier filtre imbibé d'eau distillée. La germination est réalisée à l'obscurité et à . Les plantules âgées de 6 jours sont ensuite repiquées et maintenues sur des solutions nutritives de base, dont le pH est maintenu entre 5,5 et 6, et contenant : 1 mM MgSO4, 2,5 mM Ca (NO3)2, 1 mM kH2PO4, 2 mM KNO3, 50 μM EDTA-Fe-K, 30 μM H3BO3, 10 μM MnSO4, 1 μM ZnSO4, 1 μM CuSO4, (NH4)6MO7O24. Après 12 jours de culture sur milieu de base, les plantules sont transférées sur le même milieu additionné ou non de différentes doses de CdCl2 (0–5–10–20–50 et 100 μM). Pour l'étude de l'interaction cadmium–calcium, ce dernier est ajouté aux solutions de base préalablement contaminées par 20 μM de CdCl2, sous forme de CaCl2, à des concentrations finales (0,1–0,5–1–2,5–5 et 10 mM). Les différents milieux nutritifs sont continuellement aérés par un bullage d'air comprimé. Les cultures sont réalisées dans une salle conditionnée sous plafond lumineux (photopériode : 16 h ; intensité lumineuse : 150 μM de photons m−2 s−1 ; température : pendant la période éclairée et de pendant la phase obscure ; humidité relative : 70%).
2.2 Techniques analytiques
2.2.1 Paramètres physiologiques
Au terme de chaque traitement (10 jours), les plantes âgées de 28 jours sont séparées en racines, tiges et feuilles. Chaque organe est pesé immédiatement pour la détermination de sa matière fraîche (MF). Les racines, préalablement rincées dans de l'eau distillée, sont mises, avec leurs parties aériennes correspondantes, dans une étuve à 70 °C pour la détermination de leur masse de matière sèche (MS).
2.2.2 Dosage de la chlorophylle
La chlorophylle est extraite selon la méthode décrite par [16]. Les teneurs en pigments chlorophylliens et en caroténoïdes sont déterminées selon les équations établies par [17]. Les résultats obtenus représentent la moyenne de six répétitions individuelles.
2.2.3 Dosage des ions minéraux
Le matériel végétal, issu de plantes âgées de 28 jours, préalablement séché, est soumis à une minéralisation à chaud par un mélange nitro-perchlorique (3 :1, HNO3–HClO4, v/v) selon la méthode décrite par [18]. Après évaporation complète du mélange et obtention d'un résidu de couleur blanchâtre, un volume standard (20 ml) d'une solution d'acide nitrique à 1% (v/v) est ajouté au résidu sec. Le dosage des ions minéraux est réalisé sur l'extrait nitrique à l'aide d'un spectrophotomètre d'absorption atomique (Perkin Elmer Analyst 300), les résultats sont exprimés en μmol g−1 MS.
2.3 Étude structurale
L'étude structurale est réalisée au niveau de l'hypocotyle (H) issu de plants traités par 20 μM de CdCl2. Les coupes de 5 μM d'épaisseur, confectionnées à l'aide d'un microtome à congélation (Leitz Kryomat 1700), sont préalablement mises dans l'hypochlorite de sodium (12°) pendant 1 h afin d'éliminer le contenu cellulaire. Après un traitement à l'acide acétique 30% (v/v), les coupes sont colorées par un mélange de carmin aluné et vert d'iode. Les observations, qui ont porté sur au moins cinq échantillons prélevés sur des plantes témoins ou traitées, sont effectuées à l'aide d'un microscope photonique (Leica) équipé d'une règle micrométrique.
2.4 Analyse statistique
Les expériences sont répétées au moins trois fois et les résultats présentés sont exprimés sous forme de moyennes ± (SD) calculés au seuil de probabilité inférieur ou égal à 95%. La signification des différences entre les plantes témoins et traitées au cadmium est déterminée selon le test de Tukey (HSD) en utilisant le logiciel Statistica 6.0.
3 Résultats
3.1 Accumulation et distribution du cadmium
L'accumulation endogène du cadmium dépend étroitement de la concentration du métal dans la solution nutritive et de la nature de l'organe (Tableau 1). En termes de teneur, les racines accumulent plus de cadmium que les tissus caulinaire et foliaire. À 20 μM de cadmium, les teneurs endogènes du polluant dans les racines sont estimées à 2382 μg g−1 MS, tandis qu'au niveau des tiges et des feuilles, elles ne dépassent pas 92 et 252 μg g−1 MS, respectivement (Tableau 1). En revanche, l'examen de la répartition du cadmium accumulé à l'intérieur de la plante a montré que, à faibles doses (5 et 10 μM), 91% du cadmium total incorporé par la plante se trouve compartimenté au niveau de la racine, la proportion exportée vers la partie aérienne restant faible et ne dépassant guère 9% (Tableau 1). Une distribution similaire du polluant entre organes racinaires et aériens est observée pour les traitements les plus sévères (50 et 100 μM), avec cependant une accumulation plus importante au niveau de la partie aérienne.
Effets de différentes concentrations de CdCl2 sur les teneurs endogènes en cadmium (μg g−1 MS par plante) et la croissance pondérale (mg MS par plante) des racines (R), des tiges (T) et des feuilles (F) de plants de tomate après un traitement de 10 jours. Chaque valeur représente la moyenne de six mesures individuelles. Les valeurs entre parenthèses sont exprimées en pourcents du Cd total absorbé par la plante. Les valeurs suivies par les mêmes lettres ne sont pas significativement différentes. Les indices de signification sont déterminés selon le test de Tukey (HSD), au seuil de probabilité inférieure ou égale à 95%
| Cd (μM) | R Cd (μg g−1 MS) | T Cd (μg g−1 MS) | F Cd (μg g−1 MS) | R MS (mg plante−1) | T MS (mg plante−1) | F MS (mg plante−1) |
| 0 | 0 | 0 | 0 | 122 a | 398 a | 564 a |
| 5 | 1060 (92) | 34 (2) | 87 (6) | 128 a | 225 b | 344 b |
| 10 | 1495 (91) | 41 (2) | 119 (7) | 121 a | 216 b | 310 b |
| 20 | 2382 (89) | 92 (3) | 252 (9) | 94 a | 146 b | 309 b |
| 50 | 2522 (70) | 333 (9) | 752 (21) | 79 b | 128 c | 191 c |
| 100 | 4558 (79) | 515 (9) | 652 (12) | 33 b | 52 c | 79 d |
3.2 Effet du cadmium sur la croissance
Les faibles concentrations de cadmium (5 et 10 μM) n'entraînent pas d'effet significatif sur la croissance pondérale racinaire (Tableau 1). L'effet inhibiteur du métal n'est décelable que pour les concentrations supérieures à 20 μM. Aux plus fortes doses (50 et 100 μM), cette inhibition atteint 35 et 73% par rapport au témoin respectivement. En revanche, la croissance pondérale des tiges et des feuilles se trouve sévèrement diminuée dès la plus faible dose de CdCl2 (Tableau 1). Cette diminution est fonction de la concentration du métal dans le milieu de culture : elle peut atteindre au niveau des feuilles jusqu'à 66 et 86% par rapport au témoin respectivement pour les traitements 50 et 100 μM.
3.3 Effet du cadmium sur les teneurs en chlorophylle et en éléments nutritifs
L'examen du Tableau 2 montre que, dans les feuilles, le contenu en chlorophylle totale, a et b, diminue fortement dès la plus faible dose de cadmium. En effet, en présence de 5 μM, on note une baisse de la chlorophylle totale de 23% par rapport au témoin. Cette diminution s'accentue au fur et à mesure que la concentration exogène du métal augmente : à 20 μM elle atteint 63% et, avec le traitement le plus sévère (100 μM), la baisse de la teneur en chlorophylle totale est estimée à 69% par rapport au témoin. En revanche, le rapport chlorophylle a/chlorophylle b reste relativement inchangé pour les faibles doses de cadmium.
Variations des teneurs en chlorophylles (a, b et totale) dans les feuilles en fonction de la concentration en CdCl2 dans le milieu de culture. Les valeurs entre parenthèses sont exprimées en pourcents du témoin. Les valeurs suivies par les mêmes lettres ne sont pas significativement différentes. Les indices de signification sont déterminés selon le test de Tukey (HSD) au seuil de probabilité inférieure ou égale à 95%
| Cd (μM) | Chlorophylle a | Chlorophylle b (mg mg−1 MS) | Chlorophylle totale | Chl |
| 0 | 16,0 (100) | 7,2 (100) | 23,1 a (100) | 2,2 |
| 5 | 11,6 (72) | 6,3 (87) | 18,0 b (77) | 1,8 |
| 10 | 8,2 (51) | 3,3 (45) | 11,6 c (50) | 2,4 |
| 20 | 5,5 (34) | 3,1 (43) | 8,7 c (37) | 1,7 |
| 50 | 4,6 (28) | 2,5 (34) | 7,2 d (31) | 1,8 |
| 100 | 4,4 (27) | 2,7 (37) | 7,2 d (31) | 1,6 |
L'accumulation et la distribution de certains oligo-éléments dans les tissus de la plante dépendent de l'intensité du stress et de la nature de l'organe contaminé. Ainsi, le cadmium induit une réduction des teneurs en fer perceptible dès la plus faible dose du polluant (Tableau 3). A 20 μM, elle atteint 32, 37 et 44% par rapport au témoin respectivement dans les feuilles, les tiges et les racines. L'addition du cadmium, même à très faible dose, entraîne également une diminution importante des teneurs en manganèse, aussi bien dans les organes aériens que racinaires (Tableau 3). Pour le traitement le plus sévère (100 μM), la diminution des teneurs en manganèse atteint 59, 67 et 64%, par rapport au témoin, respectivement dans les feuilles, les tiges et les racines.
Teneurs en certains éléments nutritifs essentiels (Fe2+, Mn2+, Ca2+, Mg2+) dans les racines (R), les tiges (T) et les feuilles (F) de plantes de tomate traitées pendant 10 jours par des concentrations croissantes de CdCl2. Les valeurs représentent la moyenne de six répétitions individuelles ± (SD)
| CdCl2 (μM) | R | T | F | |||||||||
| Fe2+ | Mn2+ | Ca2+ | Mg2+ | Fe2+ | Mn2+ | Ca2+ | Mg2+ | Fe2+ | Mn2+ | Ca2+ | Mg2+ | |
| (μmol g−1 MS) | ||||||||||||
| 0 | 16 ± 1 | 5,5 ± 0,6 | 236,0 ± 9,8 | 270 ± 9,8 | 2,7 ± 0,3 | 1,2 ± 0,1 | 576 ± 36 | 187 ± 12 | 4,7 ± 0,3 | 6,3 ± 0,0 | 873 ± 36 | 230 ± 14 |
| 5 | 10,0 ± 1,2 | 5,6 ± 0,5 | 258,0 ± 6,1 | 259 ± 9 | 2,4 ± 0,2 | 0,9 ± 0,0 | 541 ± 18 | 180 ± 19 | 3,0 ± 0,1 | 4,3 ± 0,5 | 854 ± 18 | 207 ± 2 |
| 10 | 9,5 ± 1,4 | 3,0 ± 0,6 | 233,0 ± 9,8 | 242 ± 12 | 1,4 ± 0,2 | 0,4 ± 0,0 | 478 ± 14 | 163 ± 6 | 2,5 ± 0,1 | 3,0 ± 0,2 | 770 ± 14 | 173 ± 16 |
| 20 | 7,0 ± 0,6 | 2,0 ± 0,1 | 219 ± 12 | 217 ± 5 | 1,0 ± 0,1 | 0,5 ± 0,0 | 492 ± 23 | 162 ± 9 | 1,5 ± 0,0 | 2,9 ± 0,4 | 716 ± 23 | 211 ± 7 |
| 50 | 5,7 ± 0,6 | 1,6 ± 0,2 | 194 ± 14 | 185 ± 11 | 0,9 ± 0,0 | 0,3 ± 0,0 | 460 ± 21 | 142 ± 11 | 1,2 ± 0,0 | 2,7 ± 0,3 | 692 ± 21 | 123 ± 9 |
| 100 | 5,0 ± 1,2 | 2,0 ± 0,2 | 186 ± 12 | 108 ± 21 | 0,7 ± 0,1 | 0,4 ± 0,0 | 457 ± 27 | 107 ± 10 | 1,2 ± 0,0 | 2,6 ± 0,2 | 648 ± 27 | 110 ± 20 |
En outre, le cadmium semble restreindre le prélèvement de certains macroéléments, comme le calcium et le magnésium (Tableau 3). La diminution de l'accumulation du calcium au niveau des parties aériennes (tiges et feuilles) s'accentue avec la dose de cadmium appliquée, mais elle reste modérée et ne dépasse pas 20% par rapport au témoin, même pour les traitements les plus sévères (50 et 100 μM). Cependant, la baisse des teneurs en Mg2+, décelée dans les différents organes des plantes traitées (Tableau 3), peut atteindre 42, 78 et 52% par rapport au témoin, respectivement, dans les tiges, les feuilles et les racines pour le traitement (100 μM).
3.4 Étude de l'interaction cadmium–calcium
3.4.1 Effet sur l'accumulation et la distribution du cadmium
L'accumulation du cadmium dans les différents tissus de la plante, en présence d'une contrainte de 20 μM de CdCl2, dépend étroitement de la concentration en calcium dans le milieu de culture. En effet, les teneurs endogènes en cadmium diminuent au fur et à mesure que la concentration en calcium exogène augmente, avec un effet plus prononcé dans les parties aériennes par rapport aux racines (Fig. 1). En présence de 10 mM de calcium, cette diminution atteint 63% par rapport aux teneurs enregistrées à 0,1 mM de calcium dans les feuilles et les tiges, alors que, dans les racines, elle ne dépasse pas 30%, avec toutefois une accumulation de la majeure partie du métal absorbé au niveau des racines (Fig. 1).
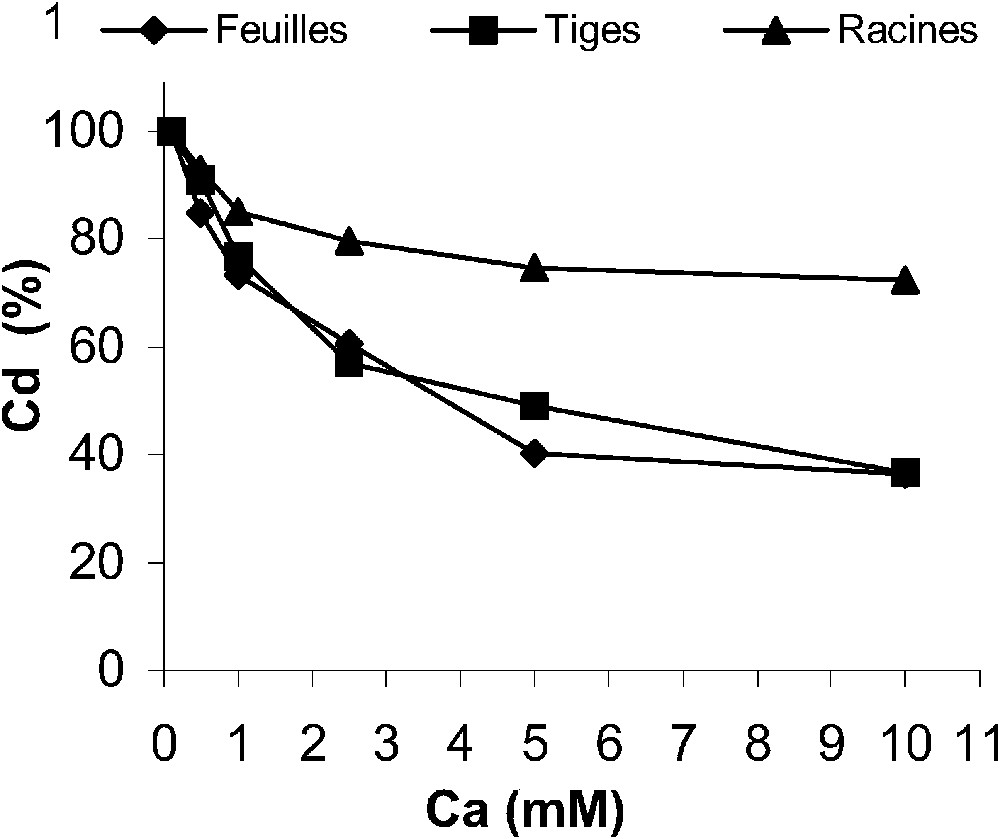
Accumulation endogène du cadmium dans les tissus de tomate en fonction de la concentration en calcium dans un milieu de culture contaminé par 20 μM de CdCl2. Les résultats sont exprimés en pourcents du témoin (racines = 2372 μg g−1 MS ; tiges = 197 μg g−1 MS ; feuilles = 452 μg g−1 MS). Chaque valeur représente la moyenne de six répétitions individuelles ± (SD).
3.4.2 Effet sur la croissance
L'addition simultanée du cadmium (20 μM) et de doses croissantes de calcium dans le milieu de culture stimule la croissance de la plante, particulièrement celle des parties aériennes : feuilles et tiges (Fig. 2). En présence d'une dose optimale de calcium (5 mM), la croissance des feuilles, des tiges et des racines augmente de 110, 153 et 140% respectivement par rapport aux plantes traitées avec 0,1 mM de calcium.

Effet du cadmium (20 μM) sur l'évolution de la masse de la matière sèche (MS) en fonction de différentes concentrations de calcium dans le milieu de culture. Chaque valeur représente la moyenne de six répétitions individuelles ± (SD).
3.4.3 Effet sur le contenu en chlorophylle et en certains éléments nutritifs
Les teneurs en pigments photosynthétiques au niveau des feuilles issues de plants traités par 20 μM de cadmium dépendent aussi de la concentration en calcium dans la solution nutritive (Fig. 3). Une hausse importante des teneurs totales en chlorophylles a et b est enregistrée en présence de la dose optimale de calcium (5 mM). Au-delà de cette concentration, les teneurs en pigments au niveau des tissus photosynthétiques baissent, tout en restant supérieures à celles enregistrées avec 0,1 mM de calcium (Fig. 3).
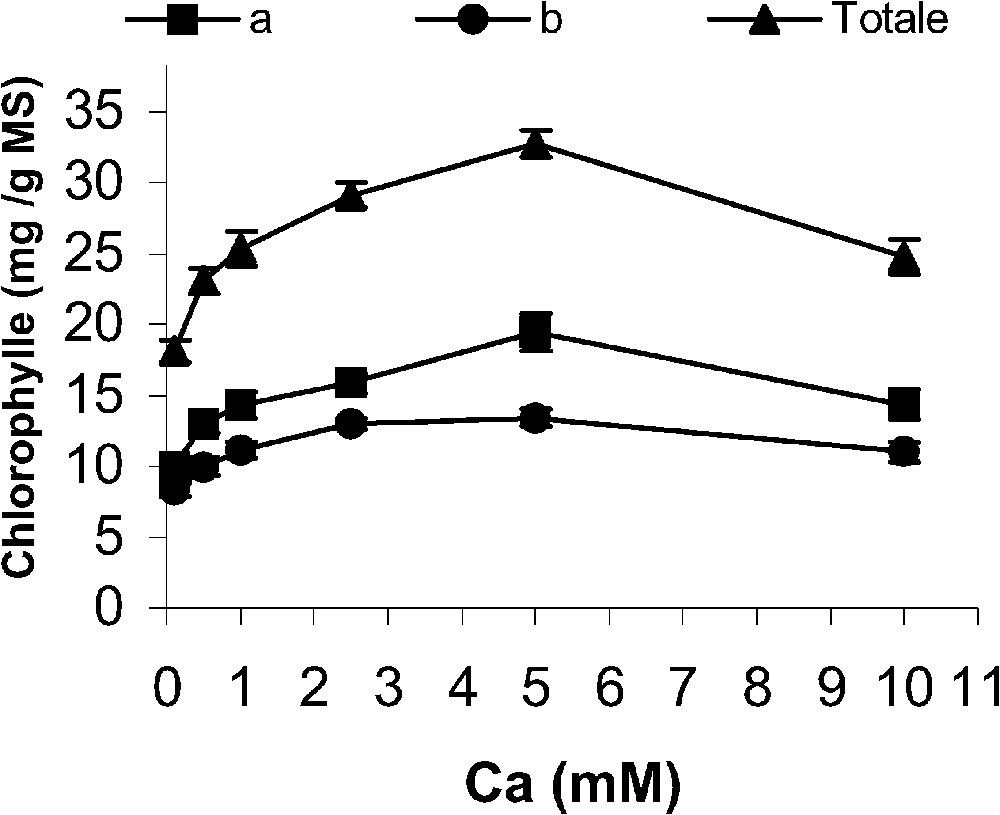
Effet du cadmium (20 μM) sur les teneurs en chlorophylle a, b et totale en fonction de différentes concentrations de calcium dans le milieu de culture. Les résultats sont exprimés en mg g−1 de matière sèche. Chaque valeur représente la moyenne de six mesures individuelles ± (SD).
L'augmentation de la concentration exogène en calcium favorise l'accumulation de certains éléments nutritifs essentiels oligodynamiques (Fe2+, Mn2+) et macrodynamiques (Ca2+, Mg2+) dans les organes de la plante (Tableau 4). Cependant, l'augmentation excessive de calcium dans le milieu de culture entraîne une chute des teneurs de ces éléments qui restent toutefois supérieures à celles enregistrées chez les plantes ayant poussées sur 0,1 mM de calcium.
Teneurs en éléments nutritifs essentiels (Fe2+, Mn2+, Ca2+, Mg2+) dans les racines (R), les tiges (T) et les feuilles (F) de plantes de tomate cultivées pendant 10 jours sur un milieu nutritif contaminé par 20 μM de CdCl2 en présence de doses croissantes de CaCl2. Les valeurs représentent la moyenne de six répétitions individuelles ± (SD)
| CaCl2 (nM) | R | T | F | |||||||||
| Fe2+ | Mn2+ | Ca2+ | Mg2+ | Fe2+ | Mn2+ | Ca2+ | Mg2+ | Fe2+ | Mn2+ | Ca2+ | Mg2+ | |
| (μmol g−1 MS) | ||||||||||||
| 0,1 | 5,8 ± 0,7 | 1,2 ± 0,1 | 120 ± 10 | 201 ± 7 | 1,2 ± 0,0 | 0,7 ± 0,0 | 464 ± 29 | 133 ± 13 | 1,8 ± 0,1 | 2,7 ± 0,2 | 679 ± 44 | 138 ± 5 |
| 0,5 | 5,4 ± 0,5 | 1,5 ± 0,0 | 141 ± 26 | 222 ± 25 | 1,5 ± 0,1 | 0,8 ± 0,0 | 516 ± 29 | 163 ± 12 | 1,7 ± 0,1 | 3,0 ± 0,3 | 690 ± 26 | 158 ± 4 |
| 1 | 9,2 ± 0,9 | 2,0 ± 0,1 | 196 ± 23 | 259 ± 9 | 1,6 ± 0,1 | 0,8 ± 0,0 | 509 ± 44 | 171 ± 9 | 1,8 ± 0,1 | 3,8 ± 0,1 | 753 ± 44 | 158 ± 8 |
| 2,5 | 10,4 ± 1,2 | 2,1 ± 0,1 | 260 ± 36 | 254 ± 19 | 2,0 ± 0,2 | 0,4 ± 0,0 | 494 ± 48 | 129 ± 19 | 1,9 ± 0,1 | 3,0 ± 0,2 | 792 ± 41 | 161 ± 10 |
| 5 | 10,1 ± 1,2 | 1,6 ± 0,1 | 295 ± 28 | 253 ± 10 | 2,5 ± 0,3 | 0,5 ± 0,0 | 554 ± 57 | 113 ± 10 | 2,5 ± 0,1 | 2,6 ± 0,1 | 853 ± 50 | 135 ± 9 |
| 10 | 6,5 ± 0,5 | 1,6 ± 0,0 | 327 ± 39 | 240 ± 25 | 1,6 ± 0,1 | 0,4 ± 0,0 | 618 ± 47 | 109 ± 25 | 2,4 ± 0,3 | 2,6 ± 0,2 | 1106 ± 84 | 116 ± 12 |
3.4.4 Effets sur la structure de l'hypocotyle et de la partie supérieure de la racine
Sur des coupes transversales de l'hypocotyle (H) et de la partie supérieure de la racine (PSR) issues de plantes traitées par 20 μM de cadmium, on observe pour les concentrations allant de 0,1 à 2,5 mM de calcium dans le milieu, une diminution du diamètre de ces organes comparativement à ceux issus des plantes non traitées (Tableau 5). Cette diminution est associée à une réduction de l'étendue des différents territoires tissulaires et de la taille des cellules particulièrement celles du parenchyme cortical (Tableau 5). En revanche, l'addition de doses supra-optimales de calcium (supérieure ou égale à 5 mM) dans le milieu de culture entraîne une augmentation du diamètre de l'(H) et de la (PSR), qui se traduit par une extension de la moelle (Tableau 5).
Effets du cadmium (20 μM CdCl2) sur l'étendue de certains territoires tissulaires au niveau de la partie supérieure de la racine (PSR) et de l'hypocotyle (H) de plantes de tomate cultivées pendant 10 jours en présence de différentes concentrations de CaCl2. Les mesures sont effectuées perpendiculairement au rayon de coupes transversales de plantes âgées de 28 jours. Les valeurs représentent la moyenne de six répétitions individuelles ± (SD). Les valeurs suivies par les mêmes lettres ne sont pas significativement différentes. Les indices de signification sont déterminés selon le test de Tukey (HSD) au seuil de probabilité inférieure ou égale à 95%
| Traitements | PSR (μm) | H (μm) | ||||
| D | Pc | Pm | D | Pc | Pm | |
| Milieu témoin | 3130 ± 170 a | 903 ± 45 a | 1830 ± 30 a | 3483 ± 40 a | 342 ± 24 a | 2730 ± 30 a |
| 0,1 mM | 2470 ± 70 b | 740 ± 7 b | 900 ± 70 b | 3228 ± 20 b | 125 ± 30 b | 2097 ± 20 b |
| 1 mM | 2770 ± 130 c | 716 ± 3 b | 1320 ± 60 c | 3242 ± 12 b | 164 ± 17 b | 2137 ± 80 b |
| 2,5 mM | 2750 ± 130 c | 720 ± 29 b | 1650 ± 110 d | 3225 ± 20 b | 180 ± 18 c | 2579 ± 10 c |
| 5 mM | 3770 ± 70 d | 912 ± 6 c | 1800 ± 70 e | 4876 ± 20 c | 666 ± 22 d | 3440 ± 20 d |
| 10 mM | 4030 ± 112 e | 1036 ± 9 d | 1878 ± 58 e | 4937 ± 37 e | 780 ± 31 e | 3620 ± 44 e |
La contrainte cadmique entraîne également, au niveau de l'(H) et de la (PSR), la formation de nouveaux méristèmes, d'origine cambiale, plus ou moins développés (Fig. 4A, B et C) dont la structure rappelle celle d'un primordium racinaire [19]. En coupe longitudinale axiale (Fig. 4D), ces primordiums racinaires différencient une coiffe, un méristème apical, avec latéralement un méristème proximal, qui donne naissance à l'écorce et, au centre, un cylindre central avec un début de formation de tissus conducteurs. La structure de ces méristèmes laisse présager la formation de racines adventives induites par le stress cadmique. Cependant, la formation de nouveaux méristèmes reste plus ou moins importante en fonction de la dose de calcium ajoutée dans le milieu nutritif. En présence de 1 mM de calcium, certains méristèmes restent sous forme d'amas cellulaires non encore différenciés (Fig. 4C), alors que d'autres montrent déjà des structures racinaires bien développées (Fig. 4A–B). En revanche, l'addition de 5 et 10 mM de calcium dans le milieu de culture ne favorise pas la formation de méristèmes que ce soit au niveau de l'hypocotyle (Fig. 4E) ou au niveau de la partie supérieure de la racine.

Coupes transversales d'hypocotyles de plantes traitées par 20 μM de cadmium pendant 10j en présence de différentes doses de calcium (A–E). A, B et C : Micrographies montrant les différents états de développement des méristèmes racinaires, formés au niveau du parenchyme cortical issus de plantes cultivées respectivement en présence de 0,1 mM (A, B) et 1 mM de calcium (C). (A : G × 112 ; B : G × 154 ; C : G × 350). D : Détail d'un méristème sous-épidermique (G × 350). E : Coupe transversale au niveau de l'hypocotyle de plante cultivée en présence de 5 mM de calcium (G × 112). Symboles : Bo, bois ; Cc, cylindre central ; Cr, cortex ; Ep, épiderme ; Fcc, future cylindre central ; Fzc, future zone corticale ; Ftc, future tissus conducteurs ; Fx, faisceau de xylème ; Pc, parenchyme cortical ; Mé, méristème ; Ph, phloème ; Vx, vaisseau de xylème.
4 Discussion
Nos résultats ont montré que la présence du cadmium dans le milieu de culture implique son incorporation dans les différents tissus de la plante. Chez la tomate, la majeure partie du cadmium absorbé se trouve stockée au niveau des racines. Ces résultats confirment l'hypothèse selon laquelle les racines de certains végétaux supérieurs peuvent jouer le rôle d'organe piège s'interposant à l'exportation des polluants métalliques vers la partie aérienne, site de divers processus physiologiques vitaux [20]. Cependant, l'accumulation endogène du cadmium est accompagnée, au-delà d'une certaine limite, d'une inhibition de la production de biomasse. Dans le cas de la tomate, cette inhibition peut être la conséquence d'une carence en éléments nutritifs (Ca2+, Mg2+, Fe2+, Mn2+) indispensables au processus photosynthétiques et à la régulation de la synthèse protéique. Des résultats similaires ont été observés chez d'autres espèces végétales, comme Betula pendula [21] et Thlaspi caerulescens [22]. En présence de cadmium, la baisse des teneurs en éléments essentiels peut être expliquée par (i) une perturbation de la perméabilité membranaire suite à une altération de leur composition lipidique [23,24], (ii) une compétition ionique au niveau des sites d'absorption [4,6] et/ou (iii) une plus forte affinité du polluant vis-à-vis de certains composés organiques, qui assurent à travers la sève xylémique et phloémique le transport des nutriments, ce qui restreint leur recirculation [25,26].
D'un autre côté, l'addition de doses croissantes de calcium dans le milieu de culture engendre un effet restrictif sur l'accumulation et la distribution du cadmium entre la partie aérienne et la racine. De nombreux travaux, effectués sur des espèces végétales, comme le haricot [27], l'orge [9] et Rhytidiadelphus squarrosus [28], ont montré que l'ajout de certains cations macrodynamiques (Ca2+, Mg2+, K+) dans le milieu de culture entraîne une diminution du prélèvement des ions toxiques au niveau racinaire. Plusieurs hypothèses, parfois contradictoires, ont été émises pour expliquer l'action inhibitrice du calcium sur le prélèvement et l'accumulation du cadmium. Sachant que les ions Cd2+ peuvent être transportés à travers les canaux protéiques du calcium au niveau des membranes des cellules racinaires [29], une éventuelle compétition entre les deux ions peut se produire pour les mêmes sites d'absorption [28,30,31]. D'après [28], le calcium est un inhibiteur compétitif de l'absorption du cadmium chez Rhytidiadelphus squarrosus. Nos résultats ont montré que l'augmentation de la concentration exogène en calcium entraîne une diminution de l'absorption de métal toxique et par conséquent une baisse de ses teneurs dans les tissus de la plante, d'où une amélioration significative de la production de la biomasse végétale. Ceci suggère que le risque d'intoxication auquel la plante est exposée dans son environnement ne dépend pas seulement de la concentration exogène du métal, mais aussi de la composition ionique du milieu et des interactions possibles entre le polluant et les autres ions présents. Ces résultats viennent confirmer ceux obtenus par [11,32,33], qui ont montré que, dans les sols riches en éléments macrodynamiques, comme le calcium et le magnésium, la toxicité des métaux lourds se trouve significativement réduite par rapport aux sols pauvres en ces cations.
En conditions de stress cadmique, l'augmentation de la concentration exogène en calcium se manifeste également par un effet protecteur sur les processus de biosynthèse de la chlorophylle contre la toxicité du métal. Une diminution des teneurs endogènes en ions toxiques au niveau des tissus foliaires, associée à une augmentation des teneurs en Mg2+, Fe2+ et Mn2+, indispensables au bon fonctionnement de la machinerie photosynthétique, pourrait être à l'origine de cet effet protecteur. En effet, l'addition de doses croissantes de calcium dans le milieu de culture améliore l'assimilation des nutriments essentiels au niveau des tissus de la tomate, mais elle aussi inhibe l'absorption et l'accumulation endogène du cadmium (Fig. 1). Une bonne intégrité et sélectivité membranaires, malgré la présence du polluant, sont nécessairement requises pour l'accomplissement de ces processus. Le rôle du calcium dans le maintien de l'intégrité structurale des biomembranes a été démontré aussi bien à l'échelle de la plante entière qu'à l'échelle cellulaire [34–36].
Par ailleurs, nos résultats ont révélé que le cadmium provoque au niveau de l'hypocotyle et de la partie supérieure de la racine l'apparition de méristèmes constituant des ébauches de racines adventives (Fig. 4). Ce type de réponse a été signalé en présence d'autres types de stress, comme le stress mécanique [37] et hypoxique [38]. Chez le lin par exemple, la formation de méristèmes au niveau de l'hypocotyle, peut être induite en combinant plusieurs stress non traumatiques (physiques ou chimiques), comme le vent, la sécheresse, le froid et la déficience en calcium [37]. L'ensemble de ces travaux stipulent que le développement de méristèmes racinaires au niveau de l'hypocotyle, en condition de stress, dépend étroitement des signaux environnementaux perçus par la plante et du taux endogène de calcium dans les tissus qui joue vraisemblablement un rôle primordial dans la transduction des signaux endocellulaires permettant de moduler la réponse de la plante aux stimuli [37]. Dans ce sens, nos résultats ont montré qu'une contrainte cadmique modérée combinée à un apport élevées en calcium (5 à 10 mM) dans le milieu de culture, inhibe la formation de ces méristèmes au niveau de l'(H) et de la (PSR) de la tomate.
En outre, nos résultats ont montré que l'augmentation de la dose de calcium dans la solution nutritive améliore la croissance des différentes parties de la plante. L'observation des coupes transversales nous a permis de révéler une augmentation du diamètre de l'(H) et de la (PSR) (Tableau 5). Cette augmentation s'explique par une extension de l'étendue de différents territoires tissulaires (cortex et moelle), mais aussi par l'augmentation de la taille des cellules. En revanche, la restriction des effets phytotoxiques causés par un excès de Na+ ou d'Al3+, chez Triticum aestivum, est due à un déplacement des ions toxiques liés à la surface des cellules racinaires grâce aux ions Ca2+ [15]. L'extension des différents territoires tissulaires s'accompagne d'une diminution de la lignification précoce induite par le cadmium, une augmentation du nombre et du calibre des vaisseaux conducteurs (résultats non illustrés), ce qui favorise une hausse des teneurs en macro- et oligoéléments accumulés dans les différents tissus de la plante et par conséquent une amélioration de la production de la biomasse végétale. L'ensemble de ces résultats suggère que le calcium, apporté à des concentrations optimale et supra-optimale dans le milieu de culture, permet une atténuation significative de certains effets toxiques engendrés par l'accumulation endogène du cadmium.


