Abridged English version
In Cd-treated tomato, we observed that the biomass of roots and leaves decreased when increasing doses of cadmium were added to the culture solutions. The decline on dry weights was more dramatic for leaves than for roots. The external concentration of 50 μM triggered 75 and 30% of reduction of leaf and root growth, respectively. A progressive decrease in the total chlorophyll content, chlorophyll a and chlorophyll b, was reduced under cadmium treatment. The decrease in chlorophyll content was parallel to the decrease in nitrate accumulation.
Cadmium stress triggered a decrease in glutamine synthetase activity in both leaves and roots; GS activity was altered to a greater extent in leaves than in roots. GS activity is the sum of GS2 and GS1 activities. In order to estimate the effect of cadmium on isoforms, GS1 and GS2 ARNm contents were investigated by northern-blot analysis. No difference in the abundance of transcripts encoding GS1 was clearly observed in the leaves of control and cadmium-treated plants. In contrast, GS1 mRNA content was increased in roots of plants treated with cadmium. Cadmium treatments led also to a decrease in the steady-state level of GS2 in both roots and leaves of tomato. The sharp decrease on GS activity in leaves might then be due to the decrease of GS2.
GS and Fd–GOGAT both cooperate in ammonia assimilation in higher plants; therefore, Fd–GOGAT activity was assayed, and a decrease in Fd–GOGAT activity was more important in roots than in leaves. Consequently, in treated plants, it seems unlikely that the remaining Fd–GOGAT activity can ensure efficient synthesis of glutamate, as illustrated by the decrease in glutamate content previously described in roots. An alternative to the Fd–GOGAT-dependent synthesis is the involvement of the NADH–GOGAT activity. In the cadmium-treated plants, NADH–GOGAT activity was increased, especially in roots. Another putative source of glutamate is the reaction catalysed by the mitochondrial NADH-dependent GDH. The change in the NADH–GDH activity was investigated. The NADH–GDH activity increased under cadmium treatment in leaves and roots. Moreover, the NAD+–GDH activity was decreased by the cadmium treatment. The NADH–GDH/NAD+–GDH ratio was increased by the cadmium treatment. In the 50-μM-treated plants, the ratio was equal to 4-fold and 3-fold of the control for leaves and roots respectively, suggesting that the change in the GDH-aminating and -deaminating activities is in favour of glutamate synthesis. The GDH mRNA steady-state level was increased by 4 fold in the leaves of tomato, when plants were treated with increasing doses of cadmium. In roots, the increase in the pre-existing high level of transcripts in the roots of the control plants was lower than in leaves. However, a concomitant increase in the ammonium content was observed. This suggested an ammonia accumulation in leaves consequently to the increase of proteasic activity. It is known that NAD(P)H cannot cross the membrane directly and uses metabolic channels and especially the malate/oxaloacetate channel, controlled by the malate dehydrogenase enzyme. We measured both NAD(P)+ and NAD(P)H MDH activities, which increased in roots, whereas the NADH- and NADPH-dependent activities were decreased in roots. This suggests that MDH isoforms preferentially catalysed the synthesis of oxalo-acetate (OAA) and had a reducing power in roots. Interestingly, the opposite was observed in leaves, suggesting that MDH catalysed preferentially malate synthesis in leaves and then constituted a supplementary sink for reducing power in leaves.
NADP+-dependent isocitrate dehydrogenase (ICDH) belongs to a multi-isoenzymatic family, whose members exist in several cellular compartments. Although an ICDH isoenzyme was found in the plastid, it was proposed that cytosolic ICDH might play a major role in 2-oxoglutarate production for use in amino acid synthesis. The effect of cadmium on ICDH activity presented in this study shows that exogenously applied cadmium clearly stimulated NADP+–ICDH activity in leaves and roots. This suggests that the synthesis of 2-oxoglutarate dedicated to amino acid synthesis and particularly to glutamate maintenance continued and that the availability of reducing power remained however sufficient. Immunoblot observation showed that a large amount of isocitrate dehydrogenase was detected in leaves and roots protein extracts. However, their amount continuously increased with cadmium concentration.
1 Introduction
L'inhibition des processus d'absorption et d'assimilation de l'azote minéral constitue l'une des causes auxquelles peut être attribuée la phytotoxicité des métaux lourds, mais les études entreprises dans ce domaine restent encore assez limitées. Nous pouvons citer, à titre d'exemple, celles des références [1–5]. Chez les végétaux supérieurs, la voie GS/GOGAT constitue, dans les conditions normales, la principale voie d'assimilation de l'ammonium, notamment celui qui provient de la réduction du nitrate [6,7]. Toutefois, lorsque, pour une raison ou pour une autre, la concentration interne en ammonium augmente, une seconde voie, contrôlée par la GDH–NADH dépendante (glutamate déshydrogénase), entre en jeu pour contribuer à faire baisser cette concentration. Certaines études ont montré l'existence d'un effet inhibiteur du cadmium sur la teneur des tissus en protéines totales solubles et les activités de certaines enzymes, comme la RubisCO [8], la NR, la NiR, ainsi que la GS [2–5,9]. Au contraire, le cadmium peut stimuler l'activité d'autres enzymes impliquées dans le métabolisme intermédiaire, comme l'isocitrate déshydrogénase, la phosphoénolpyruvate carboxylase [10–12], la malate déshydrogénase, l'asparagine synthétase et la glutamate déshydrogénase [4,5,13]. Ceci suggère qu'en condition de stress métallique, une production importante d'ammonium d'origine endogène a lieu, sans doute par accélération des processus protéolytiques.
Les résultats présentés dans ce travail montrent que la présence de Cd dans le milieu de culture conduit à une chute de la croissance des tomates, associée à une déficience nutritionnelle et hydrique. Le nitrate est l'un des éléments nutritifs dont la disponibilité au niveau des tissus est capable de moduler les processus métaboliques et la production de biomasse des plantes cultivées [14]. Cette disponibilité de l'azote minéral, qui constitue l'un des facteurs limitants majeurs de la production végétale, justifie l'utilisation des fertilisations azotées pour permettre l'accroissement de cette production. Nous avons cherché également à préciser certains paramètres susceptibles de réguler le métabolisme azoté en conditions de stress métallique. Pour cela, nous avons réalisé une série d'approches expérimentales (physiologique, biochimique et moléculaire) destinées à apporter des informations concernant la sensibilité des mécanismes régulant les différents processus d'assimilation de l'azote par la tomate, lorsque cette plante se trouve exposée à une contamination de son milieu par le cadmium.
Il est vraisemblable que la disponibilité du carbone soit en cause dans la limitation de l'assimilation du nitrate dans la plante. Plusieurs résultats suggèrent l'étroite liaison entre les métabolisme azotés et carbonés [15–17]. L'enzyme clé responsable de la fixation du carbone par la voie anaplérotique est la phosphoénolpyruvate carboxylase (PEPC). La PEPC catalyse dans le cytosol la fixation du CO2 (HCO−3) sur le PEP pour former l'oxaloacétate. La coordination entre la PEPC, et l'isocitrate déshydrogénase (ICDH), enzyme responsable de la synthèse de l'α-cétoglutarate à partir de l'isocitrate, devrait impliquer des signaux permettant une bonne répartition des métabolites carbonés nécessaires à la synthèse des acides aminés. Le nitrate, le saccharose et éventuellement certains acides aminés comme la glutamine seraient des signaux de traduction activant des protéines kinases ou phosphatases capables de moduler ces enzymes et conduisant à des changements rapides de leurs activités [18,19].
2 Matériel et méthodes
2.1 Conduite des cultures
Le matériel végétal utilisé dans ce travail est la tomate (Lycopersicon esculentum Mill. CV. 63/5 F1). Les graines sont désinfectées à l'eau oxygénée 10% (v/v) pendant 20 min, puis rincées abondamment à l'eau distillée. Elles sont ensuite mises à germer dans des boîtes de Pétri, dont le fond est recouvert d'une double couche de papier filtre imbibée d'eau distillée. La germination est réalisée à l'obscurité à une température de 25 °C environ. Les plantules sont d'abord cultivées pendant 10 j sur milieu témoin, contenant uniquement le nitrate comme source d'azote, puis placées pendant 7 j sur milieu enrichi de CdCl2 (0 à 50 μM). Les cultures sont conduites en salle conditionnée sur milieux hydroponiques, (photopériode : 16 h ; densité de flux quantique (lumière) : 150 μM/m2/s ; température moyenne : 25 °C). À la récolte, les plantules sont subdivisées en racines (R) et feuilles (F). Les racines sont rincées rapidement dans trois bains successifs d'eau distillée, puis les échantillons sont placés dans l'azote liquide pour des analyses ultérieures ou desséchés dans l'étuve à 70 °C pendant au moins trois jours, pour la détermination de la matière sèche et des teneurs ioniques.
2.2 Dosage du cadmium
Pour le dosage du cadmium, la matière végétale sèche est placée dans un matras de Kjeldahl et soumise à une extraction à chaud par une attaque nitroperchlorique (HNO3/HClO4,
2.3 Dosage de l'ammonium
Le matériel végétal, préalablement congelé dans l'azote liquide, est broyé à 4 °C dans un mortier en présence de H2SO4 12% et 0,5% (p/v) de polyclart AT. Le broyat est centrifugé pendant 15 min à
2.4 Dosage du nitrate
Pour le dosage du nitrate, la matière sèche est placée dans des piluliers et soumise à une extraction à froid en milieu acide (H2SO4 N/10). Le nitrate est dosé selon la méthode de Henriksen et Selmer-Olsen [21].
2.5 Dosage de la chlorophylle
Les limbes foliaires de la totalité du système aérien sont préalablement plongés dans l'acétone et conservés pendant une nuit à 4 °C. Le matériel végétal est broyé au mortier dans l'acétone à 80%. Après centrifugation de la suspension pendant 5 min à
3 Mesures des activités enzymatiques
3.1 Activité glutamine synthétase : GS
Le matériel végétal, préalablement congelé dans l'azote liquide, est broyé à 4 °C dans un milieu d'extraction de la composition suivante : tampon Tris-HCl (25 mM, pH 7,6), EDTA (1 mM), MgCl2 (1 mM), β-mercaptoéthanol (14 mM) et polyclar 1% (P/V). Le broyat est ensuite centrifugé pendant 20 min à
3.2 Activité glutamate synthase : GOGAT
Les méthodes d'extraction et de mesure de l'activité glutamate synthase sont celles décrites par Suzuki [24]. Les tissus frais congelés dans l'azote liquide sont broyés à 4 °C dans un tampon d'extraction contenant du phosphate de sodium (25 mM, pH 7,5) du mercaptoéthanol (14 mM), du DTT (0,5 mM), de l'EDTA (5 mM) et du PMSF (1 mM). L'activité glutamate synthase dépendante de la ferrédoxine est mesurée après 20 min d'incubation à 30 °C dans un milieu réactionnel de volume final 100 μl contenant le tampon phosphate de sodium (25 mM, pH 7,5), la glutamine (100 mM), l'α-cétoglutarate (100 mM) et le méthyl viologène (3,9 mM). La réaction est déclenchée par l'addition de dithionite de sodium (190 mM dans NaHCO3 180 mM). L'activité NADH–GOGAT est mesurée dans le même milieu réactionnel, excepté le méthyl viologène. Elle est déclenchée par l'addition de NADH (1,4 mM). Dans les deux cas, la mesure de l'activité GOGAT est déterminée par le dosage du glutamate formé à la fin de la réaction. Les produits de la réaction sont séparés par chromatographie HPLC. Le pic correspondant au glutamate permet de calculer, en référence à un étalon, la quantité de glutamate formé. Les résultats sont exprimés en nMGlu/mg protéines/min.
3.3 Activité glutamate déshydrogénase : GDH
Les méthodes d'extraction et de mesure de l'activité glutamate déshydrogénase à NADH et NAD+ correspondent à celles qui ont été définies au préalable, après une mise au point. Le matériel végétal, préalablement congelé dans l'azote liquide, est broyé à 4 °C dans un tampon Tris-HCl (100 mM, pH 7,6) contenant du mercaptoéthanol (10 mM). Le broyat est centrifugé pendant 10 min à
3.4 Activité isocitrate déshydrogénase : ICDH
Le tissu végétal préalablement conservé dans l'azote liquide est broyé dans un tampon phosphate de potassium (0,1 M pH 7,5) contenant du mercaptoéthanol (14 mM) et du PVP (1%). L'activité ICDH à NADP est mesurée par la réduction du NADP à 340 nm à 30 °C, dans un milieu réactionnel composé du tampon phosphate de potassium (100 mM, pH 7,5), de l'isocitrate (2,5 mM) et du MgCl2 (5 mM) sur une cinétique de 100 s [26]. Les résultats sont exprimés en μM NADP+ réduits/g MF/min.
3.5 Activité malate déshydrogénase : MDH
Les méthodes d'extraction et de mesure de l'activité malate déshydrogénase sont celles décrites par [27]. L'extraction de la MDH se fait dans un tampon Tris-HCl (100 mM, pH 8,3), contenant du DTT (5 mM), EDTA (2 mM), 50 mM mercaptoéthanol, 5 mM MgCl2. Les activités de la malate déshydrogénase NADH et NADPH (25 mM) dépendante sont mesurées après incubation dans un milieu réactionnel à 22 °C de volume final 300 μl contenant de tampon Tris-HCl (25 mM, pH 8), EDTA (1 mM), l'oxaloacétate (0,5 mM). La réaction est déclenchée par l'addition de NADH ou NADPH (25 mM). Les activités NADH-MDH ou NADPH–MDH sont mesurées en suivant l'oxydation du NAD(P)H à 340 nm à l'aide d'un spectrophotomètre dans le même milieu réactionnel. Les résultats sont exprimés en μM NAD(P)H oxydés/g MF/min. Les activités NAD(P)+ sont mesurées après incubation dans un milieu réactionnel à 22 °C, de volume final 300 μl, de composition : tampon Tricine de sodium (25 mM, pH 8,9), EDTA (1mM), malate (50 mM), glutamate (20 mM), hydrazine (0,2 M). La réaction est déclenchée par l'addition de NAD(P)+ (2,5 mM). Les résultats sont exprimés en μM NAD(P)+réduits/g MF/min.
3.6 Activité protéasique
La mesure de l'activité protéasique est réalisée en utilisant une solution d'azocaséine (fournie par Sigma) comme substrat [28], préalablement traitée pendant 2 min à 100 °C pour éliminer les contaminations présentes dans le produit commercialisé. Le tissu végétal frais sorti de l'azote liquide est broyé dans un tampon phosphate de potassium (100 mM, pH 7,4) contenant de l'EDTA (10 mM) et de la cystéine (7,5 mM). Le broyat est centrifugé pendant 20 min à
4 Analyse des ARNm par northern blot
Les ARN totaux sont homogénéisés et extraits selon la méthode de Vernoered et al. [29]. Le transfert de l'ARN sur une membrane de nylon se fait par capillarité dans SSC pendant une nuit (18 h). Le montage est défait et le transfert peut être vérifié aux rayons ultraviolets. La membrane est rincée dans SSC et l'ARN est fixé aux rayons ultraviolets. Le blot est conservé dans un endroit sec jusqu'à l'hybridation. L'hybridation avec la sonde radio-marquée est réalisée par la technique du marquage au
5 Résultats
Le traitement des plantes pendant 7 j par le cadmium s'accompagne de son prélèvement et de son accumulation dans la plante, comme le montre la Fig. 1A ; cette accumulation est fonction de la dose de Cd et atteint des niveaux toujours plus élevés dans les racines que dans les parties aériennes. Quatre-vingts pour-cent environ du Cd total restent confinés au niveau du système racinaire, qui ne représente que 20% de la biomasse totale de la plante (Tableau 1). Malgré cette forte accumulation de Cd dans le système racinaire, ce dernier reste moins sensible à ce polluant que la partie aérienne (Fig. 1B). En outre, les variations des teneurs en chlorophylles
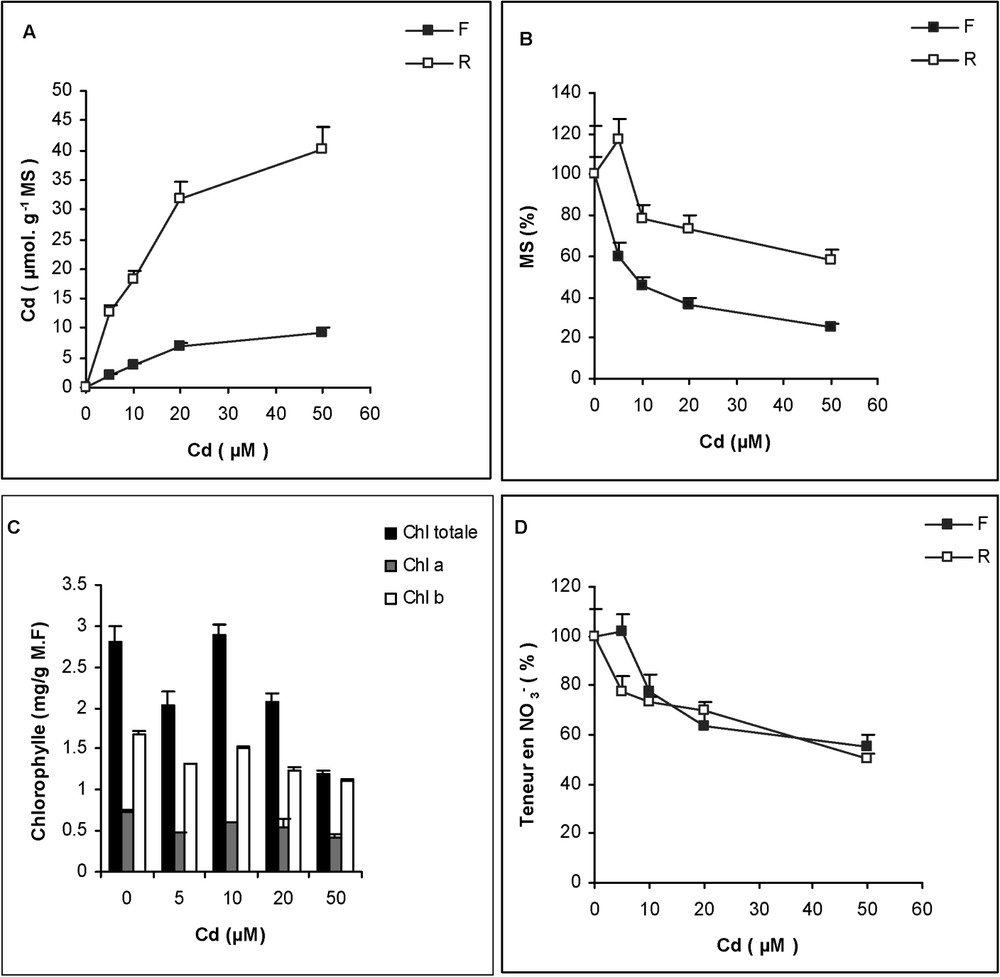
Variations (A) de la teneur en cadmium, (B) de la production de matière sèche, (C) des teneurs en chlorophylles a, b et totale, (D) du nitrate (
Variations (A) de la teneur en cadmium, (B) de la production de matière sèche, (C) des teneurs en chlorophylles a, b et totale, (D) du nitrate (
Distribution de la matière sèche et du cadmium entre les feuilles et les racines. Valeurs exprimées en % des témoins de la plante entière ; F = feuilles, R = racines
| CdCl2 (μM) | Matière sèche | Cd | ||
| F | R | F | R | |
| 0 | 87,4 | 12,6 | – | – |
| 5 | 80,4 | 19,6 | 14,0 | 86,0 |
| 10 | 78,6 | 21,4 | 17,5 | 82,5 |
| 20 | 78,7 | 21,3 | 17,8 | 82,2 |
| 50 | 87,3 | 20,7 | 18,7 | 81,3 |
En même temps que ces effets sur la croissance, l'activité et les ARNm de certaines enzymes impliquées, dans les conditions normales, dans l'assimilation de l'ammonium sont affectés par la présence de cadmium dans le milieu de culture. Pour la glutamine synthétase, les effets sont plus importants dans les feuilles que dans les racines (Fig. 2A). L'activité GS d'un tissu résulte à la fois des activités GS1 cytosolique et GS2 plastidiale. Dans les feuilles, la capacité des tissus chlorophylliens à assimiler l'ammonium, résulte de leur richesse en GS chloroplastique (GS2), qui est l'isoforme principale chez la tomate [33]. Dans les racines, l'isoforme GS1 est prédominante par rapport à l'isoforme GS2 [33,34]. La quantification des ARNm (northern blot) montrent que la transcription du gène de la GS1 est imperceptible, même chez les plantes soumises à la plus forte concentration de cadmium (50 μM) (Fig. 2B). Par contre, dans le cas des racines (Fig. 2C), la quantité des ARNm de la GS1 augmente environ deux fois par rapport aux témoins, dans les plantes soumises à 10 ou 20 μM de Cd dans le milieu de culture. Ces résultats montrent l'induction du gène GS1 sous l'effet du cadmium dans les racines de la tomate traitée par le cadmium. Dans le cas de l'isoforme plastidiale (GS2), les résultats obtenus montrent une forte diminution de la quantité des ARNm, ce qui suggère la répression de l'expression de ces gènes dans les feuilles et dans les racines (Fig. 2D). Nous pouvons constater que la diminution de la quantité des ARNm de la GS2 est plus forte dans les racines que dans les parties aériennes. Comme le montre la Fig. 3A, ces effets sont accompagnés par une augmentation de l'accumulation de l'ammonium, d'origine endogène, dans les tissus de la plante entière.

Variations (A) de l'activité GS dans les feuilles et les racines, (B) de la quantité des ARNm de la glutamine synthétase cytosolique (GS1) à partir des northern blots dans les feuilles et les racines, (C) de la quantité d'ARNm de la glutamine synthétase chloroplastique (GS2) à partir des northern blots dans les feuilles et les racines, (D) des plantules de tomate soumise à des doses croissantes de cadmium dans le milieu de culture. Les résultats sont exprimés en pourcentages des témoins : activité GS (F : 2,65±0,08 μmol γ-GHM/g MF/min, R : 1,012±0,202 μmol γ-GHM/g MF/min). Masquer
Variations (A) de l'activité GS dans les feuilles et les racines, (B) de la quantité des ARNm de la glutamine synthétase cytosolique (GS1) à partir des northern blots dans les feuilles et les racines, (C) de la quantité d'ARNm ... Lire la suite
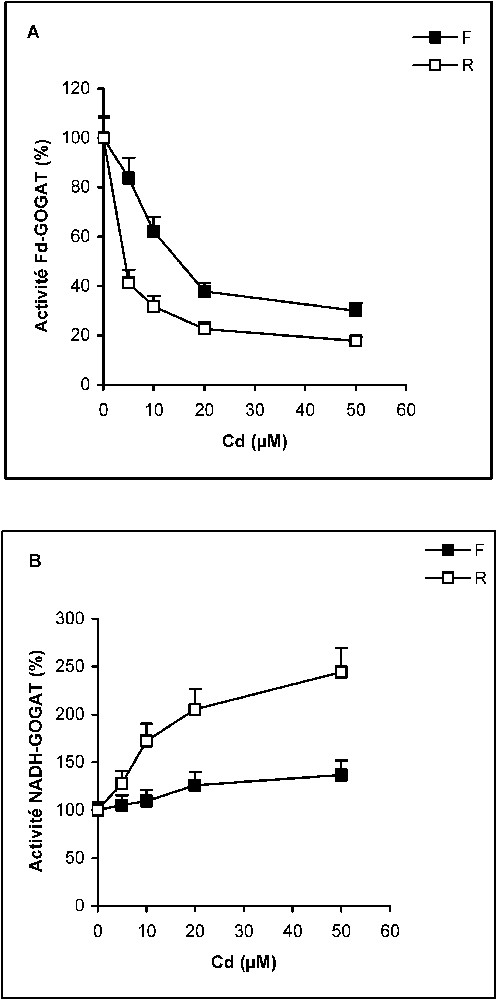
Effets de la dose de cadmium sur l'activité Fd–GOGAT(A) et NADH–GOGAT (B) chez des plantules de tomate. Les résultats sont exprimés en pourcentages des témoins. Activité Fd–GOGAT : F : 12,075 nmol Glu/mg protéines/min ; R : 1,392 nmol Glu/mg protéines/min. Activité NADH–GOGAT : F : 2,68 nmol Glu/mg protéines/min, R : 0,23 nmol Glu/mg protéines/min.
L'isoforme NADH dépendante (NADH–GOGAT) est une forme mineure, particulièrement décrite chez quelques espèces [9,35,36]. Les mesures d'activité enzymatique, réalisées pour les deux isoformes de la GOGAT, permettent de constater que, chez les plantes témoins, les valeurs des deux activités de la GOGAT sont plus élevées dans les feuilles que dans les racines. Chez les plantes traitées par différentes doses de cadmium, les activités des deux isoformes de la GOGAT ne réagissent pas de la même manière à la présence de cadmium. L'activité Fd–GOGAT diminue dans les deux organes, mais beaucoup plus dans les racines que dans les feuilles (Fig. 3A). Inversement, l'activité NADH–GOGAT augmente dans les deux organes étudiés. Cette augmentation est plus importante dans les racines que dans les feuilles (Fig. 3B).
L'activité de la NAD+–GDH dépendante est progressivement réprimée dans les feuilles des plantes traitées par le cadmium (Fig. 4A). Au niveau des tissus racinaires, l'activité de cette enzyme ne semble pas répondre à la présence de cadmium dans le milieu de culture. Contrairement à l'activité de la NAD+–GDH, la présence de cadmium dans le milieu de culture s'accompagne d'une augmentation progressive de l'activité aminatrice de la NADH–GDH (Fig. 4B). Cette stimulation est d'autant plus importante que la dose de cadmium dans le milieu de culture est élevée. Chez la tomate, l'augmentation de l'activité NADH–GDH est plus spectaculaire au niveau des racines qu'au niveau des feuilles. Le comportement différent des activités NADH–GDH et NAD+–GDH à l'égard du cadmium dans le milieu de culture apparaît lorsqu'on établit le rapport entre ces deux activités en fonction de la dose du polluant (Tableau 2). Ce rapport passe de 1,2 à 4,94 dans les feuilles et de 1,7 à 5,33 dans les racines. Ce rapport peut constituer un paramètre important pour estimer l'importance relative de la fonction aminatrice dans l'activité GDH globale d'un tissu par rapport à sa fonction désaminatrice. Les résultats de la Fig. 4C montrent que le contenu en transcrits de la GDH augmente nettement dès que la concentration de cadmium dans le milieu nutritif dépasse 10 μM. Cette augmentation est de l'ordre de 35% dans les feuilles des plantes soumises à 50 μM de Cd par rapport à celle de plantes témoins. Les résultats de quantification des ARNm de la GDH à partir des extraits racinaires de plantes traitées par différentes doses de cadmium montrent que la quantité des ARNm augmente uniquement pour les doses 5 et 10 μM de Cd (Fig. 4D). Ceci montre que l'induction du gène GDH sous l'effet du cadmium est moins importante dans les racines que dans les feuilles, et que les variations des contenus en protéine sont vraisemblablement liées à l'induction du gène GDH par le cadmium. Ainsi, nous pouvons remarquer que les variations des quantités d'ARNm GDH, d'une part, et de protéines GDH, d'autre part, détectées dans les feuilles et les racines sont cohérentes.

Variations de l'activité NAD+–GDH (A), de l'activité NADH–GDH (B), (C) de la quantité des ARNm GDH, (E) de la teneur en ammonium et (F) de l'activité protéasique dans les feuilles et les racines. Les résultats sont exprimés en pourcentages des témoins : activité NAD+–H/F : 0,273±0,015 μmol NAD+ réd/g MF/min ; R : 2,61±0,202 μmol NAD+ réd/g MF/min ; activité NADH–GDH/F : 0,328±0,024 μmol NADH ox/g MF/min ; R : 4,44±0,235 μmol NADH ox/g MF/min ;
Variations de l'activité NAD+–GDH (A), de l'activité NADH–GDH (B), (C) de la quantité des ARNm GDH, (E) de la teneur en ammonium et (F) de l'activité protéasique dans les feuilles et les racines. Les résultats sont exprimés en pourcentages des ... Lire la suite
Variation du rapport des activités NADH–GDH/NAD+ GDH dans les feuilles (A) et les racines (B), en fonction de la dose de cadmium dans le milieu de culture
| CdCl2 (μM) | A | B |
| 0 | 1,2 | 1,7 |
| 5 | 1,9 | 2,7 |
| 10 | 2,3 | 2,9 |
| 20 | 3,8 | 4,6 |
| 50 | 4,9 | 5,3 |
L'étude des variations des teneurs en ammonium dans les différents organes des plantes traitées par le cadmium montre une augmentation plus marquée dans les racines que dans les feuilles (Fig. 4E). Cette augmentation endogène en ammonium ne résulte cependant pas d'une désamination oxydative du glutamate, du fait de l'inhibition de la fonction désaminatrice de la GDH par le cadmium, mais plutôt d'une accélération des processus de dégradation et de remobilisation des protéines, à la suite de l'induction des activités protéasiques. Dans les mêmes conditions, on assiste à une augmentation de l'activité protéasique dans les différents organes étudiés (Fig. 4F). Ce type de résultat suggère que le traitement de la tomate par le cadmium conduit à une production endogène d'ammonium, résultant probablement d'une stimulation des processus de dégradation protéique, principalement de la RubisCO [13,37–39].
L'activité des différentes isoformes de la MDH (NAD+ dépendante, NADP+ dépendante, NADH dépendante et NADPH dépendante) en fonction de la concentration de cadmium dans le milieu de culture, présentée dans la Fig. 5A–D, varie largement, d'une part, en fonction du type d'organe et, d'autre part, en fonction du donneur d'électrons. Pour les activités MDH, dépendant des cofacteurs oxydés (NAD+ ou NADP+), c'est-à-dire qui catalysent la réaction dans le sens de la synthèse d'oxaloacétate (Fig. 4A–B), une inhibition est observée dans les feuilles, alors que cette activité est stimulée dans les racines. Pour les activités dépendantes des cofacteurs réduits (NADH ou NADPH), des résultats inverses sont obtenus (Fig. 4C–D).

(A) Effets de la dose de cadmium sur l'activité malate déshydrogénase NAD+ dépendante, (B) de l'activité malate déshydrogénase NADP+ dépendante, (C) de l'activité malate déshydrogénase NADH dépendante et (D) de l'activité malate déshydrogénase NADPH dépendante dans les feuilles et les racines. Les résultats sont exprimés en (%) des témoins, activité NAD+–MDH/F : 0,61±0,029 μmol/min/g MF, R : 1,031±0,0 μmol/min/g MF ; activité NADP+–MDH/F : 1,41±0,14 μmol/min/g MF, R : 0,206±0,02 μmol/min/g MF ; activité NADH–MDH/F : 0,147±0,04 μmol/min/g MF, R : 0,352±0,01 μmol/min/g MF ; activité NADPH–MDH/F : 0,45±0,04 μmol/min/g MF, R : 0,2±0,02 μmol/min/g MF. Masquer
(A) Effets de la dose de cadmium sur l'activité malate déshydrogénase NAD+ dépendante, (B) de l'activité malate déshydrogénase NADP+ dépendante, (C) de l'activité malate déshydrogénase NADH dépendante et (D) de l'activité malate déshydrogénase NADPH dépendante dans les feuilles et les ... Lire la suite
L'isocitrate déshydrogénase est une enzyme présente dans tous les compartiments cellulaires, cytosol, mitochondrie, chloroplaste et peroxysome, mais environ 90% de la totalité de la protéine est cytosolique. L'augmentation de l'activité ICDH dans tous les organes des plantes cultivées en présence de Cd (Fig. 6A) nous a amenés à essayer de détecter laquelle de ces formes est réellement stimulée par le cadmium. L'utilisation des anticorps spécifiques dans les racines par western blots a permis de montrer que les deux isoformes stimulées en présence de Cd sont la forme cytosolique NADP+ dépendante et mitochondriale NAD+ dépendante (Fig. 6B). Cette stimulation des deux isoformes dans les racines est observée dès la plus faible dose de cadmium (5 μM).

(A) Effets de la dose de cadmium sur l'activité isocitrate déshydrogénase NADP+ dépendante (NADP+–ICDH) dans les feuilles et les racines des plantules de tomate. (B) Détection de l'ICDH par anticorps dans les feuilles et les racines de plantules de tomate, traitées par différentes concentrations de cadmium dans le milieu de culture. Les résultats sont exprimés en (%) des témoins (F : 6,68±0,52 μmol/min/g MF et pour R : 12,74±0,97 μmol/min/g MF).
6 Discussion
Comme chez la majorité des espèces annuelles jusqu'à présent étudiées, les racines de la tomate cultivée sur milieu enrichi en cadmium en retiennent une forte proportion, atteignant, dans nos conditions expérimentales, 80% environ du contenu total de la plante entière, malgré la part relativement faible du compartiment racinaire dans la biomasse totale de cette plante (Tableau 1). Ainsi se trouve confirmée l'hypothèse formulée initialement par un certain nombre d'auteurs [40–42] selon laquelle les racines des végétaux supérieurs se comportent comme des organes pièges pour les métaux lourds, constituant de ce fait une barrière efficace s'opposant à une exportation massive de ces éléments vers le parenchyme foliaire, qui manifeste une forte sensibilité à l'égard de ces constituants chimiques. Ceci est confirmé par nos résultats, qui montrent qu'en dépit du niveau d'accumulation du cadmium, cinq à dix fois plus faible dans la partie aérienne que dans les racines, les effets inhibiteurs sur la croissance y sont toujours plus importants [43]. Sous l'effet du cadmium, les plantules manifestent des symptômes visibles d'intoxication tels que la chlorose et l'apparition de taches nécrotiques au niveau des limbes foliaires, ce qui explique la diminution des teneurs en chlorophylles. À cet effet, la tomate s'est révélée moyennement sensible au cadmium. En effet, une diminution de la croissance est obtenue à partir d'une dose modérée de Cd, de 10 μM. D'après la Fig. 1D, l'augmentation de la concentration externe en cadmium fait diminuer progressivement la teneur des tissus en nitrate. Ces résultats, qui ne peuvent être imputés à une accélération des processus métabolique de cet anion, traduisent sans doute un ralentissement dans le fonctionnement des systèmes membranaires des cellules racinaires impliqués dans le prélèvement du nitrate [2,44,45]. De même, le cadmium peut affecter négativement la sécrétion dans le xylème [3].
Il est généralement admis que, chez les végétaux supérieurs, l'assimilation de l'ammonium provenant de la réduction du nitrate se fait essentiellement selon la voie GS/GOGAT [9,46–49]. Une stimulation de l'activité aminatrice de la GDH (NADH–GDH ) a été observée, en même temps qu'un accroissement de la teneur des tissus en ammonium [3,4], ainsi qu'une diminution de l'activité désaminatrice de la GDH (GDH–NAD+).
Le traitement des plantes par le cadmium stimule les activités GS1 et NADH–GOGAT, à la suite d'une induction de la transcription des gènes qui contrôlent l'expression de ces enzymes, et inhibe celles de la GS2 et de la Fd–GOGAT. La stimulation des activités NADH–GDH et NADH–GOGAT suggère que ces deux enzymes pourraient compenser la diminution de l'activité Fd–GOGAT et assurer la production du glutamate. L'inhibition de l'activité GS totale suggère que la production de la glutamine n'est pas privilégiée chez les plantes traitées par le cadmium, même si on a pu constater une accumulation de la quantité de protéine GS1 et une stimulation de la synthèse de l'ARNm de cette dernière.
L'augmentation de la synthèse des ARNm GS1, de la NADH–GOGAT et de la NADH–GDH, accompagnée par une stimulation de leurs activités, constitue une réponse de type adaptatif destinée à augmenter la disponibilité du glutamate et permettant la remobilisation de l'azote protéique, à la suite de la dégradation des contenus en protéines chloroplastiques. Ainsi, l'inhibition des activités GS2 et Fd–GOGAT serait une conséquence de la destruction des chloroplastes sous l'effet d'une sénescence précoce induite par l'effet phytotoxique du cadmium. Cette sénescence induite est bien illustrée par la diminution de l'activité photosynthétique des feuilles des plantes traitées par le cadmium.
Pour expliquer les changements observés au niveau de l'activité ICDH à la suite du traitement par le Cd, une étude électrophorétique a été menée sur des extraits de feuilles et de racines, constituant l'organe préférentiel de la localisation de l'ICDH. À partir des résultats obtenus, on peut constater qu'en présence de cadmium dans le milieu de culture, il y a augmentation de la quantité de protéines dans les deux types d'organes. Nos résultats permettent donc de suggérer l'existence dans les conditions de stress métallique, d'une stimulation de l'activité ICDH–NADP+, consécutive à une forte augmentation en protéine ICDH–NADP+. Une telle situation conduit raisonnablement à la stimulation de l'activité MDH conditionnée par la demande cellulaire en chaînons carbonés, sous forme d'acides cétoniques (oxaloacétate). Ainsi, le besoin en squelettes carbonés nécessaires à la respiration pourrait solliciter une stimulation de la NAD(P)+–MDH dans les racines, afin de fournir l'oxaloacétate permettant d'alimenter le cycle de Krebs.
Les rapports entre les activités de la forme oxydée/forme réduite chez les plantes cultivées sur milieu de culture en présence de Cd montrent une stimulation de la synthèse de ce métabolite (OAA) dans les tissus racinaires et conducteurs (Tableau 3). Dans les feuilles des plantes traitées au cadmium, la chute de la photosynthèse et le besoin accru des racines en sources carbonées pourraient provoquer le phénomène inverse et solliciter la production de malate directement exportable des feuilles vers les racines. Cette hypothèse est soutenue par l'observation au niveau des feuilles d'une stimulation de l'activité de la NAD(P)H–MDH (Tableau 3) conduisant à la synthèse du malate. Notons, par ailleurs, que le malate pourrait également contribuer au piégeage du Cd. Le manque d'acides cétoniques dans les racines ainsi que la remobilisation de l'azote foliaire pourraient, selon le modèle décrit par Masclaux et al. [50], être à l'origine de l'arrêt du transport et de l'assimilation du nitrate dans ces organes. Un phénomène semblable a été décrit pour expliquer l'arrêt de l'assimilation du nitrate au cours de la sénescence quand les tissus foliaires sont soumis à la force de puits exercée par les organes reproducteurs [51,52].
Rapport des activités de la malate déshydrogénase NAD+/NADH dans les feuilles (A) et les racines (C) et NADP+/NADPH, dans les feuilles (B) et les racines (D) en fonction de la concentration de Cd dans le milieu de culture
| CdCl2 (μM) | Feuilles | Racines | ||
| A | B | C | D | |
| 0 | 16,06 | 38,9 | 1,14 | 1,03 |
| 5 | 9,32 | 15,9 | 1,85 | 1,31 |
| 10 | 7,62 | 7,11 | 2,92 | 1,69 |
| 20 | 4,84 | 5,77 | 4,68 | 2,94 |
| 50 | 4,14 | 3,13 | 7,04 | 4,79 |
En définitive, nos résultats plaident en faveur de l'hypothèse selon laquelle les conditions de stress métallique, qui accélèrent les processus protéolytiques générateurs d'ammonium, induisent un changement de pH dans les cellules de la plante. L'alcalinisation du pH cytologique est requise pour déclencher la chaîne de réactions contrôlant la stimulation coopérative de la GDH, de l'ICDH et de la MDH, pour assurer une fourniture suffisante de squelettes carbonés. Dans le cas de la GDH et de la GS1, nous avons mis en évidence l'induction transcriptionnelle des gènes correspondants et la répression d'autres gènes (GS2 pour les feuilles) sous l'effet du cadmium. Ce résultat montre qu'en situation de stress induit par le cadmium, les tissus foliaires expriment les mêmes marqueurs métaboliques qu'en situation de sénescence naturelle [13,53]. Ces changements d'expression des enzymes du métabolisme des acides organiques font partie d'un large programme assurant un détournement du flux de carbone vers la voie de synthèse de l'α-cétoglutarate capable d'assurer l'assimilation de l'ammonium. Ceci peut être considéré comme un processus adaptatif permettant une meilleure coordination entre les différentes enzymes pour se débarrasser de ce métabolite potentiellement cytotoxique. Comme l'ont suggéré certains auteurs dans des travaux effectués en conditions de stress hydrique [54,55], ces réajustements d'activités enzymatiques constituent un moyen d'adaptation permettant une réponse appropriée des plantes à la contrainte métallique. En fin de compte, il semble que les activités GDH, ICDH et MDH, qui assurent un lien étroit entre les métabolismes azoté et carboné, peuvent exercer une fonction vitale dans les conditions de stress métallique, en coopérant dans le contrôle de la synthèse de métabolites azotés impliqués dans les processus d'adaptation biochimique aux stress métalliques [56]. En revanche, la répression par le cadmium des enzymes NR, NiR, GS2 et Fd–GOGAT, contrôlant la synthèse des constituants de la matière vivante, peut être en partie responsable de la chute de l'activité de croissance. L'ensemble des résultats présentés dans ce travail suggère que, parallèlement à l'inhibition de la principale voie de la production des acides aminés, la tomate cultivée en présence de polluant métallique (cadmium) a présenté des voies de détoxication permettant de recycler l'ammonium accumulé, précisément par l'induction de la GS 1, la stimulation de la NADH–GOGAT et la forte stimulation de la GDH, consécutivement à une néosynthèse de nouvelles isoformes dans les feuilles, en coopération avec les enzymes du métabolisme carboné.


