Abridged English version
Introduction
Vanadium is a trace element distributed extensively in nature and used increasingly in various heavy industries, such as steel, oil, etc. [1]. It is a major trace metal in fossil fuels, and combustion of these materials provides a significant environmental source of this element.
The chemistry of vanadium is complex because this element can exist in oxidation states ranging from −1 to +5, preferentially +3, +4 (IV) for vanadyl and +5 (V) for vanadate. Forms of vanadium are function of pH. In neutral solutions, vanadium occurs mainly in the form of the pentavalent anion vanadate (, V5+). This form, which is the most toxic, easily enters living cells where it can be reduced into vanadyl in a process dependent on the presence of NADPH, glutathione (GSH) and other reducing substances [2].
Years ago, it was discovered that vanadium salts have a strong insulin-mimetic activity in animal models of diabetes and, more recently, in diabetic patients [3,4]. However, toxic effects of vanadate were reported, strongly reducing its therapeutic use [5,6].
Considering the problem from an opposite point of view, polyphenols are known to possess anti-oxidative properties due to their radical scavenging and metal-chelating functions. As a consequence, polyphenols are believed to display anti-toxic and anti-mutagenic activities [7]. In animal models, tea administration has been shown to inhibit tumour formation at different organ sites including the skin, stomach, intestine, liver, pancreas... [9,11]. Many publications suggest that EGCG, a major water extractable constituent of tea, has been to inhibit tumour formation in certain animal models and to display many anticancer related activities in vitro. Nevertheless, the biological activities of other polyphenolic compounds and caffeine in tea could also significantly contribute to the inhibition of tumourigenesis [8,9,11].
The aim of the present study was to evaluate the oxidative stress responses induced by an acute exposure to vanadate, in the form of ammonium metavanadate. Different changes on antioxidant enzymes activities, vitamins E and A and lipid peroxidation were observed upon metavanadate intoxication.
Experiments were carried out on male rats permanently poisoned with ammonium metavanadate injections (5 mg/kg/day) for 10 consecutive days. Some animals also received green-tea decoction as beverage in order to check whether it could decrease the vanadate-induced oxidative damages.
Material and methods
Animals
‘Wistar’ male rats, 2-months old, about 100-g body weight, fed on 15% proteins food pellets (SICO, Sfax, Tunisia), 20 g/animal/day, were kept in a breeding farm, at 22 °C, with a stable hygrometry, under constant photoperiod. They were divided into two equivalent batches for a preliminary experimental step consisting in giving either normal tap water to one batch (T0) or a tea decoction made of 66 g green tea (Camellia sinensis) dry leaves per litre of tap water to the other batch (Th0). This preliminary step lasted one month, allowing all animals to be sexually mature. Then, (T0) batch was again divided into two groups of 4 animals each. One group was kept on tap water and animals were IP injected daily with 0.9% NaCl (T). The other group (V) was kept on tap water and animals were IP injected with ammonium metavanadate: 5 mg NH4VO3/kg body weigh/day. (Th0) batch was similarly divided into two groups of four animals each. One group (Th) was kept on green-tea decoction and animals were IP injected daily with 0.9% NaCl. The other group (Th + V) was kept on green-tea decoction and animals were IP injected with 5 mg NH4VO3/kg/day. Administered amount of metavanadate and the amount of green tea (dry leaves) were chosen according to the previous studies of Haguenoer and Furon (1982) in rats and of Trevisanato (2000) in humans. Treatments were carried out for 10 days; four animals in each group were sacrificed after 1, 3, 5, and 10 days.
Estimation of lipid peroxidation
The level of lipid peroxidation products in tissues was measured as thiobarbituric acid reactive metabolites (TBA-rm) according to [26].
About 1 g of rat organs, namely: liver, kidney and testes, was cut into small pieces and immersed into 2 ml ice-cold lysis buffer (TBS, pH 7.4), then sonicated (for 10 s, twice) and centrifuged (, 30 min, 4 °C). Supernatants were Supernatants were collected and stored at −80 °C until use.
125 μl of supernatants were homogenized by sonication with 50 μl of TBS, 125 μl of TCA-BHT in order to precipitate proteins and centrifuged (, 10 min, 4 °C).
200 μl of supernatant were mixed with 40 μl of HCl (0.6 M) and 160 μl of TBA dissolved in Tris and the mixture was heated at 80 °C for 10 min.
The absorbance of the resultant supernatant was read at 530 nm. The amount of TBA-rm was calculated by using an extinction coefficient of 156 mM−1 cm−1.
Vitamins E and A
The blood was stored on ice until the serum was separated using centrifuge. Aliquots of the serum were immediately placed in obscurity to prevent the oxidation of tocopherol by ultraviolet light and stored at −70 °C until assayed.
The extraction of vitamins E and A standard preparations were performed as described by Lee et al. [23] with some modification. Briefly, 200 μl of serum were extracted in 500 μl of hexane. The sample was evaporated under nitrogen draught.
Preparations were removed and stored in amber vials at −20 °C until analysis.
In HPLC analysis, the column used was a Hypersil BDSC18 (). The mobile phase consisted of methanol/butanol/water (89.5:5:5.5). The flow rate was set at 1.7 ml/min and 50 μl of the organic extract was injected. Retinol and retinyl acetate were detected at 340 nm and α-tocopherol was detected at 292 nm.
Retention times for retinol, retinyl acetate and α-tocopherol were 2–3 min, 4–5 min and 11–15 min, respectively.
Enzyme assays
SOD activity was assayed by measuring its ability to inhibit the photoreduction of NBT [25]. In this assay, one unit of SOD is defined as the amount required to inhibit the photoreduction of NBT by 50%. One millilitre of Erythrocyte supernatant combined 50 mm phosphate buffer (pH 7.8), 39 mM methionine, 2.6 mM NBT and 2.7 mM EDTA.
Riboflavin, as to obtain a concentration of 0.26 mM, was added as the last and switching on the light started the reaction; changes in absorbance at 560 nm were recorded after 20 min.
Catalase activity was measured according to [24]. The reaction mixture (1 ml) contained a 100 mM phosphate buffer (pH = 7), 500 mM H2O2 and the erythrocyte homogenate. The reaction started by adding H2O2 and its decomposition was monitored by following the decrease in absorbance at 240 nm for 1 min. The enzyme activity was calculated by using an extinction coefficient of 0.043 mM−1 cm−1.
Results
Impact on lipid peroxidation
Oxidative stress induced by an acute exposure (1 and 10 days) to an ammonium metavanadate concentration of 5 mg/kg was studied in liver, kidneys and testes. In these tissues, we analysed lipid peroxidation. Compared to controls, 407%, 197% and 115% increase of MDA were noticeable respectively in liver, kidneys and testes. This increase indicates an enhancement of membrane lipid peroxidation after 10 days of treatment.
A one-month pre-treatment with green tea, followed by 10 days of treatment (TH) did not change lipid peroxidation in liver and testes as compared to controls, but induced a clear decrease of MDA in kidneys. Pre-treatment with green tea, followed by 10 days of co-treatment (Th + V) was found to decrease the MDA overexpression, which was induced by vanadium alone in kidneys, liver and testes.
Effects on SOD and catalase activities
In order to evaluate if the defence mechanisms against vanadium toxicity were sufficient to protect the cellular membrane against vanadium mediated oxidative damage, we analysed SOD and catalase activities in the erythrocyte supernatant.
These two enzymes activities started to increase 24 h after vanadium intoxication and continuously increased during 5 days of exposure.
Prolonged exposure to vanadium resulted in a decreased activity of SOD and catalase after 10 days, indicating an oxidative stress. In contrast, associated to green tea, vanadium did not affect SOD and catalase activities compared to controls.
Effects on vitamins E and A
To examine if vanadium exposure results in changes in the antioxidant defence system in serum, we analysed also for two scavenging molecules, such as vitamins E and A.
After 24 h of vanadium treatment, we noticed a decrease of the vitamin E level until day 10.
Concerning vitamin A, vanadium induced a decrease only after 10 days of treatment.
A one-month pre-treatment by green-tea drinking did not significantly change the level of vitamins E and A.
1 Introduction
Le vanadium est un métal très répondu dans la nature, largement utilisé dans les industries sidérurgiques, qui traitent le minerai et fabriquent des alliages à base d'acier et de vanadium. Les raffineries de pétrole brut ainsi que les centrales électrothermiques sont également des sources importantes de dispersion de ce métal dans l'atmosphère [1].
Une des caractéristiques chimiques de ce métal est qu'il présente des degrés d'oxydation allant de −1 à +5, +3 et +4 pour les « vanadyls » et +5 pour les « vanadates ». Pour des pH inférieurs à 3,5, le vanadium existe principalement sous la forme vanadyl (VO2+), alors qu'en solution alcaline la forme orthovanadate est prépondérante. Dans les solutions neutres, le vanadium est le plus souvent présent sous sa forme pentavalente (), qui est la plus toxique, car elle pénètre facilement dans la cellule, où elle est réduite en vanadyl (+4) [2].
En médecine, les composés du vanadium ont été utilisés dans le traitement des diabètes de type 1 et 2, car le vanadate mime les effets de l'insuline en prenant la place de celle-ci sur son récepteur [3,4].
Cependant, des effets toxiques ont été rapportés après une prise chronique des composés du vanadium [5,6]. Comme les autres métaux de transition, le vanadium possède la capacité de générer des radicaux hydroxyles très réactifs [7,8], susceptibles d'entraîner une peroxydation des lipides et des altérations de l'ADN [9]. Il a également été montré que le vanadium inhibait l'activité d'enzymes antioxydantes telles que la catalase et la glutathion peroxydase, ce qui aggrave le stress oxydant généré par le métal. Le stress oxydant étant suspecté d'augmenter la genèse de nombreuses maladies plurifactorielles telles que les maladies neurodégénératives, les maladies cardio-vasculaires, les cancers [10,11], de nombreux travaux ont eu pour but de trouver des moyens pour limiter le stress oxydant.
Ce travail a été entrepris dans le but de vérifier si la consommation régulière de thé vert pouvait diminuer le stress oxydant généré par le vanadium et limiter certains de ses effets toxiques. En effet, le thé vert est connu pour sa richesse en polyphénols flavonoïdes et tanins, qui possèdent des propriétés antioxydantes [12,13] dues à leurs fonctions de piégeage des radicaux libres [14–16] et de chélation des métaux [17], ainsi qu'une activité préventive vis-à-vis de nombreux cancers [18–20].
Dans ce but, des rats témoins buvant de l'eau ou une décoction de thé vert depuis un mois ont été, ou non, traité par du métavanadate d'ammonium (5 mg NH4VO3/kg de poids corporel/jour) administré par injection intrapéritonéale pendant 10 j. Dans les différents groupes de rats et en fonction du temps de traitement, on a évalué le niveau de peroxydation lipidique tissulaire (TBARS) et les systèmes de défense antioxydants : activités de la superoxyde dismutase (SOD) et de la catalase, ainsi que les concentrations sériques de vitamines A et E, connues pour piéger l'oxygène singulet et les radicaux peroxyles [21].
2 Matériels et méthodes
2.1 Animaux
Nous avons utilisé 128 rats mâles de souche « Wistar », d'environ 100 g de poids corporel. Ils ont été répartis en lots de huit par cage, et placés dans une animalerie munie d'un système de ventilation et d'un système réglant les périodes d'obscurité (10 h) et de lumière (14 h), avec une hygrométrie stable, et dans laquelle la température était régulée à 22 °C.
2.2 Protocole expérimental
Les rats ont été séparés en deux groupes : un groupe (T) buvant de l'eau du robinet et un groupe (TH) buvant une décoction de thé vert (66 g/l). Après un mois de ce traitement, chacun des groupes (T) et (TH) a été séparé en deux sous-groupes de 32 animaux. Les rats des sous-groupes V et TH + V ont reçu chaque jour une injection intra-péritonéale de 5 mg NH4VO3 par kilogramme de poids corporel. Les sous-groupes non traités (T) et (TH) ont reçu une injection de NaCl à 0,9%. Selon les lots, le traitement a été poursuivi pendant 1, 3, 5 et 10 j.
2.3 Prélèvement des échantillons et préparation des extraits
Le sacrifice des animaux a toujours eu lieu le matin par décapitation rapide, pour éviter l'effet du stress.
Le foie, les reins et les testicules ont été prélevés pour évaluer le niveau de peroxydation lipidique (TBARS). Des fragments (1 g de foie, de rein ou de testicule) ont été broyé dans 2 ml de tampon Tris (Tris 50 mM, NaCl 150 mM, pH 7,4) à l'aide d'un homogénéisateur Ultra-turax, puis centrifugé à 9000 tours/min à 4 °C pendant 15 min afin de récupérer le surnageant, qui a été rapidement congelé à −70 °C.
Pour le dosage de la vitamine E et A sériques, le sang a été recueilli sans anticoagulant puis centrifugé et le sérum a été congelé à −70 °C.
Pour les dosages enzymatiques (catalase et SOD) sur les cellules sanguines, le sang a été recueilli sur héparine et centrifugé (9000 tours/min). Le culot cellulaire a été repris dans 2 ml de tampon Tris (Tris 50 mM, NaCl 150 mM, pH 7,4) et congelé à −70 °C.
2.4 Dosages biochimiques
2.4.1 Dosage des protéines
Le dosage des protéines a été réalisé selon la méthode de Lowry et al. [22]. La quantité de protéines correspondant à la DO mesurée à 490 nm a été calculée à partir d'une courbe étalon réalisée avec des concentrations croissantes d'albumine bovine : 125 μg/ml ; 250 μg/ml ; 375 μg/ml ; 500 μg/ml.
2.4.2 Dosage des vitamines E et A sériques par HPLC
L'extraction des vitamines A et E a été réalisée selon la procédure de Lee et al. [23]. Brièvement, 200 μl de sérum ont été extrait dans 500 μl d'hexane et évaporés sous un courant d'azote. L'extrait sec a été repris dans du méthanol et 50 μl ont été injecté dans la colonne HPLC sous un débit de phase mobile de 1,7 ml/min. La colonne utilisée était de type Hypersil BDSC18, de diamètre interne et de longueur . La phase mobile était un mélange méthanol/butanol/eau (89,5%:5%:5,5%).
Le rétinol (vitamine A) et le rétinyl acétate (étalon interne) ont été détectés à 340 nm et l'α tocophérol (vitamine E) à 292 nm. Les temps de rétention pour le rétinol, le rétinyl acétate et le α-tocopherol ont été respectivement de 2–3 min, 4–5 min et 11–15 min.
2.4.3 Mesure de l'activité catalasique
L'activité catalasique a été mesurée selon la méthode d'Aebi [24] par la mesure de la diminution de l'absorbance d'une une solution d'H2O2 (concentration finale 50 mM après addition de l'extrait cellulaire), mesurée à 240 nm pendant 1 min à 25 °C, cette diminution étant due à la dismutation du peroxyde d'hydrogène par la catalase selon la réaction : 2 H2O2 → 2 H2O + O2. L'activité enzymatique a été calculée en utilisant un coefficient d'extinction de 0,043 mM−1 cm−1.
2.4.4 Mesure de l'activité de la superoxydismutase (SOD) [25]
L'activité SOD a été évaluée grâce à sa propriété de diminuer la photoréduction du NBT (nitroblue tetrazolium). Dans un milieu aérobie, le mélange riboflavine/méthionine/NBT donne une coloration bleue, dont la DO a été mesurée à 580 nm. Une unité de SOD correspond à la quantité de protéine nécessaire pour inhiber la photoréduction de 50%.
2.4.5 Peroxydation lipidique au niveau de certains organes
La peroxydation lipidique a été évaluée par le mesure des substances réagissant avec l'acide thiobarbiturique (TBARS) ce qui inclue des aldéhydes (dont le MDA) et des lipides hydroperoxydés [26].
125 μl d'extrait, 50 μl de TBS et 125 μl de TCA 20%–BHT 1% ont été mélangé pour déprotéiniser les extraits. Après agitation, incubation à 80 °C (10 min) et centrifugation (1000 tours/min pendant 10 min), le surnageant a été prélevé. 200 μl du surnageant ont été mélangé avec 40 μl de HCl (0,6 M) et 160 μl de Tris–TBA (Tris 26 mM, acide thiobarbiturique 120 mM). Après agitation, incubation à 80 °C (10 min), la densité optique a été mesurée à 530 nm. La quantité de TBARS a été calculée en utilisant un coefficient d'extinction de 156 mM−1 cm−1.
2.4.6 Statistiques
Les résultats sont présentés sous forme de moyenne . Les comparaisons entre groupes ont été réalisées par un test t de Student. Une valeur de est considérée comme significative.
3 Résultats
3.1 Effet des traitements sur les concentrations sériques des vitamines A et E
La Fig. 1 montre que le thé vert absorbé depuis un mois par les rats (TH) avant J1 n'a pas entraîné de modification significative des concentrations de vitamines E et A par rapport aux rats témoins (T).

Concentrations sériques de vitamine E et A (μg/ml) chez des rats témoins (T) ou buvant du thé depuis un mois (TH) respectivement traités par du métavanadate d'ammonium (V) et (TH + V) pendant 1, 3 et 10 j. Nombre de déterminations : 8. Comparaison avec les rats (T) : ; . Comparaison avec les rats (V) : ; .
À la suite des injections intrapéritonéales journalières de vanadium (5 mg de NH4VO3/kg de PC), les rats (V) ont présenté une diminution significative des taux de vitamine E sérique dès le premier jour et pendant toute la période de traitement (10 j). Les concentrations sériques de vitamine A ont été significativement inhibées uniquement au 10e jour de traitement.
Chez les rats (TH + V), les effets inhibiteurs du vanadium ont presque totalement disparu. En effet, seule la vitamine E a été trouvé modérément inhibée : à J1 par rapport aux rats témoins et à J1 et J3 par rapport aux rats TH. En revanche, à J10, les concentrations de vitamines A et E ont été trouvées augmentées.
3.2 Effet sur l'activité catalasique des cellules sanguines
Comme le montre la Fig. 2, le vanadium a provoqué en début de traitement (1–3 j) une très forte induction de l'activité catalasique qui a ensuite disparu à J5. Après 10 jours de traitement, l'activité catalasique était plus faible que chez les témoins.
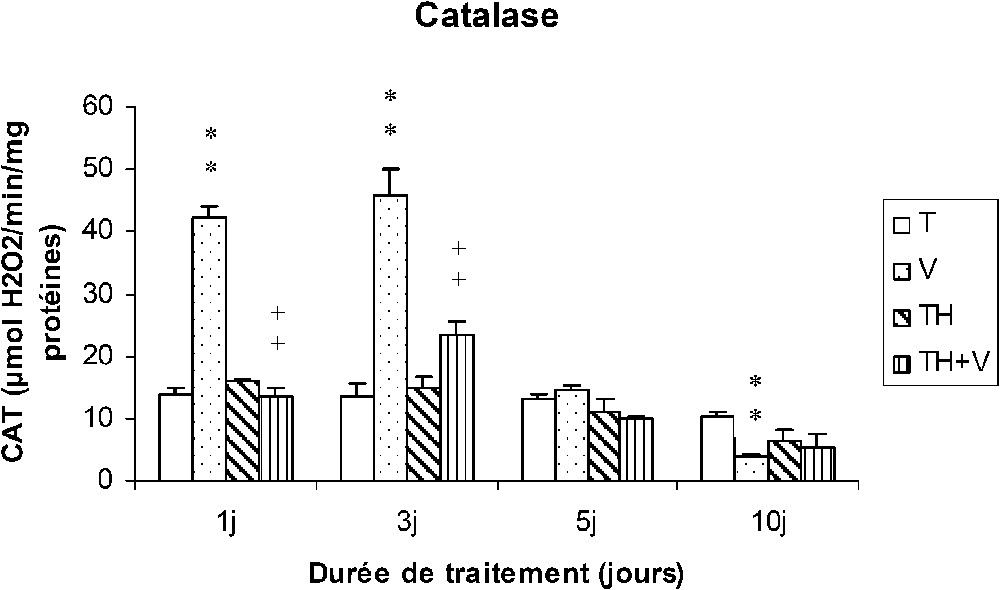
Activité catalasique des cellules sanguines (μmol H2O2/min/mg protéines) chez des rats témoins (T) ou buvant du thé depuis un mois (TH) respectivement traités par du métavanadate d'ammonium (V) et (TH + V) pendant 1, 3, 5 et 10 j. Nombre de déterminations : 8. Comparaison avec les rats (T) : ; . Comparaison avec les rats (V) : ; .
Chez les rats (TH), le thé n'a pas induit de modification de l'activité catalasique. Chez les rats consommant du thé (TH + V), le vanadium n'a induit qu'une augmentation modérée de l'activité catalasique à J3.
3.3 Impact sur l'activité de la SOD des cellules sanguines
L'activité de la SOD a été trouvée augmentée par rapport aux témoins chez les rats (V) en début de traitement (1 et 3 j) puis ensuite inhibée (5 et 10 j). Chez les rats TH + V, une augmentation de l'activité SOD a été également observée à J1 et J3, mais aucune inhibition significative n'a été mise en évidence en fin de traitement. Le thé seul n'a pas induit de modification significative (Fig. 3).
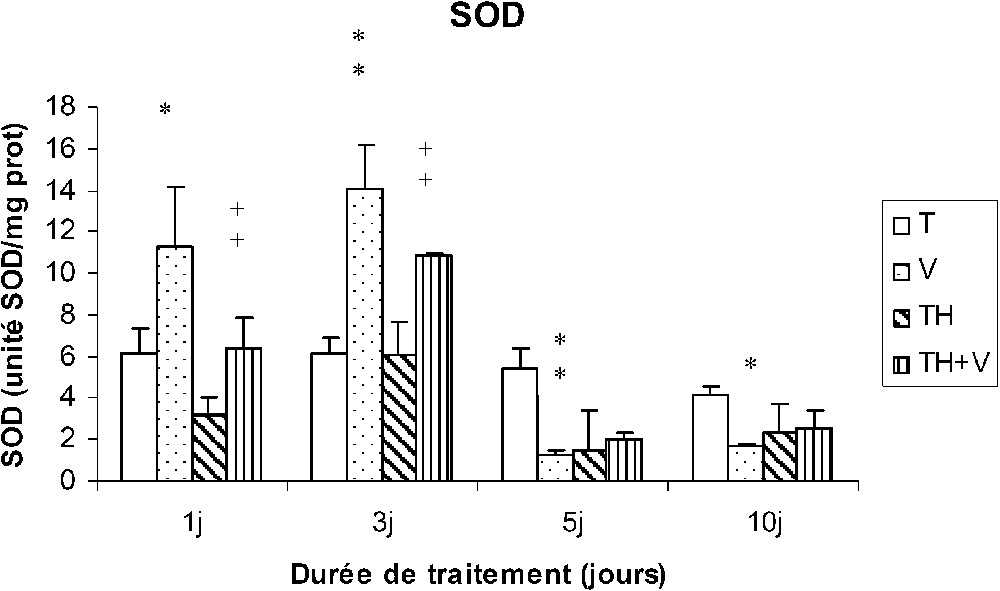
Activité de la SOD des cellules sanguines (unité SOD/mg protéines) chez des rats témoins (T) ou buvant du thé depuis un mois (TH) respectivement traités par du métavanadate d'ammonium (V) et (TH + V) pendant 1, 3, 5 et 10 j. Nombre de déterminations : 8. Comparaison avec les rats (T) : ; . Comparaison avec les rats (V) : ; .
3.4 Étude de la peroxydation lipidique (TBARS) au niveau des organes
Le vanadium a induit une importante augmentation des TBARS au niveau des tissus hépatiques, rénaux et testiculaires (Figs. 4–6), cette augmentation étant grossièrement dépendante du temps, comme le montre le Tableau 1, et particulièrement importante dès le premier jour de traitement au niveau des reins (Fig. 5).
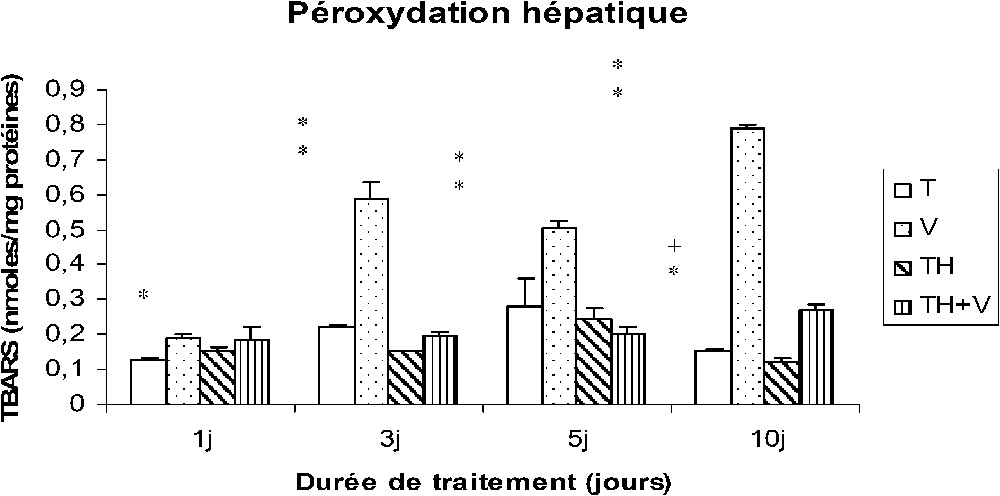
Taux des TBARS hépatiques (nmol/mg protéines) chez des rats témoins (T) ou buvant du thé depuis un mois (TH) respectivement traités par du métavanadate d'ammonium (V) et (TH + V) pendant 1, 3, 5 et 10 j. Nombre de déterminations : 8. Comparaison avec les rats (T) : ; . Comparaison avec les rats (V) : ; .
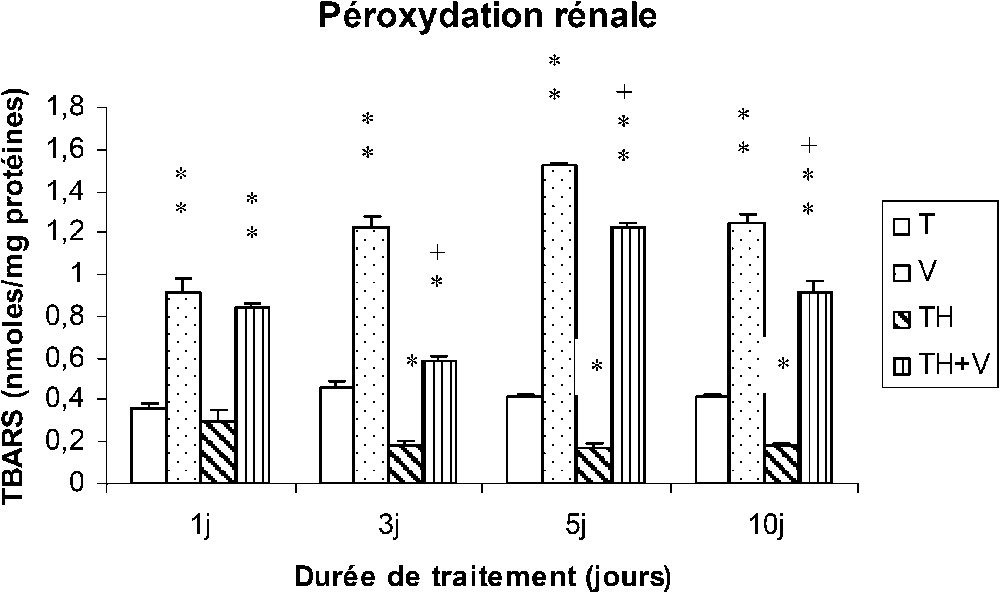
Taux des TBARS rénaux (nmol/mg protéines) chez des rats témoins (T) ou buvant du thé depuis un mois (TH) respectivement traités par du métavanadate d'ammonium (V) et (TH + V) pendant 1, 3, 5 et 10 j. Nombre de déterminations : 8. Comparaison avec les rats (T) : ; . Comparaison avec les rats (V) : ; .
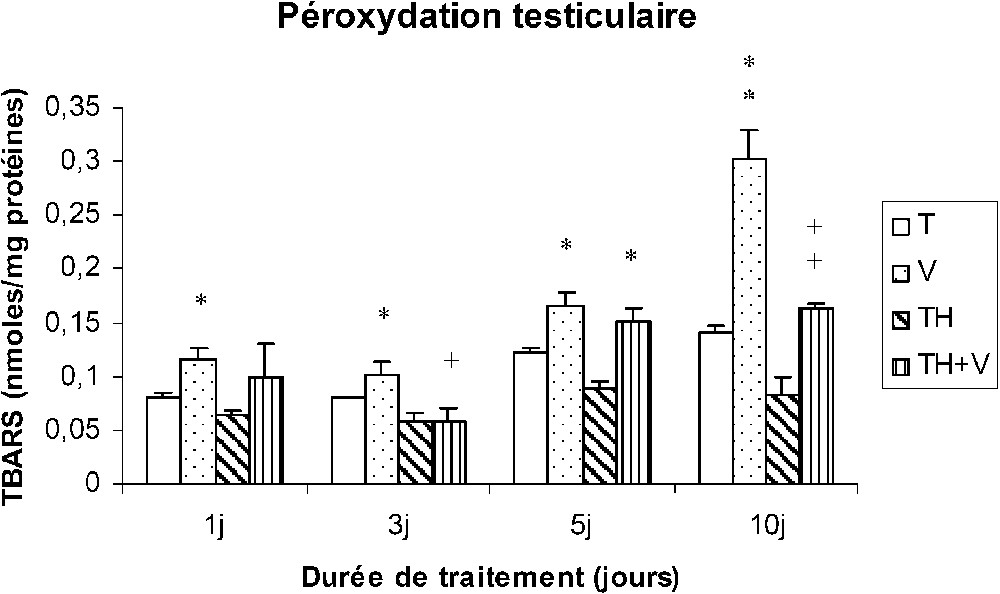
Taux des TBARS testiculaires (nmol/mg protéines) chez des rats témoins (T) ou buvant du thé depuis un mois (TH) respectivement traités par du métavanadate d'ammonium (V) et (TH + V) pendant 1, 3, 5 et 10 j. Nombre de déterminations : 8. Comparaison avec les rats (T) : ; . Comparaison avec les rats (V) : ; .
Pourcentage d'augmentation des TBARS induit par le vanadium chez les rats (V) par rapport aux rats (T)
| J1 | J3 | J5 | J10 | |
| Foie | 46 | 162 | 81 | 407 |
| Reins | 154 | 169 | 268 | 197 |
| Testicules | 43 | 27 | 36 | 115 |
Dans le foie des rats TH + V, aucune augmentation significative des TBARS n'a été trouvée de J1 à J5, seule une augmentation modérée ayant été détectée à J10. Au niveau des reins et des testicules, l'augmentation des TBARS induite par le vanadium était généralement plus faible que chez les rats (V).
La consommation de thé a induit une diminution des TBARS dans les tissus rénaux et testiculaires (TH), mais pas au niveau des tissus hépatiques.
4 Discussion et conclusion
Cette étude a été réalisée dans le but d'évaluer les effets oxydants d'un traitement chronique par le vanadium et d'élucider le rôle éventuellement protecteur de la consommation de thé vert.
Notre étude montre que l'injection du métavanadate d'ammonium par voie intrapéritonéale à la dose de 5 mg/kg/j a induit une augmentation significative de la peroxydation lipidique (TBARS) au niveau du foie, des reins et des testicules, qui apparaît dés le premier jour de traitement dans les reins. Ceci est peut être en rapport avec le rôle de filtration des reins et le fait le vanadium s'accumule préférentiellement dans cet organe [27].
Cette augmentation des TBARS confirme l'effet peroxydatif du vanadium. De nombreux auteurs ont mis en évidence une augmentation de la peroxidation lipidique après traitement par le vanadium [28–30].
Dans des cultures d'ostéoblastes, Cortiso et al. [7] ont montré que le vanadate induisait la production d'espèces réactives de l'oxygène et augmentait les TBARS, quatre heures après son introduction dans la culture. Ceci explique qu'une augmentation des TBARS ait été détectée un jour après la première injection de métavanadate d'ammonium dans les trois organes étudiés.
Nos résultats montrent que la consommation de thé vert pendant un mois n'a pas modifié le niveau basal des TBARS dans les tissus hépatiques et testiculaires des rats, mais l'a diminué au niveau des tissus rénaux. Ceci suggère que le thé a diminué le statut oxydant basal au niveau des reins.
Une diminution de la peroxydation des lipides au niveau du foie, du sérum et du tissu nerveux chez des jeunes rats recevant du thé vert pendant cinq semaines a cependant été rapportée [31]. De même, une diminution du MDA plasmatique a été noté chez des femmes ayant bu du thé pendant quatre semaines [32].
La consommation de thé a presque totalement inhibé l'effet peroxydatif du vanadium au niveau du foie et des testicules. De même, l'augmentation des TBARS induite par le vanadium au niveau des reins a été significativement diminuée par rapport à celle des rats témoins. Cet effet antioxydant est certainement dû à la richesse du thé vert en polyphénols, flavonoïdes et tanins, ainsi qu'à leur capacité de piégeage des radicaux libres [14–16].
Les cellules possèdent des systèmes de défense antioxydants, tels que les vitamines A et E (pièges à radicaux libres) et les enzymes antioxydantes : catalase et superoxyde dismutase, qui permettent de réguler le niveau des espèces réactives de l'oxygène intracellulaire.
À la suite de l'injection intrapéritonéale de NH4VO3, nous avons mis en évidence une diminution hautement significative des taux sériques de la vitamine E (tocophérol). Cette diminution est certainement en rapport avec la production d'espèces réactives de l'oxygène induite par le vanadium [7]. En effet, la vitamine E est considérée comme la première ligne de défense contre la peroxydation lipidique. Elle réagit en particulier avec le radical peroxyle ROO• pour former le radical tocophéryl, qui est stable, ce qui a pour effet d'arrêter les réactions en chaîne induites par les radicaux libres. Ce produit d'oxydation de la vitamine E est ensuite conjugué à l'acide glucuronique et excrété avec la bile. Ceci peut expliquer la diminution du taux de vitamine E chez les rats traités par le vanadium.
Ceci est en accord avec les travaux d'Aydin et al. [33] qui ont mis en évidence une augmentation du taux du MDA plasmatique et une diminution de la concentration en vitamine E chez des travailleurs d'une cimenterie âgés de 29 à 54 ans, exposés au vanadium présent dans les poussières. Une diminution de la vitamine E parallèlement à une augmentation de la peroxidation lipidique dans des cellules de Leydig de rats exposés à un stress oxydant a également été rapportée [34]. Il a par ailleurs été montré que l'administration d'α-tocophérol (355 et 585 mg/kg) inhibait les effets peroxydatifs du métavanadate de sodium [35] et que la vitamine E protégeait contre l'effet oxydant du vanadyl vis-à-vis des lipoprotéines [36].
La concentration sérique de vitamine A a également été diminuée par le métavanadate d'ammonium, mais uniquement en fin de traitement. Ceci peut être en rapport avec le fait que la vitamine A participe à la régénération de la vitamine E [37].
Chez les rats (TH + V), les taux des vitamines E et A étaient comparables à ceux des témoins, ce qui plaide en faveur du rôle protecteur du thé vert. En accord avec nos résultats, Zhu et al. [38,39] ont montré que les catéchines du thé vert protégeaient les LDL de l'oxydation, et de plus régénéraient l'α-tocophérol au niveau des LDL préalablement oxydés. L'évaluation in vitro de l'effet antioxydant des polyphénols du thé vert faite par Hashimoto et al. [40] a montré que les polyphénols ont une activité antioxydante beaucoup plus importante que celle de la vitamine E.
Nos travaux ont également montré que le vanadium induisait en début de traitement une augmentation de l'activité de la catalase et de la SOD des cellules sanguines, puis une inhibition au-delà du cinquième jour de traitement. L'augmentation de ces activités enzymatiques pourrait être expliqué par la production d'ions superoxydes, qui stimulent l'activité de la SOD, laquelle, en dismutant O2, produit de l'H2O2, qui stimule l'activité de la catalase En effet, Ye et al. [41], Huang et al. [42] et Wang et al. [43] ont montré que le vanadate induisait la production de radicaux libres et d'H2O2, ce qui induit l'activité catalasique.
La production excessive et l'accumulation de ces espèces réactives de l'oxygène pourraient expliquer les effets secondairement inhibiteurs du vanadium sur l'activité de la SOD et de la catalase ainsi que l'augmentation des TBARS observés en fin de traitement. Une diminution de l'activité de la catalase des érythrocytes de rats traités par voie orale avec 0,2 ou 1 mM de métavanadate d'ammonium a été rapportée [44]. Russanov et al. [45] ont montré également que l'administration de vanadium (0,15 mg V/ml) à des rats mâles pendant 14 j entraînait, au niveau des reins, une diminution de l'activité de la catalase et de la glutathion peroxydase. Alexandrova et al. [46] ont montré in vitro que les ions vanadium inhibaient l'activité catalase au niveau du foie et du rein et que cette diminution était en rapport avec une induction de la peroxydation lipidique.
En association avec le thé vert, le vanadium n'a pas induit de modification significative de l'activité de la catalase et de la SOD pendant les 10 jours du traitement. De même, le thé vert seul n'a pas eu d'effet. Ceci suggère que les espèces réactives de l'oxygène générées au niveau des cellules sanguines des rats traités par le vanadium étaient en quantité insuffisante pour induire l'activité de ces enzymes, et ceci du fait des capacités de piégeage des radicaux libres des composés phénoliques du thé.


