Abridged English version
The spatiotemporal distribution of decay events of radiotoxics at the cellular level is essential data for microdosimetric studies. SIMS microscopy is a surface analytical technique based on mass microscopy and secondary ion emission. The main advantage of SIMS microscopy is the ability to make direct observations of the distribution of any element occurring at the surface of a sample, with no need for specific labelling with a fluorescent or radioactive probe. SIMS microscopy is a powerful technique for studying the distribution of elements in biological tissues at the cellular level. Although having provided important information on stable and radioactive iodine distribution within the thyroid in normal and disturbed circumstances, this technique has been considered a marginal method in biology because of its poor lateral resolution and the insufficient mass separation power of the early instruments. Indeed, the main difficulty with SIMS microscopy is signal specificity, which is highly dependent on mass resolution: the complexity of the organic matrix leads to the emission of a large number of ions that can interfere with the studied element.
The latest high-resolution dynamic SIMS device (NanoSims50TM) that we used in this work has both a very good transmission at high mass resolution, and a high lateral resolution (). The emergence of thyroid cancer among the children exposed to radioiodine after the Chernobyl accident implies exhaustive information concerning the cellular contamination of their thyroid.
The objective of our study is to describe the kinetic cellular distribution of newly organified iodine in the immature thyroid using secondary ion mass microscopy (SIMS). The kinetic profile will allow us to propose an improved dynamic model for the dosimetric evaluation of the thyroid cells. To mimic a contamination by radioiodine, all pups (7 days old) received one subcutaneous injection of 0.2 μg iodine 129 (129I). Pups were sacrificed by exsanguination, 1 h to 8 days after 129I administration. The distribution of intracolloid iodine was recorded and analysed using the ionic nanoprobe NanoSims50TM. Images reflecting the distribution of newly organified iodine (129I) and the already present iodine pool (127I) were performed. Topography was revealed using 31P, which associates both with DNA in the cell's nucleus and phosphorylated cytoplasmic molecules, and 32S, which allows the identification of the thyrocolloid.
Our observations demonstrate that the distribution is varying as a function of time, and that the inter- and intrafollicular distribution of 129I is heterogeneous in the thyroid of newborn rats. Early images (1 to 8 h) show that 129I is mainly found at the periphery of the colloidal matter (ring distribution), close to the cells. A high degree of heterogeneity in the distribution of 129I within the ring was noted. Up to 7 days after administration, 129I is gradually found homogeneous in the entire colloidal matter.
SIMS microscopy allows us to obtain rapid high-resolution direct images of iodine distribution: its lateral resolution is 50 nm, contrasting with the 100 μm of autoradiography, and no radiolysis or Wolff–Chaikof effect is to fear. The animal model was set up to mimic the conditions of contamination by radioiodines in Chernobyl and the relative contribution at the cellular level of iodine-131 and short-lived isotopes of iodine. The latter deliver main part of their activity within the time of maximum heterogeneity.
1 Introduction
La distribution spatio-temporelle à l'échelon cellulaire des dépôts d'énergie d'un radiotoxique est une donnée essentielle pour réaliser les études microdosimétriques. En effet, il est essentiel d'établir un modèle d'irradiation cellulaire, et c'est à ce niveau qu'il conviendra de réaliser les études dosimétriques.
Lors de l'accident de Tchernobyl, parmi les produits de fission de l'uranium 235, les radioisotopes de l'iode 132 (132I), 133 (133I), 134 (134I) et 135 (135I) ont été dispersés avec de fortes activités, simultanément à l'iode 131 (131I) [1]. L'une des conséquences majeures de la dispersion de ces radioisotopes a été une apparition précoce (4 ans après l'accident) et importante (augmentation de l'incidence d'un facteur 100) de cancers de la thyroïde chez les enfants d'Ukraine et de Biélorussie, âgés de 0 à 15 ans en 1986 [2–4]. Cependant, de nombreux auteurs avaient prédit, lors des premières études dosimétriques, une faible augmentation des cancers thyroïdiens avec un temps de latence de 8 à 10 ans [5]. Différents facteurs peuvent expliquer cette sous-estimation du risque : l'âge de l'exposition, la déficience en iode qui existait dans les régions contaminées, le rôle des isotopes à vie courte et les hypothèses simplificatrices retenues pour les calculs dosimétriques initiaux [6–10]. En particulier, les radioisotopes de l'iode à demi-vie courte, négligés lors des premiers calculs dosimétriques, auraient, à dose égale, un risque cancérigène supérieur à celui de l'131I en raison d'un débit de dose plus élevé [11]. Par ailleurs, la captation de l'iode par la cellule thyroïdienne est un phénomène cinétique, et on peut supposer que les dépôts principaux d'énergie provenant des isotopes de l'iode à demi-vie très courte ne se produisent pas au même niveau que pour l'131I, de période plus longue. La détermination des sites cellulaires de distribution de l'iode et leurs variations au cours du temps reste donc le pré-requis essentiel pour évaluer la dose au thyrocyte.
Le but de nos travaux a été de décrire la cinétique de l'incorporation folliculaire de l'iode dans la thyroïde de rats nouveau-nés âgés de sept jours, à l'aide d'un microscope ionique : le NanoSIMS50 TM (Cameca, Paris, France). Ces travaux permettront de proposer, dans un second temps, un modèle dosimétrique dynamique.
La distribution de l'iode au sein de la glande thyroïde est généralement évaluée de façon indirecte par autoradiographie classique [12] ou, plus récemment, par l'expression des protéines impliquées dans le transport de l'iode comme l'expression du symporteur (NIS) ou de la pendrine [13,14].
La microscopie ionique analytique permet de réaliser une observation directe de la distribution de n'importe quel élément stable ou radioactif se trouvant à la surface d'un échantillon, sans recours à un marquage spécifique par une sonde fluorescente ou radioactive. Le principe de base de la microscopie ionique analytique consiste à appliquer les principes de la spectrométrie de masse à l'analyse de surface d'un échantillon solide. Cette technique de microanalyse a d'abord été utilisée pour l'étude de matériaux inertes, puis, depuis une trentaine d'années, elle est utilisée pour étudier la distribution d'éléments dans des tissus biologiques [15,16]. Bien que la microscopie ionique analytique ait fourni d'importantes informations, notamment sur la distribution de l'iode stable ou radioactif au sein de la thyroïde dans des conjonctures normales et pathologiques [17,18], celle-ci est considérée comme une méthode marginale en biologie. Ceci est dû à la faiblesse de la résolution latérale (1 à 0,5 μm) et à la faible résolution en masse des premiers instruments [19]. En effet, la principale difficulté de la microscopie ionique analytique est la spécificité du signal, qui est très dépendante de la résolution en masse : la complexité de la matrice organique conduit à l'émission d'un nombre important d'ions, qui peuvent interférer avec l'élément étudié.
Le NanoSIMS50 utilise une nouvelle nanosonde et une optique coaxiale. Ses principales caractéristiques sont une haute résolution latérale (⩽ à 50 nm), sa capacité à analyser, dans le même micro volume, cinq masses (ions) en parallèle, une excellente transmission à haute résolution en masse, et une visualisation directe de l'échantillon dans la chambre d'ionisation, permettant la sélection des zones d'intérêt [20].
2 Matériels et méthodes
2.1 Animaux
L'étude a été menée sur 11 rats nouveau-nés Wistar, issus d'une même portée. Durant toute la durée de l'étude, les animaux ont été nourris par leur mère, elle-même sous alimentation standard comprenant 2 mg d'iode 127 par kilogramme d'aliment sec.
Afin de reproduire une contamination interne par des radioisotopes de l'iode, chaque rat nouveau-né a reçu, à l'âge de sept jours, une injection sous-cutanée de 0,2 μg d'iode 129 (129I–Na+, NEN Life Science products, Boston MA, USA), sous un volume de 50 μl. L'iode 129 a été choisi pour le différencier de l'iode natif (de masse 127).
L'expérimentation animale est résumée dans le Tableau 1. Brièvement, les rats nouveau-nés ont été sacrifiés par exsanguination de 1 h à 8 j après l'administration de l'129I.
Résumé de l'expérimentation animale, avec T le temps entre l'administration de l'129I et le sacrifice, A l'âge au moment du sacrifice et N correspondant au nombre de rats nouveau-nés dans le groupe
| Groupe | T | A | N |
| 1 | 1 h | 7 | 3 |
| 2 | 4 h | 7 | 2 |
| 3 | 8 h | 7 | 2 |
| 4 | 24 h | 8 | 2 |
| 5 | 5 j | 12 | 1 |
| 6 | 8 j | 15 | 1 |
Des « témoins d'âge » (soit des animaux sans « contamination »), provenant d'une autre portée, ont été sacrifiés aux âges de 7, 12 et 15 j.
2.2 Préparation des échantillons thyroïdiens
Immédiatement après sacrifice, les thyroïdes des animaux « contaminés » et des animaux témoins ont été prélevées et fixées par de la glutaraldhéhyde à 2,5% en tampon cacodylate, puis lavées, déshydratées dans des bains successifs d'éthanol, et enfin incluses dans une résine époxy. Cette technique standard d'inclusion préserve la localisation et les concentrations locales d'iode lié aux macromolécules (99% de l'iode intrathyroïdien) et convient à la détection des éléments par microscopie ionique analytique [17].
Dans un premier temps, une série de coupes de 1 μm d'épaisseur a été réalisée, dans le but de repérer le tissu thyroïdien et d'éliminer le maximum de résine d'enrobage. Dans un second temps, des coupes de 0,5 μm d'épaisseur et de surface d'environ 1 mm2 ont été observées en microscopie optique, afin de pouvoir choisir les follicules à analyser. Les follicules sont sélectionnés parmi les follicules à colloïde, avec un diamètre folliculaire d'environ 20 μm (champs d'analyse ionique) localisés dans la partie centrale de la glande. De deux à trois coupes ultrafines (épaisseur = 0,5 μm) ont été déposées sur un porte-échantillon en inox poli.
2.3 Analyse par le NanoSIMS50
Les échantillons ont été bombardés par un faisceau d'ions césium (Cs+). Des images ioniques correspondant au pool initial d'iode (127I) et à la distribution de l'iode nouvellement incorporé (129I) ont été enregistrées. L'architecture thyroïdienne a été visualisée par l'enregistrement de la distribution du phosphore 31 (31P), élément dont les acides désoxyribonucléiques et les molécules phosphorylées du cytoplasme sont particulièrement riches, ainsi que de celle du soufre 32 (32S), permettant de visualiser la lumière folliculaire (la thyroglobuline est très riche en 32S). Dans le but de retrouver les follicules déterminés en microscopique optique, une acquisition rapide a été réalisée avec un champ d'analyse de 100 μm × 100 μm, bombardé par le faisceau Cs+ de 200 nm de diamètre, avec une intensité variant de 7 à 8 pA.
Les champs d'analyse ont été fixés entre 30 μm × 30 μm (un follicule analysé) et 80 μm × 80 μm (de deux à quatre follicules analysés), pour conserver à l'image finale la même qualité de résolution. Les follicules étant repérés, pour un champ de 30 μm × 30 μm, les échantillons ont été bombardés par un faisceau Cs+ de 100 nm de diamètre avec une intensité de l'ordre de 3 pA ; pour un champ de 80 μm × 80 μm, le diamètre du faisceau a été de 150 nm, avec une intensité de 5 pA.
Une étude préliminaire a montré que l'129I était l'élément le plus difficilement détectable. L'établissement de la résolution en masse (, avec M la masse étudiée et ΔM la plus petite différence de masse qui peut être distinguée) a donc été basée pour cette étude sur la détection de l'129I. En effet, entre les masses, 128,88 et 129, il existe beaucoup d'interférences, dont un polyatomique situé à un ΔM de 0,025 uma (Fig. 1) de l'129I. La résolution en masse pouvant séparer l'129I de ce polyatomique isobare est de 4820. Tous les éléments ont donc été analysés avec une résolution de 4820.

Spectre en haute résolution de masse enregistré à la masse 129 sur plusieurs structures de la thyroïde de rats nouveau-nés « contaminés ». L'129I n'a été retrouvé que dans la matière colloïdale à proximité des thyrocytes. Une résolution en masse de 4820 est nécessaire pour distinguer l'129I d'un ion polyatomique de masse très proche.
Les images des thyroïdes des rats nouveau-nés « témoins d'âge » acquises dans les mêmes conditions expérimentales sont présentées sur la Fig. 2. Le signal détecté à la masse 129 correspond au bruit de fond aléatoire du détecteur.

Images ioniques de la thyroïde d'un rat nouveau-né contrôle âgé de sept jours (champ = 50 × 50 μm). Les quelques « grains » distribués au hasard sur l'image 129I sont dus au mouvement propre du détecteur. Toutes les images sont présentées en échelle inversée de gris (noir = signal important).
3 Résultats
La Fig. 3A–F montre les images ioniques de la distribution folliculaire du 31P, de l'127I, de l'129I et du 32S à différents instants après l'administration de l'129I.
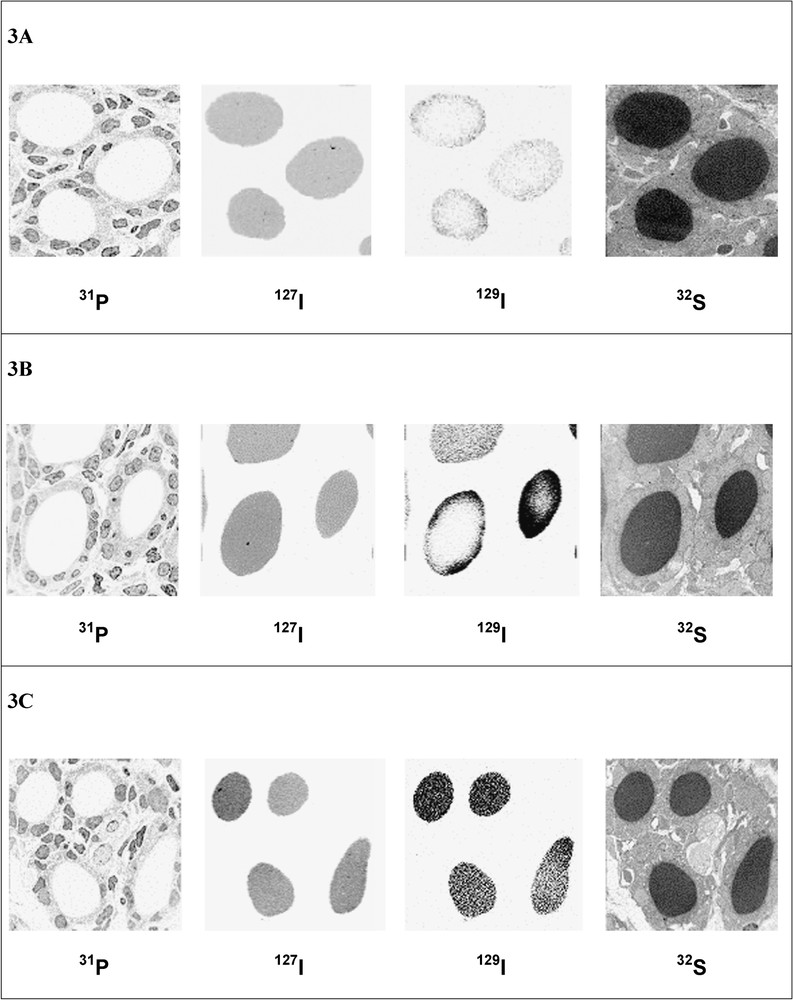

Cinétique des images ioniques des thyroïdes des rats nouveau-nés « contaminés ». (A) Images obtenues 1 h après l'administration de l'129I (champ = 45 × 45 μm). (B) Images obtenues 4 h après l'administration de l'129I (champ = 50 × 50 μm). (C) Images obtenues 8 h après l'administration de l'129I (champ = 50 × 50 μm).
Cinétique des images ioniques des thyroïdes des rats nouveau-nés « contaminés ». (D) Images obtenues 24 h après l'administration de l'129I (champ = 40 × 40 μm). (E) Images obtenues 5 j après l'administration de l'129I (champ = 50 × 50 μm). (F) Images obtenues 8 j après l'administration de l'129I (champ = 45 × 45 μm). Toutes les images sont présentées en échelle inversée de gris (noir = signal important).
À la masse 127, les images acquises montrent que, quel que soit l'âge de l'animal, la distribution colloïdale du pool d'iode initial est homogène.
Cependant, la distribution de l'129I nouvellement incorporé varie au cours du temps. En effet, sur les images ioniques obtenues précocement après la contamination (Fig. 3A et B), l'129I est essentiellement distribué à la périphérie du colloïde : distribution en anneau.
Il existe aussi une importante hétérogénéité de la distribution intracolloïdale de l'129I d'un follicule à l'autre, particulièrement chez les animaux sacrifiés 4 h après la « contamination », où sont observés quelques follicules avec une distribution homogène de l'129I (Fig. 3B). Huit heures après, la distribution de l'129I est homogène au sein de la matière colloïdale pour la plupart des follicules observés, quelques follicules présentant cependant encore une distribution hétérogène (Fig. 3C). De 1 à 8 jours après la « contamination », tous les follicules analysés présentent une distribution homogène de l'129I au sein de leur colloïde (Fig. 3D–F).
Dans Fig. 4A, des pseudo-couleurs ont été utilisées pour superposer les images obtenues pour les ions 31P− et 129I. Quatre heures après la contamination, les trois types de distribution sont visibles sur le même champ. La Fig. 4B représente la répartition de la quantité d'129I sur la surface colloïdale du follicule central. On observe qu'il existe une grande hétérogénéité fonctionnelle des thyrocytes au sein d'un même follicule.
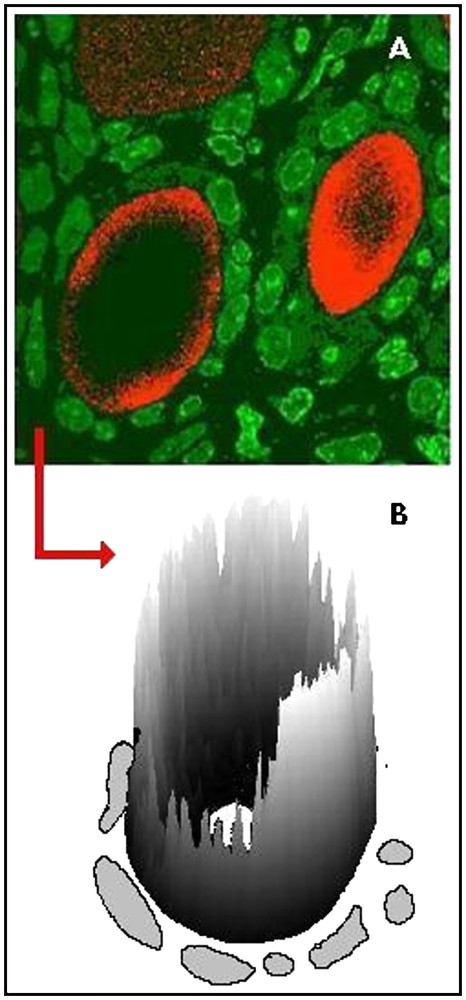
(A) Image de follicule thyroïdien d'un rat nouveau-né, 4 h après la contamination, avec superposition de pseudo couleurs, vert pour le 31P (noyaux des thyrocytes) et rouge pour l'129I (iode nouvellement organifié). (B) Représentation de la répartition de la quantité d'129I sur la surface colloïdale du follicule central (flèche rouge). Les noyaux des thyrocytes ont été dessinés pour mieux visualiser l'hétérogénéité de répartition de l'iode d'un thyrocyte à l'autre.
4 Discussion
Le NanoSIMS50TM, microscope ionique de dernière génération, nous a permis d'obtenir directement une cartographie cinétique de l'129I « nouvellement incorporé » et de l'iode 127 (127I) déjà présent, au sein d'un follicule thyroïdien de rat nouveau-né. Cette technique de microanalyse présente de nombreux avantages par rapport aux techniques autoradiographiques et microradioautographiques. Les images ioniques sont rapidement obtenues, en quelques minutes, au lieu de plusieurs jours, voire plusieurs mois d'exposition en autoradiographie. L'127I et le 32S présents en quantité importante dans les échantillons thyroïdiens sont acquis sur un temps de l'ordre de 5 ms par pixel. Pour l'129I et le 31P, le temps est de 15 ms par pixel, soit un temps d'analyse global de 15 min. La résolution spatiale est de l'ordre de 50 nm, alors qu'elle est de 1 à 10 μm en microautoradiographie et de l'ordre de 100 μm en autoradiographie sur film. Dans une étude récente, le NanoSIMS50 a permis de visualiser la fixation de l'127I-benzamide dans les grains de mélanine à l'intérieur de mélanocytes [21]. Par ailleurs, la possibilité d'utiliser des isotopes stables ou des radioisotopes à vie très longue à la place de sondes radioactives permet d'éviter les artéfacts de radiolyse. Enfin, des mesures quantitatives sont facilement réalisables. La teneur en iode 129I au sein du colloïde est évaluée après une première séance d'acquisition séquentielle de l'127I, puis de l'129I, et à nouveau de l'127I, permettant de confirmer la stabilité de l'émission des ions secondaires. Le rapport du taux d'émission de l'129I sur le taux moyen d'émission de l'127I peut être ainsi calculé.
Le modèle animal a été mis au point afin de reproduire les conditions d'une contamination interne et unique par des radioisotopes de l'iode. L'âge de contamination par l'129I (7 j) a été choisi comme correspondant à l'âge des enfants d'Ukraine et de Biélorussie au moment de l'accident de Tchernobyl, chez qui un nombre important de cancers de la thyroïde a été diagnostiqué : 90% de ces enfants avaient moins de dix ans en 1986 et 80% avaient moins de cinq ans à l'époque [1] ; quoiqu'une extrapolation directe à l'homme ne puisse être immédiate, la physiopathologie thyroïdienne du rat Wistar a été reconnue comme suffisamment proche de la physiologie humaine [22].
D'une part, le choix de l'129I pour mimer une contamination permet, de discriminer l'iode nouvellement incorporé (masse 129) de l'iode stable intrathyroïdien déjà présent (masse 127) ; d'autre part, ce radioisotope de l'iode a une période physique très longue ( années), qui permet l'inclusion en résine des échantillons thyroïdiens, en excluant les problèmes de décroissance et de transformation du signal. Sa période physique permet aussi d'éviter les effets radiotoxiques sur la thyroïde du rat nouveau-né (l'activité administrée est de 1,2 Bq). Aucun signe de nécrose cellulaire n'a d'ailleurs été observé sur les coupes thyroïdiennes utilisées pour localiser les follicules à analyser.
La masse d'129I administrée, qui est de 0,2 μg par rat nouveau-né, permet d'avoir une quantité totale d'iode incorporée dans la thyroïde de l'ordre de 20 ng, ce qui permet, d'une part, un temps correct d'acquisition des images ioniques et d'autre part d'éviter l'effet Wolff–Chaikof. En effet, un apport important d'iode inhibe la fixation organique de l'iode [23]. En tenant compte du fait que les rates ingèrent de l'ordre de 30 μg d'iode par jour [24], chaque rat nouveau-né provenant d'une portée de 10 individus en reçoit via l'allaitement approximativement 1 μg par jour. La quantité d'iode administrée correspond donc à une augmentation de seulement 20% de l'apport alimentaire quotidien.
Les calculs dosimétriques initiaux évaluant la dose absorbée par la thyroïde après l'accident de Tchernobyl ont pris comme hypothèse une répartition homogène de l'iode au sein de la thyroïde : concentration au sein de la thyroïde des radioisotopes de l'iode identique d'un follicule à l'autre et distribution dans la matière colloïdale homogène. Or, depuis près de 50 ans, on sait que l'hétérogénéité est une caractéristique essentielle du tissu thyroïdien et la diversité de la capacité des thyrocytes à métaboliser l'iode avait déjà été démontrée par autoradiographie du tissu thyroïdien, aussi bien dans les expérimentations animales que dans les études chez l'homme [25,26]. De plus, la proportion de thyrocytes ayant de faibles capacités d'organifier l'iode augmente avec l'âge [27]. Beaucoup plus récemment, des études ont mis en évidence l'hétérogénéité de l'expression du NIS sur les thyrocytes, confirmant l'hétérogénéité fonctionnelle [28]. Dans une de nos précédentes études chez l'animal, nous avions observé que la distribution des lésions radioinduites par des activités thérapeutiques et/ou diagnostiques d'131I était hétérogène d'un thyrocyte à un autre, suggérant une incorporation hétérogène d'une cellule à une autre au sein d'un même follicule [29].
Nos résultats visualisent l'hétérogénéité de la distribution précoce de l'iode nouvellement incorporé dans le colloïde (distribution en anneau, par ailleurs hétérogène) et sa disparition dans les temps plus tardifs. Enfin, la dispersion des comportements fonctionnels entre follicules voisins a été mise aussi en évidence.
Les hypothèses d'homogénéité de l'iode, d'une part, d'un follicule à l'autre et, d'autre part, d'un thyrocyte à l'autre au sein d'un même follicule, prises dans l'évaluation de la dose à la thyroïde, sont donc simplifiées.
Les radioisotopes de l'iode à vie courte ont été impliqués dans l'augmentation des cancers thyroïdiens développés par les habitants des îles Marshall, exposés en 1954 aux retombées radioactives [30]. Une des hypothèses la plus généralement admise concerne l'efficacité biologique supérieure des iodes à vie courte par rapport à l'131I : la dose délivrée à la thyroïde serait délivrée 10 fois plus vite par l'133I que par l'131I [11]. Des études récentes ont estimé à 30% la contribution globale des iodes à demi-vie courte aux doses reçues à la thyroïde par les personnes évacuées de la région de Tchernobyl, à partir de mesures d'activité réalisées quatre jours après l'accident [9]. En 2004, Gravilin et al. évaluent la contribution des iodes à vie courte à la dose reçue à la thyroïde à plus de 20% dans le cas d'une contamination précoce [10]. Malgré les nombreuses études et données, les radioisotopes de l'iode à vie courte ont été négligés dans les calculs de dose initiaux et on continue à imputer au seul 131I l'augmentation des cancers de la thyroïde après Tchernobyl [31].
Dans le cas d'une contamination par un « mélange » de radioisotopes de l'iode, les sites cellulaires « irradiés » vont varier au cours du temps. La distribution moyenne des désintégrations d'un radioisotope de l'iode à vie courte, comme l'132I ( h) par exemple, va dépendre de la façon dont se distribue l'iode dans les premières heures de sa captation par la thyroïde, alors que la distribution moyenne des désintégrations pour l'131I ( j) va correspondre à la localisation de l'iode à un temps plus tardif au sein des follicules thyroïdiens.
En conclusion, nos observations suggèrent que, dans le cas d'une contamination interne par un mélange de radioisotopes de l'iode, l'essentiel de la dose sera délivré pendant la phase d'hétérogénéité intrafolliculaire maximale. Les modèles dosimétriques utilisés pour évaluer la dose à la thyroïde devraient être revus en tenant compte de l'hétérogénéité cinétique de la distribution de l'iode.
En perspective, plusieurs études avec le NanoSIMS50 sont actuellement en cours dans notre laboratoire afin de préciser l'importance quantitative de l'hétérogénéité inter- et intrafolliculaire grâce à des images ioniques « grand champ » et à des mesures d'abondance de l'iode 129. Les rôles de l'âge et du statut iodé dans la distribution thyroïdienne des iodes seront également précisés.
Remerciements
Cette étude a fait l'objet d'un contrat n° RB 2005-09 accordé par EDF.


