Abridged English version
Introduction
Lithium therapy is extensively used to cure some psychiatric diseases and especially bipolar disorders [1–3]. Recent findings also suggest that lithium could have neuroprotective properties and be used to prevent or cure Alzheimer's disease [4,5]. Nevertheless, chronic lithium administration can lead to many undesirable side-effects [6–8]. Alteration of renal function, associated with an oxidative stress, was reported to explain hydromineral disorders and dehydration that follow high blood Li concentrations (>0.8 mM) [8,11–16]. Conversely, a growing body of evidence suggests that therapeutic relevant concentrations may produce neuroprotective effects against oxidative stress [17–19] and could limit age-linked oxidative damages [20].
In the present work, effects of low doses of lithium, administered daily to Wistar mice by intraperitoneal injections during 14 or 28 days were studied, paying special attention to the relationship between lithium toxicity and the oxidative stress in kidney and brain. For this purpose, renal function was evaluated by measuring serum creatinine and urea levels. Histological structure of brain was studied. Lithium-induced oxidative stress was evaluated by measuring the lipid peroxidation level (TBARS) and superoxide-dismutase (SOD), catalase (CAT) and glutathione-peroxidase (GPX) activities.
Materials and methods
Animals
Three-month-old Wistar male mice, weighing about 30 g, and fed with 15% protein food pellets (SICO, Sfax, Tunisia), were kept in a breeding farm, at 22 °C, with a stable hygrometry, under constant photoperiod. Food and tap water were given ad libitum. They were divided into four groups receiving daily injections of: 9‰ NaCl for control group (Te), 20, 40, or 80 mg of lithium carbonate per kilogram of body weight for Li20, Li40, and Li80 groups, respectively. Experiments were carried out for 14 or 28 days.
Methods
The serum lithium concentration was measured using a Flame Atomic Absorption Spectrophotometer (Analyst 400, PerkinElmer). Serum creatinine was determined by a method based on Jaffee's reaction using a Merck kit. Serum urea concentration was measured by the urease colorimetric test (Biomaghreb kit, Tunisia). Protein concentrations were determined using the method of Lowry et al. [21]. Lipid peroxidation was estimated by measuring the level of thiobarbituric acid reactive substances (TBARS) [22]. Catalase (CAT) activity was measured at 25 °C according to the method of Aebi [23] by measuring the decrease of H2O2 concentration at 240 nm. Glutathione-peroxidase (GPx) activity was measured by the method of Flohe and Gunzler [24]. Superoxide-dismutase (SOD) activity was assayed by measuring its ability to inhibit the photoreduction of NBT [25].
Statistic analysis
Results are expressed as the mean ± standard error to the mean (SEM). Comparisons were made using the Student's t-test. A result was considered significant for
Results
Blood levels of lithium, creatinine, and urea were increased, especially in mice receiving 80 mg/kg Li carbonate for 28 days, as compared to controls.
The TBARS level, an index of lipids peroxidation, was significantly increased in the kidney of mice receiving 80 mg/kg Li carbonate for 28 days. By contrast, no such effect was found in the brain.
Activity of catalase (CAT) and superoxide-dismutase (SOD), enzymes that play a major role in defence against oxidative aggressions, were significantly increased in kidney, but not in the brain of mice treated with 80 mg/kg Li carbonate. No change of the GPX activity was noticed.
Histological examination of the brain cortex of mice receiving 80 mg/kg Li carbonate for 28 days highlighted thicker neuronal cells and a denser network of dendrites, as compared to controls.
Discussion and conclusion
Under our experimental conditions, lithium-related nephrotoxicity occurs with the highest dose, only probably due to the peak of lithium concentration in serum following the injections. The increased activity of antioxidative enzymes (CAT and SOD) as well as the elevated level of TBARS in kidney are signs that lithium administration induced an oxidative stress in this organ. No such effects were found in the brain, which suggests that this organ is partly protected by the hemato-meningeal barrier. However, some effects of lithium treatment were observed in the brain cortex: the histological study showed an increased size of neurons and a denser dendrite network.
1 Introduction
Depuis plus de 50 ans, le lithium est l'un des principaux thymoregulateurs prescrit pour le traitement des psychoses bipolaires, mais également des dépressions résistant aux antidépresseurs, de l'agressivité chronique, des surexcitabilités et des schizophrénies dysthymiques [1,2]. De plus, il montre une claire supériorité dans la prévention du suicide chez les malades atteints de psychoses bipolaires ou unipolaires par rapport aux traitements plus récents, comme le Valproate [3]. Enfin, des études récentes suggèrent qu'il pourrait avoir un effet neuroprotecteur dans le cadre de certaines maladies neurodégénératives telles que la maladie d'Alzheimer [4,5].
Cependant, lors de traitements prolongés, de nombreux effets secondaires ont été observés [6–8]. Ils sont liés au fait que les concentrations sériques préconisées en thérapeutique (0,4–0,8 mM) sont très proches des concentrations toxiques (>0,8 mM) [9] et que la lithémie est difficile à contrôler et/ou stabiliser. En effet, l'excrétion du lithium étant dépendante de la filtration glomérulaire et de la réabsorption tubulaire proximale, les facteurs qui altèrent la filtration glomérulaire (insuffisance rénale) ou augmentent la réabsorption tubulaire (déshydratation, régime hyposodé, diurétiques) entraînent une augmentation de la lithémie et des risques d'intoxication [10]. De ce fait, de nombreux cas de néphrotoxicité progressive ont été observés lors de traitements prolongés [8,11,12]. Il semble qu'une partie des effets cytotoxiques du lithium sont liés au stress oxydant, qui résulte, soit d'une surproduction d'espèces réactives de l'oxygène [13–15], soit d'une inhibition des systèmes antioxydants cellulaires [14,16].
Inversement, à faible concentration, un prétraitement par le lithium peut induire une augmentation du glutathion [17] et protéger du stress oxydant produit par divers toxiques [18,19]. Le lithium pourrait ainsi limiter l'accumulation des dommages oxydatifs liés au vieillissement normal ou pathologique [20].
Le fait que le lithium ait une fenêtre thérapeutique étroite souligne l'importance d'un contrôle précis de l'évolution de la lithémie en fonction du temps afin de déterminer les concentrations de lithium susceptibles d'avoir des effets cytotoxiques ou bénéfiques. Dans ce but, des souris blanches de souche Wistar ont reçu pendant un mois des injections journalières de 20, 40 ou 80 mg de carbonate de lithium par kilogramme de poids corporel. Les effets néphrotoxiques potentiels ont été évalués par l'analyse de l'activité fonctionnelle (créatine, urée sérique) et du stress oxydant : peroxidation lipidique (TBARS) et activités enzymatiques antioxydantes (catalase, glutathion peroxidase, superoxyde dismutase). Des effets potentiellement bénéfiques ont été recherchés au niveau du cerveau par l'observation de la structure histologique du cortex et l'évaluation du stress oxydant.
2 Matériels et méthodes
2.1 Animaux et traitement
Nous avons utilisé des souris males de souche « Wistar » pesant en moyenne 32 g, et âgées environ de trois mois. Elles ont été réparties à raison de 12 souris par cage dans quatre cages, et placées dans une animalerie munie d'un système de ventilation et d'un système réglant les périodes d'obscurité (10 h) et de lumière (14 h), avec une hygrométrie stable, et dans laquelle la température était régulée à 22 °C.
Les souris ont été réparties en quatre groupes : un groupe témoin (Te) recevant chaque jour une injection intra péritonéale de Na Cl 9‰ et trois groupes traités Li20, Li40 et Li80, recevant respectivement 20, 40 et 80 mg de Li2CO3 par kilogramme de poids corporel, soit respectivement 0,27, 0,54 et 1,08 mol/kg.
L'alimentation et l'eau de boisson ont été fournies à volonté et le traitement a été poursuivi pendant un mois et les effets du lithium ont été analysés aux 14e et 28e jours.
2.2 Prélèvement des échantillons et préparation des extraits
Le sacrifice par décapitation des animaux a été effectué le matin, 12 h après l'injection de Li.
Le sang a été récupéré dans des tubes sans anticoagulant. Après centrifugation pendant 20 min à
Les organes prélevés (cerveau) destinés à l'étude histologique ont été placés dans un fixateur alcoolique (liquide de Bouin).
Pour les dosages biochimiques, des fragments d'organes ont été broyés dans un tampon Tris (Tris 50 mM, NaCl 150 mM, pH 7,4) à l'aide d'un homogénéisateur Ultra-Turax, puis centrifugés à
2.3 Dosage du lithium
La lithémie a été mesurée par spectrométrie d'émission de flamme (PerkinElmer Analyst 400). Afin de déterminer la courbe d'élimination du lithium, des souris ont reçu des injections de 20 mg et 80 mg de Li2CO3/kg de PC, et la lithémie a été mesurée après 30 min, 1 h, 2 h, 3 h, 4 h, 5 h, 6 h, 12 h et 24 h. Pour les souris traitées pendant 14 ou 28 jours, la lithémie a été mesurée 12 h après l'injection.
2.4 Dosages biochimiques
2.4.1 Dosage des protéines
Le dosage des protéines a été réalisé selon la méthode de Lowry et al. [21].
La quantité des protéines correspondant à la densité optique mesurée à 490 nm a été calculée à partir d'une courbe étalon réalisée avec des concentrations croissantes (125, 250, 500 μg/ml) d'albumine bovine.
2.4.2 Dosage de la créatinine sérique
Le principe est basé sur la réaction de Jaffé (Kit Merk). Après déprotéinisation sulfotungstique, la créatinine réagit avec l'acide picrique en milieu alcalin, pour donner une coloration jaune orangée, dont l'absorption a été mesurée à 510 nm.
2.4.3 Dosage de l'urée sérique
L'urée a été dosée par une méthode enzymatique (kit Biomaghreb) basée sur l'hydrolyse de l'urée par l'uréase.
2.4.4 Peroxydation lipidique
La peroxydation lipidique a été évaluée par la mesure des substances réagissant avec l'acide thiobarbiturique (TBARS), qui comprennent des aldéhydes (dont le MDA) et des lipides hydroperoxydés [22].
125 μl d'extrait, 50 μl de TBS et 125 μl de TCA 20%- BHT1% ont été mélangés pour déprotéiniser les extraits. Après agitation et centrifugation (
2.4.5 L'activité catalasique (CAT)
L'activité catalasique a été mesurée selon la méthode d'Aebi [23] par la mesure de la diminution de l'absorbance d'une solution d'H2O2 (concentration finale 50 mM après addition de l'extrait cytosolique), mesurée à 240 nm pendant 1 min à 25 °C, cette diminution étant due à l'hydrolyse du peroxyde d'hydrogène par la catalase selon la réaction : 2 H2O2 → 2H2O + O2.
L'activité enzymatique a été calculée en utilisant un coefficient d'extinction de 0,043 mM−1 cm−1.
2.4.6 La glutathion peroxydase (GPX)
L'activité de la glutathion peroxydase (GPx) a été mesurée selon la méthode de Flock et Gunzler [24], modifiée ultérieurement en utilisant H2O2 comme substrat. L'activité GPx a été calculée par la diminution de taux de GSH réduit par rapport à la réaction non enzymatique « blanc ». Elle a été exprimée en μmol de GSH oxydé/min/mg de protéines.
2.4.7 La superoxyde dismutase (SOD) [25]
L'activité SOD a été évaluée grâce à sa propriété de diminuer la photoréduction du NBT (nitroblue tetrazolium). Dans un milieu aérobie, le mélange riboflafine/méthionine/NBT donne une coloration bleue, dont la DO a été mesurée à 580 nm. Une unité de SOD correspond à la quantité de protéines nécessaire pour inhiber la photoréduction de 50%.
2.5 Histologie du cerveau
Après fixation, inclusion en paraffine et coloration à l'hématoxyline-éosine, les coupes ont été observées au microscope optique (Leitz-dialuxe 22) et photographiées à l'aide d'un appareil photo Leica Wild MP 48.
2.6 Statistiques
Les résultats sont présentés sous forme de moyenne ± erreur standard de la moyenne (SEM).
Les comparaisons entre groupes ont été réalisées par le test « t » de Student. Une valeur de
3 Résultats
3.1 Effet du traitement sur la lithémie
Les concentrations sériques de lithium mesurées au cours des 24 h suivant la première administration de 20 mg ou 80 mg de Li2CO3/kg de PC sont présentées sur la Fig. 1A. Dès le premier prélèvement, soit 0,5 heures après chaque injection, on observe des pics de concentration qui sont respectivement de l'ordre de 0,25 et 1 mM. Ces concentrations diminuent ensuite rapidement pendant les cinq heures suivantes, pour atteindre des valeurs à la limite de la détection.

Variations de la lithémie au cours du temps, (A) après une injection intrapéritonéale de 20 ou 80 mg/kg PC de carbonate de lithium, (B) après des injections quotidiennes, la lithémie étant mesurées aux 14e et 28e jours, 12 h après l'injection. Les valeurs représentent la moyenne ± SEM (n=4).
Pour les souris traitées quotidiennement pendant un mois, la lithémie a été mesurée 12 h après l'injection, ceci afin de se situer en dehors du pic de concentration. Comme le montre la Fig. 1B, les injections journalières ont induit une augmentation temps-dépendante. Chez les souris Li20 et Li40, la lithémie a atteint respectivement des valeurs de l'ordre de 0,07/0,09 au 14e jour et de 0,11/0,12 mM au 28e jour, alors que chez les souris Li80, la lithémie a varié de 0,21 à 0,25.
3.2 Analyse fonctionnelle des reins : urémie et créatinémie
Aucune modification de l'urémie et de la créatinémie n'a été notée chez les souris Li20. En revanche, chez les souris Li40 et Li80, une augmentation significative de la créatinémie respectivement de 30 et 50% au 14e jour, puis de 40 et 82% au 28e jour a été observée (Tableau 1).
Parallèlement, une augmentation de l'urémie a été détectée aux 14e jour (+34%) et 28e jours (+122%) chez Li80, et uniquement au 28ème jour (+58%) chez Li40 (Tableau 2).
3.3 Effet du lithium sur l'état oxydatif au niveau du rein et du cerveau
3.3.1 Peroxydation lipidique (TBARS)
Seule la dose de 80 mg/kg de PC a induit une augmentation modérée mais significative (

Variation des concentrations des TBARS (nmol/mg de protéines) au niveau du rein (A) et du cerveau (B) des souris témoins (Te) ou traitées par 20 (Li20), 40 (Li40) et 80 (Li80) mg de carbonate de lithium/Kg de PC. Les valeurs représentent la moyenne ± SEM (n=5). *p⩽0,05.
Aucune modification significative n'a été mise en évidence au niveau de cerveau, quelle que soit la dose et la durée du traitement (Fig. 2B).
3.3.2 Activité des enzymes antioxydantes
Au niveau du rein, seules les souris Li80 ont présenté une augmentation significative des activités CAT et SOD, par comparaison aux souris (Te) au 28e jour du traitement. En revanche, aucune modification de l'activité GPX n'a été mise en évidence dans les tissus rénaux des souris traitées (Figs. 3A, 4A, 5A).
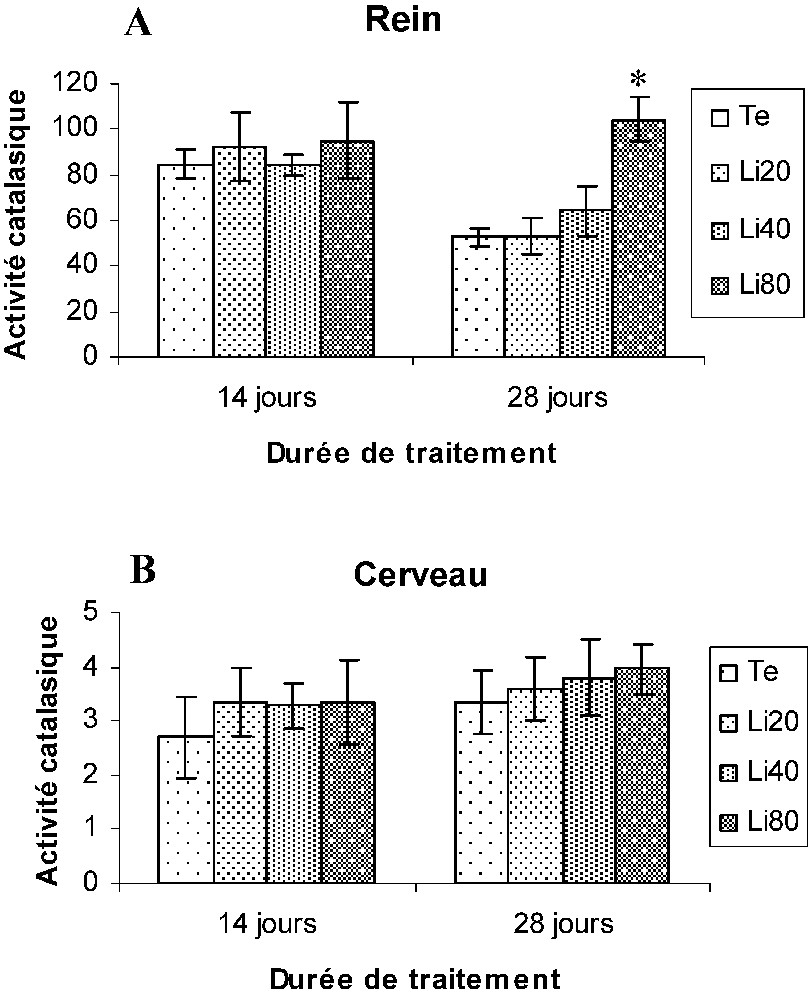
Variation de l'activité catalasique exprimée (μmoles de H2O2/min/mg de protéines) au niveau du rein (A) et du cerveau (B) des souris témoins (Te) et traitées au carbonate de lithium (Li20, Li40, Li80). Les valeurs représentent la moyenne ± SEM pour chaque groupe (cinq déterminations). *p⩽0,05.

Variations de l'activité glutathion peroxydase (GPX) exprimée en nM de GSH oxydées/mg de protéines, au niveau du rein (A) et du cerveau (B) des souris témoins (Te) et traitées au carbonate de lithium (Li20, Li40, li80). Les valeurs représentent la moyenne ± SEM pour chaque groupe (cinq déterminations).
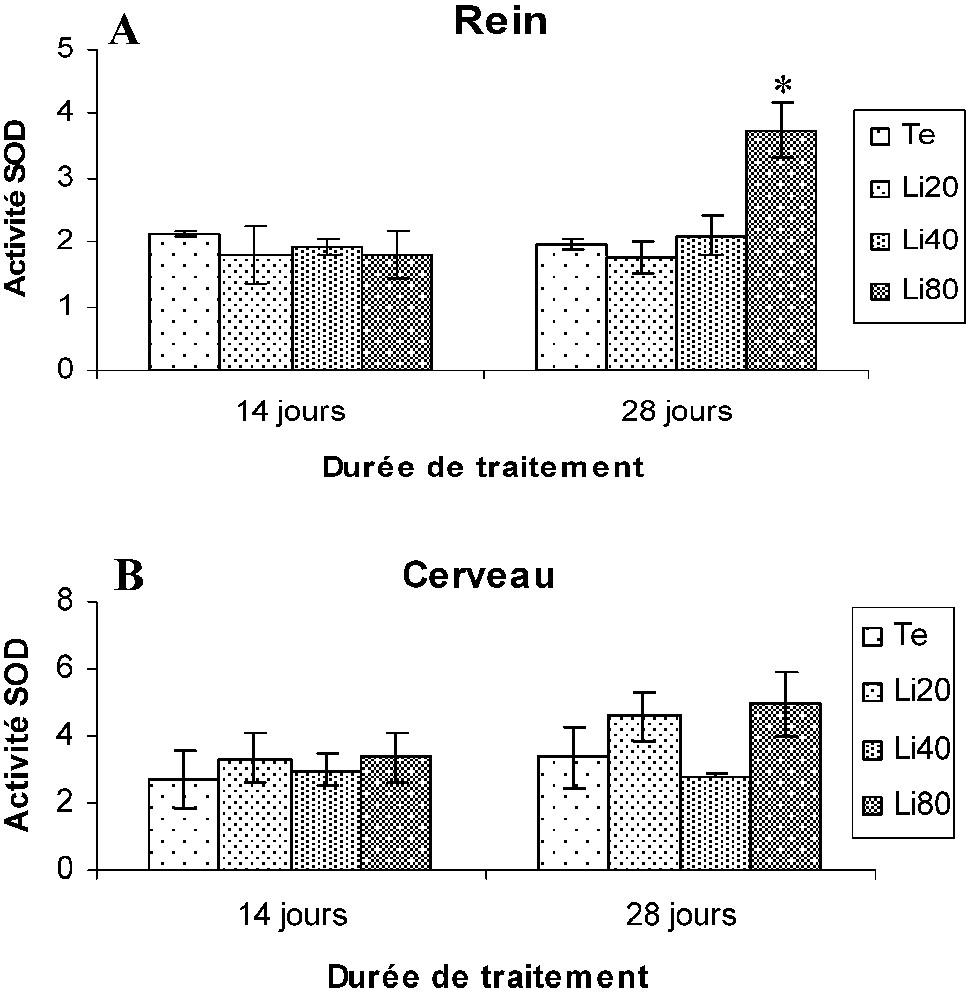
Variations de l'activité superoxyde dismutase (unités/mg de protéines) au niveau du rein (A) et du cerveau (B) des souris témoins (Te) et traitées au carbonate de lithium (Li20, Li40, li80). Les valeurs représentent la moyenne ± SEM pour chaque groupe (cinq déterminations).
Au niveau du cerveau, aucune modification significative de ces activités enzymatiques n'a été observée chez les souris traitées (Li20, Li40, Li80) par rapport aux souris (Te) (Figs. 3B, 4B, 5B).
On peut cependant remarquer que le niveau de base de l'activité catalasique (et dans une moindre mesure de la glutathion peroxydase) est beaucoup plus faible dans le cerveau que dans les reins.
3.4 Étude histologique du cerveau
Au niveau du cerveau, des modifications structurales du cortex ont été observées chez les souris Li80 traitées pendant 28 jours (Fig. 6). Le corps cellulaire des cellules pyramidales est apparu plus volumineux que chez les souris témoins et les prolongements dendritiques et axonaux apparaissaient plus denses.
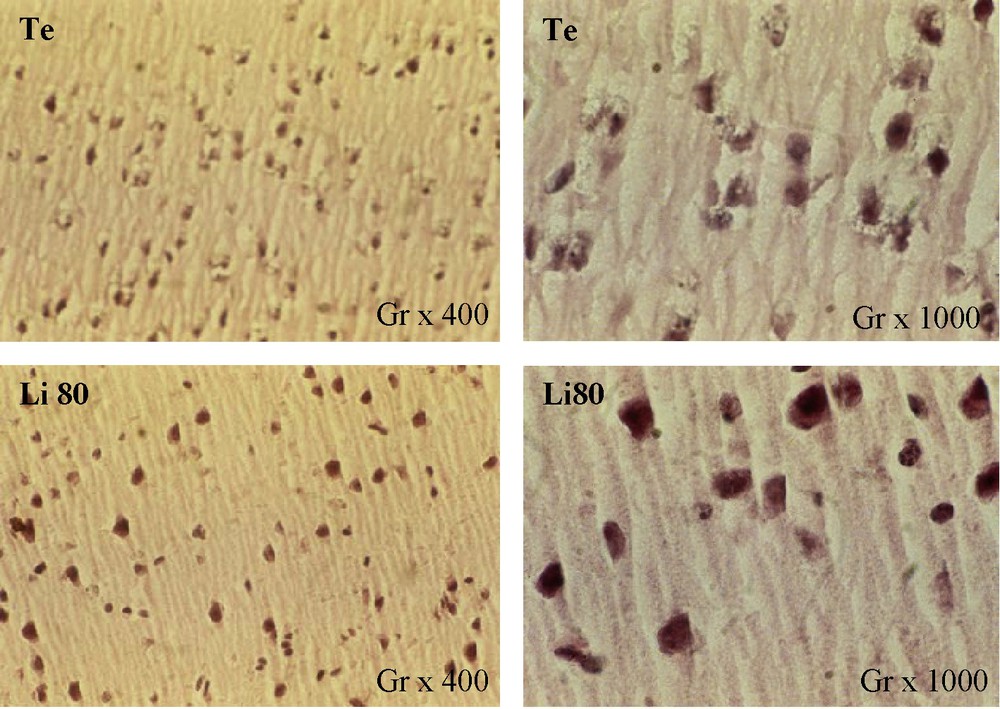
Structure histologique du cortex cérébral des souris témoins (Te) et traitées (Li80) au carbonate de lithium pendant 28 jours. Coloration : hématoxyline–éosine.
4 Discussion et conclusion
Notre étude a été développée dans le but de compléter les connaissances sur les concentrations seuil de lithium pouvant entraîner des effets cytotoxiques secondaires et d'évaluer les relations possibles avec une perturbation du statut oxydant tissulaire.
Dans nos conditions expérimentales, le lithium a induit une insuffisance rénale dose et temps dépendante, mise en évidence par une perturbation de la filtration rénale. De façon surprenante, cette néphrotoxicité est apparue pour des lithémies très faibles, inférieures à 0,2 mM, alors que le travail effectué précédemment dans notre laboratoire par Allagui et al. [12] a montré que l'administration orale du carbonate de lithium chez le rat provoquait une augmentation significative de la créatinine sérique chez les rats ayant une lithémie comprise entre 0,62 et 0,75 mM. Dans nos conditions expérimentales, la toxicité élevée du lithium est sans doute en rapport avec le mode d'administration, c'est-à-dire une injection unique journalière entraînant un pic de concentration important (1 mM) pendant les premières heures. Nous avons, par ailleurs, observé une augmentation de la lithémie moyenne en fonction du temps, ce qui est certainement le résultat de l'insuffisance rénale induite par les pics successifs de lithium. Ceci montre qu'il est important de maintenir le niveau de la lithémie en dessous d'un seuil critique, qui semblerait être de l'ordre de 0,5 mM chez la souris.
La nephrotoxicité du lithium pourrait être expliquée, du moins en partie, par le stress oxydant induit par le traitement. En effet, les souris Li80 traitées pendant 28 jours et ayant la lithémie la plus élevée ont présenté une augmentation de la peroxydation lipidique et de l'activité enzymatique de la catalase et de la SOD. Des résultats similaires ont été rapportés par Allagui et al. [26] chez des rats traités per os pendant 21 jours et présentant une lithémie supérieure à 1 mM.
Le fait que certains antioxydants protègent les reins des effets toxiques du lithium [14,15,17] montre le lien existant entre stress oxydant et toxicité rénale. De plus, l'augmentation, également rapportée, des activités enzymatique de la SOD [26,28] et de la catalase [19,26] est en faveur de l'implication des espèces réactive de l'oxygène (ROS) telles que l'ion superoxyde (
Les SOD catalysent la dismutation de l'
Bien que divers auteurs aient montré que le lithium induisait une inhibition de l'activité GPX [26,27] nous n'avons pas observé de modification de l'activité GPX dans nos conditions expérimentales induisant une lithémie généralement inférieure à 0,5 mM.
Nous avons observé que l'activité de base des enzymes antioxidantes (catalase et GPx) était plus faible au niveau du cerveau que dans les reins, ce qui est en accord avec les travaux rapportés dans la revue de B. Halliwell [20] montrant que le cerveau était mal équipé en systèmes de défense antioxydants.
Malgré cela, dans nos conditions expérimentales, le traitement par le lithium n'a pas induit de modification des TBARS et des activités de la GPX, catalase et SOD. Ceci est certainement en rapport avec le fait que le lithium ne passe pas rapidement la barrière hémato-méningée. De ce fait, il est vraisemblable que les pics sériques observés après chaque injection de lithium ne se soient pas, ou peu, répercutés au niveau du tissu nerveux.
Des modifications structurales du cortex cérébral ont cependant été induites chez les souris traitées, et en particulier un accroissement de la taille du corps cellulaire, suggérant une activité métabolique augmentée, mais également une augmentation de la densité des neurites, ce qui pourrait induire une augmentation du nombre des synapses inter neuronales.
Chez le rat, divers travaux suggèrent que le lithium (1 mM) favorise la neurogenèse [30–32], mais cet effet semble survenir essentiellement au niveau de l'hippocampe.
In vitro, divers travaux ont montré que le lithium augmente la proportion de cellules Neuro-2a présentant des neurites [33,34]. Cependant, ces effets ont été notés pour des expositions de courte durée (48 h) à des concentrations toxiques de lithium (10–20 mM). Di et al. [35] n'ont pas observé de modification dans des cultures de neurones SH-SY5Y cultivés pendant 4 jours en présence de 2 mM de lithium.
Il reste donc à déterminer si les effets que nous avons observés sur le cerveau sont le reflet d'un effet bénéfique ou néfaste du traitement, d'autant plus qu'ils ont été observés au 28e jour chez les souris traitées par la plus forte dose.
En conclusion, nos travaux montrent que des pics de concentrations transitoires et répétés de lithium sont susceptibles d'induire, à long terme, une nephrotoxicité pouvant empêcher la lithémie de se stabiliser et perturber les effets neuroprotecteurs du lithium. Il est donc important, si l'on veut identifier les effets bénéfiques d'un traitement par le lithium au cours du vieillissement pathologique, de choisir un protocole d'administration qui permette d'avoir une lithémie aussi stable que possible.


