Abridged English version
Porcellionides pruinosus (Brandt, 1833) is considered the most widely distributed terrestrial isopod across the world. Its populations exhibit different reproductive behaviours and they show a polymorphism in some morphological characters such as the length of the antennae or the pleotelson's form. This paper presents a useful contribution to the knowledge of a widespread species of Oniscidea, exhibiting a confused taxonomic status.
Ten populations belonging to Porcellionides pruinosus from different geographical localities, seven bioclimatics areas in Tunisia and Greece, showed a variable reproductive behaviour. Populations of Tabarka, Korba, and Tamerza presented continuous reproduction, whereas those of Garat Nâam, Raccada, Sahline, Gafsa, Rdayef, Gabès, and Athens exhibited a seasonal reproductive period. A previous analysis, using scanning electron microscopy, showed important phenotypic variations between theses populations. The form of the pleotelson and its lateral borders exhibited a priori an appreciable difference between the various populations, and this difference can be used as a discriminating character between populations of P. pruinosus.
In the present study, a phenetic analysis has been performed to compare these populations. For this, 19 quantitative characters in 800 specimens of P. pruinosus, belonging to nine populations located in the North, the Centre, and the South of Tunisia, and one population from Athens (Greece) were studied. The dendrogram showed that the population of Tabarka, exhibiting a reproductive activity, is isolated from the other populations studied, followed by the population of Garat Nâam, characterized by seasonal reproduction. The others represented two groups. The first grouped the populations of the Southeast and the West of Tunisia. The second pooled the populations of the Northeast and the Centre of Tunisia with the population of Athens.
These results suggested the presence of a phenotypic polymorphism in this species, interpreted as a response to geographic variations, and allowing us to make the hypothesis that this cosmopolitan species could hide evenly a complex of species and not only the same cosmopolitan species as the complex of Oritoniscus flavus and Oniscus asellus.
1 Introduction
Le statut taxinomique de Porcellionides pruinosus est controversé. Cette espèce cosmopolite présente une grande plasticité écologique ; sa capacité de colonisation des différents continents et d'adaptation à divers habitats expliquerait ses variations morphologiques, comportementales et génétiques. En effet, des variations morphologiques ont été signalées par Vandel [1] et interprétées comme répondant à des variations géographiques. Près d'une vingtaine de races ou de sous-espèces ont été reconnues telles que Metoponorthus (Metoponorthus) pruinosus, meleagris Budde-Lund [1]. Plus tard, Garthwaite et Sassaman [2] ont découvert une nouvelle espèce, Porcellionides floria, sympatrique de Porcellionides pruinosus sur la base des caractères tégumentaires et l'aspect des antennes. Récemment, des différences phénotypiques appréciables, au niveau de la forme et de l'aspect du pléotelson, ont été également mises en évidence par microscopie électronique à balayage entre spécimens issus de quelques populations tunisiennes [3].
Cette espèce manifeste également des variations au niveau de son comportement reproducteur. Contrairement à la majorité des Isopodes terrestres, qui ont une reproduction saisonnière, les populations analysées de P. pruinosus sont caractérisées, soit par une reproduction saisonnière, soit par une activité reproductrice continue, comme les populations africaines (Togo) et européennes (Saint-Cyran, en France) [4]. Ceci est confirmé par d'autres auteurs, notamment [3,5,6], qui ont analysé des populations françaises (de Saint-Martin-du-Fouilloux), de Grèce, de Tunisie et de la Réunion.
Du point de vue la définition biologique de l'espèce, des tests d'interfertilité réalisés entre individus appartenant à des populations géographiquement éloignées ont mis en évidence un isolement reproductif entre les variétés de P. pruinosus togolaise et française (Saint-Cyran), chez lesquelles l'accouplement n'a lieu qu'exceptionnellement ; dans ce cas, tous les œufs pondus avortaient. Ceci a été interprété par l'appartenance de ces populations à deux sous-espèces géographiques, dont l'hybridation n'est plus possible [4]. De plus, les populations de Saint-Martin-du-Fouilloux ne peuvent plus se reproduire avec celles de Grèce, de Tunisie et de la Réunion, chez lesquelles l'interfécondité et totale, ce qui confirme l'hypothèse du complexe d'espèces. L'étude de la variabilité génétique semble confirmer l'appartenance de ces populations de quatre origines géographiques éloignées à deux espèces différentes [5]. Ceci est renforcé par l'analyse de l'ADNmt des individus de P. pruinosus et des bactéries du genre Wolbachia, qui montre qu'il ne s'agirait pas de la même espèce de Porcellionides, car on ne serait pas en présence du même groupe de Wolbachia, l'association hôte–bactérie restant spécifique [7,8].
Plusieurs auteurs ont utilisé les analyses biométriques dans l'étude des populations des espèces et sous-espèces d'Isopodes terrestres. Lors de l'examen de deux populations de P. pruinosus, l'une togolaise et l'autre française, Bougrier [9], sur la base des données biométriques, a mis en évidence la présence d'une variabilité interpopulationnelle.
C'est dans le but d'approfondir nos connaissances sur la variabilité interpopulationnelle que nous avons entrepris, pour la première fois, une analyse phénétique, qui repose sur la numération de plusieurs caractères relevés chez différents individus, non pas issus de populations géographiquement éloignées (cas des populations grecque, françaises, de la Réunion, togolaise et tunisiennes analysées par Marcadé et al. [7], Michel-Salzat et al. [8] et Bougrier [9]), mais de neuf populations d'origine géographique plus restreinte, le territoire tunisien ; la population d'Athènes est considérée comme un outgroup. Les nuages de points obtenus sont traités par l'analyse en composantes principales. Nous avons également effectué deux autres types d'analyse, l'analyse factorielle des correspondances (AFC) et l'analyse canonique discriminante (Candisc) dans le but de visualiser les différences biométriques des populations de P. pruinosus.
L'analyse phénétique des populations tunisiennes a mis en évidence une hétérogénéité, qui mérite d'être complétée et approfondie par des analyses génétiques et des tests d'interfertilité, afin de définir le statut taxinomique des populations tunisiennes de P. pruinosus.
2 Matériels et méthodes
2.1 Populations étudiées
Les différentes populations étudiées sont répertoriées dans le Tableau 1, et leurs provenances illustrées sur la Fig. 1.
Localisation et étage bioclimatique des stations choisies
| No de la population | Sigle | Stations de récolte | Étage bioclimatique |
| 1 | TAB | Tabarka | Humide |
| 2 | KOR | Korba | Subhumide |
| 3 | SAH | Sahline | Semi-aride inférieur |
| 4 | RAC | Raccada | Aride supérieur |
| 5 | GN | Garat Nâam | Semi-aride inférieur |
| 6 | GAF | Gafsa | Aride supérieur |
| 7 | RDF | Rdayef | Aride inférieur |
| 8 | GAB | Gabès | Aride inférieur |
| 9 | TAM | Tamerza | Saharien supérieur |
| 10 | ATH | Athènes | Humide |

Localisation géographique des populations tunisiennes analysées de Porcellionides pruinosus (Brandt, 1833).
Neuf populations tunisiennes et une population grecque (près de l'aéroport d'Athènes) ont fait l'objet de nos recherches phénétiques (Tableau 1). Pour chaque population, 80 individus adultes, mâles et femelles, ont été examinés.
2.2 Caractères morphologiques étudiés
Pour analyser la variabilité interpopulationnelle, 19 caractères quantitatifs ont été choisis. À l'exception des caractères sexuels mâles (V8, V9, V18 et V19), tous les autres caractères sont communs aux deux sexes ; l'ACP porte donc sur 15 caractères chez les femelles contre 19 chez les mâles (Tableau 2). Les mesures ont été effectuées sous une loupe binoculaire équipée d'un micromètre.
Liste des caractères morphologiques étudiés
| Codes | Symboles | Caractères |
| V1 | LT | Longueur totale |
| V2 | Lrg 4è pte | Largeur du 4è péréionite |
| V3 | LngC | Longueur céphalique |
| V4 | LrgC | Largeur céphalique |
| V5 | LngHp | Longueur de la hampe de l'antenne |
| V6 | LngFl | Longueur du flagelle de l'antenne |
| V7 | LngUp | Longueur de l'uropode |
| V8 | LngAp | Longueur de l'apophyse génitale |
| V9 | LngEndI | Longueur de l'endopodite I |
| V10 | L4/LT | Largeur du 4è péréionite/Longueur totale |
| V11 | LngC/LT | Longueur céphalique/Longueur totale |
| V12 | LrgC/LT | Largeur céphalique/Longueur totale |
| V13 | LrgC/LngC | Largeur céphalique/Longueur céphalique |
| V14 | LngHp/LT | Longueur de la hampe/Longueur totale |
| V15 | LngFl/LT | Longueur du flagelle/Longueur totale |
| V16 | LngFl/LngHp | Longueur du flagelle/Longueur de la hampe |
| V17 | LngUp/LT | Longueur de l'uropode/Longueur totale |
| V18 | LngAp/LT | Longueur de l'apophyse/Longueur totale |
| V19 | LngEndI/LT | Longueur de l'endopodite I/Longueur totale |
2.3 Analyse statistique des caractères morphologiques
Les données morphologiques ont été soumises aux analyses statistiques suivantes :
- – une analyse de variance, à un et à deux critères de classification, suivie d'une comparaison des moyennes ;
- – une analyse en composantes principales ;
- – une analyse canonique discriminante.
Ces techniques sont complémentaires et apportent chacune des informations qui permettent de mieux affiner l'interprétation de nos résultats. L'analyse des données a été effectuée en utilisant le programme SAS (Statistical Analysis System), version 6.11 (1996) du centre de calcul El Khawarizmi.
3 Résultats
3.1 Étude globale de la diversité phénotypique
Pour mieux élucider la structuration de la variabilité morphologique, nous avons réalisé une analyse conjointe des caractères retenus. La divergence entre les populations a été visualisée en procédant à des analyses multivariées, traitant simultanément tous les caractères tels que l'analyse en composantes principales (ACP). Cette technique est largement utilisée pour la description et l'évaluation de la variabilité morphologique des populations et des espèces animales. Elle fournit une matrice de corrélations entre les caractères mesurés, ainsi qu'une représentation graphique des individus dans un espace défini par les composantes principales.
3.2 Matrice des coefficients de corrélation
L'examen de la matrice des coefficients de corrélation (Tableau 3) met en évidence de fortes corrélations (0,98) entre les variables suivantes :
Matrice des coefficients de corrélation entre les différents caractères analysés chez les mâles de Porcellionides pruinosus (Brandt, 1833)
| Variables | LT | Lrg pte | LngC | LrgC | LngH pe | LngFl | LngU rp | LngA ph | LngE ndI | L4/LT | LngC/LT | LrgC/LT | LrgC/LngC | LngH/LT | LngF/LT | LngF/LngH | LngU/LT | LngAp/LT | LngEnd/LT |
| LT | 1,000 | ||||||||||||||||||
| Lrg 4epte | 0,942 | 1,000 | |||||||||||||||||
| LngC | 0,847 | 0,842 | 1,000 | ||||||||||||||||
| LrgC | −0,29 | −0,24 | −0,65 | 1,000 | |||||||||||||||
| LngHp | 0,909 | 0,924 | 0,85 | −0,31 | 1,000 | ||||||||||||||
| Long.Fl | 0,875 | 0,88 | 0,86 | −0,37 | 0,897 | 1,000 | |||||||||||||
| LngUp | 0,941 | 0,932 | 0,82 | −0,27 | 0,932 | 0,866 | 1,000 | ||||||||||||
| LngAp | 0,741 | 0,731 | 0,937 | −0,77 | 0,760 | 0,780 | 0,726 | 1,000 | |||||||||||
| LngEndI | 0,849 | 0,857 | 0,874 | −0,46 | 0,896 | 0,857 | 0,846 | 0,85 | 1,000 | ||||||||||
| L4/LT | −0,33 | −0,00 | −0,16 | 0,189 | −0,11 | −0,12 | −0,18 | −0,16 | −0,13 | 1,000 | |||||||||
| LngC/LT | −0,70 | −0,70 | −0,90 | 0,843 | −0,71 | −0,74 | −0,68 | −0,94 | −0,77 | 0,149 | 1,000 | ||||||||
| LrgC/LT | −0,72 | −0,66 | −0,89 | 0,850 | −0,69 | −0,71 | −0,67 | −0,93 | −0,76 | 0,303 | 0,983 | 1,000 | |||||||
| LrgC/LngC | 0,726 | 0,705 | 0,95 | −0,82 | 0,728 | 0,752 | 0,702 | 0,954 | 0,792 | −0,19 | −0,96 | −0,95 | 1,000 | ||||||
| LngH/LT | 0,161 | 0,308 | 0,32 | −0,16 | 0,548 | 0,376 | 0,335 | 0,318 | 0,430 | 0,406 | −0,28 | −0,19 | 0,277 | 1,000 | |||||
| LngFl/LT | 0,001 | 0,124 | 0,262 | −0,26 | 0,199 | 0,468 | 0,1 | 0,286 | 0,226 | 0,389 | −0,27 | −0,19 | 0,264 | 0,486 | 1,000 | ||||
| LngFl/LngH | −0,15 | −0,16 | −0,43 | −0,11 | −0,32 | 0,121 | −0,22 | −0,01 | −0,17 | 0,037 | −0,02 | −0,02 | 0,002 | −0,446 | 0,537 | 1,000 | |||
| LngUp/LT | 0,30 | 0,407 | 0,311 | −0,07 | 0,485 | 0,402 | 0,593 | 0,298 | 0,390 | 0,261 | −0,27 | −0,2 | 0,261 | 0,582 | 0,325 | −0,22 | 1,00 | ||
| LngAp/LT | 0,481 | 0,495 | 0,804 | −0,86 | 0,540 | 0,590 | 0,484 | 0,935 | 0,673 | −0,05 | −0,91 | −0,88 | 0,892 | 0,32 | 0,374 | 0,083 | 0,23 | 1,00 | |
| LngEnd/LT | −0,24 | −0,13 | 0,066 | −0,31 | −0,00 | −0,02 | −0,14 | 0,2 | 0,294 | 0,366 | −0,12 | −0,06 | 0,131 | 0,49 | 0,386 | −0,06 | 0,18 | 0,33 | 1,0 |
Chez les femelles :
- – la longueur totale (LT) et la longueur céphalique (Lng C) montrent une forte corrélation positive avec la largeur du quatrième péréionite, la longueur du flagelle, celles de la hampe et de l'uropode ;
- – le rapport longueur céphalique/longueur totale(LngC/LT) est fortement corrélé positivement(0,959) avec le rapport largeur céphalique/longueur totale (LrgC/LT) et négativement (–0,948) avec le rapport largeur céphalique/longueur céphalique (LrgC/LngC). On note également une corrélation négative (–0,928) entre le rapport largeur céphalique/longueur totale (LrgC/LT) et le rapport largeur céphalique/longueur céphalique (LrgC/LngC) ;
- – la longueur du flagelle (LngFl) et celle de la hampe (LngHp) sont corrélées positivement avec la longueur de l'uropode (LngUp) (Tableau 3).
- – la longueur totale (LT) est corrélée positivement avec la largeur du quatrième péréionite, de la longueur du céphalon, du flagelle, de la hampe et de l'uropode et avec le rapport largeur céphalique/longueur céphalique LrgC/LngC, et négativement avec les rapports longueur céphalique/longueur totale (LngC/LT) et la largeur céphalique/longueur totale (LrgC/LT) ;
- – la longueur de la hampe est corrélée positivement avec les longueurs du flagelle, de l'uropode, de l'apophyse et de l'endopodite ;
- – les rapports longueur céphalique/longueur totale (LngC/LT) et largeur céphalique/longueur totale (LrgC/LT) montrent généralement une corrélation négative avec la majorité des caractères analysés ;
- – le critère longueur de l'apophyse/longueur totale (LngAp/LT) présente une corrélation importante avec la longueur et la largeur du céphalon, les rapports longueur céphalique/longueur totale (LngC/LT), largeur céphalique/longueur totale (LrgC/LT) et largeur céphalique/longueur céphalique (LrgC/LngC) (Tableau 3).
3.3 Représentation de la variabilité par les trois premiers axes de l'ACP et leur signification par rapport aux variables
3.3.1 Généralités
Chez les femelles :
- – les trois premiers axes de l'analyse en composantes principales absorbent 76,91% de la variabilité totale, ce qui témoigne d'une bonne structuration de la variabilité au sein de l'espèce ;
- – l'axe 1, première composante principale, absorbe 37,1% de la variabilité totale (Tableau 4). Il est défini essentiellement par la longueur de la hampe, la longueur céphalique, la longueur de l'uropode, la longueur du flagelle et la largeur du quatrième péréionite ;
- – la deuxième composante principale, représentant 26,45% de l'inertie globale, est corrélée aux critères suivants : la largeur céphalique et les rapports largeur céphalique/longueur totale, longueur céphalique/longueur totale et largeur céphalique/longueur céphalique ;
- – le troisième axe est défini par les rapports longueur du flagelle/longueur de la hampe, longueur de la hampe/longueur totale et enfin longueur du flagelle/longueur totale. Il représente 13,35% de la variabilité. Les deux rapports, longueur du flagelle/longueur de la hampe et longueur du flagelle/longueur totale, lui sont corrélés négativement, alors que le rapport longueur de la hampe/longueur totale présente une corrélation négative avec cet axe (Tableau 4).
- – les trois premiers axes de l'analyse en composantes principales, chez les mâles de P. pruinosus, absorbent 82,46% de la variabilité totale (Tableau 5) ;
- – l'axe 1 représente 56,4% de l'inertie globale. Il est corrélé positivement à la longueur du céphalon, de l'apophyse génitale, de l'endopodite et au rapport largeur céphalique/longueur céphalique, et négativement au rapport longueur céphalique/longueur totale ;
- – le deuxième axe (13,4% de l'inertie totale) est défini par les rapports longueur de l'endopodite I/longueur totale, longueur du flagelle/longueur totale, longueur du quatrième péréionite/longueur totale et longueur de la hampe/longueur totale ;
- – la troisième composante représente 12,5% de la variabilité totale. Elle est corrélée positivement aux caractères suivants : largeur céphalique, longueur de l'uropode/longueur totale et longueur de la hampe/longueur totale, et négativement au rapport longueur du flagelle/longueur de la hampe.
Représentation de la variabilité par les trois premiers axes de l'analyse en composantes principales et leur signification par rapport aux variables chez les femelles de Porcellionides pruinosus (Brandt, 1833)
| Axe 1 | Axe 2 | Axe 3 | ||||
| Valeur propre | 5,565 | 3,968 | 2,003 | |||
| Proportion | 37,1 | 26,4 | 13,3 | |||
| % cumulé | 37,1 | 63,5 | 76,9 | |||
| Variables | Coef | Variables | Coef | Variables | Coef | |
| V1 | LT | 0,33 | LT | 0,192 | LT | 0,11 |
| V2 | Lrg 4è pte | 0,334 | Lrg 4è pte | 0,232 | Lrg 4è pte | −0,04 |
| V3 | LngC | 0,357 | LngC | −0,21 | LngC | −0,02 |
| V4 | LrgC | 0,02 | LrgC | 0,49 | LrgC | 0,061 |
| V5 | Lng Hp | 0,36 | LngHp | 0,183 | LngHp | −0,14 |
| V6 | LngFl | 0,351 | LngFl | 0,144 | LngFl | 0,311 |
| V7 | LngUp | 0,356 | LngUp | 0,218 | LngUp | 0,017 |
| V8 | L4/LT | 0,015 | L4/LT | 0,089 | L4/LT | −0,32 |
| V9 | LngC/LT | −0,24 | LngC/LT | 0,395 | LngC/LT | 0,081 |
| V10 | LrgC/LT | −0,23 | LrgC/LT | 0,408 | LrgC/LT | −0,01 |
| V11 | LrgC/LngC | 0,23 | LrgC/LngC | −0,40 | LrgC/LngC | −0,07 |
| V12 | LngHp/LT | 0,202 | LngH/LT | 0,055 | LngHp/LT | −0,39 |
| V13 | LngF/LT | 0,165 | LngF/LT | −0,03 | LngF/LT | 0,379 |
| V14 | LngF/LngHp | 0,001 | LngF/LngHp | −0,08 | LngF/LngHp | 0,657 |
| V15 | LngUp/LT | 0,194 | LngUp/LT | 0,124 | LngUp/LT | −0,11 |
Représentation de la variabilité par les trois premiers axes de l'analyse en composantes principales et leur signification par rapport aux variables chez les mâles de Porcellionides pruinosus (Brandt, 1833)
| Axe 1 | Axe 2 | Axe 3 | ||||
| Valeur propre | 10,727 | 2,561 | 2,379 | |||
| Proportion | 56,4 | 13,4 | 12,5 | |||
| % cumulé | 56,4 | 69,9 | 82,4 | |||
| Variables | Coef | Variables | Coef | Variables | Coef | |
| V1 | LT | 0,262 | LT | −0,28 | LT | 0,117 |
| V2 | Lrg 4è pte | 0,262 | Lrg 4è pte | −0,15 | Lrg 4è pte | 0,206 |
| V3 | LngC | 0,296 | LngC | −0,04 | LngC | −0,05 |
| V4 | LrgC | −0,2 | LrgC | −0,16 | LrgC | 0,388 |
| V5 | LngHp | 0,274 | LngHp | −0,09 | LngHp | 0,246 |
| V6 | LongFl | 0,272 | LngFl | −0,03 | LngFl | 0,095 |
| V7 | LngUp | 0,264 | LngUp | −0,17 | LngUp | 0,230 |
| V8 | LngAp | 0,291 | LngAp | 0,041 | LngAp | −0,13 |
| V9 | LngEndI | 0,28 | LngEndI | 0,000 | LngEndI | 0,103 |
| V10 | L4/LT | −0,04 | L4/LT | 0,417 | L4/LT | 0,241 |
| V11 | LngC/LT | −0,28 | LngC/LT | −0,03 | LngC/LT | 0,182 |
| V12 | LrgC/LT | −0,27 | LargC/LT | 0,032 | LrgC/LT | 0,225 |
| V13 | LrgC/LngC | 0,286 | LrgC/LngC | 0,018 | LrgC/LngC | −0,17 |
| V14 | LngHp/LT | 0,126 | LngHp/LT | 0,361 | LngHp/LT | 0,359 |
| V15 | LngFl/LT | 0,093 | LngFl/LT | 0,448 | LngFl/LT | −0,02 |
| V16 | LngFl/LngHp | −0,24 | LngFl/LngHp | 0,12 | LngFl/LngHp | −0,36 |
| V17 | LngUp/LT | 0,129 | LngUp/LT | 0,182 | LngUp/LT | 0,375 |
| V18 | LngAp/LT | 0,252 | LngAp/LT | 0,181 | LngAp/LT | −0,25 |
| V19 | LngEndI/LT | 0,038 | LngEndI/LT | 0,49 | LngEndI/LT | −0,05 |
3.3.2 Dispersion des populations dans le plan 1–2 de l'ACP
Chez les femelles :
- – la représentation graphique de la dispersion des populations dans le plan engendré par les deux premiers axes (63,55% de la variabilité totale) révèle une grande hétérogénéité entre les femelles de P. pruinosus ;
- – la population de Garat Nâam, située du côté positif de l'axe 2, est définie par un large céphalon. En revanche, toutes les autres populations sont groupées au milieu, et beaucoup plus du côté négatif, de l'axe 2 (Fig. 2).
- – la dispersion des mâles dans le plan défini par le système d'axes 1–2, représentant 69,93% de la variabilité totale montre, qu'à l'instar des femelles, la population de Garat Nâam se distingue des autres populations par la longueur cépalique (Lng C) et celle de l'apophyse (Lng Ap) avec un éloignement graduel des populations selon l'axe 1 ou l'axe 2.

Représentation de la dispersion des populations analysées dans le plan 1–2 de l'analyse en composantes principales (ACP) réalisée chez les femelles de Porcellionides pruinosus (Brandt, 1833). A, Garat Nâam ; B, Tamerza ; C, Gafsa ; D, Rdayef ; E, Sahline ; F, Gabès ; G, Korba ; H, Raccada ; I, Tabarka ; J, Athènes.
3.3.3 Répartition des populations dans le plan 1–3 de l'ACP
Chez les femelles :
- – la répartition des populations dans le plan défini par le système d'axes 1–3 (39,8%) montre une concentration des individus étudiés autour du point de rencontre des axes. Aucune des populations n'en diverge.
- – l'axe 3, défini par la largeur céphalique et les rapports longueur de l'uropode/longueur totale et la longueur de la hampe/longueur totale, permet une bonne description du nuage de points. Malgré son faible pourcentage (12,5%) par rapport à l'axe 1 qui concentre 56,4% de la variabilité totale, il oppose la population de Garat Nâam à l'ensemble des autres populations (Fig. 3).

Représentation de la projection des populations étudiées dans le plan 1–3 de l'analyse en composantes principales (ACP) réalisée chez les mâles de Porcellionides pruinosus (Brandt, 1833). A, Garat Nâam ; B, Tamerza ; C, Gafsa ; D, Rdayef ; E, Sahline ; F, Gabès ; G, Korba ; H, Raccada ; I, Tabarka ; J, Athènes.
3.3.4 Répartition des populations dans le plan 2–3 de l'ACP
Chez les femelles :
- – la dispersion des populations dans le plan défini par le système d'axes 2–3 (39,7%) montre une séparation nette entre la population de Garat Nâam, qui occupe le côté positif de l'axe 2, d'une part, et l'ensemble des autres populations, qui forment un agrégat autour du point de rencontre des axes, d'autre part. L'axe 2, défini par la longueur de la hampe, la longueur céphalique et la longueur de l'uropode, oppose la population de Garat Nâam à celle de Tabarka.
- – la dispersion des populations dans le système défini par les axes 2–3, concentrant 25,9% de l'inertie globale, montre des points éparpillés ne conduisant pas à une bonne interprétation.
3.4 Analyse canonique discriminante et analyse factorielle des correspondances
Le calcul des valeurs propres pour ces deux types d'analyse et les représentations graphiques des différentes populations confirment les résultats obtenus à partir de l'analyse en composantes principales, c'est-à-dire la discrimination et la ségrégation de la population de Garat Nâam des autres populations. Mais les résultats de ces deux analyses ne fournissent pas d'informations supplémentaires par rapport à ceux déjà obtenus. C'est pour cette raison qu'ils ne figurent pas dans ce travail.
3.5 Distances de Mahalanobis
Les distances de Mahalanobis, calculées entre les couples de populations, sont toutes significatives, voire même hautement significatives (Tableau 6). Ces distances sont comprises entre 1,13 et 206,95 chez les femelles et entre 1,2 et 193,88 chez les mâles. Les populations de Raccada (RAC) et de Sahline (SAH) se sont avérées les plus proches, avec une distance de 2,10. La distance la plus grande (206,95) est enregistrée entre les populations Garat Nâam (GNA) et Korba (KOR).
Matrice des distances de Mahalanobis calculées pour les mâles des différentes populations de Porcellionides pruinosus (Brandt, 1833)
| Pop | GNA | RDF | GAF | TAM | KOR | GAB | SAH | RAC | TAB | ATH |
| GNA | 0 | |||||||||
| RDF | 187,8 | 0 | ||||||||
| GAF | 173,01 | 5,34 | 0 | |||||||
| TAM | 99,79 | 3,31 | 4,29 | 0 | ||||||
| KOR | 206,95 | 6,66 | 8,31 | 1,77 | 0 | |||||
| GAB | 141,15 | 6,3 | 2,70 | 3,22 | 8,52 | 0 | ||||
| SAH | 140,35 | 4,72 | 1,5 | 2,8 | 4,94 | 3,38 | 0 | |||
| RAC | 127,73 | 3,17 | 1,6 | 3,29 | 6,35 | 1,23 | 1,13 | 0 | ||
| TAB | 95,08 | 6,00 | 3,84 | 5,79 | 10,11 | 5,82 | 3,73 | 3,24 | 0 | |
| ATH | 63,17 | 2,27 | 1,87 | 3,56 | 3,47 | 3,08 | 2,17 | 1,79 | 1,96 | 0 |
3.6 Classification hiérarchique des populations
Après l'analyse de la variance, l'ACP, l'analyse canonique discriminante et l'AFC, nous avons entrepris une classification hiérarchique des populations, qui se traduit par la construction d'un dendrogramme permettant de mieux visualiser le groupement des populations et de quantifier le degré de ressemblance entre ces populations sur la base des moyennes des variables morphologiques mesurées.
Le dendrogramme, construit à partir des coordonnées euclidiennes des populations et illustré par la Fig. 4, montre trois groupes :
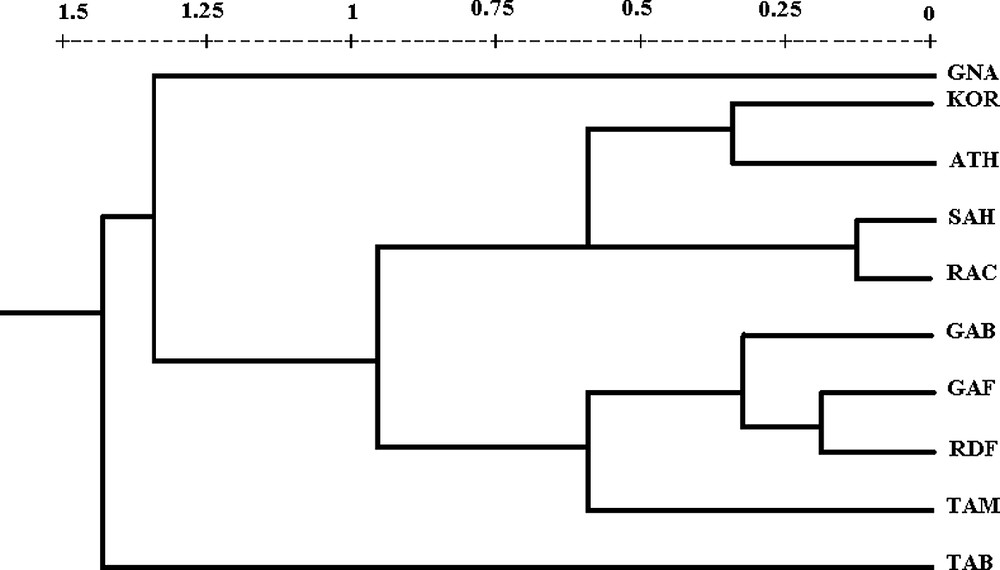
Dendrogramme construit à partir des coordonnées euclidiennes entre les populations de Porcellionides pruinosus (Brandt, 1833).
- – le premier est formé par l'unique population de Tabarka ;
- – le deuxième est réservé à la population de Garat Nâam qui se distingue des autres populations ;
- – le troisième, groupant toutes les autres populations, peut être subdivisé en deux sous-groupes, le premier composé des populations tunisiennes du Sud-Est, Gabès (GAB) et du Sud-Ouest Gafsa (GAF), Rdayef (RDF) et Tamerza (TAM), le deuxième comprenant aussi bien les populations tunisiennes de Korba (KOR), de Sahline (SAH) et de Raccada (RAC) que la population grecque en provenance d'Athènes (ATH). Dans le premier sous-groupe, la population de Tamerza se détache des autres populations, GAB, GAF et RDF, alors que le deuxième sous-groupe est subdivisé en deux ensembles, dont le premier est formé par les populations de Korba (KOR) et d'Athènes (ATH), le second par les populations de Sahline (SAH) et de Raccada (RAC).
4 Discussion et conclusion
L'analyse biométrique que nous avons effectuée révèle la présence de quelques caractères permettant de discriminer les populations. Ceux qui méritent d'être retenus, quel que soit le sexe, sont la longueur et la largeur du céphalon, la longueur de l'uropode, celle de la hampe et du flagelle ; on relèvera aussi les caractères sexuels secondaires du mâle, tels que la longueur de l'apophyse génitale et de l'endopodite du pléopode I.
La population de Tabarka présente les tailles les plus faibles, alors que la population de Garat Nâam est caractérisée par les tailles les plus élevées. Par ailleurs, ces deux populations se distinguent également par leur comportement reproducteur : la première est caractérisée par une activité reproductrice continue, alors que la deuxième l'est par une reproduction saisonnière, suivie d'un repos sexuel. Quant aux autres populations, morphologiquement similaires, elles présentent aussi les deux types de comportement reproducteur : activité reproductrice continue des populations de Korba et Tamerza, et reproduction saisonnière de celles de Sahline, Raccada, Gafsa, Gabès, Rdayef et Athènes.
La séparation des populations de P. pruinosus en fonction de leur comportement reproducteur peut être attribuée aux conditions climatiques, particulièrement à l'humidité. En effet, les populations de Tabarka et de Korba appartiennent aux étages bioclimatiques humide et subhumide, alors que les autres populations, telles que celles de Sahline, Raccada, Garat Nâam, Gafsa, Rdayef et Gabès, caractérisées par une reproduction saisonnière, sont plutôt cantonnées aux étages bioclimatiques arides à semi-arides. La population de Tamerza s'isole des autres populations du Sud par son comportement reproducteur, ce qui pourrait s'expliquer par le biotope particulier qu'elle occupe (oasis au voisinage d'un cours d'eau). La population de Korba et celle d'Athènes, malgré la distance géographique qui les sépare, forment un groupe morphologiquement similaire aux deux populations du Centre, Sahline et Raccada, les plus proches géographiquement, et dont la distance entre elles est la plus faible (0,12).
L'analyse phénétique se présente comme un outil particulièrement intéressant pour la discrimination et la séparation des populations de P. pruinosus analysées. Ceci confirme les différences phénotypiques appréciables mises en évidences, par microscopie électronique à balayage, chez ces mêmes populations [3]. Cette variabilité phénétique interpopulationnelle, avec celle décrite au niveau du comportement reproducteur, plaident en faveur de l'hypothèse de la présence de sous-espèces différentes, voire même un complexe d'espèces [8,10]. En effet, Caruso et Costa [11] ont utilisé les analyses biométriques lors de l'étude des populations des sous-espèces, Armadillidium badium siculorum, Armadillidium badium badium et Armadillidium badium pelagicum, issues de différentes régions d'Italie, telles que la Sicile, Lampeduse et Linosa. L'examen des individus de deux populations de P. pruinosus, l'une togolaise (Lomé) et l'autre française (Indre) [9], sur la base des données biométriques, a montré un dimorphisme sexuel au niveau de la taille chez les représentants de cette espèce ainsi que la présence d'une variabilité interpopulationnelle.
L'analyse factorielle des correspondances (AFC), chez une population française (Saint-Martin-du-Fouilloux) de la même espèce, Porcellionides pruinosus, montre que les conditions climatiques sont indépendantes de la physiologie des animaux. Ce résultat suggère qu'il n'existe pas une stricte influence des conditions climatiques sur la croissance et la reproduction des animaux [6]. L'application de l'AFC, dans l'étude de quelques populations tunisiennes de Porcellio variabilis, a permis la nette discrimination de la population de Ain Drahem et à un degré moindre celle de Gafsa [12]. L'analyse de la variance ainsi qu'une analyse en composantes principales (ACP), effectuées afin d'estimer la diversité phénotypique des populations naturelles d'Artemia en Tunisie, ont montré que la population de Sijoumi et celle de El Adhibet se distinguent des autres populations analysées [13].
En effet, depuis les années 1960, l'estimation de la variation génétique entre les populations d'une même espèce ou entre les espèces différentes, permettant de définir leur structure génétique, a été possible grâce à la technique d'électrophorèse qui analyse la variation protéique chez de nombreux individus. Dans ce cadre, plusieurs études ont été menées en vue de recherches de la différenciation génétique intra et interspécifique entre populations de quelques Oniscidea tels que Armadillidium vulgare [14–16], deux espèces du genre Porcellionides, pruinosus et floria [2], autres espèces d'Oniscidea, comme le complexe Porcellio imbutus [17], Oniscus asellus [18] et Porcellio variabilis [19].
L'analyse génétique de quelques populations de P. pruinosus a été également entreprise [20] pour vérifier, en partie, l'idée avancée par Vandel [1], qui soulignait que, chez cette espèce, la présence d'un polymorphisme phénotypique étendu interprété comme répondant à des variations géographiques, d'une part, et l'hypothèse avancée par [6] estimant que cette espèce cosmopolite pourrait cacher également un complexe d'espèces et non pas une seule et même espèce cosmopolite et polytypique, comme l'existence d'un complexe d'espèces chez Oritoniscus flavus [21] et chez Oniscus asellus [22], d'autre part.
Dans le but de mieux préciser le degré de parenté des populations, nous avons tenté une nouvelle approche basée sur le polymorphisme isoenzymatique et l'estimation des distances génétiques entre les populations tunisiennes [20].



Vous devez vous connecter pour continuer.
S'authentifier