Les maladies qualifiées de « négligées » sont celles qui affectent les populations des régions les plus pauvres ou marginalisées (celles de régions rurales reculées, vivant dans des bidonvilles ou dans des zones de conflit) de la planète (Engels et Savioli [1], Mathers et al. [2], Singer et Ryff [3]). Du fait de leur localisation, ce sont en majorité (mais pas exclusivement) des pathologies tropicales (Canning [4], Singer et Ryff [3], Utzinger et de Savigny [5]) : le choléra et les maladies diarrhéiques endémiques, la dengue/la dengue hémorragique, la dracunculose (maladie du ver de Guinée), la filariose lymphatique, les géohelminthiases (nématodoses, ankylostomiase et trichurose), la leishmaniose, la lèpre, la maladie de Chagas, l'onchocercose, la schistosomiase, le trachome, les tréponématoses endémiques (pian, caraté, syphilis endémique), la trypanosomiase humaine africaine (maladie du sommeil) et l'ulcère de Buruli. Dans les pays en développement (PED) au climat tropical ou subtropical les cas sont souvent regroupés géographiquement et il est fréquent qu'une même personne contracte plusieurs infections ou soit touchée par plusieurs des agents pathogènes responsables de maladies négligées (Mathers et al. [2,6]). En bloc, ces maladies ont un poids similaire à celui incluant les « trois grandes pathologies » que sont : VIH/SIDA, tuberculose et paludisme, pour lesquelles la communauté a pu trouver des moyens de recherche et de lutte qui commencent à montrer leur efficacité (Engels et Savioli [1], Hotez et al. [7]).
Ces maladies sont favorisées par l'absence d'eau salubre, les mauvaises conditions de logement et le manque de moyens d'assainissement. Les enfants sont les plus vulnérables. Ces infections tuent, handicapent ou rendent irrémédiablement invalides des millions de gens qui souffrent et qui sont socialement exclus pour le restant de leurs jours. Faute d'intérêt, nous ne disposons pas de statistiques épidémiologiques fiables pour plusieurs d'entre elles. Nous savons pourtant qu'elles représentent une priorité pour la santé publique des pays en développement. Parce qu'elles sont entretenues par la pauvreté, leur morbidité ne diminue pas et on estime qu'environ un milliard de personnes souffrent encore d'une ou plusieurs maladies négligées (Jamison et al. [8], Lopez [9], Mathers et al. [2,6], World Health Organization [10,11]).
Tant que ces maladies n'affectent pas les populations des pays développés :
- – soit par le séjour de visiteurs originaires de pays développés se rendant dans les zones concernées par ces infections ;
- – soit par le risque d'exportation de ces maladies vers les payes économiquement forts ;
Pour la plupart de ces maladies, nous manquons d'outils de diagnostic adaptés aux conditions de travail en zone tropicale, de vaccins, de médicaments qui répondent aux besoins spécifiques des malades des pays pauvres. Les principaux freins à une activité de recherche et de développement spécifique sont connus (Daar et al. [16], Molyneux [17], Urdea et al. [18], Webber et Kremer [19] :
- (1) L'état de la science, notamment un manque de compréhension de certaines maladies, et une relative complexité des technologies nécessaires aux études des ces maladies pour mettre au point de nouvelles molécules thérapeutiques ou des vaccins ;
- (2) L'absence d'indication de priorités selon le fardeau (poids en terme de santé publique) que représentent les différentes maladies. Pour cela des études épidémiologiques doivent être réalisées pour :
- – actualiser la morbi-mortalité et préciser la prévalence et l'incidence associées à ces infections,
- – identifier les facteurs de risques liés à ces pathologies,
- – décrire les données démographiques des populations concernées,
- – caractériser les agents infectieux en cause (résistances aux anti-infectieux, supports et mécanismes de virulence, …) ;
- (3) L'absence de moyens adaptés qui fait que les actions de surveillance et de veille microbiologique sur le terrain ne sont pas réalisées. Globalement, les moyens nécessaires pour gérer ces données sont souvent insuffisants, voire inexistants dans les zones concernées ;
- (4) La notion de propriété intellectuelle doit être abordée car elle représente l'essentiel du moteur de l'industrie pharmaceutique. Elle est souvent jugée insuffisante par les industriels qui opposent comme argument un retour quasiment nul (voire déficitaire) sur leur investissement en recherche et développement sur ces maladies. La solution pourrait passer par des mécanismes de compensation qui restent à définir ;
- (5) Enfin, la non utilisation des médicaments (cas de la tri thérapie pour l'infection VIH/SIDA) ou des vaccins (rougeole, typhoïde par exemple) par les populations les plus défavorisées qui n'ont qu'un accès limité aux moyens thérapeutiques ou de préventions existant.
Certaines de ces maladies sont étudiées depuis longtemps par les organismes de recherche français impliqués dans les problèmes de santé des pays en voie de développement (IRD, Institut Pasteur, …). C'est le cas des maladies diarrhéiques sévères de l'enfant en PED tropicaux. L'ensemble des problèmes posés par la prise en charge et la prévention de cette pathologie a été à l'origine d'une réflexion pour créer un programme de recherche pilote destiné à répondre de façon spécifique et pertinente aux attentes des populations touchées. L'idée de ce programme pilote intégrant simultanément plusieurs composantes d'études est née du constat que la plupart des maladies négligées requièrent :
- – d'actualiser les connaissances épidémiologiques,
- – d'améliorer les moyens de diagnostic sur le terrain (au chevet du malade par exemple),
- – d'adapter les algorithmes de prise en charge médicale à la fois aux germes en cause, aux conditions de travail (dispensaire de brousse) et aux ressources économiques (éviter le recours systématique au laboratoire),
- – de développer des vaccins adaptés aux zones endémo-épidémiques en connaissant mieux les causes potentielles d'échec de la vaccination.
1 Diarrhées infectieuses sévères de l'enfant en PED (modèle pilote de programme intégrant plusieurs composantes de recherche)
La diarrhée est au second rang des causes de mortalité liées aux maladies infectieuses dans le monde (Fig. 1). L'OMS estime entre 2,1 millions et 2,4 millions le nombre de morts par an par maladie diarrhéique dans le monde (Kosek et al. [20]). La grande majorité de ces diarrhées frappe des enfants de moins de 5 ans. La morbidité est très élevée, avec parfois jusqu'à 12 épisodes diarrhéiques par an. Le poids de la maladie en terme d'années de vie perdues est estimé à 6 2451 000 disability-adjusted life-years (DALYs) et peut mobiliser jusqu'à 60% du temps de travail des parents. Concrètement, la diarrhée concerne des zones où le bas niveau sanitaire (en raison du sous développement économique) ne permet pas encore de prévenir efficacement (en cassant la chaîne de contamination entre l'homme, l'animal, les aliments et l'environnement) la maladie (absence de contrôle des eaux usées, latrines sauvages, eau de boisson non contrôlée, …). Dans ces régions, les règles d'hygiènes (lavage des mains, usage de latrines, …) ou de soins (hydratation des enfants diarrhéiques par exemple) les plus évidentes ne sont pas appliquées pour de multiples raisons (éducation insuffisante, influence culturelle, absence de moyens, …). Le constat est que la diarrhée est souvent inévitable, endémique et parfois épidémique (Kosek et al. [20], World Health Organization [10]).
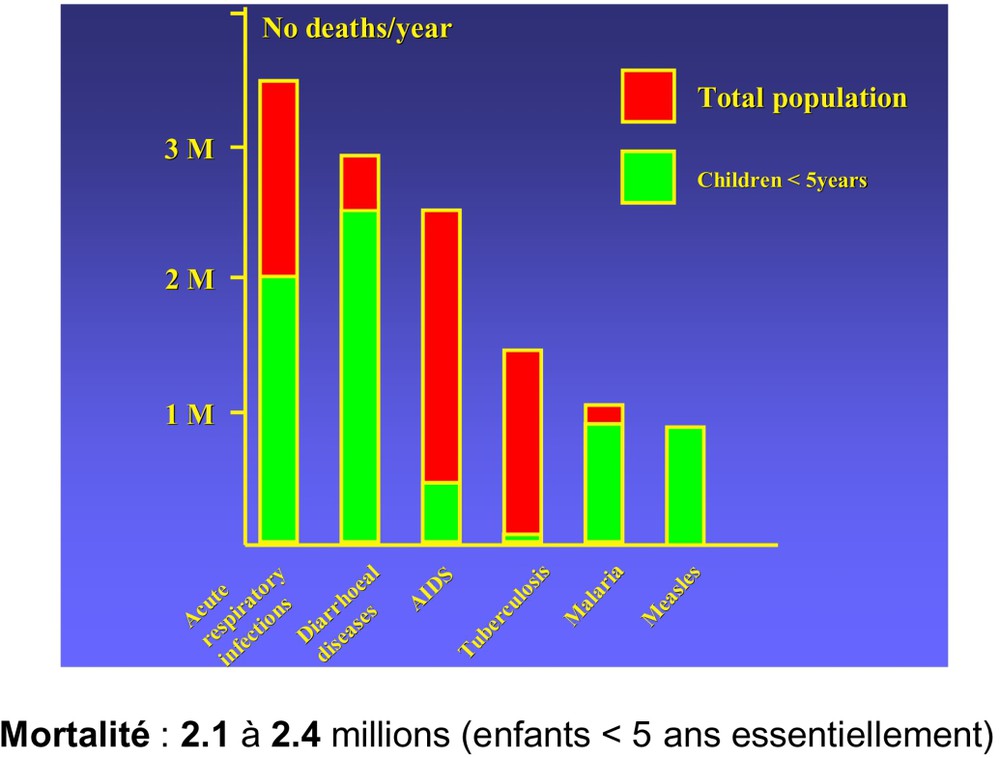
La diarrhée est au second rang des causes de mortalité liées aux maladies infectieuses dans le monde.
En dehors du contexte particulier du SIDA, les principaux agents étiologiques des diarrhées sévères sont les suivants (Fig. 2) :
- – Shigella spp.
- – Escherichia coli agents d'entérites : pathovars entérotoxinogènes (ETEC), entéroinvasifs (EIEC), entéroagrégants (EAEC), entéropathogènes (EPEC), entérohémorragiques (EHEC)
- – Vibrionaceae (V. choleare O1 et O139)
- – Salmonella enterica (en incluant la typhoïde)
- – Entamoeba histolytica
- – Rotavirus
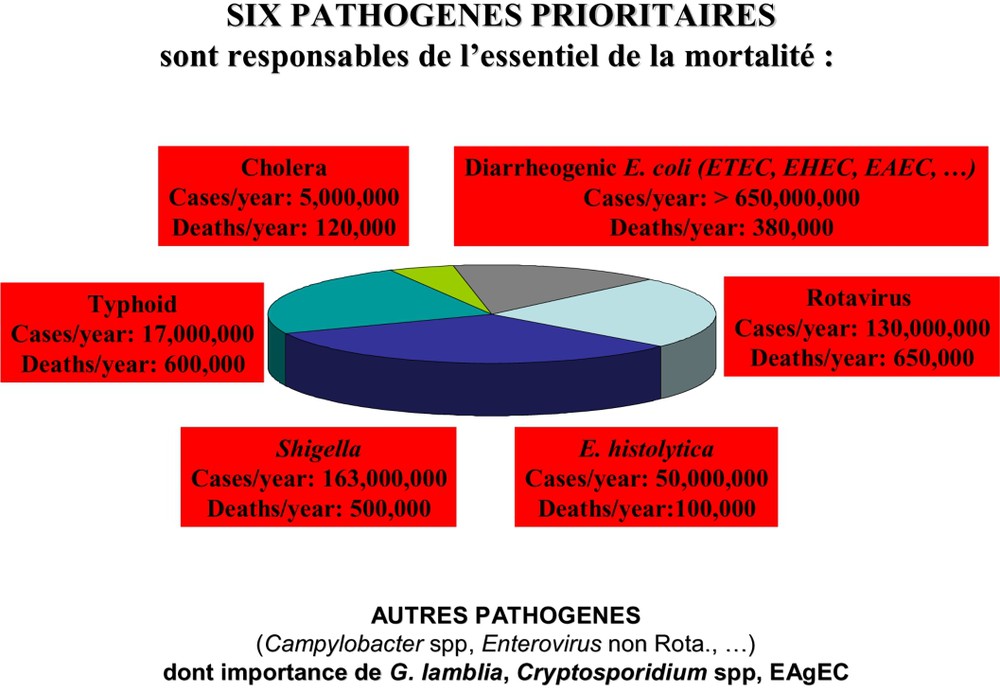
Principaux agents étiologiques des diarrhées sévères, morbidité et mortalité, dans les pays en développement.
Les mécanismes étiopathogéniques ont été très étudiés et peuvent impliquer :
- – des bactéries entérotoxinogènes (ne provoquant pas de lésion tissulaire irréversibles) ; elles sont à l'origine :
- (i) d'intoxination simple (par la seule action de la toxine présente dans l'aliment (cas de Bacillus cereus par exemple)),
- (ii) d'intoxication impliquant la bactérie (pour coloniser le tissu cible par exemple) et comme principal facteur de virulence des toxines cytotoniques (cas de V. cholerae, des ETEC) ;
- – des bactéries cytotoxiques à l'origine de lésions tissulaires irréversibles, et colonisant l'intestin grêle (EPEC) ou le colon (EHEC, EPEC, C. difficile, Klebsiella oxytoca) ;
- – des bactéries invasives provoquant des lésions tissulaires et une importante réponse inflammatoire, essentiellement au niveau de l'intestin grêle (Salmonella enterica, Campylobacter jejuni, Y. enterocolitica), ou du colon (Shigella spp, EIEC, …).
La mortalité est encore élevée (bien qu'elle ait été réduite d'un tiers en 30 ans) ; la morbidité importante (toujours constante depuis 30 ans) des maladies diarrhéiques chez le jeune enfant dans les pays pauvres tient au retard à parvenir à une offre de soins adaptée (Fig. 3). Plusieurs raisons sont à l'origine de la baisse de la mortalité et à la constance de la morbidité :
- 1. Une meilleure éducation des parents avec deux notions clés enseignées : (i) faire boire les enfants et leur donner une diète hypercalorique durant les épisodes diarrhéiques ; (ii) souligner l'importance de l'alimentation au sein dans la protection ;
- 2. Une large implémentation, sous l'impulsion de l'OMS, des solutions de réhydratation par voie orale (SRO = eau + glucose + électrolytes) ;
- 3. L'amélioration de l'hygiène et de la qualité des soins primaires dans de nombreuses régions du monde (surtout en Asie et en Amérique du Sud) ;
- 4. L' « inondation » planétaire par les antibiotiques générant un risque de crise du fait de la multirésistance de certaines espèces comme Salmonella typhi, Shigella spp, E. coli (Taylor [21]).
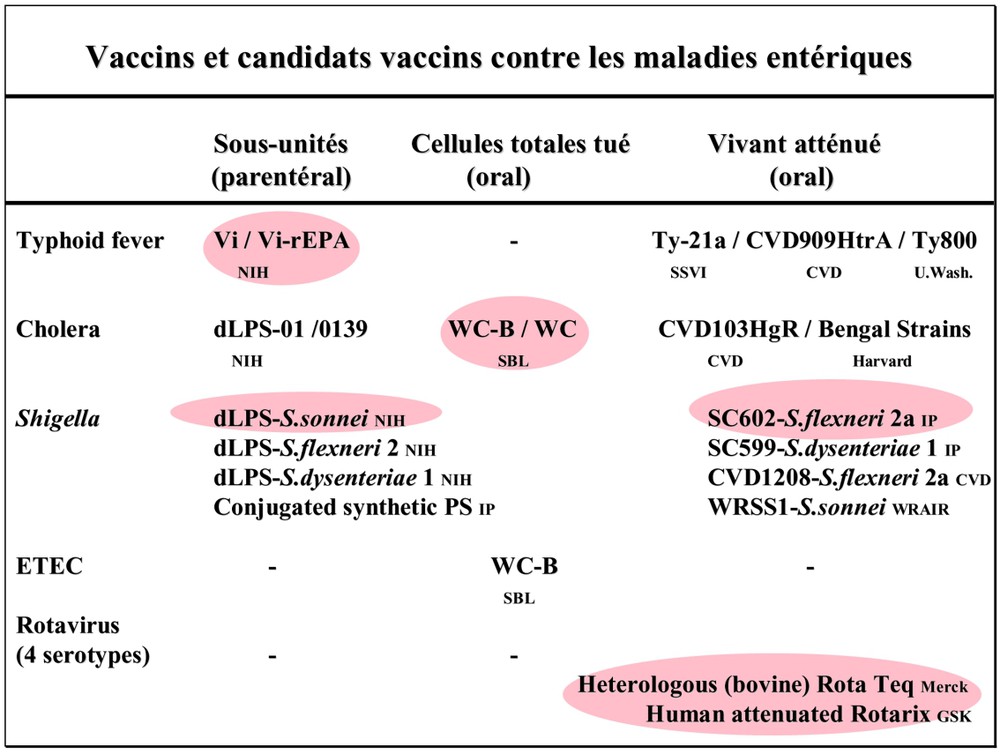
Vaccins et candidats vaccins actuellement développés contre les agents pathogènes entériques.
Cette évolution de la pathologie entérique infectieuse chez les enfants des PED crée de nouveaux besoins pour mieux prendre en charge et prévenir les diarrhées infantiles graves dans les PED (diagnostic, épidémiologie, physiopathologie, immunité, vaccinologie, prise en charge médicale) et justifie l'organisation d'un programme intégrant les composantes identifiées pour apporter des réponses spécifiques.
2 Mise en place du programme intégré multidisciplinaire
Les objectifs du programme sont :
- 1. De développer des outils de diagnostic innovants ;
- 2. D'actualiser les données épidémiologiques en intégrant une surveillance épidémiologique pour connaître l'impact global sur la santé et son coût ;
- 3. De répondre à des questions fondamentales concernant la physiopathologie, l'immunité, et la prévention vaccinale dans les zones endémo épidémiques en intégrant microbiologie, gastroentérologie, nutrition, immunologie.
2.1 Développement d'outils diagnostic innovant
2.1.1 Rationnel
Diagnostic et amélioration de la prise en charge des diarrhées graves sont liés : diagnostiquer plus rapidement avec des outils adaptés aux conditions de travail des PED permettra d'optimiser la prise en charge médicale.
2.1.2 Objectifs
Le but est de réaliser un diagnostic rapide (15 minutes) sur le terrain (au chevet du malade), directement dans les selles, à l'aide de bandelettes immunochromatographiques simples à fabriquer et à utiliser, peu onéreuses et robustes (conservation à température ambiante).
Quatre objectifs sont visés :
- • Faciliter la prise en charge clinique ;
- • Permettre des actions de surveillance (investigations épidémiologiques / veille à l'émergence) décentralisées (dépendant le moins possible d'un laboratoire central) ;
- • Permettre des interventions sur sites épidémiques (rapidité de réponse) ;
- • Faciliter les essais vaccinaux (études épidémiologiques en amont, pendant et en aval des essais).
2.1.3 Démarche expérimentale
La mise au point des bandelettes implique : (i) d'identifier la cible support du diagnostic [facteur de virulence commun au genre Shigella ou un commun à l'espèce E. histolytica, toxines Shiga (Stx1 et Stx2) produites par ECEH O157 et S. dysenteriae 1, LPS spécifique d'espèce (S. sonnei) ou de sérotype (S. flexneri 2a, S. dysenteriae 1, E. coli O157] ; (ii) de purifier les antigènes ciblés ; (iii) de produire les anticorps monoclonaux (mAbs) dirigés contre ces antigènes et de les coupler à l'or colloïdal (conjugué), (iv) d'assembler et d'optimiser les bandelettes ; (v) d'évaluer les bandelettes au laboratoire et sur le terrain.
2.1.4 Résultats et perspectives
Sur les sept bandelettes initialement prévues, quatre ont été construites pour S. flexneri 2a, S. dysenteriae 1, E. histolytica et la toxine Shiga. Les autres sont en développement très avancé. La preuve du concept de diagnostic direct dans les selles par bandelette a été réalisé pour S. flexneri 2a (PloS ONE, April 2007 | Issue 4 | e361). Une partie de ce développement technologique bénéficie du mécénat industriel (TOTAL SA).
La perspective est de développer un système multivalent immunochromatographique (par exemple en couronne) de diagnostic rapide dans les selles, organisé selon le syndrome diarrhéique ou selon les étiologies en cause, par exemple :
- – Un système pour les diarrhées aqueuses sévères (rotavirus, cholera, ETEC, Salmonella enterica) ;
- – Un système pour les diarrhées sanglantes / inflammatoires (Shigella spp and EIEC, EHEC, Entamoeba histolytica) ;
- – Un système pour les diarrhées chroniques (EPEC, EAgEC) ;
- – Un système pour Shigella (générique et S. dysenteriae 1, 2 and 3 ; S. flexneri 1b, 2a, 2b, 3a, 6b ; S. sonnei) ;
- – Un système pour Salmonella enterica (les groupes O9, O4, O7, O8, O2, O3 couvrent 85 to 90 % des sérotypes courants).
2.2 Epidémiologie
Sur les sites où la diarrhée infantile grave est identifiée comme un problème de santé publique, la mise à jour des données épidémiologiques est indispensable pour mieux connaître le fardeau que représente la maladie et ainsi organiser de façon rationnelle des actions programmées.
Ces connaissances épidémiologiques sont également indispensables :
- – Pour identifier les sites où les nouveaux outils de diagnostic peuvent être validés ;
- – Pour mettre à jour les algorithmes de prise en charge (diagnostic / traitement / nutrition) ;
- – Pour identifier des zones où pourraient se dérouler les essais vaccinaux sur les candidats vaccins validés au Nord ;
- – Pour répondre aux questions posées par la vaccination en zone d'endémie (prédictivité des candidats vaccins notamment), et orienter les stratégies vaccinales (vaccins vivants atténués ou glycoconjugués ?).
A Madagascar, une étude transversale est en cours dans le but d'identifier le site qui sera dédié au programme diarrhée. Sur ce site, une étude cas/témoins sera réalisée à l'issue (horizon 2009) dans le but de préciser le fardeau que représente la maladie, les étiologies en cause et leurs caractéristiques microbiologiques, les morbi-mortalité des diarrhées et les données démographiques de la population touchée, et les facteurs de risques. Une partie des investigations épidémiologiques est soutenue par le mécénat industriel (TOTAL SA). Des études similaires sont en cours en Afrique continentale, en Amérique du sud et en Asie.
Des données épidémiologiques recueillies dépendent la mise en place des études en vaccinologie, et une recherche intégrée fondamentale alliant la microbiologie, la gastrentérologie, la nutrition, l'immunologie et la génétique.
2.3 Vaccinologie
Elle a une excellente valeur intégrative et formatrice qui amène à associer dans une même action coordonnée :
- – La validation d'outils diagnostics ;
- – La surveillance épidémiologique, la veille à l'émergence et celle de la variation du pathogène considéré ;
- – Les études épidémiologiques ;
- – La modélisation de l'impact attendu du vaccin candidat ;
- – La mise en place et la réalisation d'essais cliniques, en particulier pour les phases II et III ;
- – Le développement et l'utilisation d'outils d'immunomonitorage et de tentative de définition de corrélats de protection.
Il serait actuellement opportun de profiter du mouvement favorable observé :
- – avec les industriels qui reprennent les programmes de développement des vaccins contre les maladies entériques,
- – avec la construction d'un Institut de recherche sur les maladies négligées (Novartis) pour consolider ce type de programme,
- – avec le Programme de la Fondation Bill & Melinda Gates « Shigella-ETEC Vaccines »,
2.4 Recherche intégrée fondamentale et clinique
Intégrer à la fois : la microbiologie, la gastroentérologie, la nutrition, l'immunologie et la génétique est fondamental pour :
- – Déterminer les causes d'échec des algorithmes OMS actuellement proposés pour la prise en charge des diarrhées infantiles dans les PED. En identifiant ces causes et en modifiant en conséquence les algorithmes nous réduirons la proportion des diarrhées échappant aux procédures adaptées aux structures démunies des PED ;
- – Déterminer comment reconnaître précocement les troubles nutritionnels liés à des diarrhées chroniques/intraitables ou récidivantes et les prendre en charge efficacement ;
- – Etudier l'inflammation et l'immunité de la muqueuse intestinale en zone endémo épidémique pour les maladies diarrhéiques ;
- – Etudier la physiopathologie des diarrhées chroniques/intraitables et leur répercussion sur la nutrition ;
- – Etudier la réponse immunitaire protectrice pour une meilleure définition des antigènes vaccinants ;
- – Rationaliser le choix des meilleurs candidats vaccins en zone endémo épidémique (vaccin glycoconjugué parentéral ou vaccin vivant atténué oral ?)
2.5 Études sociologiques
Elles seront centrées sur :
- – La perception qu'ont les parents, les familles et les responsables dans les communautés de l'importance des diarrhées infantiles graves, notamment :
- • La notion de sévérité et celle du risque pour les enfants,
- • L'appréciation des causes et de leur signification,
- • La prévention primaire (hygiène individuelle et alimentaire),
- • Les traitements (SRO), et les risques lies aux antibiotiques,
- – La demande pour des vaccins contre les diarrhées infantiles graves ;
- – L'attitude vis à vis des vaccins en général ;
- – Les stratégies pour la promotion des vaccins disponibles.
2.6 Formation et pérennisation du programme
Le constat réalisé lors de l'analyse des besoins pour pérenniser le programme est qu'il est difficile aux scientifiques de certains PED d'accéder à des formations d'un niveau comparable à celles délivrées dans les pays développés.
Pour répondre à ce besoin deux actions sont engagées :
- – Des formations doctorales « classiques » sur site, dans le cadre d'un partenariat entre des universités au Sud et au Nord. Le financement de deux bourses prévues à l'aide d'un mécénat industriel (TOTAL SA) ;
- – La création d'un « International Master in Infectious Diseases » sous l'égide de l'OMS et coordonné par l'Institut Pasteur et la fondation HsET, incluant un module de formation dans le domaine des maladies entériques.
3 Pour conclure
Une action intégrée programmatique présente plusieurs avantages, notamment :
- • Une large capacité d'association et d'intégration Nord-Sud de compétences institutionnelles et individuelles (nationales et internationales) ;
- • La création d'une masse critique indispensable à l'impact de l'action en PED ;
- • Elle donne une visibilité et de l'attractivité à la thématique et à l'action proprement dite ce qui facilite :
- – Le recrutement de participants motivés à la fois dans les pays développés et dans les PED (jeunes médecins et scientifiques, experts, …),
- – L'obtention de financements auprès d'organismes publics, de fondations privées et d'industriels,
- • Elle crée une base et une diversité suffisante de compétences pour la mise en place d'une plate-forme de formation ;
- • Elle facilite de ce fait l'irradiation et la pérennisation de l'action.
- • Le transfert d'un maximum de compétences en PED, par l'accueil des programmes au sein de structures souples liant Nord et Sud, réactives, ainsi capables de favoriser des transferts technologiques vers les PED ;
- • La création d'au moins un pôle susceptible d'irradier ses compétences à d'autres sites régionaux ;
- • Un leadership médico-scientifique fort, en particulier pour l'attraction des compétences et pour la levée de fonds ;
- • La mise en place d'une mobilité interne dans les institutions partenaires ;
- • La mise en place d'un suivi des actions avec un comité de pilotage médico-scientifique extérieur ;
- • La structuration des actions de formation ;
- • Une modification des systèmes de gestion des droits de propriétés intellectuelle pour attirer l'investissement industriel et la création de nouvelles entreprises inovantes.


