1 Introduction
L'existence d'une diapause chez de nombreuses espèces d'Insectes a été exploitée [1–10]. Selon les espèces, la diapause est imaginale, nymphale, larvaire ou embryonnaire. Sur la diapause embryonnaire, les recherches ont été effectuées plus particulièrement sur les Lépidoptères, notamment Bombyx mori [11–21], sur les Orthoptères, Melanoplus differentialis [1,2,4], Aulocara elliotti [22] et Ephippiger cruciger (Orthoptera : Tettigoniidae) [23]. L'embryologie des Acridiens est bien connue grâce en particulier aux travaux classiques de Roonwal [24,25]. Chez Locusta migratoria L., l'existence de souches polyvoltines sans diapause et de souches univoltines avec diapause embryonnaire, associée aux grandes dimensions des œufs paraît favorable à une analyse physiologique de l'embryogenèse. Les données concernant L. migratoria L. ont été complétées par des analyses plus ponctuelles [26–44]. Les études chronologiques du développement embryonnaire de L. migratoria L. sont nombreuses [24,25,27–29,31,32,37]. Elles ont été établies à des températures diverses, allant de 19 °C à 33 °C. De plus, les critères utilisés pour la définition des stades diffèrent d'un auteur à un autre. Bien que la chronologie du développement établie par Le Berre [27] puisse présenter un intérêt particulier puisqu'elle concerne des souches avec ou sans diapause embryonnaire, nous avons préféré reprendre celle donnée par Chapman et Whitham [31]. Celle-ci a le mérite d'être valable pour l'ensemble des Acridiens, car les stades de 0 à IX sont définis par les principaux événements de l'embryogenèse communs aux différentes espèces. Nous donnons la chronologie de l'embryogenèse de la souche « Espiguette » avec ou sans diapause de L. migratoria L.
2 Materiels et methodes
2.1 Matériel biologique
Ce travail a été réalisé sur les œufs et les embryons d'une souche de L. migratoria L. : la souche « Espiguette », mixte. Cette dernière a été récoltée près du phare de l'Espiguette, au sud du Grau-du-Roi, entre Sète et les Saintes-Marie de la Mer, près de la côte méditerranéenne en France. La latitude est de 43°28 Nord. La longitude est de 4°8 Est. Cette souche de L. migratoria est intéressante car selon les œufs et selon les conditions de température, le développement est soit ininterrompu soit avec diapause.
2.2 Méthodes
Les embryons utilisés pour les expériences proviennent d'un élevage de criquets en forte densité, maintenu en permanence au laboratoire. Les criquets sont essentiellement nourris de graminées sauvages : de paturins (Poa sp.), pour les trois premiers stades larvaires ; un mélange de deux autres espèces végétales : Dactylis glomerata et Holcus lanatus, graminées à texture moins tendre pour les stades ultérieurs. Un complément de son de froment est fourni à partir du cinquième stade larvaire. L'alimentation est renouvelée tous les jours. Dès les premières copulations, des pondoirs sont disposés dans le double compartiment du fond de la cage. Afin d'avoir des œufs datés avec précision, les femelles sont surveillées dès qu'elles commencent à forer un trou de ponte dans le sable humide. Nous considérons le moment où la femelle retire son abdomen et ferme l'orifice de ponte comme le temps zéro dans notre chronologie du développement embryonnaire. La durée de l'oviposition fluctue de 30 minutes à deux heures. Elle est en accord avec les observations de Popov in Albrecht [30], celles de Petavy [32] et d'Ihsan [36,37]. Pour l'incubation des œufs, nous avons repris la méthode mise au point par Petavy [32]. La détermination des stades embryonnaires et la comparaison des chronologies de développement avec ou sans diapause ont été faites à partir des observations du matériel fixé pour une éventuelle étude histologique. L'observation des caractères morphologiques à la loupe binoculaire de lots d'une vingtaine d'embryons fixés quotidiennement nous a permis de faire une étude comparative du développement embryonnaire avec ou sans diapause.
3 Résultats
3.1 Embryogenèse sans diapause
Notre échelle chronologique débute au moment où la femelle ferme l'orifice de ponte. Etant donnée la durée de l'oviposition, nous pouvons estimer que les œufs sont datés à une heure près.
Dès la ponte, les énergides de segmentation se multiplient rapidement et migrent vers la périphérie de l'œuf pour édifier le blastoderme. 48 heures après la ponte, nous observons une densité plus forte de cellules près du pôle postérieur de l'œuf, là où apparaîtra l'écusson embryonnaire (Fig. 1a). Trois jours après la ponte, l'ébauche embryonnaire est une jeune bandelette : le procéphalon élargi coiffe le pôle postérieur de l'œuf. Il est prolongé par un protocorme de même longueur que lui (Figs. 1b, 4a). Au cours des vingt-quatre heures qui suivent, le procéphalon s'élargit en deux lobes procéphaliques. Il présente une courbure très prononcée. L'invagination stomodéale est visible. Parallèlement, le protocorme s'allonge et les segments gnathaux et thoraciques sont délimités. Le reste du protocorme encore indivis est presque aussi long que l'ensemble des segments gnathaux et thoraciques (Figs. 1c, 1d, 4b). Les embryons âgés de 5 jours sont au stade IIIc (Figs. 1e, 4c). A ce stade, l'anatrepsis a commencé et la bandelette embryonnaire recule vers le pôle antérieur de l'œuf. Les lobes procéphaliques, de forme plus ramassée, portent les ébauches des antennes et celles du labre. Ce dernier surplombe l'ouverture stomodéale. Les ébauches des pièces buccales sont présentes. Celles des mâchoires et du labium sont légèrement bilobées. Les ébauches des trois paires de pattes sont bien développées. L'abdomen présente 8 à 9 segments délimités. Le premier segment porte des pleuropodes. Les dimensions des embryons âgés de 6 jours se sont nettement accrues. Sur la tête, les deux ébauches oculaires sont proéminentes. L'extrémité des antennes atteint la limite gnatho-thoracique. La morphologie des pièces buccales se précise : en particulier les mâchoires, les futurs lacinia, galea et palpes sont bien distincts. Les palpes labiaux se sont allongés. Les pattes plus longues présentent chacune cinq subdivisions (Figs. 1f, 4d). Au cours des vingt-quatre heures qui suivent, les pattes postérieures montrent une flexion au niveau du tibia. Le bord interne des tarses se touche. Les ébauches des stigmates sont bien visibles (Figs. 1g, 4e1–4e2). La catatrepsis qui correspond au stade V défini par Chapman et Whitham [31] commence 8 jours après la ponte. Elle s'effectue rapidement par une flexion de l'embryon. Il contourne le pôle postérieur et remonte vers le pôle antérieur de l'œuf, la tête en avant. La catatrepsis est un évènement rapide. Nous avons constaté une certaine variabilité chronologique, car certains embryons de 8 jours commencent juste leur catatrepsis avec la courbure au niveau de la tête (Fig. 4f1). D'autres embryons se trouvent en milieu de catatrepsis avec la courbure au niveau du thorax (Fig. 4f2) ou en fin de catatrepsis, l'abdomen contournant déjà le pôle postérieur. Nous pouvons considérer qu'en général les embryons achèvent leur catatrepsis 9 jours après la ponte (Fig. 1h). Vingt-quatre plus tard, l'embryon est désormais placé du côté de la face convexe de l'œuf, sa tête dirigée vers le pôle antérieur de l'œuf. Au-dessus de lui, le vitellus extra-embryonnaire est encore très abondant. Le début de la coloration des yeux apparaît. La différence de taille entre les pattes postérieures et les deux autres paires s'accentue davantage (Figs. 1i, 4g). L'embryon a une croissance importante pendant les jours suivants. Il prend une extension à la fois en longueur et en largeur. 11 jours après la ponte, il s'étend sur les 3/4 postérieurs de l'œuf avec, au-dessus de lui, du vitellus extra-embryonnaire. La fermeture dorsale de l'embryon progresse de l'arrière vers l'avant (Fig. 4h). Les antennes sont longues. Les articles du tarse sont identifiables. Les pattes postérieures s'étendent sur 3 ou 4 segments abdominaux. Le tibia est replié sur le fémur. A l'extrémité de l'abdomen, nous observons nettement la paire de cerques (Figs. 1j, 4h+). La fermeture dorsale de l'embryon est achevée 13 jours après la ponte. Il n'y a plus de vitellus extra-embryonnaire. Les yeux composés sont d'une coloration très prononcée. Les dents des mandibules commencent à se modeler. La pigmentation des antennes est encore absente. Les pattes postérieures couvrent 5 segments abdominaux (Figs. 1bis, 1k, 4i). Les embryons de 14 jours sont davantage pigmentés : la pigmentation de l'œil est renforcée. Le tégument se teinte par endroits. L'extrémité des antennes est colorée. Le front et le clypeus se distinguent nettement (Fig. 4k). Selon Petavy [32], la position de l'articulation fémoro-tibiale des pattes postérieures est le repère le plus pratique pour distinguer le stade VIIIb du stade VIIIa : au stade VIIIb, cette articulation se situe en arrière de la limite entre les 5èmes et les 6èmes segments abdominaux (Figs. 1bis, 4l). Le stade IXa est marqué par un renforcement de la pigmentation du tégument. Il est atteint environ 16 jours après la ponte. Les fémurs métathoraciques arrivent jusqu'à la marge antérieure du 7ème segment abdominal. Le stade IXb est observé 17 jours après la ponte. Les dents mandibulaires sont très foncées, presque noires. Les fémurs métathoraciques arrivent jusqu'à la marge antérieure du 8ème segment abdominal (Figs. 1bis m ; 4l). Les premières éclosions se manifestent 20 jours après la ponte mais elles sont encore peu nombreuses. La majorité des jeunes larves éclôt les deux jours suivants. Quelques éclosions tardives peuvent avoir lieu jusqu'au 24ème jour.
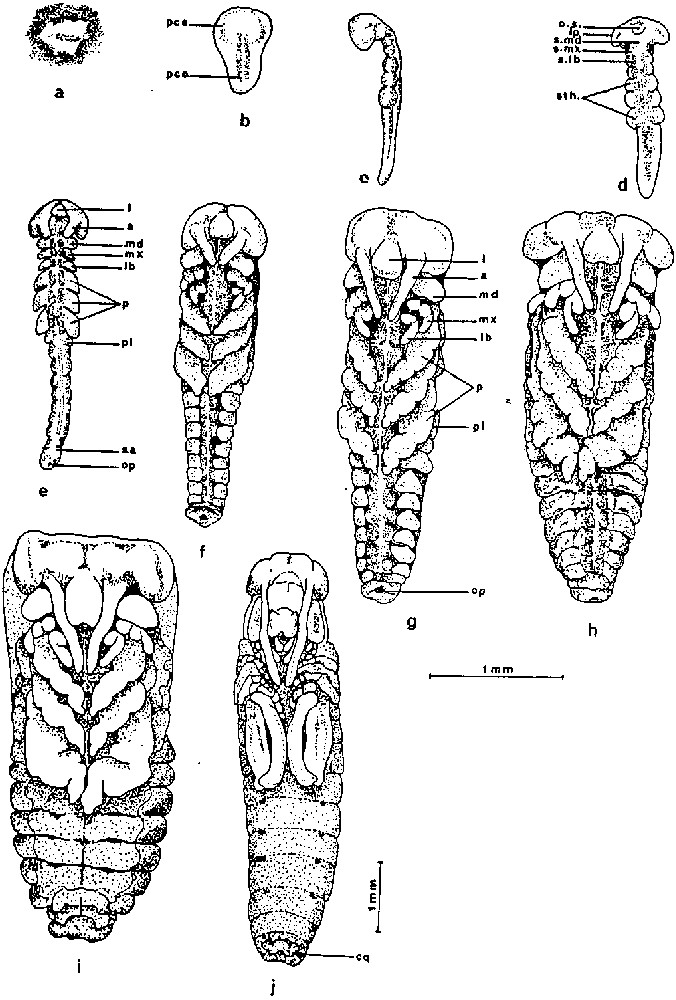
Les différents stades embryonnaires chez la souche « Espiguette» : développement sans diapause jusqu'au 11èmejour après la ponte, à la température de 27 ± 0,5 °C (dessins des différents stades d'après Ihsan [7]). a : 2 jours après la ponte, stade I. b : 3 jours après la ponte, stade IIb. c et d : 4 jours après la ponte, stade IIIb. e : 5 jours après la ponte, stade IIIc+. f : 6 jours après la ponte, stade Iva1. g : 7 jours après la ponte, stade IVb2. h : 8 jours après la ponte, stade Va. i : 10 jours après la ponte, stade VI. j : 11 jours après la ponte, stade VII. a : antenne ; I : ébauche du labre ; lb : ébauche du labium ; lp : lobe procéphalique ; md : ébauche de la mandibule ; mx : ébauche de la mâchoire ; op : orifice proctodéal ; os : ouverture stomodéale ; p : ébauche des pattes ; pce : procéphalon ; pco : protocorme ; pl : pleuropode ; sa : segment abdominal ; slb : segment labial ; smd : segment mandibulaire ; smx : segment maxillaire ; sth : segment thoracique. Masquer
Les différents stades embryonnaires chez la souche « Espiguette» : développement sans diapause jusqu'au 11èmejour après la ponte, à la température de 27 ± 0,5 °C (dessins des différents stades d'après Ihsan [7]). a : 2 jours après la ponte, stade I. ... Lire la suite

Les stades embryonnaires de L. migratoria, souche « Espiguette» : développement sans diapause à 27 ± 0,5 °C, jusqu'au 17ème jour après la ponte. a : 3 jours après la ponte, stade IIb. b : 4 jours après la ponte, stade IIIb. c : 5 jours après la ponte, stade IIIc. d : 6 jours après la ponte, stade IVa1. e1 et e2 : 7 jours après la ponte, stades IVb1 et IVb2. f1 et f2 : 8 jours après la ponte, stades Va et Vb. g : 10 jours après la ponte, stade VI. h : 11 jours après la ponte, stade VII. h+ : 12 jours après la ponte, stade VII+. i : 13 jours après la ponte, stade VIIIa. j : 14 jours après la ponte, stade VIIIb. k : 16 jours après la ponte, stade IXa. l : 17 jours après la ponte, stade IXb. Masquer
Les stades embryonnaires de L. migratoria, souche « Espiguette» : développement sans diapause à 27 ± 0,5 °C, jusqu'au 17ème jour après la ponte. a : 3 jours après la ponte, stade IIb. b : 4 jours après la ponte, stade IIIb. ... Lire la suite
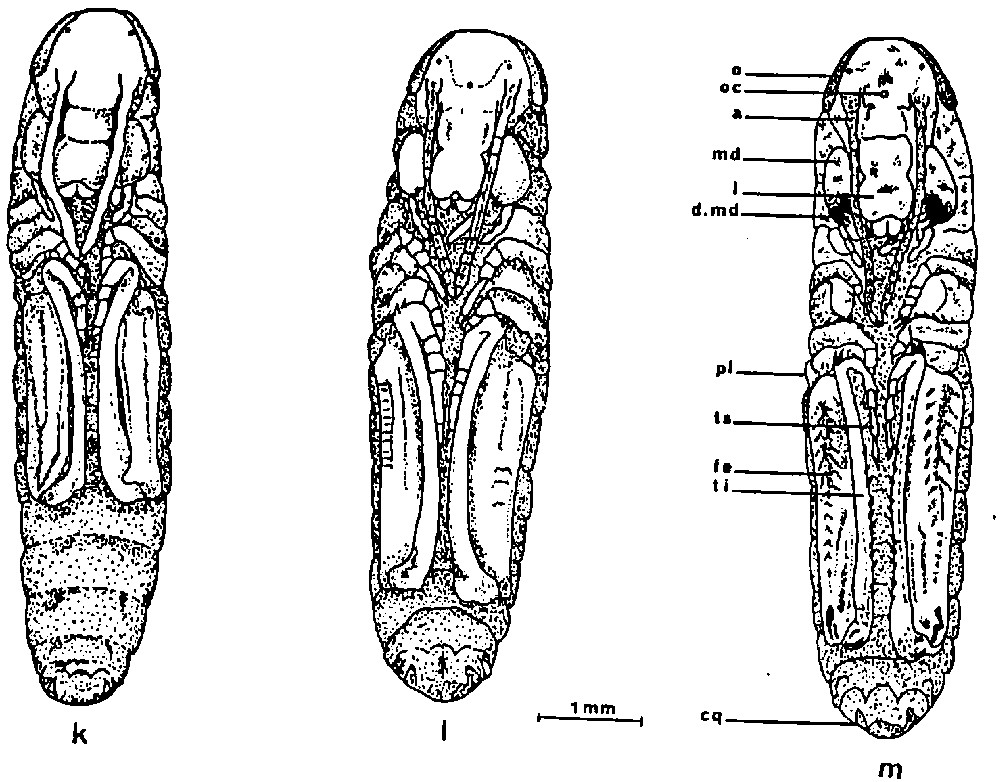
Les stades embryonnaires de L. migratoria L., souche « Espiguette» : développement sans diapause à 27 ± 0,5 °C, du 13ème jour après la ponte jusqu'à l'éclosion (dessins des différents stades d'après Ihsan [7]). k : 13 jours après la ponte, stade VIIIa. l : 14 jours après la ponte, stade VIIIb. m : 17 jours après la ponte, stade IXb. a : antenne ; cq : cerque ; d.md : dent mandibulaire ; fe : fémur ; l : labre ; md : mandibule ; o : œil ; oc : ocelle ; pl : pleuropodes ; ti : tibia. Masquer
Les stades embryonnaires de L. migratoria L., souche « Espiguette» : développement sans diapause à 27 ± 0,5 °C, du 13ème jour après la ponte jusqu'à l'éclosion (dessins des différents stades d'après Ihsan [7]). k : 13 jours après la ponte, ... Lire la suite
3.2 Embryogenèse à diapause
Une étude comparable à la précédente a été menée dans le cas d'un développement à diapause (Fig. 2). Les œufs incubés à
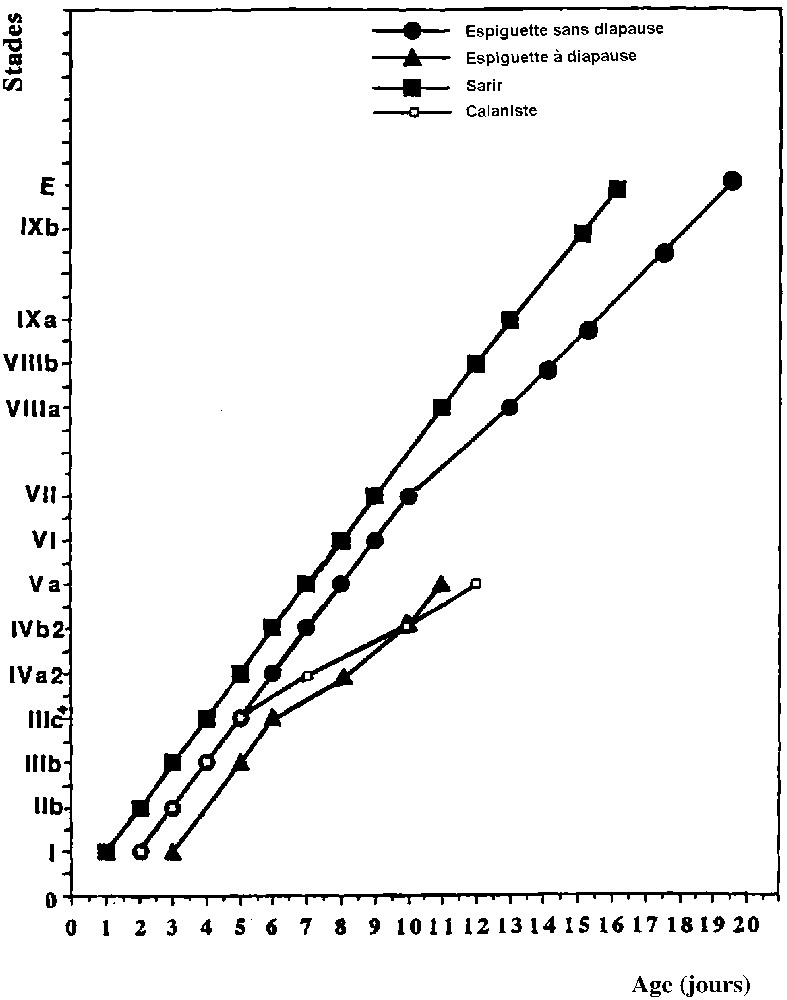
Chronologie du développement embryonnaire sans diapause et avec diapause, de la souche « Espiguette» : comparaison avec celle d'autres souches (Sarir et Calaniste) de L. migratoria.
3.2.1 Période de pré-diapause
Bien qu'ils soient soumis à la même température d'incubation, les œufs qui devront entrer en diapause ont une évolution plus lente que celle que nous venons de décrire dans le cas d'un développement continu. Le stade I n'est en effet observable que dans les œufs âgés de 3 jours. On note alors l'apparition d'une ébauche embryonnaire près du pôle postérieur. L'écusson embryonnaire n'est observable que 4 jours après la ponte. C'est une jeune bandelette triangulaire composée de deux parties : le procéphalon et le protocorme. Sa longueur est la même que chez les embryons de 3 jours de la lignée sans diapause. Cinq jours après la ponte, le procéphalon s'élargit et se différencie en deux lobes procéphaliques avec l'ouverture stomodéale visible. Au cours des 24 heures qui suivent, le protocorme s'allonge. Les segments gnathaux et thoraciques sont délimités. La partie postérieure, encore non segmentée de la bandelette s'est allongée. 7 jours après la ponte, la croissance de la bandelette germinative est très importante. La segmentation abdominale est achevée. Les ébauches des antennes, les appendices gnathaux et thoraciques sont bien visibles. Les embryons de 8 jours sont au stade IVa2 avec des mandibules légèrement bilobées, des mâchoires constituées de trois parties, les ébauches des palpes labiaux bien distinctes. Les embryons sont donc à peu près au même stade de développement que les embryons de 6 jours de la souche sans diapause. La morphogenèse de l'embryon continue à progresser. La segmentation de l'abdomen est achevée 9 jours après la ponte. Les pattes subdivisées en 5 parties, montrent une flexion au niveau du tibia. De dimensions plus grandes, les embryons âgés de 10 jours après la ponte présentent les mêmes caractéristiques morphologiques qu'au stade précédent. Les embryons de 11 jours ont la morphologie d'un embryon au début du stade V. Par contre, ils ne débutent pas leur catatrepsis.
3.2.2 Période de diapause
Comme c'est le cas pour les autres souches univoltines, les embryons entrent en diapause. Incubés à
3.2.3 Période de la reprise du développement
Pour assurer une bonne reprise du développement, les embryons sont soumis à un réchauffement progressif pendant 3 jours à la température ambiante. Ils sont ensuite incubés à la température de

Chronologie du développement embryonnaire, après la rupture de la diapause, chez la souche « Espiguette» de L. migratoria. Le moment où les oeufs sont placés à 27 °C, après le palier de 3 jours, est considéré comme le jour 0.
4 Discussion
De nombreuses chronologies du développement embryonnaire ont été établies pour L. migratoria. Elles montrent parfois de nettes différences. Pour une même température (33 °C) les œufs de la souche utilisée par Roonwal [24,25], originaire du Soudan, se développent plus lentement que ceux de la souche provenant du Mali, utilisée par Petavy [32]. Le Berre [27] a comparé les chronologies du développement jusqu'à la fin de l'anatrepsis d'une souche univoltine, L. migratoria gallica, provenant des Landes de Gascogne et d'une souche polyvoltine, L. migratoria cinarescens, originaire du département du Var, en France. Ces deux souches étaient élevées à 25 °C. Les œufs de la souche univoltine se développaient plus lentement que ceux de l'autre souche ; le retard s'accroissait progressivement jusqu'à l'entrée en diapause. Les observations d'Ihsan [37] ont été faites sur deux autres souches de L. migratoria, la souche « Sarir » polyvoltine, provenant de l'oasis de Sarir en Lybie et la souche « Calaniste », univoltine issue de Roumanie, près de la ville de Satu-Mare. Elles confirment le retard du développement des souches univoltines par rapport à celui des souches polyvoltines. Les incubations ayant été réalisées à 27 °C, il nous a donc paru intéressant de comparer la vitesse de développement des œufs de la souche « Espiguette » à celle établie par Ihsan [37] pour les souches « Sarir » et « Calaniste ». Les élevages et l'incubation des oothèques pour ces trois souches ont été réalisés selon le même protocole et dans les mêmes conditions.
Nous avons pris pour comparaison la souche « Sarir » comme référence ; cette souche est typiquement polyvoltine, sans manifestation de diapause embryonnaire. Ihsan [37] a constaté que le développement embryonnaire de la souche « Calaniste », souche à diapause obligatoire est d'emblée plus lent que pour la souche « Sarir ». Le retard s'accentue à partir du stade IIIc jusqu'à l'entrée en diapause. La souche « Espiguette », nous l'avons vu, est moins stricte que les deux souches précédentes. A 27 °C, certains œufs se mettent en diapause, alors que les autres poursuivent leur développement jusqu'à l'éclosion. Ceux qui se mettront en diapause manifestent un retard important par rapport à la chronologie établie pour la souche « Sarir », retard plus important que celui de la souche « Calaniste ». Comme pour la souche « Calaniste », un ralentissement de l'embryogenèse apparaît à partir du stade IIIc ; à ce stade, l'embryon commence l'anatrepsis, remontant vers le pôle antérieur. Ainsi toute cette période d'anatrepsis à laquelle fait suite une rapide catatrepsis dans le développement sans interruption se trouve nettement ralentie. La tendance à une entrée en diapause apparaît donc entraver le déplacement de l'embryon dans l'œuf, la morphogenèse de cet embryon est en même temps ralentie.
Les œufs de la souche « Espiguette » qui ne manifestent pas de diapause présentent un développement d'emblée plus lent que ceux de la souche « Sarir » si bien que les durées des premiers stades sont les mêmes que pour la souche « Calaniste ». Mais contrairement à cette dernière, le retard ne s'accroît pas après le stade IIIc ; l'embryon effectue l'anatrepsis et la catatrepsis à la même vitesse que les embryons de la souche « Sarir » ; leur morphologie évolue également à la même vitesse jusqu'au stade VII. Cependant la fin du développement se déroule plus lentement si bien que l'éclosion a lieu 4 jours après l'éclosion des œufs de la souche « Sarir ».
Deux moments critiques existent donc : le premier au début de l'anatrepsis concerne les œufs qui se mettront en diapause ; le deuxième qui a eu lieu au stade VII, c'est-à-dire après la fermeture dorsale de l'embryon, touche les œufs qui ont échappé à la diapause. A ces moments critiques doivent vraisemblablement correspondre des états particuliers du métabolisme embryonnaire qui aurait tendance à devenir moins élevé. Après le premier moment critique, cela entraîne l'entrée en diapause des embryons tandis qu'après le deuxième moment critique, cela n'a pour effet qu'un ralentissement du développement.
Remerciements
Ce travail a été soutenu par le programme Tassili n° 08MDU726 dans le cadre du projet Globalbiodiv. A.H. remercie Madame Le Professeur Raccaud-Schoeller, en retraite, pour l'avoir accueilli dans son Laboratoire de Physiologie des Insectes de l'Université Pierre et Marie Curie, Paris 6 à Paris et dirigé ses travaux de recherche. Nous rendons un grand hommage à la mémoire de Monsieur Le Professeur Verdier pour nous avoir fourni deux précieuses souches de L. migratoria L. Nos remerciements vont également au personnel du Centre Interuniversitaire de Microscopie Electronique, CIME-Jussieu, Paris VI où a été effectué tout le travail ultrastructural.


