Abridged English version
Terrestrial pulmonate gastropods occupy a wide range of habitats and show great differences in life-history traits. Variations within species depend on the variety of habitat, seasonality, climate, ecological tolerance, adaptation and life stage of the parental individuals. Helix aperta (syn. Cantareus apertus commonly called green snails) has a primarily peri-Mediterranean distribution area. The adaptation and evolution of populations of this species in discontinuous biotopes (sometimes insular) deserves particular interest in their ecophysiology to elucidate the role of various factors of adaptation and possibly of breeding control. Indeed some populations are dramatically declining (in France) or constitute an important economic resource (Tunisia, Italy) whereas in other regions they are a pest for crops (Sicily, Australia, New Zealand).
Adult and sub-adult H. aperta were sampled in the region of Bazina (North-West Tunisia) at the end of summer (September) and were used for experimental breeding. Data demonstrated the influence of photoperiod on the growth and reproduction of this species for which mainly the shell and the genital tract have been described for determination of the species.
After adaptation to a diet specifically designed for snails (Helixal®), the larger snails (around 14 g) reared under a short-day photoperiod (8hL–16hD) at 20 °C and 80% humidity started mating and laying a large number of white eggs (up to 400 eggs per clutch), with a diameter of 2.8 to 3 mm and a fresh mass of 12 to 14 mg. Young emerged after 12 days at 20 °C with a good hatching success (80 to 90%). In contrast, snails reared under a long-day photoperiod (18hL–6hD) mated but did not lay eggs.
The physiological effect of short and long photoperiods on growth was reversible and appeared after a time lag that depended on the change considered: when the photoperiod was shortened (LD to SD), the stimulating effect appeared after 4 weeks. The inhibiting effect on shifting to a long-day photoperiod was visible only after 8 weeks when a calcareous epiphragm was secreted and the snails became inactive.
After hatching, successive steps of ontogenesis (nursery, growth, differentiation and maturation of the genital tract and reproduction) were observed with the short day photoperiod over a 23-week cycle (18 weeks for growth and then reproduction from the 18th to the 23rd week). Eggs produced by this first generation gave second generation hatchlings which reached adult size in 15 weeks. Although this species of snails presents periods of inactivity in the field with the secretion of a calcareous epiphragm, continuous breeding was possible, i.e. without a “refractory” period, when the animals were maintained under optimal ecophysiological conditions.
Experimental breeding of H. aperta for two successive generations allows us to describe the different life traits of this species in a controlled laboratory environment (photoperiod: 8hL–16D; temperature: 20 °C; humidity: 80% and Helixal® snail food ad libitum). The experiments revealed the particular photoperiodic determinism of this thermophilous and photophobic species which is adapted to the ecological conditions of North-West of Tunisia. Growth and reproduction were stimulated by exposure to short days whereas long day photoperiod induced the aestivation characteristic of this species. Other investigations should now be performed with H. aperta from other sites where this species is still present and abundant to determine the role of latitude, season and altitude as has been done to study adaptative variations of other organisms (insects, fish, reptiles and mammals). The present results show the feasibility of the development of rational breeding from reproducers taken from the North West of Tunisia and probably from other regions after checking their sensitivity to different photoperiods over the seasons. The data obtained would make it possible to consider the reintroduction of the most suitable lines in areas where this species has more or less completely disappeared, e.g. the south of France. In this way, present result could contribute to the protection of this species in the regions where it represents an ecological richness and economic resource.
1 Introduction
Les gastéropodes pulmonés terrestres occupent une grande diversité d'habitats et montrent d'énormes variations d'histoires de vie. Selon les espèces, il y a souvent des variations considérables suivant la diversité des habitats, les saisons, le climat, la tolérance écologique et la taille ou le stade de vie des individus [1].
Helix aperta = Cantareus apertus (Born, 1778) ou escargot naticoïde (Helix naticoides Draparnaud, 1801) est une espèce particulièrement intéressante et énigmatique aux divers titres évoqués par Heller [1]. En effet, sa répartition autour de la Méditerranée, à des altitudes inférieures à 900 m [2,3] suggère l'influence de conditions climatiques chaudes avec toutefois des variations saisonnières bien marquées. De plus les populations actuelles se sont adaptées à des écosystèmes, certes méditerranéens, mais qui présentent des caractéristiques différentes résultant des modifications géomorphologiques et climatiques du bassin. On se trouve ainsi en présence d'une espèce dont l'aire de répartition est bien déterminée mais dont les populations présentent des morphotypes suivant les régions. Ainsi les escargots naticoïdes de Tunisie importés en Italie seraient plus gros que ceux de Sardaigne (Elmslie, communication personnelle). D'autre part, le fait que cette espèce ait évolué indépendamment dans des îles méditerranéennes (Corse, Sardaigne et Sicile) représente un intérêt tout particulier d'étude de l'interaction des facteurs de l'environnement et des caractéristiques physiologiques en relation avec l'isolement insulaire. Enfin malgré qu'en Italie du Sud la consommation de cette espèce « noble » donne lieu à des festivals importants et qu'en Tunisie elle soit également consommée et exportée, beaucoup d'aspects de son écophysiologie ne sont pas connus. En effet, la description de la coquille et ses différences de taille suivant la provenance a été faite par plusieurs auteurs [2–7] mais on n'a pas d'indication sur le poids des animaux ni sur leur croissance. L'appareil génital a fait l'objet de descriptions détaillées et de comparaisons avec celui d'autres espèces d'escargots [2–4]. Comme chez Helix aspersa = Cantareus aspersus (Müller, 1774), des différences de dimensions de certaines parties du tractus génital de populations de différentes localités ont été observées chez H. aperta et comparées par Giusti et al. [7]. De même le comportement lors de l'accouplement chez H. aperta a été observé et décrit avec beaucoup de détails [8] à partir de spécimens collectés près d'Orbetello et de Castelnuovo Berardenga (Sienne, Toscane) et maintenus au laboratoire pour des observations continues. Ces auteurs vérifient qu'H. aperta s'accouple préférentiellement de début octobre à mi-décembre tandis que chez Theba pisana collectés près d'Orbetello (Grosseto, Toscane) l'accouplement est observé de préférence entre Septembre et Octobre.
Cependant le cycle de vie complet d'H. aperta reste incomplètement connu ; on sait seulement que les adultes thermophiles et photophobes [9,10] s'enfoncent dans le sol pendant le jour et en Italie subissent de longues périodes d'estivation. En Tunisie leur recherche est généralement pratiquée par déterrage dans les sites repérés par des ramasseurs qui récoltent les escargots sans critère de taille ; comme pour les autres espèces d'escargots comestibles, le tri des escargots naticoïdes adultes se fait après la récolte pour la vente à des collecteurs et ceux qui sont trop petits sont donnés aux animaux domestiques.
Dans ce contexte, l'objectif de cette étude est d'obtenir expérimentalement la maîtrise de la reproduction et du développement d'Helix aperta en s'inspirant des méthodes d'élevage mises au point pour les escargots terrestres H. aspersa et H. pomatia et de déterminer l'influence de la photopériode sur l'histoire de vie de cette espèce méditerranéenne.
2 Matériels et méthodes
2.1 Animaux
Helix aperta étant très répandu dans la Tunisie septentrionale (présent dans 22 stations parmi les 63 prospectées par Ktari et Rezig [4]), les spécimens utilisés pour cette étude ont été récoltés en Septembre au nord de Bazina enfouis dans le sable de l'Oued Jefna (37°02′52″N ; 9°26′42″E), dans un secteur proche de la Khroumirie où Gadeau de Kerville avait effectué un remarquable inventaire des mollusques terrestres [11]. En Tunisie, on recherche H. aperta dans les champs, au pied des oliviers ou des figuiers de Barbarie où il s'enterre mais dans le nord ouest de la Tunisie on le trouve aussi dans des faciès végétaux variés et différents : à asphodèle (Asphodelus sp.), à urginée (Urginea maritima), à arum (Arisarum vulgare), à diss (Ampelodisma mauritanica) ou pin d'Alep (Pinus halepensis).
Les escargots de taille adulte ont été transportés en France à l'Université de Franche Comté où l'étude de leur reproduction et du développement de leur progéniture a été réalisée en laboratoire dans des conditions d'environnement contrôlées comparables à celles utilisées pour réaliser l'élevage d'autres espèces d'escargots terrestres [12–21].
2.2 Elevage et protocole expérimental
Le cycle biologique (reproduction, développement, croissance) a été suivi dans des boîtes en polystyrène (boîtes à souris, réf. 08.001, Charles River IFFA-CREDO, L'Arbresle, France) de 1,9 dm3 (24 × 10 × 8 cm) dont le fond est tapissé de papier absorbant humide ou d'une couche de sol. La nourriture est une farine (Helixal®, Ets Chays, Valdahon, France) à base de céréales, de vitamines et sels minéraux (Tableau 1) distribuée dans une coupelle (boîte de Pétri). La nourriture et le papier humide sont remplacés 3 fois par semaine.
Composition des aliments utilisés pour la croissance et la reproduction des escargots. Les valeurs énergétiques respectives du 1er âge et du 2e âge sont de 1259 kcal/kg et de 1503 kcal/kg.
| Teneur en (g/100g) | Vitamines (UI/kg) | Métaux (mg/kg) | ||||||||
| Aliment | Protéines | Lipides | Cellulose | Cendres | Ca | A | D3 | E | Cu | Zn |
| 1er âge | 13,4 | 4,3 | 2,5 | 34,6 | 12,1 | 15 000 | 2000 | 20 | 13 | 65 |
| 2è âge | 15,7 | 7,3 | 1,8 | 31 | 10,3 | 20 500 | 3900 | 39 | 30 | 137 |
Les expériences ont été réalisées à la température de 20 °C ± 2 car celle-ci s'est révélée favorable à l'élevage d'H. aspersa [20,22] qui cohabite avec H. aperta en Tunisie. Deux photopériodes constantes de jours longs (JL = 18hL–6hO) et de jours courts (JC = 8hL–16hO ont été appliquées pour savoir dans quelle mesure H. aperta est sensible ou non à la durée d'éclairement journalier. Des inversions de photopériode ont également été réalisées à la fin du stade juvénile (passage JL à JC et inversement à 6 semaines) correspondant à celui également utilisé pour mettre en évidence les différences de croissance en laboratoire d'Helix aspersa dans des conditions semi contrôlées [23,24].
Après l'accouplement des escargots, un pot de verre rempli de terreau horticole est disposé dans l'enceinte d'élevage afin que les escargots puissent y déposer leurs pontes. Le développement des œufs se fait soit dans le terreau où ils ont été pondus soit dans des boîtes de Pétri dont le fond a été recouvert de papier humide après pesée des pontes et comptage des œufs. L'incubation s'effectue à 20 °C et lorsque les jeunes éclosent ils viennent se grouper sous le couvercle où ils sont comptés pour déterminer le pourcentage d'éclosion.
La croissance des jeunes escargots éclos se déroule dans des boîtes à souris et elle est évaluée par des pesées régulières chaque semaine.
Le protocole expérimental de réalisation du cycle biologique complet comporte 3 phases successives. La première consiste en la reproduction de 2 lots de 3 escargots pour chaque photopériode pendant 10 semaines. La deuxième correspond à la phase initiale de croissance (nursery) des petits escargots nouvellement éclos qui sont transférés pendant 4 semaines dans des boîtes d'élevage (IFFA-CREDO) à 20 °C avec de la nourriture Helixal® 1er âge. Au fur et à mesure de leur développement le nombre de petits par boîte est diminué pour éviter un effet de groupe négatif : semaines 1 et 2 (1788/m2 de surface des parois de leur habitat) ; semaine 3 (1238/m2) ; semaine 4 (600/m2). Pour chacune des pontes étudiées (1A et 2A), la moitié des petits est élevée en JC (8hL–16hO) et la moitié en JL (18hL–6hO). Pour la troisième phase (prépubertaire), et pour chaque photopériode, des jeunes escargots en fin de nursery sont répartis en 4 lots homogènes de 5 escargots parmi les plus gros, afin d'étudier l'influence de la nourriture pour escargots (1er âge et 2e âge) sur la croissance et la maturation sexuelle. La densité des animaux était de 55 par m2 pendant les semaines 4 à 6 et ensuite de 38 au m2.
2.3 Expression des résultats et comparaisons statistiques
Pour chaque type de conditions d'environnement le poids moyen des escargots et l'écart type sont calculés chaque semaine. Les poids moyens des escargots des différentes séries sont comparés à chaque intervalle de temps par analyse de covariance (ANCOVA) [25], en utilisant le poids final comme réponse et le poids initial (aux changements de photopériode) comme covariable. Le nombre d'œufs et de petits éclos est exprimé respectivement sous forme de moyennes et de pourcentages. L'ensemble des analyses statistiques a été réalisé avec le logiciel R (version 2.7.0) [26].
3 Résultats
3.1 Obtention en laboratoire du cycle biologique complet d'Helix aperta pendant deux générations successives. Influence de la photopériode
3.1.1 Première génération
3.1.1.1 Phase initiale de reproduction (accouplements, pontes et éclosions).
Pendant cette période de 10 semaines on a observé une reprise de poids pendant les premières semaines qui suivent leur réveil puis des accouplements dans tous les lots mais on a uniquement obtenu des pontes en jours courts (Tableau 2).
Évolution du poids des escargots pendant l'étude de leur reproduction sous 2 photopériodes (JC = 8hL–16hO ; JL = 16hL–8hO) à 20 ± 2 °C du 9 octobre au 15 décembre (10 semaines).
| Photopériode | Lots d'escargots | Poids moyens en g (écart-type) | Nombre pontes | Nombre d'oeufs | |||
| au réveil 9 octobre | Après 3 sem. | fin exp. (10 sem.) | moyen | (extrêmes) | |||
| JC | A | 6,41 | 15,37 | 14,40 | 8 | 288 | 225–405 |
| (3 gros) | (0,62) | (1,64) | (2,36) | (64) | |||
| 8hL–16hO | B | 4,15 | 11,87 | 8,67 | 4 | 261 | |
| (3 moyens) | (0,48) | (1,37) | (1,85) | ||||
| JL | C | 6,69 | 14,03 | 12,70 | 0 | ||
| (3 gros) | (1,33) | (4,22) | (1,82) | ||||
| 18hL–6hO | D | 4,24 | 10,23 | 11,48 | 0 | ||
| (3 moyens) | (2,09) | (3,70) | (3,26) |
Les œufs des 2 premières pontes (1A et 2A) ont un poids moyen respectif de 12,6 et 14,8 mg ; ils sont sphériques et de couleur blanche. L'éclosion des petits s'effectue au bout de 12 jours avec un pourcentage de réussite de 89,8% (288 petits) pour la ponte 1A et de 79,5% (322 petits) pour la ponte 2A.
3.1.1.2 Phase de croissance initiale (nursery) : 4 semaines.
Pendant les 4 premières semaines de leur élevage la croissance des escargots élevés en jours courts est deux fois plus importante que celle de ceux placés en jours longs (Tableau 3).
Influence de la photopériode sur la croissance d'H. aperta juvéniles pendant la période de nursery des escargots des pontes du lot A.
| Lot | Photopériode | Nombre de petits | Pourcentage de mortalité | Poids (en g) | ||
| au départ | fin de nursery | Moyen | Extrêmes | |||
| 1A | 8hL–16hO | 142 | 130 | 8,5 | 0,42 | 0,10–1,6 |
| 1A | 18hL – 6hO | 142 | 121 | 14,8 | 0,20 | 0,05–0,5 |
| 2A | 8hL – 16hO | 161 | 156 | 3,1 | 0,46 | 0,10–1,9 |
| 2A | 18hL – 6hO | 161 | 156 | 3,1 | 0,25 | 0,06–0,7 |
3.1.1.3 Phase de croissance post nursery et pré-pubertaire (semaines 4 à 13).
Pour les jeunes issus de la ponte 1A les poids des escargots sont rapportés dans le Tableau 4 et il apparaît que l'exposition des jeunes à une photopériode de jours courts stimule la croissance qui ne se produit pas en jours longs.
Évolution du poids moyen en g (écart-type) et valeurs extrêmes, des escargots du lot 1A de la fin de la nursery à l'état adulte (semaines 4 à 13).
| Semaine | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | |
| Densité | 55/m2 | 38/m2 | |||||||||
| Poids moyen (g) et (écart type) – valeurs extrêmes | |||||||||||
| JC | 1er âge | 1,26 | 2,25 | 4,54 | 6,51 | 7,49 | 8,12 | 8,49 | 9,01 | 8,95 | 9,62 |
| (0,22) | (0,27) | (0,55) | (0,55) | (0,78) | (0,83) | (0,87) | (1,06) | (1,22) | (1,01) | ||
| 1–1,6 | 2–2,6 | 3,8–5,5 | 5,9–7,4 | 6,1–8,8 | 6,9–9,3 | 7–9,6 | 7–10,2 | 7–11 | 7,9–11 | ||
| JC | 2e âge | 1,13 | 2,12 | 4,09 | 6,37 | 7,39 | 7,63 | 8,15 | 8,98 | 8,82 | 9,52 |
| (0,27) | (0,42) | (0,87) | (0,67) | (0,98) | (0,84) | (0,91) | (1,12) | (1,00) | (0,93) | ||
| 0,9–1,6 | 1,6–2,5 | 3–6,1 | 5,6–7,9 | 6–9,4 | 6–8,6 | 6,8–9,5 | 7,8–11,4 | 7,4–10 | 8,3–11 | ||
| JL | 1er âge | 0,47 | 0,49 | 0,49 | 0,50 | 0,43 | 0,47 | 0,50 | 0,54 | 0,50 | 0,53 |
| (0,11) | (0,13) | (0,14) | (0,16) | (0,13) | (0,13) | (0,14) | (0,16) | (0,18) | (0,14) | ||
| 0,3–0,6 | 0,3–0,7 | 0,3–0,7 | 0,3–0,7 | 0,2–0,6 | 0,3–0,7 | 0,3–0,7 | 0,3–0,8 | 0,3–0,8 | 0,3–0,7 | ||
| JL | 2e âge | 0,53 | 0,53 | 0,54 | 0,53 | 0,50 | 0,48 | 0,53 | 0,56 | 0,54 | 0,54 |
| (0,14) | (0,13) | (0,13) | (0,12) | (0,14) | (0,10) | (0,17) | (0,16) | (0,13) | (0,14) | ||
| 0,3–0,7 | 0,4–0,8 | 0,3–0,7 | 0,4–0,8 | 0,2–0,6 | 0,3–0,7 | 0,3–0,8 | 0,4–0,9 | 0,5–0,8 | 0,4–0,9 |
Pour les lots de jeunes escargots issus de la ponte 2A (405 œufs), la croissance a été identique à celle des escargots de la ponte 1A avec les mêmes effets de la photopériode. De la 4e semaine à la 13e semaine, avec de l'aliment 2e âge, le poids moyen est passé de 1,45 ± 0,32 g à 10,16 ± 0,65 g en jours courts tandis qu'il n'y a pas eu de développement des jeunes dont la nursery s'est effectuée en jours longs de même que les semaines suivantes (poids moyen à 4 semaines : 0,61 ± 0,21 g ; poids moyen à 13 semaines : 0,57 ± 0,26 g).
Le diamètre des coquilles des escargots élevés en JC est également comparable pour les animaux des 2 pontes. A la 9e semaine, lorsque les escargots de la ponte 1A pèsent 7,63 ± 0,84 g et 8,12 ± 0,83 g, le diamètre de leur coquille est respectivement de 2,69 ± 0,12 cm et 2,69 ± 0,11 cm et pour les escargots de la ponte 2A, pour un poids moyen de 7,53 ± 0,59, le diamètre de la coquille est de 2,67 ± 0,11 cm.
3.1.1.4 Phase de maturation sexuelle et reproduction (semaines 14 à 23 avec une période de quiescence : semaines 17 à 19).
Pendant la phase de maturation sexuelle (semaines 14 à 17), le poids moyen des animaux élevés en JC qui sont devenus adultes reste stable (entre 6 et 10 g). A l'état adulte, le bord de la coquille forme un petit rebord recouvert par le bord du manteau (Fig. 1) mais il est très peu prononcé. A ce stade les escargots s'accouplent (Fig. 1) et leur appareil génital bien différencié présente un asynchronisme de développement identique à celui observé chez Helix aspersa [27] (Fig. 2).

Accouplement d'Helix aperta après 4 mois d'élevage en jours courts. Le pied très large s'étale sur le substrat de chaque côté du corps et le manteau forme un petit bourrelet sur le bord parfois légèrement retourné de la dernière spire très développée de la coquille dont le diamètre varie de 24 à 30 mm.
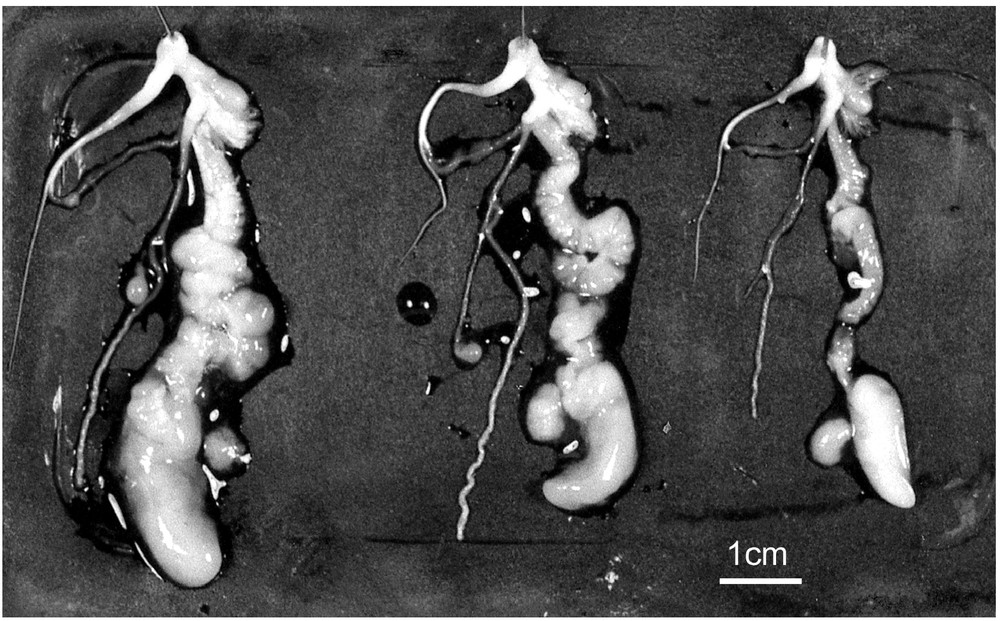
Appareil génital d'Helix aperta au moment des accouplements. On note le tractus 3,6 fois plus développé d'un individu de type femelle (2,45 g à gauche, avec une très grosse glande à albumine : 0,98 g) que celui d'un individu de type mâle (0,67 g à droite).
Après deux semaines de quiescence au sec (semaines 17 à 19) les escargots de la ponte 1A remis en activité à 20 °C et JC pendant 4 semaines (19 à 23), en présence d'un pondoir rempli de terre, ont déposé 9 pontes pour un total de 818 oeufs dont le développement a été suivi (2e génération) en laboratoire après leur éclosion.
3.2 Croissance et reproduction de la deuxième génération (F2)
Les jeunes éclos de la première ponte du lot A (25 novembre) élevés en JC sont devenus adultes en 4 mois et ont à leur tour déposé leur première ponte (113 œufs de 2,8 à 3 mm de diamètre, Fig. 3A) le 11 avril de l'année suivante (4 mois et demi) d'où sont sortis 64 petits (56% d'éclosions) de poids moyen 15 mg (Fig. 3B). Ces petits ont été répartis en deux lots de 32 dont la nursery a été effectuée respectivement en JC et JL pendant 4 semaines. En JC (8hL–16hO) il restait 27 petits (mortalité 15,6%) dont le poids moyen était de 0,34 g tandis qu'en JL (18hL–6hO) il restait 20 petits (mortalité 37,5%) dont le poids moyen était de 0,23 g.

Aspect de 2 œufs au moment de la ponte (A) et 12 jours plus tard : éclosion de petits escargots naticoïdes (B) dont la coquille est encore translucide. Barre = 1 mm (A), = 2 mm (B).
A l'issue de la nursery, les 20 plus gros juvéniles ont été répartis en 4 lots de 5 (2 élevés en JC et 2 élevés en JL). Leur croissance, suivie du 28 mai au 14 août (semaines 4 à 15) et relatée dans le Tableau 5 confirme l'effet stimulateur de la photopériode de jours courts.
Croissance (masse moyenne, (écart-type) et valeurs extrêmes) des escargots de la F2 d'H.aperta sous deux photopériodes.
| Semaines | 4 | 5 | 8 | 10 | 11 | 13 | 15 |
| Poids moyen (g) et (écart type) – valeurs extrêmes | |||||||
| JC : 8hL–16hO | 0,47∗ | 1,15∗∗ | 4,0∗∗∗ | 6,29∗∗∗ | 7,70∗∗∗ | 9,37∗∗∗ | 9,40∗∗∗ |
| (0,12) | (0,27) | (0,65) | (0,97) | (1,32) | (1,76) | (1,77) | |
| 0,37–0,60 | 0,80–1,60 | 3,10–5,30 | 4,60–7,70 | 5,10–10,0 | 6,0–12,80 | 6,20–12,50 | |
| JL : 18hL–6hO | 0,35 | 0,79 | 2,12 | 3,22 | 3,99 | 4,41 | 4,46 |
| (0,11) | (0,27) | (1,11) | (1,62) | (1,89) | (2,17) | (2,20) | |
| 0,20–0,50 | 0,50–1,20 | 0,90–4,20 | 1,0–6,20 | 0,90–6,70 | 0,90–6,80 | 0,90–7,60 |
3.3 Détermination du temps de réponse à l'inversion de la photopériode (JL/JC et JC/JL) sur la croissance et la reproduction d'H. aperta
Les résultats obtenus après exposition à des photopériodes constantes (partie I) permettent de concevoir des élevages avec croissance et reproduction permanentes sous photopériode de jours courts (8hL–16hO). Pour savoir dans quelle mesure l'influence de ces expositions est réversible ou non et déterminer le temps de réponse à un changement de durée d'éclairement, on a réalisé une inversion de photopériode sur des lots de 10 escargots de la ponte du lot 1A respectivement élevés en JC et en JL pendant le stade juvénile. La Fig. 4 permet la comparaison des poids moyens des escargots élevés en photopériodes constantes avec ceux des escargots qui ont subi un changement d'exposition lumineuse.
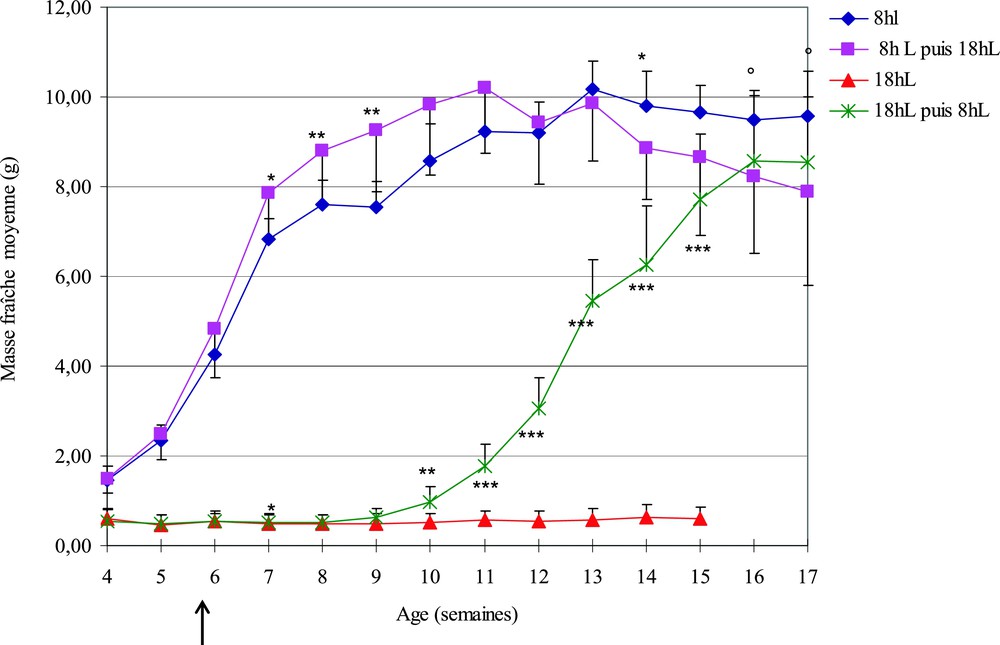
Courbes de croissance des escargots naticoïdes (F1) élevés en photopériode constante (JC ou JL) ou après inversion JC/JL ou JL/JC. La flèche (→) indique le moment du changement de photopériode. Les astérisques symbolisent une différence significative dans les masses moyennes des escargots soumis aux inversions de photopériodes par rapport aux photopériodes constantes. ∗ pour p < 0,05, ∗∗ pour p < 0,01 et ∗∗∗ pour p < 0,001. Le symbole o représente l'absence de différence significative entre les masses moyennes des escargots soumis à l'inversion de photopériode JL/JC et JC constante.
Dans le cas de l'inversion JC/JL, les escargots élevés pendant 6 semaines en JC qui avaient un poids moyen de 4,83 ± 1,08 g lorsqu'ils ont été passés en JL ont grandi pendant 4 semaines d'une façon plus importante que celle des témoins restés en JC. Ensuite le poids moyen reste sensiblement constant chez les témoins restés en JC de la semaine 14 à la semaine 17 tandis que les escargots transférés en JL perdent progressivement du poids (de 10,2 à 8 g en 6 semaines). A partir de la 18e semaine la moitié d'entre eux forment un opercule et entrent en quiescence tandis que les témoins en JC se reproduisent (4 pontes de la semaine 18 à la semaine 23).
L'inversion JL/JC se traduit par le phénomène inverse, les petits escargots élevés jusqu'à la 6e semaine en JL qui avaient un poids moyen de 0,53 ± 0,18 g ont recommencé à grandir significativement 4 semaines après le changement de photopériode (Fig. 4). Ils ont atteint un poids moyen de 8,5 g à la 17e semaine, non significativement différent de celui des animaux élevés en photopériode courte constante.
Ces expériences montrent que l'influence des photopériodes employées est réversible mais que l'effet stimulateur des JC a des caractéristiques différentes de l'effet inhibiteur des JL quant à la durée de la période de latence. En effet l'influence stimulatrice des JC est perceptible dès la 4e semaine après l'inversion de photopériode (Fig. 4) et permet aux escargots de rattraper en fin d'expérience le retard de croissance pris par rapport aux animaux élevés en JC. L'effet inhibiteur des JL est plus lent et commence seulement à se manifester 8 semaines après l'inversion de photopériode et se répercute principalement sur le comportement en induisant la formation de l'opercule et l'entrée en quiescence.
4 Discussion–conclusion
L'étude expérimentale de la croissance et de la reproduction des escargots naticoïdes (Helix aperta = Cantareus aspersus) du nord ouest de la Tunisie permet de mettre en évidence plusieurs caractéristiques originales de l'écophysiologie de cette espèce méditerranéenne, quelque peu énigmatique, particulièrement prisée gastronomiquement et importante dans plusieurs chaînes alimentaires impliquant le sol, la végétation et divers prédateurs de la faune terrestre (oiseaux, petits mammifères et l'homme).
Tout d'abord, les escargots adultes récoltés dans la nature à la fin de l'été se reproduisent (accouplement et ponte) lorsqu'ils sont transférés en élevage en JC à 20 °C et s'adaptent très bien à la nourriture en farine élaborée pour les espèces d'escargots terrestres européennes. Les escargots naticoïdes (H. aperta = Cantareus aspersus) les plus gros produisent des pontes avec un nombre impressionnant de petits œufs (jusqu'à 400 œufs de poids moyen compris entre 13 et 15 mg par ponte) alors que les escargots petits gris (H. aspersa) de poids comparable déposent des pontes de 80 à 200 œufs dont le poids moyen est de l'ordre de 30 mg. Les œufs obtenus sont sphériques, de couleur blanche et mesurent de 2,8 à 3 mm de diamètre alors que Germain [2,3] décrivait des œufs « ovoïdes ( ; ) entourés d'une enveloppe membraneuse très mince, peu transparente, blanchâtre ou jaunacée ». La durée de l'incubation à température constante (20 °C) est comparable à celle des œufs d'H. aspersa et l'éclosion des jeunes a été notée au bout de 12 jours.
Le développement des jeunes éclos dans ces conditions s'effectue régulièrement jusqu'à l'état adulte sans période de quiescence lorsque ceux-ci sont élevés en photopériode de jours courts (8hL–16hO). Les deux aliments (1er et 2ème âge mis au point pour H. aspersa conviennent aussi bien l'un que l'autre pour la croissance et la reproduction d'H. aperta alors que le 2ème âge convenait mieux à la croissance prépubertaire et à la reproduction d'H. aspersa [20]. Par contre leur croissance est inhibée par une photopériode de jours longs (18h lumière/jour). La dépendance de la croissance et de la reproduction d'H. aperta d'une photopériode de jours courts est ainsi l'inverse de celle mise en évidence expérimentalement pour les escargots petits gris H. aspersa récoltés en France [12–14,20,23,28]. L'interprétation de cette différence de déterminisme est problématique. On peut cependant supposer qu'elle résulte principalement de la différence de latitude et de température entre la Tunisie et la France et qu'elle correspond à une adaptation de cette espèce à la vie fouisseuse (photophobe) avec une longue estivation endogène remarquée par Sacchi [9,10] en Italie pendant la saison la plus chaude suivie d'une période d'accouplements d'octobre à décembre comme cela a été observé par Giusti et Andreini [8] dans la région de Sienne. Cette période de reproduction automnale en jours déclinants donnerait naissance aux petits escargots nouvellement éclos observés sur les feuilles d'asphodèle et d'arum lors d'une mission franco tunisienne exploratoire en Décembre 1994 dans les environs du poste forestier de Joumine.
Cette démonstration d'une influence opposée de la photopériode chez deux espèces d'escargots du même genre (C. aspersus et C. apertus), dont l'anatomie de l'appareil génital est proche [4,8] et la phylogénie moléculaire (boostrap : 96%) très étroite [29], révèle l'importance des phénomènes d'adaptation des espèces aux conditions d'environnement de leurs biotopes respectifs. Elle offre des perspectives d'études pour vérifier et préciser les interprétations suggérées. En effet le mode d'action de la photopériode mérite des études comparatives approfondies d'une part pour savoir si l'action inhibitrice des jours longs est saisonnière et quelle est sa durée et d'autre part pour comparer le déterminisme photopériodique de la croissance et de la reproduction des populations d'H. aperta de Tunisie (35° latitude nord) avec celui des populations de Nouvelle Zélande et d'Australie (30–45° latitude sud) où cette espèce importée d'Europe du sud s'est très bien adaptée au point de présenter un danger pour les cultures.
D'autre part il serait intéressant de savoir comment réagissent à différentes photopériodes des individus d'H. aperta récoltés sur la côte méditerranéenne française (s'il en existe encore car l'espèce était en danger lorsque l'espèce a été protégée [30,31]) ou sur l'île Corse où leur reproduction (accouplements, pontes et éclosions) a été observée pendant l'automne 1995.
La méthode d'élevage mise au point a permis d'obtenir le cycle complet de cette espèce pendant 2 générations et de mettre en évidence le déterminisme photopériodique particulier de cette espèce en Tunisie septentrionale (tout au moins en fin d'été et en automne). De nouvelles expériences avec des animaux ramassés en fin d'hiver (au printemps) et en été après différentes durées d'estivation doivent être envisagées pour analyser l'action de la photopériode et de la température au cours des saisons sur les différentes activités et états physiologiques d'H. aperta par rapport aux autres espèces communes d'escargots terrestres d'Afrique du Nord.
Concernant les effets physiologiques de photopériodes constantes de JC et de JL sur la croissance il a été démontré que ceux ci sont réversibles mais nécessitent une période de latence qui est plus courte lors de l'inversion JL/JC (5 à 7 semaines) pour l'apparition de l'effet stimulateur que lors du passage JC/JL qui permet la poursuite de la croissance pendant les 7 semaines suivantes et dont l'effet inhibiteur se manifeste principalement par l'entrée en quiescence et la sécrétion d'un épiphragme calcaire. Ces observations fournissent des renseignements sur les durées respectives de mise en place des systèmes de régulations endocrines stimulateurs et inhibiteurs photo-dépendants et pourront être affinées en appliquant soit des programmes d'éclairement mimant les cycles annuels naturels de Tunisie soit des conditions d'environnement semi contrôlées avec variations de photopériode couplées avec des différences de température en tenant compte des périodes d'activité des animaux comme cela a été fait pour d'autres escargots terrestres [15,16,18–21,23,24].
Les résultats obtenus constituent une base de données pour des applications novatrices à l'élevage d'une espèce renommée ainsi que pour des études complémentaires concernant l'évolution et l'adaptation de cette espèce dans le Bassin Méditerranéen avec des populations insulaires plus ou moins indépendantes. Dés à présent les observations réalisées permettent de rapprocher le comportement reproducteur d'H. aperta de celui d'espèces d'escargots terrestres qui se reproduisent en photophase décroissante comme Theba pisana en Italie [8] et Theba pisana et Cernuella virgata en Australie [19]. Ainsi chez les gastéropodes pulmonés il se dégage une grande diversité de réponses à la durée d'éclairement journalier suivant les espèces et les conditions d'environnement. Parmi les espèces d'escargots une inhibition de la croissance et de la reproduction par les JC a été mise en évidence selon l'amplitude décroissante suivante : Helix pomatia > Helix aspersa aspersa > Helix aspersa maxima [18,32] tandis que chez Cepaea nemoralis la croissance et la reproduction sont peu affectées par les JC par rapport aux JL [33]. Parfois la croissance et la reproduction réagissent différemment, ce qui est le cas chez la limace Limax maximus dont la croissance s'effectue normalement en JC tandis que la reproduction est complètement inhibée [34].
Du point de vue des applications écologiques, on peut considérer qu'Helix aperta présente les caractéristiques d'une espèce de gastéropode pulmoné terrestre sentinelle de l'environnement particulièrement adaptée à fournir des renseignements sur les sols où elle s'enterre et les faciès végétaux correspondants. La mise au point d'une méthode d'élevage permet d'envisager son utilisation pour déterminer sa sensibilité aux contaminants des écosystèmes de ses aires de répartition géographique comme cela a été réalisé avec Helix aspersa [35–37].
Remerciements
Ces expériences ont pu être réalisées grâce à une collaboration entre l'Université de Tunis (Tunisie) et l'Université de Franche Comté (France) à la suite d'une mission exploratoire organisée par le Ministère de l'Agriculture Tunisien (Institut National de Recherche Forestière). Les auteurs remercient le Professeur Gomot pour la réalisation de cette mission et pour sa participation à ce travail. Cette publication est dédiée à la mémoire du Professeur Mohamed Rezig, initiateur de ces recherches, trop tôt emporté par la maladie. La version finale de cette note a bénéficié des suggestions pertinentes et appréciées de deux référés de la revue.


