1 Les réactions suraiguës post-traitement : une définition encore subjective
1.1 Une limitation pour les traitements
On compte chaque année en France environ 320 000 nouveaux cas de cancers. Une grande majorité d’entre eux sont traités par radiothérapie. Toutefois, certains patients, dont la proportion est généralement estimée entre 1 et 10 %, peuvent présenter des réactions tissulaires suraiguës dont la gravité et la date d’apparition dépendent de la nature du traitement, de la localisation tumorale et vraisemblablement du statut génétique. Les réactions tissulaires les plus fréquentes ne concernent pas systématiquement la peau avec les érythèmes et les dermites bien décrits et souvent subis par les pionniers des radiations. En effet, les praticiens peuvent faire face à des rectites pour les cancers de la prostate, des fibroses pour les cancers de l’œsophage, etc. Toutes ces réactions limitent le bon déroulement du traitement et peuvent même l’arrêter dans certains cas extrêmes [2,3].
1.2 Réactions précoces et tardives ou un continuum de réactions étalées dans le temps ?
Depuis des décennies, les réactions suraiguës post-irradiation ont été le plus souvent divisées en réactions précoces et réactions tardives [2,3]. En fait, les inflammations, infections, ulcères, fibroses, nécroses, arrêts fonctionnels, etc., sont rencontrés dans des périodes de temps très variables pendant ou après la fin du traitement. Des corrélations entre les réactions précoces et les réactions tardives ont été signalées pour certains tissus [4]. Dörr et Hendry ont introduit en 2001 la notion de réactions tardives dites « aggravées » (consequential late effects ou CLE) qui concernent essentiellement un organe, généralement associé aux réactions radio-induites précoces, qui peut subir un stress mécanique ou chimique causant un traumatisme supplémentaire pour les tissus sous-jacents. C’est le cas notamment du système urinaire et intestinal et, dans une certaine mesure, de la peau [3]. On peut parler ici de réponse clinique des systèmes biologiques intégrés. Toutefois, avec le développement de thérapies innovantes basées sur un dépôt d’énergie de plus en plus massif dans la tumeur, l’incidence de certaines réactions considérées comme tardives avec les modalités courantes sont devenues de plus en plus précoces : un véritable continuum dans la survenue et la gravité des réactions suraiguës post-irradiation est apparu progressivement, remettant en cause la distinction entre ces deux types de réactions [3].
1.3 Une multitude d’échelles de gravité
Au vu de la complexité des phénomènes, il paraît clair qu’à ce jour, les actions concernant les réactions suraiguës dues au traitement anti-cancéreux se font toujours sur la seule base de l’expérience du clinicien et non sur des critères quantifiables de biologie moléculaire, cellulaire ou tissulaire, faute de paramètres fiables et identifiés. Le terme-même de réactions « suraiguës », adopté arbitrairement tout au long de cette revue fait encore débat. En dépit d’un certain nombre de tentatives, la définition et la classification des réactions suraiguës post-irradiation n’est pas consensuelle. En effet, ces réactions suraiguës sont justement définies sur des observations macroscopiques difficilement quantifiables et des bases temporelles qui sont peut-être aujourd’hui à moduler pour les raisons évoquées plus haut. Citons toutefois les échelles WHO (1979), CTC (1983), RTOG/EORTC (1984), LENT (1995), CTC (1998), CTCAE (2003) qui sont représentatives des efforts de la communauté pour une classification universelle [2]. L’insuffisance de prédiction et de définition biologique et clinique des réactions suraiguës post-traitement explique pourquoi leur nombre exact reste encore méconnu dans les centres anti-cancer et les centres hospitaliers.
1.4 Réactions tissulaires post-irradiation et erreurs de dosimétrie
À la suite des accidents de surirradiation d’Epinal et de Toulouse, une échelle a été mise en place pour informer le public sur les événements de radioprotection affectant des patients dans le cadre d’une procédure de radiothérapie. Résultat des efforts de l’Autorité de sûreté nucléaire (ASN), de la Société française de radiothérapie oncologique (SFRO) et de l’Institut de radioprotection et de sûreté nucléaire (IRSN), cette échelle prend en compte des effets inattendus ou imprévisibles dus à des doses ou à des volumes irradiés inappropriés mais ne concerne pas les éventuels effets secondaires, quel que soit leur grade, résultant de la stratégie de traitement retenue par le praticien en concertation avec le patient (voir les sites http://www.asn.fr, http://www.sfro.org et http://www.irsn.fr). Les réactions suraiguës post-irradiation ont été d’ailleurs intuitivement et souvent associées à des erreurs de dosimétrie [5]. Évoquons au moins deux explications possibles :
- • la formation : par obligation réglementaire, les praticiens sont tenus de suivre des formations en radioprotection qui n’incluent pas forcément les développements les plus récents de radiobiologie. Les radiothérapeutes travaillent chaque jour en collaboration étroite avec les radiophysiciens alors que les radiobiologistes, peu nombreux, ne sont généralement pas intégrés à l’hôpital ni ne participent aux réunions régulières de travail et de concertation. Ainsi, il est donc naturel que les cliniciens se tournent préférentiellement vers leurs collègues radiophysiciens quand un patient montre des réactions suraiguës, d’autant plus que les mêmes manifestations cliniques seraient attendues si la dose de radiation était effectivement plus élevée ;
- • les connaissances : le lien causal entre les réactions suraiguës tissulaires et les altérations moléculaires n’est pas encore clairement établi. Ce constat pose le problème de la définition de la dose biologique, bien distincte de celle de la dose physique, tant en termes spatiaux que temporels. Comme on le verra plus loin, la complexité des mécanismes moléculaires et cellulaires de la réponse aux radiations explique qu’aucun test prédictif de la radiosensibilité n’ait été encore accrédité et pourquoi de très nombreuses directions ont été suivies par les radiobiologistes, jetant alors le trouble dans la démarche à suivre pour les praticiens.
Alors que la démarche du praticien vers le radiobiologiste reste encore rare, la littérature scientifique suggère pourtant que la susceptibilité individuelle joue un rôle important dans la réponse finale au traitement anti-cancer. En particulier, lors des accidents de surirradiation d’Epinal et de Toulouse, les mêmes erreurs dosimétriques ont été commises sur tous les patients alors qu’un large gradient de sévérité dans les réactions tissulaires a été observé [5]. Cette dernière remarque suggère l’impact possible de la susceptibilité individuelle dans la réponse au traitement anti-cancer. La prise en compte du statut génétique des tissus sains du patient apparaît donc de plus en plus indispensable tant dans le choix du traitement que dans la prévention des réactions suraiguës [6,7].
2 La radiosensibilité intrinsèque : une évidence centenaire
2.1 La susceptibilité individuelle aux radiations : l’évidence d’un continuum
À ce stade de la revue, citons une communication écrite par M. Bouchacourt en 1911. Ce Chef du service de radiologie de l’hôpital Dubois décrit l’arrivée dans son service d’un jeune couple de personnes de 27 et 23 ans qui souhaitaient se faire épiler par irradiation [8]. Au départ réticent à ce genre de traitement, Bouchacourt s’y plie finalement et décrit en détails les différentes évolutions des érythèmes et dermites sur les différentes parties du corps du patient et de la patiente dans un article au titre évocateur : « Sur la différence de sensibilité aux rayons de Röentgen des différents sujets, et sur le même sujet, des différentes régions du corps ». Il déduit de ses observations l’évidence d’une spécificité de la réponse entre individus mais également entre organes, premiers jalons de la notion de radiosensibilité intrinsèque [8]. Dans ce texte aux apparences anecdotiques, le lecteur appréciera la prescience du radiologue qui décrit des phénomènes de voisinage (effets abscopiques ou bystander) quand les réactions cutanées sont observées sur des territoires non irradiés. Quelques années plus tard, à partir de données in vitro cette fois, Claudius Regaud insistera sur le continuum des effets des radiations [9]. Ainsi, alors que les variations individuelles d’incidence des réactions suraiguës représentaient une évidence pour la majorité des praticiens au début du xxe siècle et suggéraient logiquement l’établissement d’une individualisation des soins, les contraintes pratiques et économiques firent disparaître la notion de susceptibilité individuelle à travers la mise au point de traitements anti-cancer standard. En parallèle, de nombreux travaux sur des modèles sophistiqués de levures ou de rongeurs ont contribué à accroître nos connaissances dans le rôle de chaque protéine impliquée dans la réparation et la signalisation des dommages de l’ADN mais ont fait oublier les notions de continuum des réponses aux radiations [10]. En effet, à la fois in vitro et in vivo, des études très moléculaires ont contribué à considérer la réponse aux radiations comme un phénomène de tout ou rien avec des couples d’échantillons très radiorésistants et très radiosensibles [6]. D’ailleurs, les radiosensibilités extrêmes des modèles animaux sont généralement associées à des mutations de protéines qui n’existent pas chez l’homme [6,11]. Les premiers essais prédictifs basés sur des concepts de biologie moléculaire furent ainsi éprouvés, non sur une large gamme de radiosensibilité mais avec des couples radiosensibles-radiorésistants non représentatifs des cas cliniques : l’évidente nécessité de disposer de paramètres biologiques quantifiables et de prédire chaque niveau de gravité des réponses aux radiations disparut au profit des projets de recherche monogéniques qui représentent encore aujourd’hui la quasi-totalité des communications traitant de radiobiologie des tissus sains [6,11]. Concernant la radiobiologie des tumeurs, une approche plus cellulaire et plus proche de la clinique fut menée en se basant sur l’impact de l’oxygénation et des phénomènes d’hypoxie.
2.2 La radiosensibilité définie par convention
Comment définir la notion de radiosensibilité afin qu’elle soit quantifiable et valable tant in vivo qu’in vitro ? Cette question résume les efforts fournis pendant les 60 premières années de la radiobiologie (Fig. 1). En 1896, le médecin lyonnais Victor Despeignes soumit un de ses patients souffrant d’un cancer de l’estomac à l’un des tout premiers traitements radiothérapiques : « …je pus soumettre le malade chaque jour à 2 séances d’une ½ heure … Au bout de 8 jours d’un tel traitement, je constatais …une diminution considérable du volume de la tumeur… » [12]. En 1901, Pierre Curie voulant reproduire une première expérience réalisée par l’allemand Giesel, appliqua sur son bras une ampoule contenant du radium : « …M. Curie a reproduit sur lui-même l’expérience … en faisant agir sur son bras …pendant 10 h du chlorure de baryum radifère…, …52 jours après…, il reste encore une plaie grisâtre indiquant une mortification profonde… » [13]. Ces deux exemples historiques montrent, avec celui de Bouchacourt, que la biologie des radiations resta descriptive dans ses premières années, faute de paramètres quantifiables (Fig. 1). Deux conclusions s’imposent :
- • avec Despeignes, la réduction du volume tumoral (ou contrôle local) apparaît comme le meilleur paramètre pour décrire l’effet stérilisant des radiations ;
- • avec Curie, le processus de mort cellulaire et tissulaire s’avère complexe et étalé dans le temps. De plus, la plupart des cellules restent physiquement présentes, suggérant que la mort cellulaire n’est pas nécessairement associée à une disparition physique de la cellule. Les connaissances biologiques n’étaient pas suffisantes à l’époque pour définir un paramètre quantifiable précis.
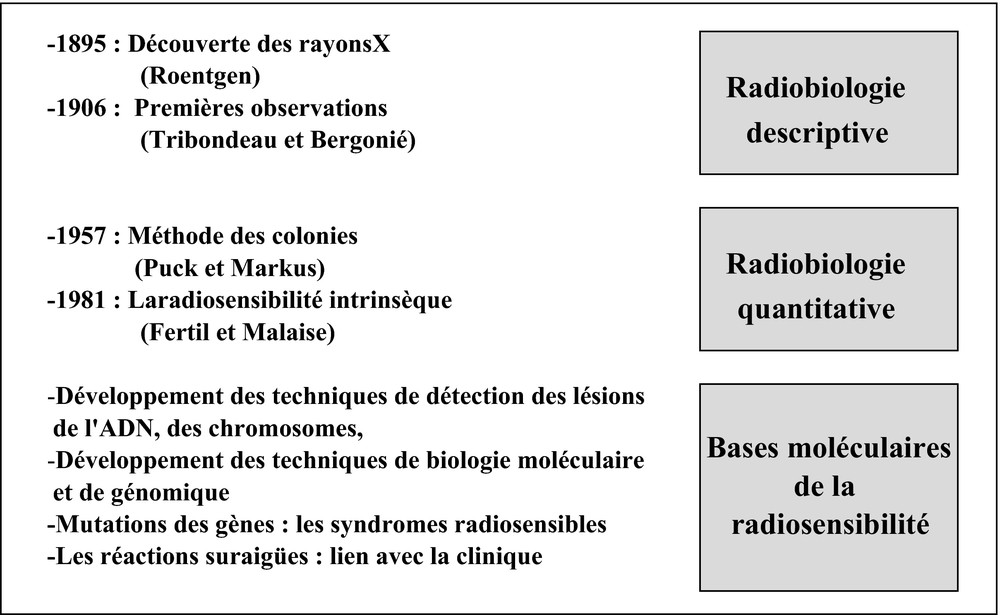
Illustration schématique des différentes démarches de la radiobiologie depuis la découverte des rayons X par Röentgen : après une période descriptive des effets des radiations au niveau tissulaire puis cellulaire, où figurent en pionniers les travaux de Pierre Curie et de Victor Despeignes, suit une période de quantification initiée par les travaux de Puck et Markus [14] sur les techniques de mesure de la survie clonogénique. Jusque dans les années 1980, une somme considérable de données sur la survie clonogénique a permis la mise en évidence de la radiosensibilité intrinsèque [1]. Cette étape coïncide avec la mise au point d’un nombre croissant de techniques de détections des dommages de l’ADN puis d’outils de biologie moléculaire et de génomique afin de déterminer les bases moléculaires de la radiosensibilité.
Ainsi, la mort radiobiologique fut définie comme la perte définitive de la capacité de division des cellules irradiées, puisque une telle définition restait commune à l’approche radiothérapique des cancers consistant à stériliser les tumeurs et aux observations expérimentales sur les morts tissulaires. Il fallut cependant attendre une soixantaine d’années afin qu’un test correspondant à une telle définition s’impose pour mesurer in vitro l’effet létal causé par les radiations. En effet, Puck et Marcus proposèrent les premiers le test des colonies mesurant la survie clonogénique. Ce test devint le standard pour mesurer la radiosensibilité in vitro [14]. Ce test consiste à ensemencer un nombre connu de cellules, à les irradier à une dose donnée et à en quantifier les clones ou colonies qui résulteraient des divisions cellulaires après irradiation [14]. Grâce à cette technique, la relation dose-effet fut décrite dans de très nombreuses conditions suivant la nature des cellules, le type de rayonnement ou les protocoles d’irradiation [1,14].
2.3 La radiosensibilité et ses pièges
La définition de la radiosensibilité évoquée plus haut ne doit pas faire oublier son champ de validité : la biologie cellulaire. Ainsi, rappelons que même morte « radiobiologiquement », une cellule peut continuer à métaboliser et notamment à réparer son ADN (notion de biologie moléculaire). Ainsi, alors qu’après des centaines de Gy la cellule ne prolifère plus, son noyau reste encore le lieu d’une réparation qui obéit aux règles de la biochimie [6]. Une autre vue biaisée de la radiosensibilité fut causée par la popularité de la loi introduite par Tribondeau et Bergonié en 1906 sur la radiosensibilité et son lien avec le pouvoir karyocinétique des cellules. En effet, ces deux pionniers montrèrent que « les rayons X agissent avec d’autant plus d’intensité sur les cellules que l’activité reproductrice de ces cellules est plus grande, que leur devenir karyocinétique est plus long, que leur morphologie et leurs fonctions sont moins définitivement fixées » [15]. Cette loi véhicula l’idée (fausse) que les tissus les plus aptes à proliférer, notamment ceux montrant une absence d’arrêt du cycle, sont systématiquement plus radiosensibles. C’était la base idéale pour justifier une radiothérapie. Toutefois, des fibroblastes quiescents montrant des réponses très différentes aux radiations suivant leur statut génétique ou des tumeurs très radiorésistantes en sont des contre-exemples.
2.4 La radiosensibilité quantifiée
Une fois la radiosensibilité définie, les radiobiologistes se mobilisèrent pour mieux décrire, quantifier et comprendre ses bases moléculaires et cellulaires de la radiosensibilité (Fig. 1). En 1981, une corrélation entre la réponse clinique (contrôle local) et la radiosensibilité (évaluée in vitro par les tests de survie clonogénique) fut établie par Fertil et Malaise, non seulement pour les cellules tumorales, mais aussi pour les tissus sains [1]. D’autre part, le continuum des réponses clonogéniques observé entre les lignées les plus radiorésistantes et les plus radiosensibles fut confirmé [1,16]. En plus de cette corrélation, Fertil et Malaise confirmèrent à partir d’une centaine de lignées cellulaires le bien-fondé de la notion de radiosensibilité intrinsèque illustrée notamment par le fait que les courbes de survie clonogénique se croisent très rarement (Fig. 2). La valeur de la fraction survivante à 2 Gy apparut rapidement comme le paramètre de survie le plus pratique car le fractionnement de la dose en sessions de 2 Gy était déjà et reste encore le traitement radiothérapique le plus courant [17]. La surface sous la courbe de survie (), représentant la dose correspondant à 37 % de survie fut également utilisée en tant que paramètre de survie [17] (Fig. 2). En parallèle, de nombreuses études biostatistiques furent consacrées à la description mathématique de la relation dose-effet. De nombreux modèles furent proposés alliant un bon ajustement des courbes de survie avec des théories biophysiques, biomoléculaires ou cellulaires. L’un des enjeux majeurs de ces efforts était de comprendre si, à travers l’analyse de la pente initiale de la courbe de survie, un seuil pouvait exister à des doses faibles. Malgré la popularité du modèle (n, DO) qui proposait une pente initiale nulle, le modèle linéaire-quadratique (α, β) s’imposa pour la fidélité de ces ajustements avec toutes les courbes de survie. Malheureusement, ce modèle est empirique et la signification biologique de ces paramètres restent encore à démontrer [18] (Fig. 2).
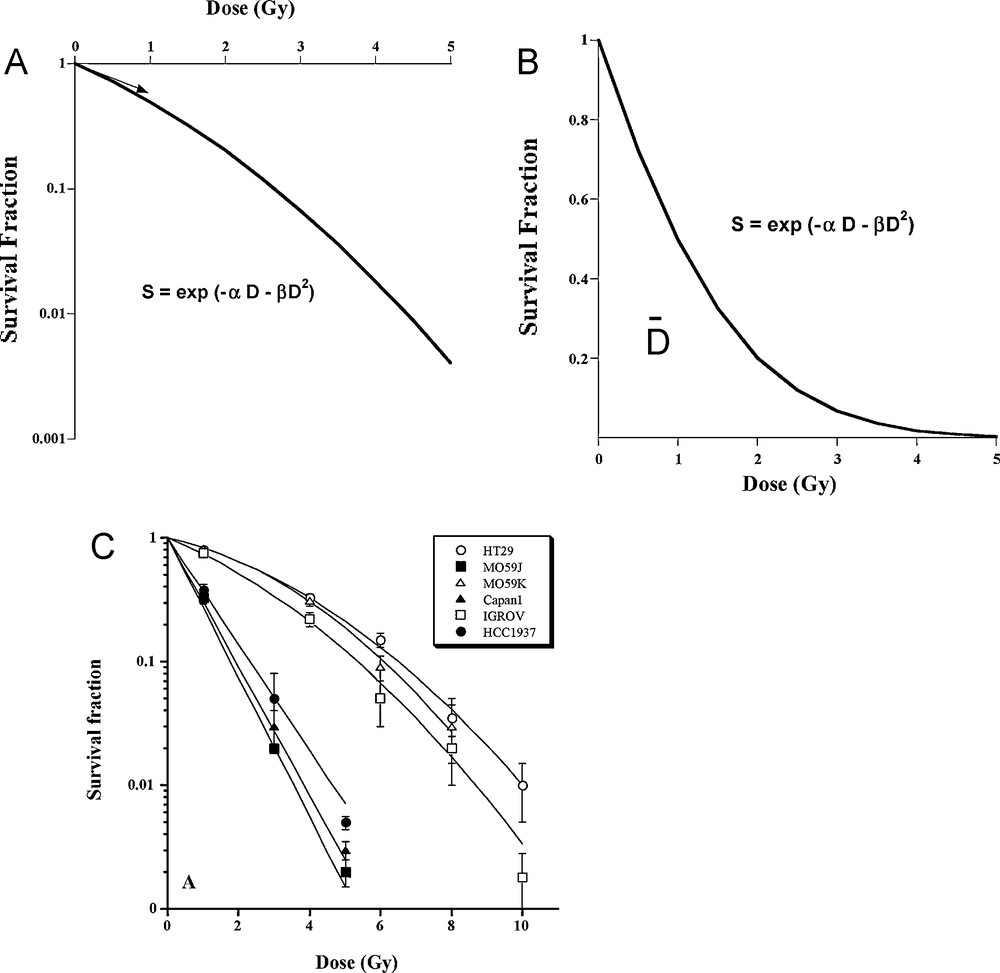
Illustration schématique de la relation dose-effet décrite par les courbes de survie clonogénique issues des tests clonogéniques [14]. A. L’ajustement des courbes de survie est mieux assuré par le modèle linéaire-quadratique que par tout autre modèle biostatistique. B. La radiosensibilité qui est reflétée par la courbe de survie peut être quantifiée par la donnée de la SF2 ou par la dose d’inactivation moyenne (ou ) qui correspond à la surface sous la courbe de survie en échelle linéaire ou à la dose correspondant à une survie de 1/e (environ 37 %). C. L’analyse de plusieurs courbes de survie montre qu’elles se croisent très rarement, suggérant graphiquement la notion de radiosensibilité intrinsèque (tiré de [69]).
Progressivement, les tests clonogéniques apparurent pour certains groupes de recherche comme des protocoles trop lourds et trop longs : l’usage des tests clonogéniques, qui nécessitaient efforts et patience liés à la culture de tissus, se réduisit rapidement au profit de recherches sur les bases moléculaires et cellulaires de la radiosensibilité dans l’espoir d’un test idéal, c’est-à-dire fiable, plus rapide et plus facile à mettre en place. Dans ce but, de nombreux événements moléculaires (lésions de l’ADN, réparation et signalisation), cellulaires, (effets du cycle et différents types de morts) et tissulaires (réoxygénation, repopulation, etc.) furent explorés. Alors que les tests clonogéniques étaient basés sur le même protocole expérimental que les lignées soient tumorales ou non, on vit apparaître deux approches pourtant complémentaires mais qui se distinguèrent au gré des besoins et des contraintes technologiques :
- • la prédiction de la radiosensibilité des tissus sains qui concentra des approches plus moléculaires dans l’identification du rôle biologique des protéines de réparation de l’ADN ;
- • la prédiction de la radiosensibilité des tumeurs qui mobilisa plutôt les efforts sur l’importance de la réoxygénation et de la prolifération cellulaire. C’est l’objet du chapitre suivant (Fig. 3).
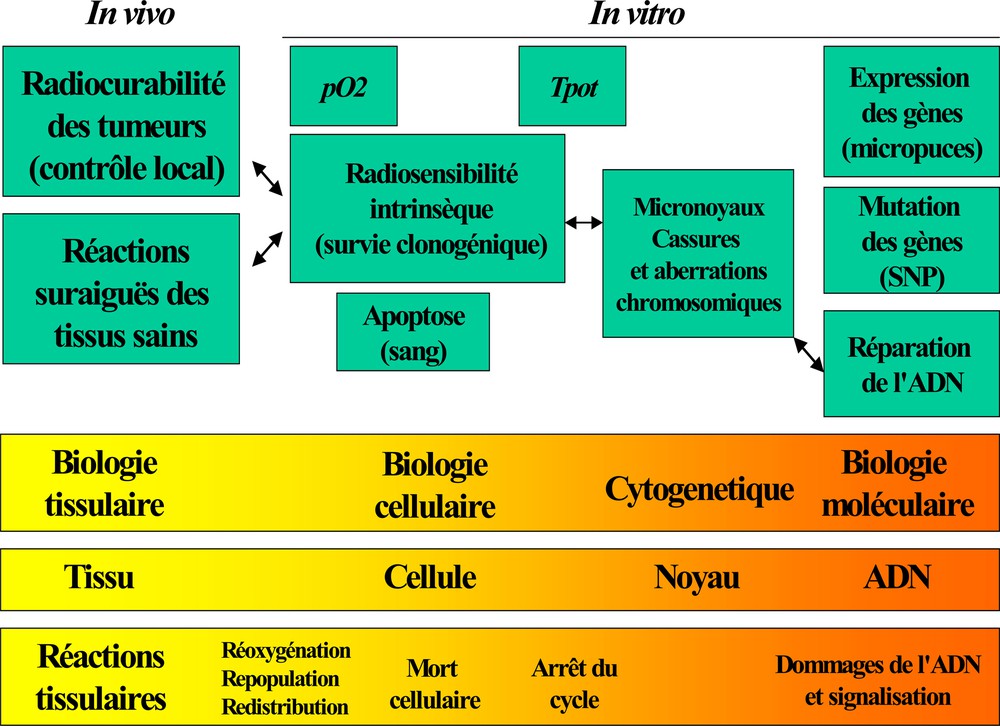
Synopsis des différentes échelles et démarches qui ont donné les tests prédictifs de la radiosensibilité. Les développements ont suivi le progrès technologique et les connaissances fondamentales en rendant possibles des investigations aux niveaux moléculaires (ADN). Toutefois, le lien entre les différents paramètres sur lesquels se base chaque test prédictif n’est pas forcément corrélatif ni linéairement lié avec la dose de radiation.
3 Les premiers essais prédictifs sur les tumeurs
3.1 Tests basés sur la mesure de la prolifération cellulaire : Tpot
Comme le contrôle local de la tumeur était considéré comme le paramètre reflétant le mieux la radiocurabilité in vivo, il était logique d’analyser son équivalent in vitro, c’est-à-dire tous les indices de prolifération cellulaire qui pouvaient expliquer l’augmentation du volume tumoral. Ce fut le cas du temps de doublement potentiel (Tpot). En règle générale, le Tpot fut mesuré à partir de biopsies tumorales à travers la définition suivante : Tpot = Ts/LI où Ts est la durée de la phase de synthèse de l’ADN et LI désigne l’index de marquage (label index ou LI) c’est-à-dire la proportion de cellules synthétisant leur ADN. Une quantité considérable de données a été accumulée sur le Tpot pendant une vingtaine d’années et on estime à environ 2000 patients dans le monde le nombre de cas soumis à ce test [19–21]. Toutefois, le Tpot ne peut être considéré aujourd’hui comme un indicateur pronostique tant il existe de limites dans les applications de ce test. En particulier, le nombre de patients où la tumeur fut bien caractérisée était trop faible. De plus, comme ces tests nécessitaient une biopsie et un établissement de lignée in vitro, l’hétérogénéité intrinsèque de la tumeur pouvait conduire à fausser les données, voire à favoriser les sous-populations cellulaires les plus proliférantes. Enfin, la corrélation qui pouvait exister entre les rythmes de croissance observés in vitro en conditions (favorables) de culture et son rythme d’évolution in vivo était loin d’être vérifiée [19].
3.2 Tests basés sur la mesure de l’hypoxie : pO2
Entre 1950 et 1970, l’impact de l’oxygène dans la réponse aux radiations, d’abord symbolisé par les travaux de Gray, a influencé un certain nombre de projets de recherche en radiobiologie. En particulier, l’hypothèse que la pression partielle d’oxygène (pO2) inférieure à 10 mm de mercure peut générer une situation favorisant la radiorésistance a été à la base de la mesure systématique de la pression en oxygène dans des biopsies de tumeurs [22]. Toutefois, la nécessité de faire appel à des technologies avancées pour mesurer un tel paramètre a limité considérablement les études. Même si certaines entreprises comme Eppendorf ont développé des techniques basées sur la polarographie, les radiobiologistes et les radiothérapeutes ont de nouveau été confrontés à l’hétérogénéité des tumeurs et à certains phénomènes antagonistes d’intermittence hypoxie-réoxygénation qui rendaient difficile l’obtention de données fiables. De plus, l’utilisation de plus en plus fréquente du fractionnement de la dose dans les modalités radiothérapiques favorise la réoxygénation, limite les zones hypoxiques et donc l’application d’un tel test [22]. Notons enfin que le taux d’oxygénation dans les cultures cellulaires in vitro de routine (5 % de CO2) reste très éloigné de l’hypoxie relative (10 à 20 % de CO2) qui règne dans nos tissus.
4 Les différentes morts cellulaires
4.1 Quelles morts pour la mort radiobiologique ?
La mort radio-induite, telle qu’elle a été définie plus haut (perte définitive de la capacité de division) constitue l’une des fonctions biologiques essentielles. Il était donc naturel de baser des tests prédictifs de la radiosensibilité sur les mécanismes moléculaires directement liés à la fonction de mort cellulaire. Cependant, la mort radio-induite est le résultat final de diverses contributions pouvant prendre des aspects très différents ; à chaque type de mort correspond un ou plusieurs tests moléculaires spécifiques. Lequel choisir ? Bien que la littérature scientifique soit très riche en termes décrivant les différentes étapes des voies de mort cellulaire, retenons-en seulement trois dont l’impact dans la perte de prolifération, la description anatomopathologique et les mécanismes moléculaires sous-jacents sont bien connus : la mort mitotique, la sénescence et l’apoptose (Fig. 3 et 4).
La mort mitotique est la voie de mort radio-induite la plus importante pour tous les tissus à l’exception des lymphocytes. Dans les années 1930, ce fait apparaissait comme acquis [9]. La mort mitotique se caractérise par la formation de micronoyaux, contenant des fragments chromosomiques irréparables directement issus de cassures de l’ADN qui se propagent tout au long du cycle cellulaire jusqu’en mitose. La formation des micronoyaux suit plusieurs étapes dont l’exonucléose qui décrit la sortie du micronoyau du noyau cellulaire principal et l’exocytose qui décrit la sortie du micronoyau de la cellule. Entre l’exonucléose et l’exocytose peuvent s’écouler plusieurs dizaines d’heures suivant l’état de prolifération des cellules (Fig. 4). Le taux de micronoyaux radio-induits a été quantitativement corrélé à la radiosensibilité depuis les années 1960 grâce à un protocole simple et robuste consistant à bloquer le processus d’exonucléose par des drogues comme la cytochalasine B [23]. Cependant, les tests de micronoyaux ont paru pour certains groupes de recherche comme des protocoles expérimentaux aussi longs et lourds que la méthode des colonies : le test des micronoyaux reste encore peu appliqué systématiquement alors que la littérature suggère dans son ensemble qu’il constituait le premier test cytogénétique prédictif de la radiosensibilité [23].

Les trois principales morts radio-induites définies fonctionnellement. L’importance relative de la mort mitotique, de la sénescence et de l’apoptose représentée ici est celle que l’on rencontre habituellement pour les fibroblastes humains non-transformés. Les différentes proportions peuvent changer drastiquement suivant la nature du tissu, de l’irradiation et du statut génétique. Les photos désignent respectivement des exemples de noyaux et micronoyaux et de corps apoptotiques colorés au 4’,6’ diamidino-2-phényl-indole (DAPI) et observés en immunofluorescence.
Bien que l’impact de la mort mitotique sur l’effet létal des radiations ionisantes soit majeur pour des cellules qui peuvent se multiplier, la sénescence (c’est-à-dire l’arrêt irréversible des cellules en phase G1) est très souvent rencontrée dans les tissus irradiés en phase de quiescence. D’ailleurs, la part relative de la mort mitotique et de la sénescence dans la mort clonogénique dépend du niveau de dose de radiation qui interdira ou non toute prolifération après l’irradiation (Fig. 4). Par exemple, pour les fibroblastes de peau, la mort mitotique est prépondérante en-deçà de 4 Gy alors que la sénescence s’observe pour des doses supérieures. Bien que l’expression de p21 est généralement liée à la sénescence, le test idéal permettant de mesurer le taux de sénescence reste à développer. D’ailleurs, il n’y a toujours pas de corrélation quantitative publiée entre la sénescence et la radiosensibilité [24]. Il est à noter ici que les tests d’exclusion de colorants (exclusion dye assays) comme le dimethylthiazole diphenytetrazolium bromide (MTT), rapides et très commercialisés, sont souvent substitués aux tests clonogéniques alors qu’ils ne tiennent pas compte des cellules arrêtées irréversiblement dans le cycle. En effet, le colorant d’exclusion peut rentrer dans la cellule sénescente et être métabolisé alors que celle-ci est condamnée : la mort cellulaire radio-induite globale mesurée par ces tests est donc sous-estimée.
L’apoptose est une voie de mort cellulaire très spectaculaire et facilement détectable par microscopie (Fig. 4). Ce terme est devenu si populaire que certains auteurs considèrent l’apoptose comme un synonyme de mort radio-induite et de radiosensibilité. Toutefois, il faut rappeler qu’il n’existe toujours pas de corrélation quantitative entre la radiosensibilité (survie clonogénique) et l’apoptose, pour les tissus sains comme pour les tumeurs [6,25,26]. En guise d’exemple représentatif, rappelons que les fibroblastes de peau de patients atteints de l’ataxie télangiectasique, le syndrome associé à la plus forte radiosensibilité connue chez l’homme, ne montrent pas d’apoptose [6]. En outre, les corps apoptotiques, issus du hâchage de l’ADN par des nucléases sont encore trop souvent confondus avec les micronoyaux de la mort mitotique (Fig. 4). Cette erreur d’interprétation est amplifiée par le développement de tests cytométriques basés sur la détection de fragments d’ADN. En effet, comme les micronoyaux sont des fragments d’ADN non réparés, de nombreux faux-positifs peuvent signaler la présence de corps apoptotiques alors que ce sont en fait de simples micronoyaux [6].
À partir de 63 volontaires sains, Schmitz et al. ont constaté que, pour un même donneur, les taux d’apoptose radio-induite dans des lymphocytes T positifs pour les marqueurs CD4 et CD8 ne sont corrélés ni entre eux, ni avec ceux mesurés dans les lymphocytes B. En outre, le même groupe de recherche a montré que l’apoptose spontanée et radio-induite augmente significativement avec l’âge pour les lymphocytes T positifs pour CD8 mais non pour ceux positifs pour CD4 ni pour les lymphocytes B [27,28]. Enfin, l’apoptose radio-induite est plus prononcée chez les hommes pour les lymphocytes B et T positifs pour CD8 et chez les femmes pour les lymphocytes T positifs pour CD4 [27,28]. De tels résultats sont en désaccord avec les travaux de Ozsahin et al. qui concluent à une corrélation entre l’apoptose radio-induite des lymphocytes positifs pour CD4 et CD8 d’un même donneur, indépendamment de l’âge et du sexe [29,30]. Dans ce contexte particulier, un certain nombre d’auteurs ont tenté d’établir un lien entre l’apoptose et les réactions suraiguës post-traitement [31]. C’est notamment le cas des études sur l’apoptose radio-induite après 8 Gy mesurée sur des lymphocytes T positifs pour CD4 et CD8 issus de 399 patients irradiés. Aucune association n’a été trouvée entre l’apoptose spontanée et l’apoptose radio-induite. Les réactions tardives de grade 2 et de grade 3 ont été prédites par l’apoptose radio-induite avec les lymphocytes T positifs pour CD8 mieux qu’avec les lymphocytes T positifs pour CD4. Aucune prédiction des réactions précoces n’a pu être effectuée [29,30]. Conscients de la fiabilité des tests clonogéniques, des tests des micronoyaux et des avantages des autres tissus tels que les fibroblastes, Ozsahin et al. ont admis dans leur étude que c’est plutôt la rapidité d’obtention des résultats qui constitue le premier avantage de leur test d’apoptose radio-induite [29]. Du point de vue statistique, la prédiction de ces tests ne concerne pas toute la gamme de radiosensibilité mais une petite fenêtre de réactions tardives [29,30]. D’autre part, la sévérité des réactions de grade 2 ou 3 n’est pas corrélée quantitativement à l’apoptose radio-induite : en d’autres termes, ce ne sont pas les patients qui font les réactions les plus sévères qui montrent les taux d’apoptose les plus élevés [29]. Ces résultats suggèrent donc que l’apoptose pourrait prédire une certaine gamme de radiosensibilité uniquement associée à des réactions tardives et seulement limitée à certains niveaux de gravité : l’apoptose radio-induite des lymphocytes ne peut donc servir de test prédictif universel. À l’évidence, de nouvelles investigations sont nécessaires pour mieux évaluer la contribution de l’âge, du traitement et de localisation tumorale pour affiner la zone de confiance statistique de la mesure de l’apoptose radio-induite dans la prédiction des réactions suraiguës post-traitement.
5 Les paramètres moléculaires : expression de gènes, mutations ou fonctions ?
5.1 Quel paramètre moléculaire prédictif faut-il choisir ?
Comme évoqué plus haut, parallèlement à l’approche cellulaire sur la radiosensibilité des tumeurs, une approche plus moléculaire se concentra sur la réponse des tissus sains. Toutefois, vu la difficulté de rassembler un grand nombre de lignées cellulaires provenant de patients souffrant de réactions diverses après radiothérapie, les radiobiologistes se focalisèrent sur la réponse aux radiations des lymphocytes et des fibroblastes de peau provenant de maladies génétiques associées à une radiosensibilité. Ce fut notamment le cas de l’ataxie télangiectasique (mutations d’ATM), le syndrome de Nimègue (mutations de NBS1), du syndrome ATLD (ataxia telangiectasia-like disorder) (mutations de MRE11), de l’anémie de Fanconi (mutations des gènes FANC), du syndrome de Bloom (mutations de BLM), de xeroderma pigmentosum (mutations des gènes XP), du syndrome de Cockayne (mutations des gènes CS), des mutations de la ligase I (agammaglobulinémie) et de la ligase IV (LIG4) [11]. Notons cependant que la fréquence de ces syndromes est de l’ordre de 1/100 000. De telles fréquences ne peuvent donc pas expliquer la totalité des réactions suraiguës d’autant plus que les symptômes qui leur sont associés sont généralement détectables dès les premières années de la vie et non représentatifs des cas observés dans les services de radiothérapie. Ainsi, il faut considérer ces recherches simplement comme les premières investigations des réponses les plus anormales aux radiations : comme on l’a dit plus haut, les approches monogéniques favorisèrent surtout l’étude des gènes dont les mutations causaient les plus fortes radiosensibilités. Parallèlement, des questions d’importance se posèrent sur l’approche à adopter pour mieux prédire la radiosensibilité. Doit-on mesurer l’expression radio-induite des gènes ? Doit-on examiner la nature des mutations des gènes ? Doit-on quantifier une dysfonction moléculaire et cellulaire ? La récente révolution de la génomique a fourni un nombre considérable de données pour répondre à cette question importante. Toutefois, l’évidence de la spécificité des réponses pour chaque organe et individu et le continuum des réponses aux radiations imposent d’étudier :
- • une gamme de réponses aux radiations aussi large que possible afin de définir des paramètres moléculaires ou cellulaires fiables permettant de prédire une situation quelconque pour une dose donnée ;
- • des modèles humains ou humains-compatibles afin d’éviter les biais qui, en raison des différences entre espèces et de la gamme de dose étudiée, peuvent modifier les interprétations des phénomènes observés ;
- • des conditions d’irradiation (dose, fractionnement, etc.) et des modèles de tumeurs ou de tissus sains qui soient cohérents avec la réalité clinique sans faire l’impasse sur des relations dose-effet qui ne sont généralement pas linéaires.
Pour la suite du paragraphe, gardons à l’esprit ces trois conditions pour obtenir une corrélation quantifiée entre la radiosensibilité cellulaire (survie clonogénique) et le paramètre moléculaire à choisir.
5.2 Expression de gène et radiosensibilité
Si l’expression radio-induite d’un gène pouvait prédire tous les niveaux de réponses cellulaires et tissulaires aux radiations, cela impliquerait que l’expression de ce gène varie avec la dose de radiation en corrélation avec la survie clonogénique. Toutefois, les protéines impliquées dans les événements radio-induits précoces (formation des dommages de l’ADN, reconnaissance, signalisation et réparation) sont très abondantes et aucune variation de leur expression en fonction de la dose n’a encore été mise en évidence. En revanche, certains acteurs protéiques impliqués dans les événements radio-induits plus tardifs (plusieurs dizaines de minutes à plusieurs heures après irradiation) montrent souvent (mais pas systématiquement) une sur- ou une sous-expression radio-induite. C’est le cas notamment des protéines impliquées dans le contrôle du cycle cellulaire et certaines voies de mort cellulaire comme la protéine p21 (désormais appelée CDKN1A) [7]. Une étude récente utilisant la technique de la Q-PCR quantitative (quantitative polymerase chain reaction) et concernant des cultures de lymphocytes T établis à partir de 22 patientes atteintes d’un cancer du sein a montré que le niveau d’expression de CDKN1A prédit correctement la survie clonogénique après 2 Gy [32]. À l’inverse, en utilisant la technologie des micropuces, Svensson et al. ont constaté que sur les lymphocytes de 38 patients souffrant de carcinome de la prostate (dont 21 avec des complications graves et 17 sans symptôme apparent), aucune sur- ou sous-expression radio-induite sur les milliers de gènes testés ne pouvait prédire les réactions suraiguës post-irradiation [33]. Comme on le voit, la variété des techniques utilisées ne facilitent pas l’interprétation sur le pouvoir potentiellement prédictif de l’expression des gènes. Il faut donc considérer pour l’instant ces tests comme des outils ponctuels, utiles pour la détermination d’une réponse éventuellement anormale aux radiations dans des conditions très spécifiques mais sans donner forcément une mesure quantitative de l’ampleur de la réaction. Notons enfin que, comme la plupart de ces tests d’expression de gènes sont effectués sur des lymphocytes, des investigations sont nécessaires pour vérifier la validité de ces tests sur d’autres tissus plus directement concernés par les réactions suraiguës post-irradiation.
Notons également quelques pièges concernant l’expression des gènes. Par exemple, certaines mutations de la célèbre protéine p53, causent souvent une surexpression du gène qui évolue avec la dose et qui est généralement associée à une forte radiorésistance [34]. D’autre part, les nouvelles technologies basées sur les ARN interférents (short interference RNA ou siRNA) permettent aujourd’hui de diminuer l’expression de gènes afin de mieux comprendre leur rôle biologique. Cependant, rappelons que la diminution drastique voire l’extinction in vitro totale de certains gènes n’existe pas à l’état naturel. Ainsi, une expression de gène réduite par génie génétique mais qui n’est jamais éteinte en réalité peut conduire le chercheur à conclure sur des effets qui n’ont pas de sens physiologique. C’est notamment le cas pour de nombreux gènes dont les mutations homozygotes ne sont pas viables chez l’homme. Un exemple particulier est le gène BRCA1, dont les mutations hétérozygotes sont impliquées dans les cancers familiaux du sein alors que les mutations homozygotes conduisent à la létalité cellulaire : le gène est toujours exprimé chez l’homme alors que les siRNA de BRCA1 sont largement utilisés dans la littérature pour simuler les conséquences biologiques de ses mutations [34–36]. On pourra d’ailleurs citer dans le même cas la neurofibromatose [37].
5.3 Mutation de gène et radiosensibilité
Vu la diversité des réponses aux radiations, un seul gène endommagé ne permet pas d’expliquer tous les gradients de réactions tissulaires radio-induites. Au contraire, de nombreuses revues ont mis en évidence l’implication d’un très grand nombre d’acteurs protéiques dans la réponse aux radiations, agissant à différents étapes des processus moléculaires et cellulaires [10,38–40]. Il est souvent vérifié que pour un même gène, les mutations peuvent conduire à des phénotypes très différents : par exemple, des mutations ponctuelles de la protéine ATM confèrent une radiosensibilité modérée et une espérance de vie plus longue si elles ne concernent pas le domaine kinase de la protéine [6,41,42]. La séquence intégrale du génome suffit-elle pour autant à prédire toute la radiosensibilité humaine ? Là encore, la nature multigénique de la réponse aux radiations et l’influence probable de facteurs épigénétiques rendent insuffisante la seule connaissance du génome d’une cellule pour prédire son comportement sous irradiation. Un exemple concret a été fourni par un article récent sur la radiosensibilité de fibroblastes de peau provenant d’un patient atteint de xeroderma pigmentosum C, syndrome associé à une radiosensibilité modérée : la complémentation par l’ajout du gène sauvage XPC n’a réduit que partiellement la radiosensibilité des cellules, suggérant ainsi que le syndrome n’était pas causé uniquement par les effets dus à la mutation du seul gène XPC [43]. Une approche consistant à prédire la radiosensibilité à partir de la recherche de mutations doit donc inclure une connaissance complète de la relation génotype-phénotype. Ce n’est pas encore le cas pour la plupart des gènes concernés par une forte radiosensibilité.
La génomique et la protéomique ont facilité et popularisé la recherche de certains polymorphismes de gènes impliqués dans la réponse aux radiations : c’est le cas des polymorphismes concernant un simple nucléotide (single nucleotide polymorphism, ou SNP) [31]. Les polymorphismes désignent des variations de paires de bases du génome qui n’entraînent pas des changements conformationnels mesurables. En particulier, les SNP représentent 90 % des cas de polymorphismes et se retrouvent dans notre génome toutes les 300 paires de bases : un individu est donc porteur de plusieurs centaines de milliers de SNP où généralement une cytosine se substitue à une thymine. Les progrès de la génomique ont permis l’identification d’un nombre considérable de SNP. Toutefois, le lien entre polymorphismes et syndromes n’est cependant pas évident puisque la substitution d’une base par une autre ne suffit généralement pas (par définition) à modifier significativement le tableau clinique. Certains SNP des gènes ATM, XRCC1, XRCC3, SOD2, RAD21, TGF-β1 et PARP-1 ont été mis en évidence et ont été associés à une réponse anormale aux radiations [7,31,44–46]. Cependant, là encore, parce que les porteurs d’un même SNP peuvent montrer des réactions suraiguës de grades différents, un seul SNP ne peut expliquer tous les gradients de réponses aux radiations et donc ne peut être corrélé à la radiosensibilité. Notons enfin que, face à la non-significativité des corrélations entre un seul SNP et les manifestations d’une radiosensibilité, certains auteurs regroupent plusieurs SNP ensemble d’une part et plusieurs gradients de sévérité de réactions d’autre part : la nature de la corrélation (souvent significative) s’en trouve évidemment biaisée [47]. La détermination de SNP pourrait cependant être utile pour la prédiction de prédispositions à certains cancers et à des réponses bien particulières sur des localisations tumorales spécifiques [44–46]. C’est justement le cas des SNP de la PARP-1 qui pourraient être associés à certains cancers de la prostate, de l’œsophage et du poumon [7,31].
On voit donc ici que la mesure de l’expression des gènes comme la détermination de mutations sont utiles pour mieux rendre compte de risques spécifiques à certaines affections et réactions mais ne peuvent constituer des paramètres qui évolueraient en corrélation quantitative avec la dose et la survie clonogénique afin de prédire toute la radiosensibilité humaine dans n’importe quelle condition d’irradiation.
5.4 Le sang en question
À ce stade de la revue, nous devons insister sur le fait que la majorité des expériences sur l’expression ou la mutation des gènes ont été effectuées sur des lymphocytes (sang frais ou cellules transformées). Pourtant, les réactions suraiguës post-irradiation concernent plus particulièrement les tissus conjonctifs, l’épithélium ou l’endothélium. Ainsi, même si le choix des lymphocytes reste principalement basé sur des considérations pratiques de rapidité, de disponibilité et d’acquisition simplifiée (pour le praticien, un prélèvement sanguin est facile à mettre en place), il suggère néanmoins plusieurs remarques importantes :
- • l’existence de corrélation entre les effets in vitro mesurés sur le sang et la prédiction de réactions cliniques survenant sur d’autres tissus bien différents reste encore à vérifier ;
- • l’apoptose, plus fréquente dans les cellules sanguines que dans les autres tissus pourrait constituer un biais technique dans la mise au point des tests prédictifs de la radiosensibilité ;
- • la taille des noyaux de lymphocytes est environ 1,5 fois plus petite que celles des noyaux cellulaires des autres tissus, suggérant l’organisation d’une chromatine plus condensée qui pourrait également constituer un biais technique dans la prédiction de la radiosensibilité ;
- • la manipulation des lymphocytes est délicate (faible espérance de vie en culture in vitro) et peut nécessiter alors une transformation par le virus d’Epstein-Barr (EBV) qui modifie la radiosensibilité (les lymphocytes transformés ou lymphoblastes sont généralement plus radiorésistants que leurs homologues non-transformés) [48,49].
En 1990, Kushiro et al. n’ont pas trouvé de corrélation entre la radiosensibilité de fibroblastes et de lymphocytes issus d’un même donneur [50]. En 1991, à partir de fibroblastes et de lymphocytes irradiés en phase G0/G1, Green et al. ont montré sur 34 donneurs que les fibroblastes discriminaient les patients en fonction de leur radiosensibilité alors que les lymphocytes ne le permettaient pas [51]. Enfin, en 1992, à partir de 30 fibroblastes et 29 lymphocytes, Geara et al. conclurent également qu’il n’y avait pas de corrélation entre la survie clonogénique des fibroblastes et celle des lymphocytes provenant d’un même donneur [52]. Ainsi, malgré l’incontestable rapidité de tests prédictifs basés sur les lymphocytes, une analyse générale de la littérature incite à la plus grande prudence quant à la portée des résultats obtenus avec ce type de cellules. De nouvelles approches systématiques viendront sans doute à bout de ces limitations.
6 La fonction de réparation
Parmi toutes les fonctions cellulaires, la mort cellulaire est par définition la plus proche de l’effet létal des radiations ionisantes. Toutefois, nous avons vu qu’il existe plusieurs types de morts cellulaires et que chacune est quantifiable par des techniques différentes, ce qui rend difficile la mesure de la mort radiobiologique globale. En amont de la mort cellulaire se trouvent les mécanismes d’arrêt du cycle et de contrôle de la prolifération. Toutefois, sur des cellules qui seraient déjà quiescentes, les arrêts du cycle influenceront peu la réponse aux radiations. Enfin, en amont des fonctions de mort et de prolifération cellulaire se trouve la notion de gestion des dommages de l’ADN ou des chromosomes et de leur signalisation. C’est l’objet de ce chapitre.
6.1 Cytogénétique : entre cassures et aberrations chromosomiques
La cytogénétique est née d’observations microscopiques anciennes et de la mise au point de techniques de colorations des chromosomes, notamment avec le colorant Giemsa [53] (Fig. 5). Ainsi, les cassures mais aussi les aberrations chromosomiques devinrent détectables donc mesurables. Concernant les cassures chromosomiques, leur induction apparut rapidement proportionnelle à la dose ainsi que celle des micronoyaux dont elles sont la cause [54]. Toutefois, un facteur limitant l’intérêt de ces tests cytogénétiques est la période de temps (quelques heures) nécessaire pour obtenir des métaphases, indispensables à la visualisation de chromosomes. En effet, au cours de cette période de temps, certains phénomènes de réparation peuvent se produire et biaiser le résultat final. C’est d’ailleurs encore plus le cas pour la dosimétrie biologique des irradiations accidentelles où cette période s’ajoute aux incertitudes sur les paramètres de l’exposition exacte aux radiations pendant l’accident. Afin d’éviter ce biais, la technique de condensation prématurée des chromosomes (PCC ou premature chromosome condensation) a été mise au point. La PCC consiste à faire apparaître plus rapidement les fragments chromosomiques en fusionnant la cellule testée avec une cellule en mitose. L’hétérodikaryon ainsi formé permet l’échange des facteurs mitotiques à la cellule en G0/G1 et produit alors une condensation prématurée de la chromatine. La PCC a permis d’établir une corrélation entre cassures chromosomiques non réparées et radiosensibilité [11,55]. C’est grâce à cette technique que Cornforth et Bedford (1987) démontrèrent avec une lignée fibroblastique humaine qu’une cassure chromosomique non réparée par cellule suffit à entraîner un événement létal [56] (Fig. 5).
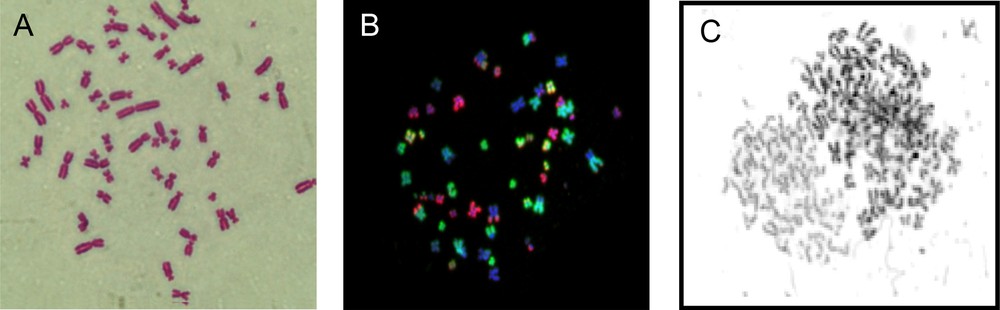
Illustration de l’évolution technologique de la cytogénétique. A. Chromosomes colorés par Giemsa où les différentes zones condensées apparaissent plus foncées. B. Chromosomes colorés par la technique du FISH où les télomères sont marqués en jaune. C. Fusion par condensation prématurée des chromosomes (PCC) où l’on voit à droite, une mitose de tumeur synchronisée et à gauche, les chromatides d’un fibroblaste humain condensées par les facteurs mitotiques (données du laboratoire).
Concernant les aberrations chromosomiques, elles sont soit stables (translocations), soit instables (chromosomes dicentriques, acentriques, anneaux) [57,58]. L’incidence des dicentriques et des fragments acentriques est généralement proportionnelle à la dose. Par contre, l’incidence des translocations suit souvent une loi linéaire-quadratique. Cette dernière observation a pu être considérée comme une argument de correlation avec les courbes de survie clonogénique qui obéissent au modèle linéaire-quadratique (α, β). Toutefois, les paramètres d’ajustement ne sont pas comparables quantitativement et des lignées radiosensibles qui montrent pourtant des aberrations chromosomiques comme les lignées mutées pour le gène ATM ont des courbes de survie mono-exponentielles [42].
En 1986, une avancée technologique s’est produite avec le développement de sondes spécifiques de chromosomes entiers ou de structures chromosomiques (centromères, télomères) [59]. Cette technique couramment appelée FISH (fluorescence in situ hybridization) a permis de dénombrer avec précision la plupart des types d’aberrations [60]. La méthode du FISH associée ou non à la PCC a permis d’établir une corrélation entre les cassures chromosomiques et la radiosensibilité. Toutefois, la lourdeur de ces techniques l’a emporté sur sa fiabilité à refléter la réponse aux radiations [60,61] (Fig. 5).
Enfin, plus récemment, une autre technique, l’hybridation génomique comparative (comparative genomic hybridization ou CGH) a été développée sur la base des progrès de la génomique de masse et permet aujourd’hui de dresser rapidement la carte cytogénétique de n’importe quelle tumeur [62,63]. Cependant, la CGH fournit la liste des séquences répétées qui peuvent éventuellement refléter l’instabilité génomique et l’association à certains cancers mais ne peut révéler des aberrations stables comme des translocations ou des inversions. D’autre part, la CGH ne peut être une mesure d’effet radio-induit de haute précision puisque les dommages de l’ADN sont généralement distribués au hasard sur tout le génome et de façon stochastique dans chaque cellule. Ainsi, les CGH ne peuvent refléter une relation dose-effet indispensable à la prédiction de l’effet létal radio-induit ni donc se substituer à des tests fonctionnels.
Les techniques cytogénétiques comme le FISH ou la coloration Giemsa fournissent actuellement l’une des bases prédictives de la radiosensibilité les plus fiables. D’ailleurs, encore aujourd’hui, la dosimétrie biologique reste basée sur des mesures cytogénétiques de dicentriques, de translocations voire de marqueurs télomériques [64]. À ce titre, signalons que les tests cytogénétiques développés par l’IRSN sont les seuls tests de dosimétrie biologique accrédités en France [65]. Toutefois, ces tests ont pour but d’estimer la dose biologique de radiations qu’un individu a pu subir lors d’un accident et non de caractériser la susceptibilité individuelle car les mêmes taux de cassures et/ou d’aberrations chromosomiques peuvent être produits par des dysfonctionnements moléculaires et des causes génétiques très différents [66,67].
6.2 Réparation par suture et réparation par recombinaison homologue : quoi d’autre ?
Comme les dommages chromosomiques sont générés par des lésions de l’ADN, il semblait donc logique d’étudier, après la cytogénétique, les mécanismes de réparation de l’ADN et leur lien éventuel avec la radiosensibilité (Fig. 1 et 2) [10,42,68–70]. Cependant, quel dommage radio-induit de l’ADN choisir pour mieux prédire la radiosensibilité ? Dans une revue précédente, nous avons exposé tous les arguments en faveur des cassures double-brin de l’ADN (CDB) plutôt que des cassures simple-brin (CSB) ou des dommages de bases [6,71]. Nous n’y reviendrons pas mais rappelons un fait : aucune corrélation n’existe dans la littérature entre la radiosensibilité et les défauts de réparation des dommages de bases ou de CSB. En particulier, l’ataxie telangiectasique, le syndrome humain associé à la plus forte radiosensibilité connue, causé par les mutations du gène ATM, n’est pas associé à des défauts de réparation des dommages de bases ni de CSB mais plutôt à des défauts de réparation des CDB [6].
La réparation des CDB chez les mammifères a longtemps été décrite comme duale avec deux voies majeures : la recombinaison homologue (homologous recombination, ou HR) [39] et la suture non-homologue (non-homologous end-joining, ou NHEJ) [38]. Toutefois, comme la voie HR est seulement active en phase S-G2/M et la voie NHEJ est seulement active en G0/G1, le paradigme « NHEJ ou bien HR » ne peut expliquer la radiosensibilité de cellules quiescentes (en G0/G1) qui seraient normales pour la suture NHEJ [6,11]. D’autre part, les voies HR et NHEJ étant des voies essentiellement fidèles, comment expliquer l’instabilité génomique issue d’une mauvaise réparation ? L’existence d’une voie alternative de réparation devrait donc à la fois expliquer certaines radiosensibilités en G0/G1 et certaines prédispositions au cancer [6,11].
En plus de ces interrogations, les modèles actuels de réparation des CDB issus des données sur les rongeurs et les microorganismes, impliquent une vingtaine d’acteurs majeurs dont les mutations ne correspondent à aucun syndrome connu chez l’homme. En effet, les protéines Ku, DNA-PKcs, RAD51, RAD52 sont indispensables à la vie cellulaire (mitose, méiose, etc.) et leur absence n’est pas viable chez l’homme [6]. À l’inverse, les levures ou les cellules de rongeurs porteurs de mutations de Ku, DNA-PKcs, RAD51, RAD52 existent mais sont radiosensibles [40,72,73]. Ce paradoxe s’explique notamment par le fait que les gènes humains se distinguent souvent de leurs homologues des autres espèces par des différences importantes de séquences avec rarement les mêmes fonctions biologiques[74,75]. Par exemple, la protéine Rad51 humaine porte un domaine endonucléase III qui permet à cette protéine de couper l’ADN alors que le gène considéré comme homologue chez la bactérie, appelé RecA, possède une séquence deux fois moins longue et un domaine endonucléase est absent [74,75]. L’accumulation des connaissances sur les séquences des gènes s’est en effet effectuée à une vitesse bien plus grande que la détermination de leurs fonctions biologiques. Ainsi, l’usage des mêmes sigles des gènes est effectivement trompeur. En prenant l’exemple du gène BRCA1, associé aux cancers familiaux du sein et de l’ovaire, rappelons que la séquence du gène Brca1 chez le rat n’a que 58 % d’identité de séquence avec son homologue humain BRCA1 [76]. De plus, il faut souligner que les modèles de rongeurs mutés pour Brca1 montrent très rarement des phénotypes associés à des cancers du sein mais quand ils en montrent, les mutations considérées sont issues du génie génétique avec des expressions de gène conditionnelles [77]. Ainsi, l’usage des noms-mêmes des gènes doit inspirer une grande prudence en ce qui concerne l’extrapolation des modèles à d’autres espèces. Les gènes de réparation de l’ADN en sont des exemples représentatifs.
6.3 Nature de la corrélation entre radiosensibilité et réparation des CDB
Les CDB fragmentent l’ADN. Les premières techniques de mesure des CDB ont été basées sur la discrimination des fragments radio-induits d’ADN en fonction de leur taille. Cela a été notamment le cas de la sédimentation en gradients de sucrose, de l’élution neutre et de l’électrophorèse en champs pulsés [71,78]. Un tel principe a l’avantage de mesurer la réparation des CDB indépendamment de toutes voies moléculaires de réparation quel que soit le temps post-irradiation. En revanche, ces techniques ne permettent pas d’évaluer la qualité de la réparation, c’est-à-dire son caractère fidèle ou bien fautif. Les CDB mais surtout les CSB radio-induites, plus nombreuses, provoquent dans certaines conditions une augmentation du noyau cellulaire due à la décondensation de la chromatine. La technique du halo consiste, à l’aide d’intercalants fluorescents, à quantifier une telle augmentation [79]. La technique de la comète combine l’électrophorèse et la technique du halo toutes deux appliquées individuellement à chaque cellule [80]. Les données issues de la technique de la comète sont généralement fournies sous la forme du produit de l’augmentation de la taille du noyau (tête de comète) par la distance de migration des fragments de l’ADN (queue de comète). Toutefois, comme la décondensation de la chromatine et la religation des brins d’ADN ne sont pas organisées par les mêmes voies protéiques [70,81], la technique de la comète ne fournit pas une mesure directe du rythme de réparation des CDB mais une estimation globale de la gestion des CSB et des CDB, ce qui pose souvent un problème d’interprétation des données.
Toutes les techniques détaillées ci-dessus nécessitent une préparation de l’ADN ou des cellules qui s’étalent sur un ou deux jours. Elles ont été progressivement abandonnées au profit de tests plus rapides. Pourtant, les données issues de ces techniques sont à l’origine des premières corrélations entre la réparation des CDB et la radiosensibilité. En compilant les résultats obtenus sur des lignées tumorales humaines avec toutes ces techniques, nous avons montré dans une revue publiée en 1997 que 13 sur 20 publications, (représentant 89 sur 101 lignées testées), montrèrent une corrélation significative entre la réparation des CDB et la radiosensibilité [71]. Concernant les cellules non tumorales et notamment les fibroblastes, la même tendance fut observée mais le nombre de lignées testées était très inférieure. De plus, la nature de la corrélation apparaissait plus complexe. En effet, malgré une radiosensibilité identique (même survie clonogénique), le taux de cassures non réparées est deux à quatre fois plus élevé dans des fibroblastes issus d’un patient muté dans la ligase IV que dans des cellules provenant de patients atteints d’ataxie telangiectasique (mutations d’ATM). Inversement, certains syndromes très différents comme le syndrome de Bloom et xeroderma pigmentosum respectivement causés par des mutations de gènes BLM et XP, sont souvent associés à la même survie clonogénique après 2 Gy (SF2) [6,11].
6.4 Le test H2AX n’est pas suffisant pour expliquer toute la radiosensibilité humaine
Comme évoqué dans les chapitres ci-dessus, une grande majorité de radiobiologistes ont développé des études monogéniques qui ont l’avantage d’élucider le rôle biologique d’un seul gène dans la réponse aux radiations. Cependant, une telle approche ne peut fournir une vue globale et comparative du continuum des réactions post-irradiation. Récemment, la technique d’immunofluorescence basée sur des marqueurs d’histones H2AX phosphorylés (γ-H2AX) a permis une mesure précise du nombre de CDB au sein-même du noyau des cellules irradiées sous la forme de foci nucléaires. Il existe une relation linéaire entre le nombre de CDB et le nombre de foci γ-H2AX [82]. Malheureusement, malgré la précision et la rapidité (quelques heures de traitement) de ce test, la réalité est plus complexe. D’une part, le signal de fluorescence et la lisibilité des foci γ-H2AX peuvent être perturbés par des dysfonctionnements de la chromatine dus au traitement ou au statut génétique (Fig. 6). D’autre part, comme il est précisé dans le paragraphe suivant, les foci γ-H2AX disparaissent à un rythme normal dans certains cas de radiosensibilités [6,11].
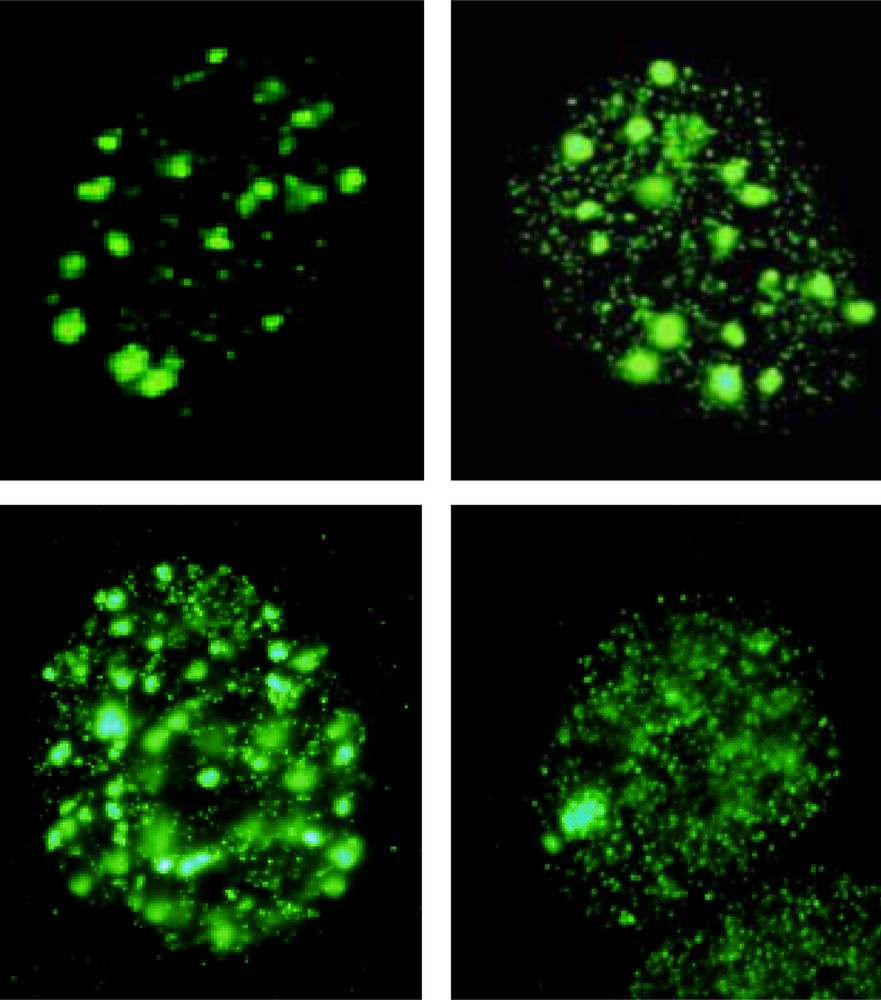
Exemples représentatifs d’images de noyaux de cellules humaines irradiées contenant des foci γ-H2AX obtenus par immunofluorescence. Pour le même traitement (2 Gy de rayons X suivies de 4 h de réparation), on peut dénombrer les foci γ-H2AX dans les deux photos du haut. Toutefois, le fond du noyau peut être couvert d’une coloration verte artéfactuelle ou d’un certain nombre de petits foci dont la prise en compte dans le comptage final est un réel problème technique (photos du bas).
Depuis une dizaine d’années, au rebours des études monogéniques, notre groupe a délibérément choisi d’adopter une démarche avec le plus grand spectre possible de radiosensibilité. La relation entre la radiosensibilité et la réparation des CDB a été examinée dans un premier temps au sein d’une collection de 40 fibroblastes humains représentant au moins huit différents syndromes génétiques [6,11]. Cette démarche se poursuit aujourd’hui avec une centaine de lignées cellulaires issus de syndromes connus ou de patients ayant montré de fortes réactions tissulaires après radiothérapie. L’application systématique de la plupart des tests moléculaires prédictifs de la radiosensibilité nous a permis d’obtenir une corrélation quantitative entre la radiosensibilité cellulaire et la réparation des CDB valable pour toutes les cellules de mammifères : la SF2 apparaît comme inversement proportionnelle au taux de CDB non réparées reconnues par la phosphorylation de H2AX (Fig. 7). Une telle corrélation nous apprend qu’il suffit d’une à deux CDB restant encore non réparées 24 h après irradiation pour entraîner la mort d’une cellule irradiée [6,11]. Cependant, le test γ-H2AX ne permet à lui seul de prédire l’ensemble de la radiosensibilité humaine. En effet, ce test distingue difficilement les cellules radiorésistantes des cellules montrant une radiosensibilité modérée. Sur la Fig. 7, on voit notamment que la limite inférieure de ce que l’on pourrait appeler des cellules radiorésistantes cohabitent avec la limite supérieure du groupe de cellules montrant une radiosensibilité modérée mais significative. Pour des raisons statistiques, on ne peut ainsi affirmer que ces fibroblastes sont déficients dans la voie NHEJ. Étant irradiés en quiescence (G0/G1), la voie HR ne peut être incriminée. De tels cas de radiosensibilité modérée suggèrent donc l’existence d’une troisième voie de réparation des CDB, indépendante des deux autres et dont le dysfonctionnement serait responsable d’une radiosensibilité modérée.
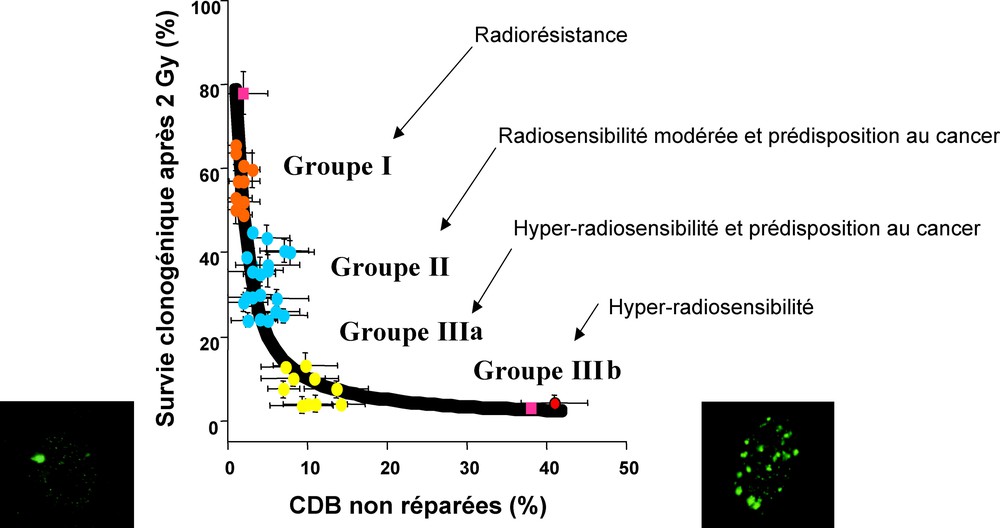
Relation entre la SF2 et le pourcentage de CDB non réparées mesurée par immunofluorescence γ-H2AX 24 h après l’irradiation. Ces données sont issues de [11]. Les flèches désignent les différents groupes de radiosensibilité (groupe I : 65,6 % < SF2 < 45,2 % ; groupe II : 45,2 % < SF2 < 7,4 % ; groupe III : SF2 < 7,4 %. Le groupe III contient pour l’instant deux sous-groupes concernant respectivement certaines mutations de ATM (IIIa) et certaines mutations de la ligase IV et de DNA-PKcs (IIIb). Les carrés roses correspondent aux lignées de rongeur très radiorésistantes et très radiosensibles de la famille CHO-xrs [11]. La SF2 est inversement proportionnelle aux CDB non réparées. Les deux photos montrent des exemples représentatifs de foci γ-H2AX après 24 h sur des lignées radiosensibles et radiorésistantes.
6.5 La voie MRE11-dépendante, une alternative à la réparation par suture
Dans notre étude, toutes les cellules de radiosensibilité modérée proviennent soit de syndromes génétiques associés à une forte prédisposition au cancer, soit de patients traités pour un cancer. De façon systématique, ces cellules montrent également un taux de foci nucléaires formés par la protéine MRE11 significativement plus élevé après irradiation que les cellules plus radiorésistantes (Fig. 8). La protéine MRE11 est une nucléase dont la séquence est particulièrement conservée à travers les espèces. Le fait qu’une protéine qui peut couper soit anormalement plus active dans des cellules associées à une forte instabilité génomique impliquée suggère qu’elle joue un rôle dans un processus de réparation recombinatoire fautif [11]. Le nombre de foci MRE11 a été justement corrélé à des phénomènes d’hyper-recombinaison indépendant de la HR et associé à une forte prédisposition au cancer [11]. Le test des foci MRE11 permettrait donc la quantification de la « mauvaise » réparation, responsable de l’instabilité génomique mais participant aussi à la réparation globale et donc aux processus de radiorésistance. Le double test γ-H2AX-MRE11 nous donne alors une vision quantifiée de la radiosensibilité et de l’instabilité génomique radio-induite. Une classification des cellules en fonction de leur SF2 et des taux de foci γ-H2AX et MRE11 a donc été proposée :
- • le groupe I décrit les cellules radiorésistantes sans instabilité génomique particulière ;
- • le groupe II rassemble les cellules montrant une radiosensibilité modérée (SF2 comprise entre 7 et 45 %), un taux de CDB non réparées inférieur à 7 % et une forte instabilité génomique. Il regroupe notamment la plupart des syndromes génétiques associés à une forte prédisposition au cancer et les patients montrant des réactions suraiguës après un traitement radiochimiothérapique ;
- • le groupe III concerne les cellules hyper-radiosensibles (SF2 inférieures à 7 %) et correspond à des syndromes génétiques dont les premiers signes cliniques sont observés au niveau pédiatrique [6,11] (Fig. 7).
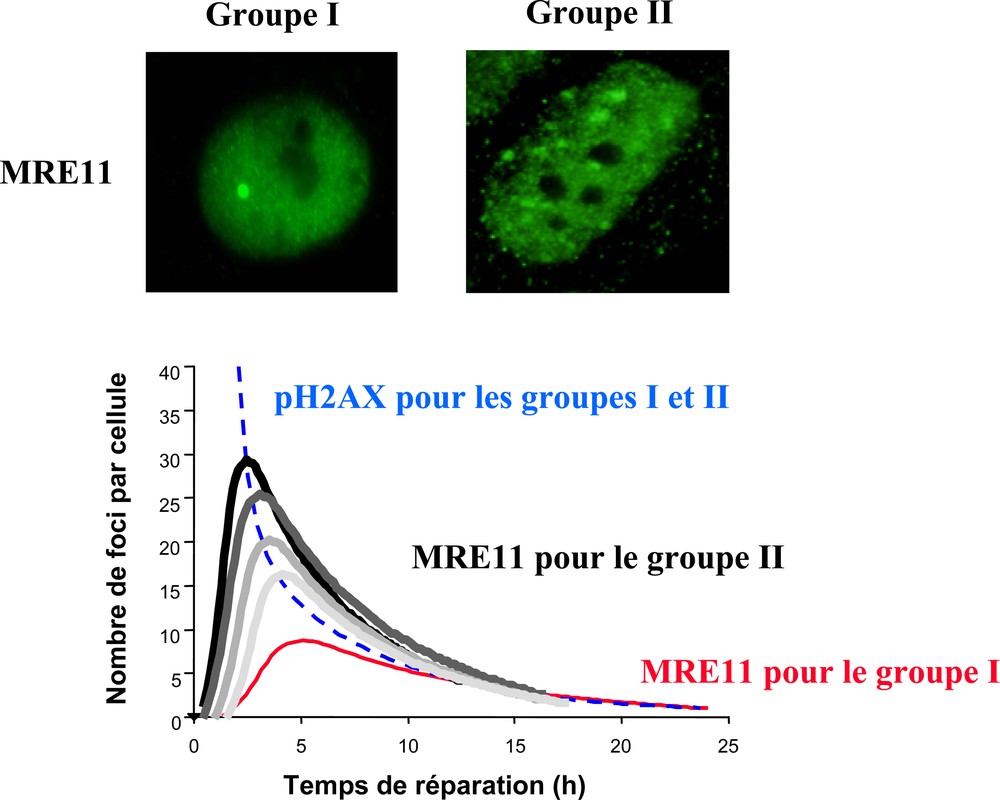
Foci MRE11 et patients radiosensibles. Les cellules des patients du groupe II (radiosensibilité modérée et prédisposition au cancer) montrent un nombre de foci MRE11 radio-induits plus nombreux que les patients du groupe I (radiorésistants). Ces conclusions sont illustrées à la fois par des photos d’immunofluorescence (haut) et le graphe (bas) résumant schématiquement le nombre de foci MRE11 au cours du temps après une dose de 2 Gy de rayons X [11].
6.6 Un lien fort avec les conditions cliniques d’irradiation
Dans le cadre d’une radiothérapie où la dose est fractionnée, les cellules du groupe II accumulent des taux de CDB non réparées non négligeables au fur et à mesure des sessions de radiothérapie. Les réactions suraiguës peuvent alors survenir quand ces taux atteignent des valeurs comparables à celles obtenues en dose unique pour des cellules du groupe III [6,11] (Fig. 9). La définition de ces trois groupes est bien sûr provisoire. Notre laboratoire la documente régulièrement par l’ajout de nouvelles données sur des syndromes génétiques connus associés à une radiosensibilité et/ou une forte prédisposition au cancer mais surtout à partir de biopsies de peau issues de patients ayant montré des réactions suraiguës à la suite de leur traitement radiothérapique. À partir d’un double test γ-H2AX-MRE11 sur une biopsie de peau, il est donc aujourd’hui possible de prédire de façon fiable la radiosensibilité des tissus sains d’un individu tant en termes diagnostiques que pronostiques, et ce, quelle que soit la modalité d’irradiation.
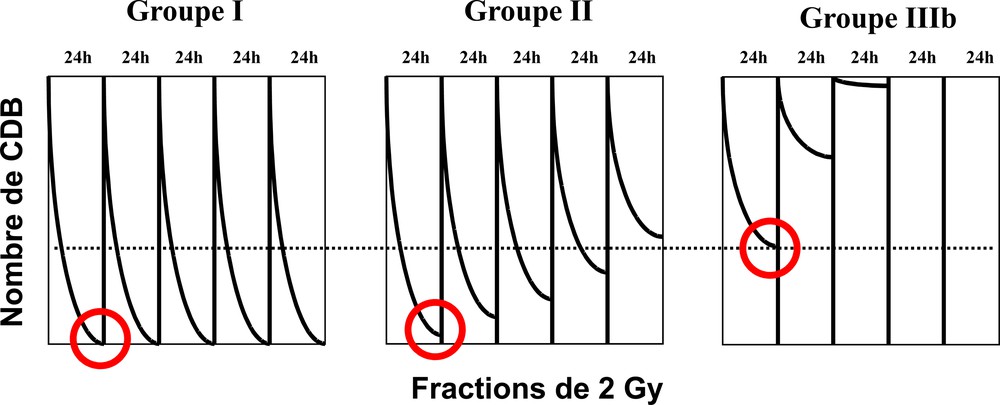
Influence du groupe de radiosensibilité dans la réponse au fractionnement de dose : lors d’une séance de dose fractionnée standard (2 Gy espacés de 24 h), le nombre de CDB diminue avec le temps de réparation jusqu’à un taux de CDB non réparables. Ce taux s’accumule progressivement tout au long des séances pour atteindre éventuellement des taux de toxicité (pointillés) comparables aux effets observés en dose unique pour les cellules les plus radiosensibles (groupe III). Ainsi, les patients du groupe II, souffrant d’un défaut de réparation faible en dose unique, peuvent montrer des réactions suraiguës résultant d’une accumulation de dommages à partir d’un nombre de séances de radiothérapie théoriquement prévisible par les tests de réparation.
En plus des doses utilisées habituellement en radiothérapie, il faut également souligner l’importance croissante de la prise en compte des faibles doses de rayons X appliquées soit par l’imagerie portale pendant le traitement radiothérapique, soit par des radiodiagnostics standard (scanners, radiographies, etc.). La mise en évidence du phénomène d’hypersensibilité aux faibles doses de rayons X généralement observé entre 1 mGy et 50 cGy sur des tissus à fort pouvoir métastatique constitue également une véritable opportunité pour éprouver nos hypothèses sur le pouvoir prédictif des tests basés sur la réparation des CDB [83]. Ainsi, aucune expression de gène ni aucune mutation unique n’a jusqu’à présent été corrélée au phénomène d’hyperradiosensibilité aux faibles doses afin de prédire la radiosensibilité observée dans un continuum allant de 1 mGy à plusieurs Gy [83,84]. Par contre, certaines fonctions comme l’activité kinase de DNA-PK ou la mesure des taux non réparés des CDB permettent aujourd’hui de mieux rendre compte de ce phénomène [83–85].
6.7 La radiosensibilité et les réactions observées en clinique
Nous avons cité dans cette revue des maladies génétiques associées à de fortes radiosensibilités causées par des mutations homozygotes mais dont la fréquence est de l’ordre de 1/100 000 : elles ne constituent donc pas la majorité des cas de radiosensibilité que l’on peut rencontrer dans les services de radiothérapie à la suite d’un traitement anti-cancer. À l’inverse, les cas observés en radiothérapie sont plutôt des cas de radiosensibilités modérées (groupe II) (Granzotto et al., en préparation). Une radiosensibilité modérée de type groupe II est justement l’un des symptômes cliniques associé aux mutations hétérozygotes de la plupart des gènes précités. Les porteurs hétérozygotes des gènes comme ATM, NBS1, MRE11 pourraient ainsi représenter une fraction importante des patients radiosensibles. En particulier, les porteurs de mutations hétérozygotes d’ATM représentent environ 1 % de la population mondiale et seraient associés à des prédispositions au cancer plus élevées que la moyenne [86]. Quantifier et tenir compte de la susceptibilité individuelle reste donc une des tâches majeures de la radiobiologie et de la radiothérapie. Rappelons toutefois que le seul patient portant une mutation de la ligase IV a été soumis puis a succombé à son traitement radiothérapique à la suite d’un lymphome détecté dans son adolescence alors que rien ne laissait supposer durant les premières années de sa vie qu’il souffrait d’une telle radiosensibilité [87]. Plus récemment encore, en 2010, un patient atteint d’une tumeur de Wilms a succombé à son traitement radiothérapique : une analyse post-mortem a conclu à une mutation du gène ATM [88]. Les doses appliquées en radiothérapie sont évidemment plus élevées qu’un stress environnemental quotidien et pourraient mettre en évidence brutalement des affections peu décelables dans la vie de tous les jours.
7 Conclusions
Les bases moléculaires et cellulaires de la radiosensibilité sont incroyablement complexes. Toutefois, leur élucidation rendra possible le développement de tests fiables :
- • pour prédire l’efficacité des traitements radiochimiothérapiques contre les tumeurs ;
- • pour anticiper et optimiser les nouvelles modalités anti-cancer (cyberknife, irradiation par modulation d’intensité, micro-irradiations, hadronthérapie, etc.) ;
- • pour prévoir et prévenir l’apparition des réactions suraiguës.
Sept points majeurs sont à retenir :
- • les tissus sains comme les tumeurs montrent un très large spectre de radiosensibilité dont le statut génétique est l’un des facteurs essentiels ;
- • la rapidité d’un protocole n’est pas une preuve de fiabilité ni de prédictibilité : les différences inter-individuelles, inter-organes, inter-tissus ainsi que les tests moléculaires rapides peuvent être des pièges. De plus, l’usage des lymphocytes peut entraîner des biais dans la prédiction des réactions radio-induites des tissus conjonctifs ;
- • la mesure de la survie clonogénique reste le « standard » cellulaire pour évaluer quantitativement la radiosensibilité in vitro, prédire la radiocurabilité des tumeurs in vivo et prévoir les réactions suraiguës sur les tissus sains irradiés ;
- • tous les paramètres relatifs à la croissance cellulaire ou à l’hypoxie sont insuffisants pour prédire correctement la radiosensibilité des tissus sains ou des tumeurs ;
- • les tests cytogénétiques rendent assez fidèlement compte d’une large gamme de radiosensibilité mais la période de temps nécessaire à l’obtention des métaphases peut être source de biais ;
- • la mesure de l’expression radio-induite ou la détermination de SNP souvent effectuées à partir de lymphocytes présentent des avantages de rapidité, d’acquisition de données, mais la littérature actuelle suggère qu’ils ne prédisent pas suffisamment la relation dose-effet ainsi que les réactions suraiguës qui surviennent généralement sur les autres tissus ;
- • l’étude d’une multitude de syndromes génétiques consolide la conclusion que les tests prédictifs basés sur la fonctionnalité des voies de réparation de l’ADN permettent de quantifier et de prévenir les réactions suraiguës post-traitement quelle que soit leur sévérité. De nouvelles investigations sont cependant nécessaires pour établir encore plus finement les relations existant entre les dysfonctionnements de la réparation des CDB et la radiosensibilité et choisir au mieux le ou les marqueurs prédictifs des acteurs de la réparation.
Conflit d’intérêt
Aucun.
Remerciements
Nous remercions les Prs M. Tubiana (Académie des sciences), J.L. Lagrange (CHU Henri-Mondor de Créteil), E. Lartigau (centre Oscar-Lambret, Lille), J.-M. Cosset (institut Curie, Paris), J. Bourhis (institut Gustave-Roussy, Villejuif), les Drs C. Carrie et L. Claude (centre Léon-Bérard, Lyon) ainsi que l’équipe des praticiens hospitaliers de l’hôpital cantonal de Genêve pour leur concours. Nous remercions également les Drs E.P. Malaise, V. Favaudon, D. Averbeck, P. Gourmelon et L. Sabatier pour leurs conseils précieux. Ce travail a été réalisé grâce au soutien d’Électricité de France (Commission de radioprotection), du Centre national d’études spatiales, de l’Agence nationale de la recherche, de l’Institut national du cancer et de l’Association pour la recherche sur l’ataxie-telangiectasie. Les auteurs de cette revue ont reçu le Prix Louis-Fontaine 2008 de la Fondation Rhône-Alpes Futur pour leur travail sur la prédiction des réactions suraiguës après traitement radiochimiothérapique. G.V. est lauréat du Prix Mallet 2009 et N.F. est lauréat de l’Académie des sciences (Prix du Dr et de Mme Peyré 2009).


