Abridged English version
Coastal filaments are typical features associated with eastern boundary regions. They are near-surface structures, tens of kilometers in width, which may extend up to several hundred kilometers in length, connecting the coastal upwelling with the open sea [5,6]. Several studies have shown that upwelling filaments may play a key role in the transport of nutrients [7], chlorophyll [8,9] and zooplankton [10,11] to the open ocean.
In our study, we propose to identify the dispersive capacity of Cape Ghir upwelling filament located in (31°N) and aspects under which this dispersive environment could influences the structure, the biomass and the trophic relations in this ecosystem. We have studied the structure of this permanent filament throughout the spatiotemporal distribution of copepods species in this area.
Five oceanographic cruises conducted between 2008 and 2009 were realized, onboard the research ship “Al Amir Moulay Abdallah”. The cruises were performed every two months for 1 year covering all seasons (December 2008, February, April, June and October 2009). In total, 11 stations were sampled on two radial, seven stations coast-large and four parallel to the coast line (Fig. 1). At each station, the zooplankton was sampled by a Bongo net equipped with 145 μm mesh. Environmental parameters were measured (surface temperature and chlorophyll), using a probe (Neil Brown) and the Chlorophyll “a” productions was measured fluorimetrically [15]. Data of Sea Surface Temperature (SST) and chlorophyll satellites images are obtained in real time.
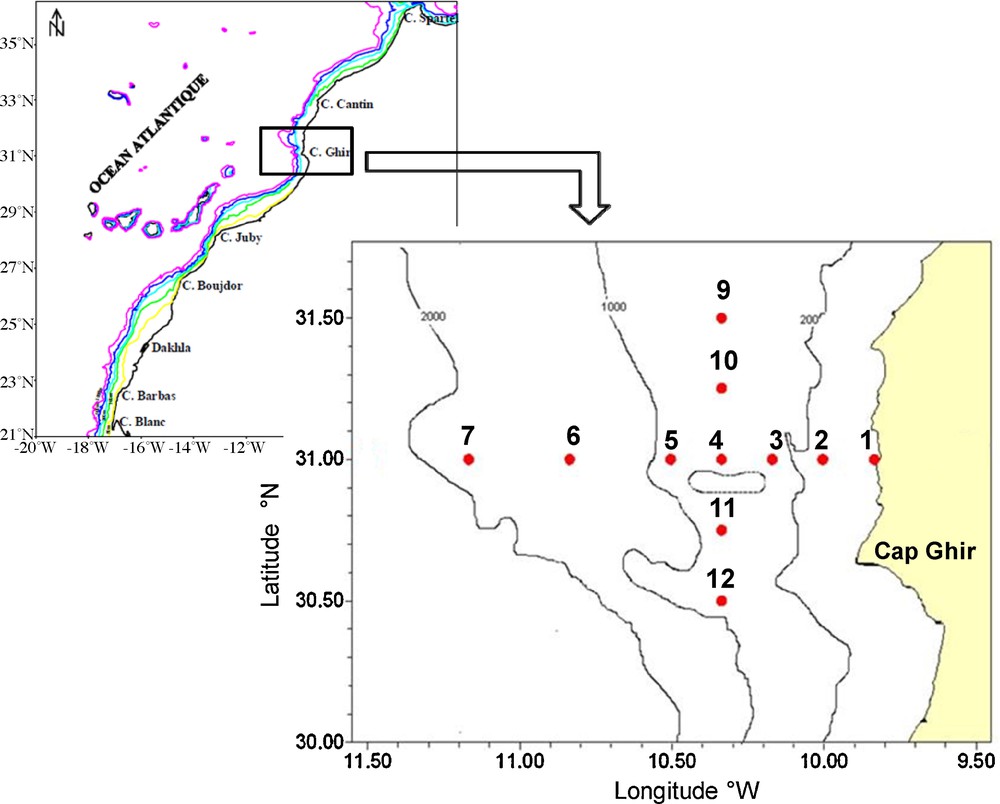
Carte des stations échantillonnées.
The hydrographic conditions during the cruise reflect a period of upwelling processes. The upwelling is clearly visible with the comparison of the values of surface temperatures registered in situ and by profile image of satellite surface temperature (SST). According to several authors [31,32], the Cape Ghir filament was characterized by localized coastal upwelling taking place for all year round, intensified specially during summer. This process is actually verified in this work, where the filament is clearly present throughout the year, with a maximum of intensity accentuated in summer (June).
The cold-water upwelling brings nutrients deep waters to the surface, necessary for primary and consequently secondary production. In this work, a clear correlation is observed between surface temperature and biological production (chlorophyll “a” and zooplankton) in the period of upwelled water. The maximum biological production occurs between April and October; and the lowest temperatures are recorded from April, coinciding with intensified process of upwelling. The biomass of zooplankton recorded on the radial 31°N decreased along the radial side-wide, but remains relatively high, especially in October; this implies a dynamic of filament. Several authors [35–37] have demonstrated that a more effective way than Ekman transport to transfer properties from the upwelled region to the interior ocean is through coastal filaments.
The Zooplankton community was characterized by the dominance of copepods with maximum of 99%, high species diversity; 86 species of copepods belonging to 26 families dominated by Acartia clausi and Oncaea venusta during all the periods surveyed and in all stations. Some others species dominate differently depending on the season like: Calanus helgolandicus, Clausocalanus arcuicornis, Euterpina acutifrons, Oithona nana, Oithona plumifera, Oithona similis and Paracalanus parvus. Deep water species such, C. helgolandicus related to the Canary Current [49], Calanoides carinatus is observed and at shallower layers coinciding with the upwelling season [53] and Ctenocalanus vanus species at height of either sub-tropical and polar waters [54,55] have been identified mainly in April and June. Thus supporting the results of ocean parameters and reflecting a net upwelling movement in which these species are transported to the surface. Moreover, some species of copepods populating the coast are listed in the open ocean, reflecting the dynamics of the filament. As an example, A. clausi is a good indicator of advection of water to sub-mesoscale, considered by many authors as neritic species [39,52,56]. It is preponderance in our study, is very consistent with the observations of several authors that have investigated the coastal regions of Morocco in general and the region of Agadir in particular [42]. Preliminary data suggest, however, that a strong seasonal pattern in A. clausi densities exists. Their presence in the south prove clearly the presence of oceanic water transport from the coast to the south in February and April and a northward alongshore transport in June and October.
Several concepts of sub-mesoscale phenomena have been advanced [65]. In many cases, it represents a deformation of coastal jet stream generating meanders and displacing upwelled waters towards the ocean of about 100–300 km [3]. The filaments are part of the meander from towards to the open sea. The filaments may also be generated by the mesoscale eddy field, in regions where the velocity field is directed towards the open sea.
The multivariate analyses support this analysis hypothesis, which permit us to view the stations assembly varying in time and space. Several areas have been distinguished, especially in April, June and October. In April, coast stations 1 and 2 show compositions of similar species at south stations of Cape Ghir 11 and 12. However, in June and October the coastal stations show a resemblance to north stations of the longitudinal radial. This variability or similarity of the copepod population structure between stations is mainly attributed to environmental conditions related to the dynamics filament associated.
Several studies have demonstrated that the Cape Ghir area is characterized by an activity of resurgence intensified during summer [31,32]. This result is well confirmed with our study, supported with the high primary production from south in February and April and by the variation of temperature between the large and the coast reflecting a large activity, which intensifies the upwelling filament in April and June. In June and October, the continuity of the filament is directed to the north similar results was described by Hernandez-Leon [66] for another filament off Northwest Africa, he noted that the biomass of mesozooplankton is also transported and their biomass is high in all areas affected by the filament. The cold waters and filament assure an export for nutrient and primary production to the open sea and constitutes the basic sequence for completion of phytoplankton bloom, exploited by zooplankton. In terms of structure, copepods are predominantly coastal species, best adapted to the variability of environmental and trophic conditions. Moreover, some species are more specifically related to the hydrodynamics, as C. helgolandicus, transported by the Canary Current, or C. carinatus and C. vanus, that characterize the upwelling zones. The associations identified by multivariate analysis help us to provide an outline of the dynamics of the filament, which meanders disperse plankton organisms towards the south in April and northward in June and October. As the case of A. clausi, neritic species populating the coast and recorded offshore, reflecting the dynamics of the filament. The results suggest the uplifting of cold water and filament are responsible of mechanisms of transport for chlorophyll (primary production) and copepods into oceanic zone.
1 Introduction
Les zones d’upwelling côtier sont des régions océaniques de grande productivité biologique. Elles se présentent avec une multitude de structures (tourbillons, filaments, méandres…), agissant, ainsi, sur les ressources halieutiques et le cycle océanique [1,2]. L’ensemble de ces structures, formées le long du courant côtier, peuvent se détacher et transporter vers le larges des masses d’eau, issues des résurgences, relativement froides et riches en sels nutritifs. Elles peuvent ainsi accroître la production primaire des eaux du large.
Les tourbillons de surface entraînent une modification de la circulation océanique tridimensionnelle qui pourrait conduire à une diminution de l’intensité de l’upwelling induit. En revanche, les structures filamentaires relativement fines dans le sens de leur largeur, quasi rectiligne ou fortement déformée par des instabilités [3] et souvent localisées au niveau des caps [4], peuvent s’étendre vers le large sur de grandes distances reliant l’upwelling côtier avec la mer ouverte [5,6]. Ces structures assurent un export des nutriments [7], de chlorophylle [8,9] et du zooplancton vers le large [10,11]. Leurs signaux de température et de chlorophylle, observés par satellite, contrastent généralement avec l’environnement hauturier.
Sur la côte nord-ouest africaine, plusieurs formations filamenteuses se développent dont la plus importante étant celle de Cap Ghir [12] qui procure un caractère permanant [13,14]. La réponse de la productivité (chlorophylle et zooplancton) le long de ce filament est l’objet de cette étude afin d’approfondir nos connaissances sur la dynamique de ce phénomène à sub-mésoéchelle selon un cycle annuel.
2 Matériels et méthodes
2.1 Échantillonnage
Le prélèvement des échantillons d’eau et du matériel biologique au niveau du filament de Cap Ghir (Fig. 1) a été effectué à bord du navire océanographique « Al Amir Moulay Abdallah ». Les campagnes ont été effectuées tous les deux mois pendant une durée d’un an couvrant ainsi cinq périodes (décembre 2008, février, avril, juin et octobre 2009). Au total, 11 stations ont été échantillonnées sur deux radiales perpendiculaires : l’une méridionale (31°N) avec sept stations côte-large et l’autre longitudinale (10°09′W) avec cinq stations d’orientation nord-sud. L’intersection entre les deux radiales correspond à la station 4 (Fig. 1).
Au niveau de chaque station, la température de surface a été mesurée directement à l’aide d’une multisonde CTD (Neil Brown). Les teneurs en chlorophylle « a » ont été mesurées par fluorimétrie [15] sur des échantillons d’eau prélevés à différents niveaux le long de la colonne d’eau, par des bouteilles en rosette. En même temps, la collecte du zooplancton a été réalisée à l’aide du filet Bongo, grand modèle (60 cm de diamètre) de 147 μm de vide de maille. Le filet est équipé d’un débitmètre à son ouverture pour la mesure du volume d’eau filtrée. Le contenu du collecteur est recueilli et conservé dans du formol neutralisé à 5 %.
Le traitement des échantillons du zooplancton consiste, d’abord, en une estimation quantitative par mesure de la biomasse humide du zooplancton par unité de volume (mg.m−3) et une évaluation qualitative basée sur l’identification et le comptage des différents groupes de copépodes, constituants majeurs du zooplancton. Pour ce faire, un fractionnement de l’échantillon est obtenu à l’aide de la boîte « Motoda » et l’identification et le comptage sont réalisés sous une loupe binoculaire. La détermination des espèces de copépodes a été effectuée à l’aide de clés appropriées [16,17]. D’autres travaux concernant des révisions de genres ou de familles ont été nécessaires au cours de l’identification [18–21].
À côté des données prises in situ, des images de température de surface (SST) et de chlorophylle « a » acquises par satellite (Modis/Aqua) du niveau 3 (L3), sont également présentées.
2.2 Analyse numérique des données
Deux analyses multivariées ont été utilisées pour identifier les assemblages de stations à l’aide du logiciel SYSTAT : une méthode de classification hiérarchique (destinée à produire des classes par agrégations successives des échantillons, sur un critère de ressemblance entre les échantillons et la distance entre tous les échantillons) et une méthode d’ordination (Non-Metric Multidimensional Scaling [NMDS]).
La classification hiérarchique a été basée sur la méthode du groupement selon l’association « Ward » [22]. Le principe de cette méthode est de donner le même poids à tous les objets dans le calcul de l’association ;
Cadrage multidimensionnel non métrique : cette méthode d’ordination, développée par Shepard [23], puis Kruskal [24], est fortement conseillée en écologie [25,26]. La méthode NMDS minimise un critère appelé stress de Kruskal. Ce stress varie entre 0 et 1, la valeur nulle indiquant une représentation parfaite entre les échantillons. Une valeur inférieure à 0,2 traduit une représentation satisfaisante.
La liste des espèces de copépodes, utilisée lors des deux analyses multivariées, est limitée aux taxons dont le pourcentage d’abondance est supérieur au seuil de 0,1 % [27,28] et sont présents au moins quatre fois dans la zone d’étude. Ainsi, sur les 86 espèces recensées au cours des cinq périodes, 20, 20, 27, 24 et 25 espèces seulement ont été retenues respectivement en décembre 2008, février, avril, juin et octobre 2009. Par la suite, les données ont été organisées dans une matrice quantitative et transformées en valeurs logarithmiques. Le coefficient de distance euclidienne a été employé comme mesure de dissimilarité entre échantillons. L’utilisation conjointe des deux méthodes a permis de classer les stations en fonction du profil d’abondance des espèces dans le milieu et de confirmer les assemblages des stations.
3 Résultats
3.1 Température de surface
Sur la radiale côte-large, l’évolution des températures superficielles, prises in situ, met en évidence une activité de l’upwelling qui s’accentue en juin (Fig. 2). En effet, en décembre, février et avril, les températures oscillent entre 15,2 °C et 17 °C avec un écart thermique qui ne dépasse pas 2 °C. À partir de juin, les températures présentent un gradient côte-large de 4 °C. Ce gradient persiste en octobre, reflétant une continuité de l’activité de l’upwelling. Le long de la radiale nord-sud, la variation des températures de surface est faible en décembre et en février, alors qu’elle est plus marquée au cours des autres périodes où les faibles températures, proches de celles des stations côtières, sont enregistrées, soit vers le sud (avril), soit vers le nord (juin et octobre).
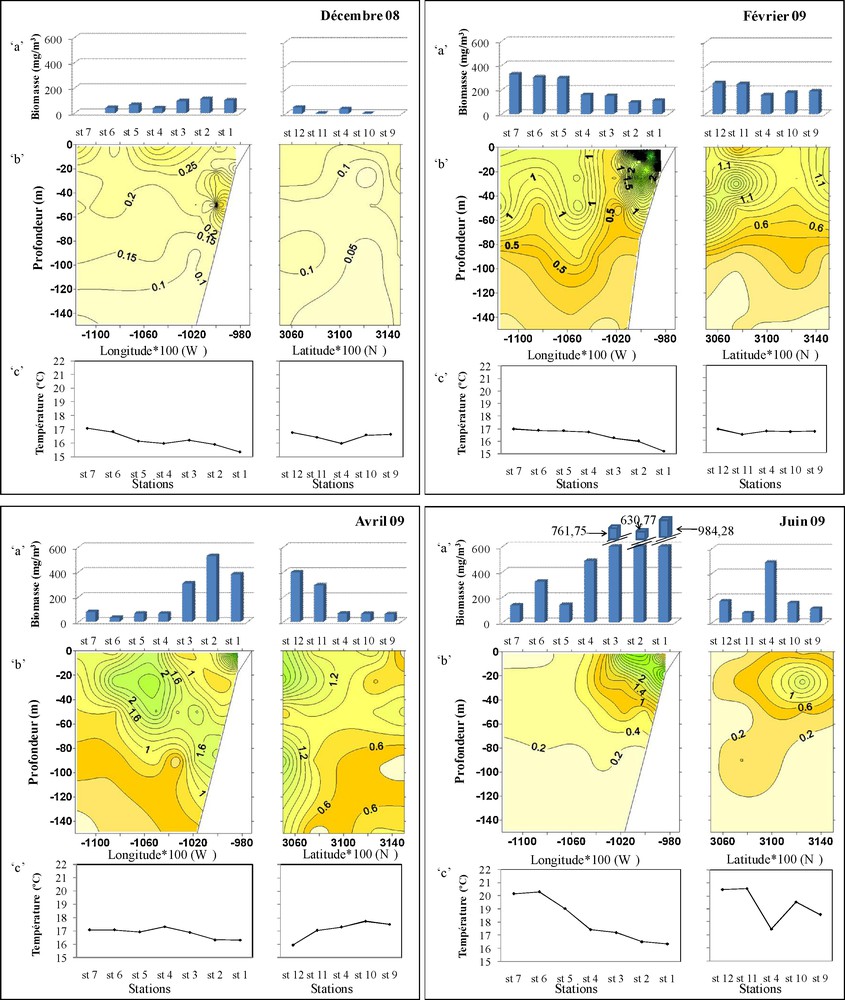
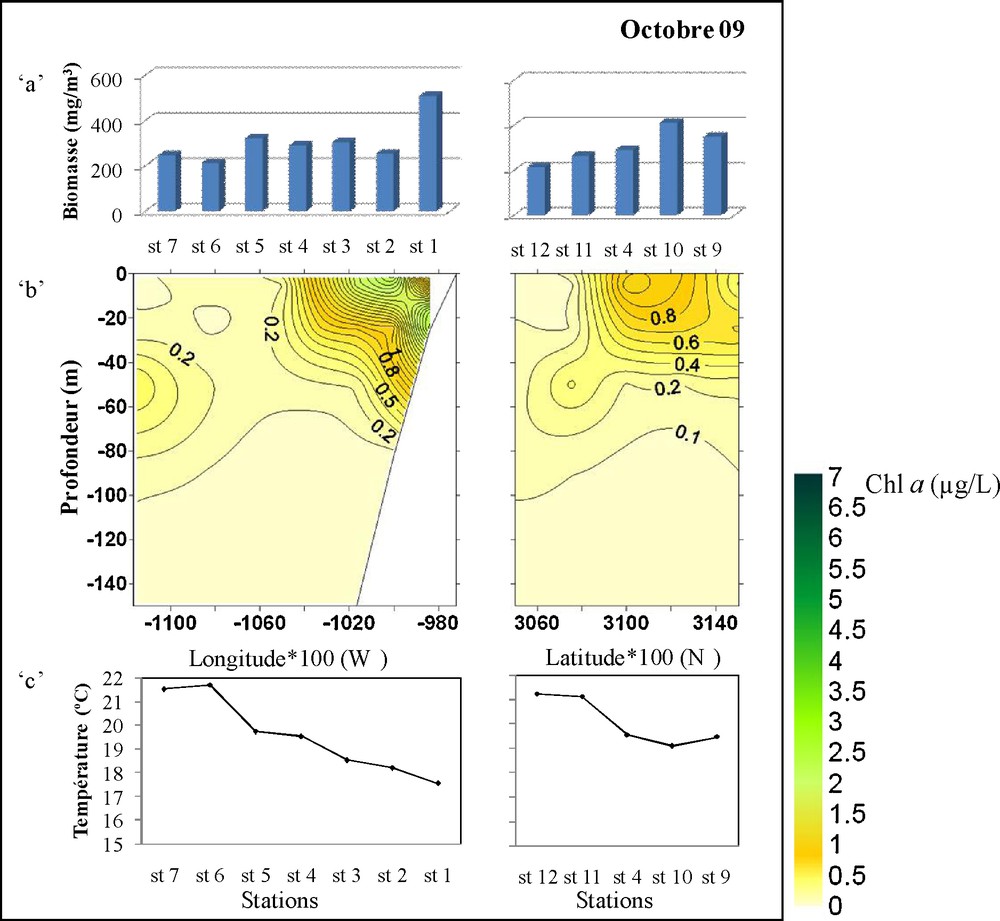
Distribution pendant les cinq périodes, décembre 2008, février, avril, juin et octobre 2009. a : biomasse humide du zooplancton (mg.m−3) ; b : chlorophylle « a » le long de la colonne d’eau (μg/L) ; c : température de surface (°C).
L’analyse des cartes de distribution superficielle de la température de l’eau de mer acquises par le capteur Modis-Aqua montre que la structure thermique du filament du Cap Ghir est multiforme et généralement étendue vers le large avec une migration vers le nord ou vers le sud en fonction de la saison (Fig. 3). L’activité de ce filament s’avère presque permanente avec un maximum d’activité qui se prononce durant la période été automne où le contraste thermique est à son maximum entre les eaux côtières plus froides issues de l’upwelling et les eaux du large.
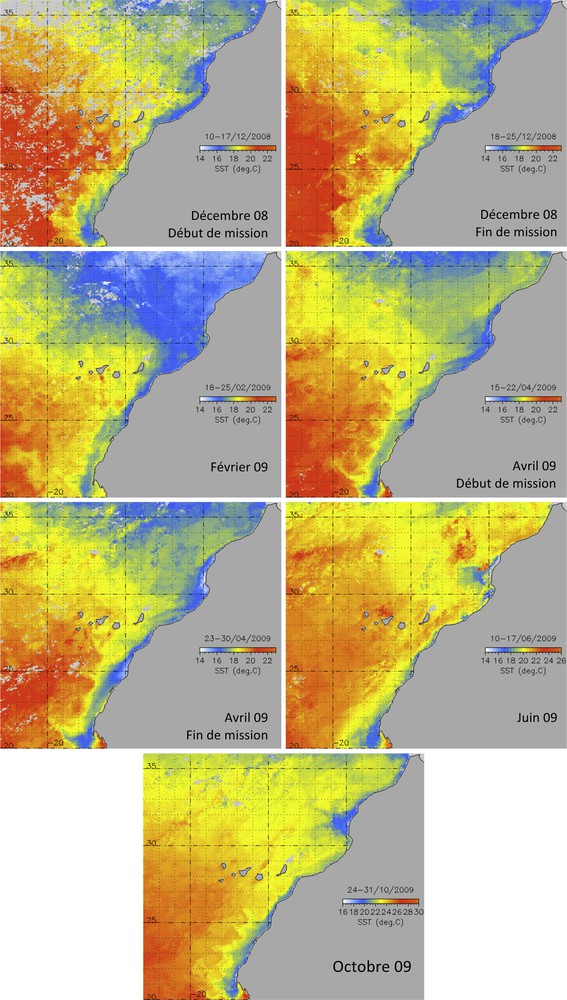
Carte satellite de la distribution de la température de surface (SST) de la côte atlantique du Maroc couvrant l’étendue du filament d’eau froide de Cap Ghir au cours de décembre 2008, février, avril, juin et octobre 2009.
3.2 Chlorophylle « a » et biomasses du zooplancton
L’analyse de distribution de la biomasse chlorophyllienne par image satellite a permis de mieux localiser l’extension du filament (Fig. 4). Une extension des fortes concentrations de la chlorophylle « a » vers le sud du Cap Ghir est bien visible en février et avril. Toutefois, en juin et octobre la chlorophylle « a » de surface est à son niveau maximum. Au cours de ces deux périodes, des biomasses importantes ont été localisées au nord de Cap Ghir et dans une moindre mesure vers le large.
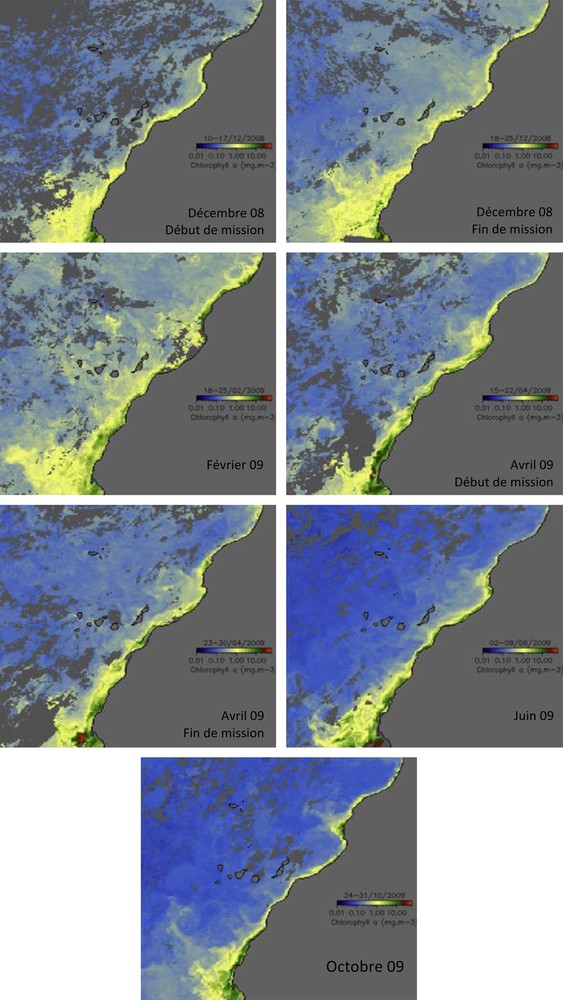
Carte satellite de la variation de la chlorophylle « a » de surface dans la région de Cap Ghir au cours de décembre 2008, février, avril, juin et octobre 2009.
Selon les prélèvements in situ (Fig. 2), les teneurs en chlorophylle « a » enregistrées en décembre ne dépassent pas 0,7 μg/L sur la radiale côte-large avec des biomasses humides du zooplancton faibles par rapport aux autres périodes (un maximum de 113 mg.m−3 dans la station 2). Ces valeurs sont encore moins importantes sur la radiale nord-sud, aussi bien pour la production primaire que la production secondaire.
En occurrence, les concentrations de la chlorophylle « a » enregistrées en février et avril atteignent respectivement 6,7 μg/L et 4,4 μg/L dans la station 1, témoignant d’une forte production primaire près de la côte. Inversement, la biomasse humide du zooplancton enregistre en février un maximum au large (325 mg.m−3) et en avril un maximum près de la côte (528 mg.m−3). Sur la radiale nord-sud, les stations 11 et 12 montrent des teneurs relativement élevées aussi bien pour la chlorophylle « a » que pour la production secondaire.
En juin, les concentrations de la chlorophylle « a » sont moins importantes avec un maximum de 3,7 μg/L enregistré à la station 1. À l’inverse, la biomasse du zooplancton est à son niveau le plus élevé de toutes les périodes, avec un maximum de 984 mg.m−3 près de la côte. Toutefois, sur la radiale nord-sud, les valeurs de la chlorophylle et de la biomasse zooplanctonique reflètent une faible production en cette période.
La situation en octobre est presque identique à celle de juin pour la chlorophylle « a » ; alors qu’une richesse relativement importante est notée pour le zooplancton au niveau des deux radiales.
3.3 Composition et abondance du zooplancton
L’ensemble des taxons identifiés sur les deux radiales se répartit en deux formes de vie. D’une part, l’holoplancton, représenté par 14 groupes : les chaetognathes (genre Sagitta), les appendiculaires, les ptéropodes, les euphausiacés, les mysidacés, les méduses, les siphonophores, les ostracodes, les cladocères, les amphipodes, les salpidés (genre Salpa), les doliolidés, les isopodes épicarides et les copépodes. D’autre part, le méroplancton est représenté par quatre groupes : les larves de cirripèdes, les larves de décapodes, les annélides polychètes et les stades larvaires de mollusques.
Sur l’ensemble des périodes prospectées, les copépodes constituent le groupe le plus important. Ils représentent 65 à 99 % du nombre total du zooplancton, à l’exception des échantillons des stations 10 et 11, prélevés respectivement en avril et en décembre. Ces deux échantillons se caractérisent par une forte abondance des chaetognathes et des appendiculaires, alors que les copépodes n’y représentent que 52 % et 38 % respectivement.
Au total, 86 espèces de copépodes ont été répertoriées (Tableau 1), appartenant à 41 genres et 26 familles. Le nombre d’espèces de copépodes recensées est généralement le même d’une période à l’autre. En revanche, la composition qualitative change légèrement, avec une différence au niveau des abondances relatives pour les espèces dominantes.
Liste exhaustive des copépodes prélevés dans les eaux du filament Cap Ghir au cours des cinq périodes entre 2008 et 2009.
| Acartia (Acartia) danae Giesbrecht, 1889 |
| Acartia (Acartiura) clausi Giesbrecht, 1889 |
| Acartia (Acartiura) longiremis (Lilljeborg, 1853) |
| Aegisthus spinulosus Farran, 1905 |
| Aetideus armatus (Boeck, 1872) |
| Aetideus giesbrechti Cleve, 1904 |
| Bradyidius armatus Giesbrecht, 1897 |
| Calanoides carinatus (Krøyer, 1848) |
| Calanus helgolandicus (Claus, 1863) |
| Calocalanus contractus Farran, 1926 |
| Calocalanus pavo (Dana, 1849) |
| Calocalanus sp. |
| Candacia armata (Boeck, 1872) |
| Candacia longimana (Claus, 1863) |
| Centropages bradyi Wheeler, 1901 |
| Centropages chierchiae Giesbrecht, 1889 |
| Centropages typicus Kröyer, 1849 |
| Centropages violaceus (Claus, 1863) |
| Clausocalanus arcuicornis (Dana, 1849) |
| Clausocalanus jobei Frost & Fleminger, 1968 |
| Clausocalanus paululus Farran, 1926 |
| Clausocalanus pergens Farran, 1926 |
| Clytemnestra gracilis (Claus, 1891) |
| Copilia mediterranea (Claus, 1863) |
| Corycaeus (Agetus) flaccus Giesbrecht, 1891 |
| Corycaeus (Agetus) typicus (Krøyer, 1849) |
| Corycaeus (Corycaeus) clausi F. Dahl, 1894 |
| Corycaeus (Onychocorycaeus) giesbrechti F. Dahl, 1894 |
| Corycaeus sp. |
| Ctenocalanus vanus Giesbrecht, 1888 |
| Euchaeta pubera Sars, 1907 |
| Euchirella curticauda Giesbrecht, 1888 |
| Euchirella rostrata (Claus, 1866) |
| Euterpina acutifrons (Dana, 1848) |
| Gaetanus tenuispinus (Sars, 1900) |
| Labidocera wollastoni (Lubbock, 1857) |
| Lucicutia flavicornis (Claus, 1863) |
| Lucicutia maxima Steuer, 1904 |
| Lucicutia tenuicauda Sars, 1907 |
| Macrosetella gracilis (Dana, 1848) |
| Mecynocera clausi Thompson, 1888 |
| Microsetella norvegica (Boeck, 1864) |
| Microsetella rosea (Dana, 1848) |
| Nannocalanus minor (Claus, 1863) |
| Neocalanus gracilis (Dana, 1849) |
| Oculosetella gracilis (Dana, 1852) |
| Oithona brevicornis Giesbrecht, 1891 |
| Oithona linearis Giesbrecht, 1891 |
| Oithona nana Giesbrecht, 1892 |
| Oithona parvula (Farran, 1908) |
| Oithona plumifera Baird, 1843 |
| Oithona setigera (Dana, 1849) |
| Oithona similis Claus, 1866 |
| Oithona sp. |
| Oncaea media Giesbrecht, 1891 |
| Oncaea mediterranea (Claus, 1863) |
| Oncaea sp. |
| Oncaea venusta Philippi, 1843 |
| Paracalanus denudatus Sewell, 1929 |
| Paracalanus nanus Sars, 1907 |
| Paracalanus parvus (Claus, 1863) |
| Paracalanus sp. |
| Paraeuchaeta hebes (Giesbrecht, 1888) |
| Paraeuchaeta sp. |
| Phaenna spinifera Claus, 1863 |
| Pleuromamma abdominalis (Lubbock, 1856) |
| Pleuromamma gracilis (Claus, 1863) |
| Pleuromamma robusta (F. Dahl, 1893) |
| Pontella sp. |
| Pseudhaloptilus eurygnathus (Sars, 1920) |
| Pseudocalanus elongatus (Boeck, 1865) |
| Rhincalanus cornutus (Dana, 1849) |
| Rhincalanus nasutus Giesbrecht, 1888 |
| Sapphirina iris Dana, 1849 |
| Sapphirina nigromaculata Claus, 1863 |
| Sapphirina opalina Dana, 1849 |
| Sapphirina sp. |
| Scolecithrix bradyi Giesbrecht, 1888 |
| Scolecithrix danae (Lubbock, 1856) |
| Subeucalanus crassus (Giesbrecht, 1888) |
| Subeucalanus monachus (Giesbrecht, 1888) |
| Temora longicornis (Müller, 1792) |
| Temora stylifera Dana, 1849 |
| Triconia conifera (Giesbrecht, 1891) |
| Triconia minuta Giesbrecht, 1892 |
| Xanthocalanus obtusus Farran, 1905 |
Au cours de l’ensemble des périodes prospectées, deux espèces dominent dans toutes les stations et présentent des abondances relatives élevées : Acartia clausi et Oncaea venusta. À côté, d’autres espèces dominent en fonction de la période : Calanus helgolandicus, Clausocalanus arcuicornis, Oithona nana, Oithona plumifera, Oithona similis, Paracalanus parvus et Euterpina acutifrons dans les stations de la côte. Ces espèces forment une partie importante de la communauté de Cap Ghir sur le plan quantitatif et se présentent sous une succession d’alternance entre eux, aux différentes stations et périodes.
3.4 Indicateur biologique de la dynamique du filament
L’utilisation du copépode côtier A. clausi comme indicateur de déplacement des masses d’eau du filament d’upwelling se justifie par sa prépondérance dans le secteur étudié et l’importance de sa variation saisonnière (Fig. 5).
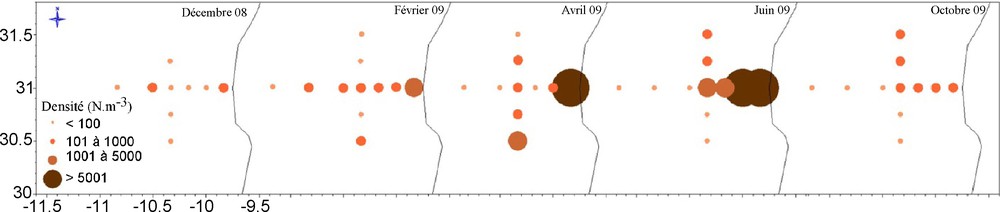
Distribution spatiotemporelle de la densité d’Acartia clausi (ind.m−3).
En décembre, A. clausi présente des densités très faibles sur les deux radiales en comparaison avec les autres périodes (1 à 168 ind.m−3). En février, on observe clairement et à la fois un gradient décroissant côte-large (allant de 1484 à 16 ind.m−3) et un gradient croissant nord-sud (st 11 : 77 ind.m−3 et st 12 : 107 ind.m−3). En avril, cette espèce renforce son abondance le long de la radiale méridionale selon le même gradient (st 1 : 6561, st 7 : 203 ind.m−3). Sa plus forte densité (1633 ind.m−3) est observée au niveau de la station 12 à l’extrémité sud de la radiale latitudinale. En juin, ce copépode est fortement abondant dans la zone côtière avec des densités atteignant 248 805 ind.m−3. Sur la radiale nord-sud la situation est inversée. Les plus fortes abondances sont observées au nord (419 ind.m−3 au niveau de la station 9 et 715 ind.m−3 dans la station 10). En octobre, la densité de cette espèce diminue, la valeur maximale (675 ind.m−3) est enregistrée à la station 3. Par ailleurs, les stations du nord (9 et 10) maintiennent leur forte richesse par rapport à celles du sud.
3.5 Analyse numérique des données
Les partitions de l’espace des stations de prélèvements, obtenues par le cadrage multidimensionnel non métrique (NMDS), sont réalisées avec des résultantes de stress très faibles (0,04 ; 0,04 ; 0,1 ; 0,04 ; 0,05 respectivement pour les prélèvements de décembre, février, avril, juin et octobre). Ces partitions sont en accord avec les résultats de l’analyse hiérarchique.
En décembre, la station 1 s’individualise en tant que station côtière. Les stations 2, 3 et 4 forment un groupe intermédiaire homogène, avec une ressemblance aux stations 6 et 12. Les stations 10 et 11 forment un groupe plus loin de la zone néritique.
En février, ces analyses ont permis de différencier deux groupes de stations. Le premier groupe est composé des stations les plus proches de la côte, le deuxième regroupe les stations les plus au large.
À partir d’avril, une nette dynamique est signalée par les associations des stations en comparaison avec décembre et février. Les stations côtières 1 et 2 présentent des affinités avec celles du sud (11 et 12) montrant un déplacement d’eau côtière vers le sud. À l’exception de la station 3, le reste des stations (intermédiaires, du large et du nord) forment un groupe homogène.
En juin, deux groupes sont individualisés. L’association de la station 10, située sur la partie nord de la radiale latitudinale, aux stations les plus proches de la côte (1, 2, 3 et 4) témoigne d’un déplacement de l’eau vers le nord.
En octobre, les analyses témoignent de la présence de quatre groupements. Cependant, sur le plan spatial, on peut estimer une tendance selon deux directions : une tendance vers le nord à partir de la côte et une tendance vers le large à partir du sud.
4 Discussion et conclusion
La côte atlantique marocaine est soumise à l’action des remontées d’eaux froides. Sa situation géographique par rapport au courant des Canaries est influencée par l’un des cinq courants mondiaux générateurs d’upwelling [29]. L’enrichissement en sels nutritifs, en rapport avec ce phénomène saisonnier, favorise la production primaire locale et par la suite la production secondaire. Cela s’est vérifié effectivement lors de cette étude. En décembre 2008, en octobre et surtout en avril et juin 2009, les biomasses du zooplancton fluctuent fortement en fonction de la concentration en chlorophylle « a ». En revanche, en février, la présence de fortes concentrations chlorophylliennes vers la côte et de fortes biomasses zooplanctoniques au large suggère qu’il y a un décalage entre le développement du phytoplancton et celui du zooplancton, surtout qu’il s’agit d’une zone où l’upwelling est saisonnier [30].
Selon plusieurs auteurs [31,32], l’upwelling de Cap Ghir a lieu tout au long de l’année, bien que la remontée s’intensifie au cours de l’été. Effectivement, les températures de surface, aussi bien celles prises in situ que par satellite, sont localement plus basses. Par ailleurs, la structure filamentaire de Cap Ghir est nettement claire à travers les images satellites de la chlorophylle. Cela suppose que l’activité filamentaire au niveau du Cap entraîne les caractéristiques de la côte vers le large à de grandes distances en prenant la forme de méandre. Ce filament se propage à plus de 100 km vers le large suite favorisé principalement par un vent localement modifié par l’inflexion du trait de côte au sud de ce Cap et la présence des îles Canaries [33,34].
Une relation entre les températures de surface et la production biologique (phytoplancton et zooplancton) est observée. La production biologique maximale se produit entre avril et octobre, sachant que les plus basses températures sont enregistrées à partir d’avril. Durant ces périodes actives en termes de production, les biomasses du zooplancton enregistrées sur la radiale 31°N diminuent tout au long de la radiale côte-large. Cependant, elles restent relativement importantes surtout en octobre. Cela suppose une certaine dynamique du filament. Certains auteurs estiment que ces phénomènes à sub-mésoéchelle sont des moyens plus efficaces que le transport d’Ekman pour transférer les eaux des résurgences côtières vers le large [35–37]. D’autres considèrent que la moitié du transport vers le large se passe dans ces structures [38].
L’analyse des échantillons de zooplancton collectés durant les cinq périodes a montré une nette dominance des copépodes (Fig. 6). La dominance de ce groupe est signalée dans plusieurs travaux effectués dans les eaux atlantiques marocaines [28,39–42]. Les copépodes planctoniques représentent généralement une biomasse importante dans les écosystèmes aquatiques côtiers [43–48]. Malgré la dominance des copépodes, le zooplancton de la zone est relativement diversifié et se compose de 18 autres groupes faunistiques.
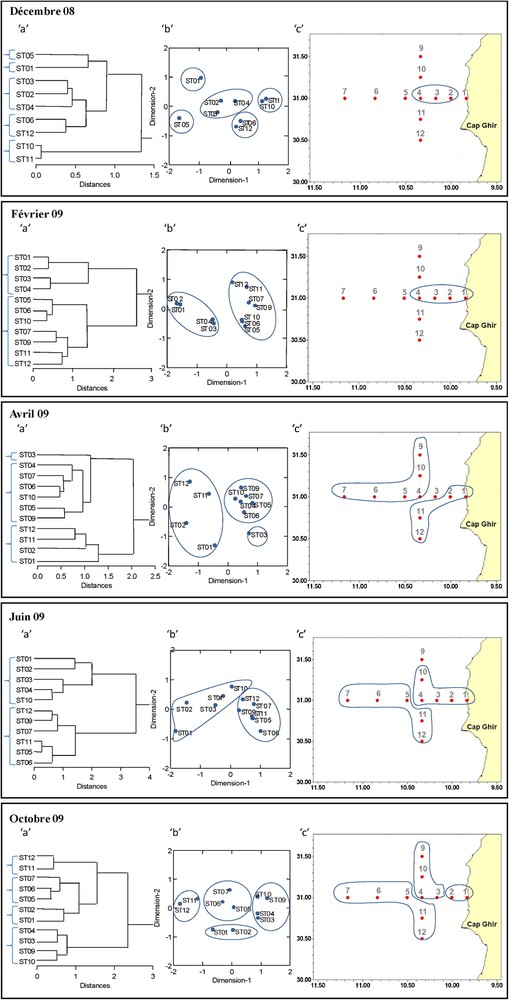
Analyses multivariées réalisées de la matrice d’abondances d’espèces de copépodes. a : classification hiérarchique ; b : analyse NMDS ; c : cartes récapitulatives des groupements de stations.
L’examen du zooplancton a permis le recensement de 86 espèces de copépodes appartenant à 41 genres et 26 familles. La composition définie est similaire à celle décrite par d’autres auteurs le long de la côte atlantique marocaine. Chiahou et Ramdani [40], ont répertorié sur les côtes d’Al Jadida les même espèces : A. clausi, C. helgolandicus et P. parvus. À Agadir, Youssara et al. [42] ont montré qu’A. clausi et P. parvus dominent l’ensemble des copépodes. De même, Somoue et al. [28] ont montré que le peuplement de copépodes entre Cap Boujdor et Cap Blanc est dominé par C. helgolandicus, P. parvus, A. clausi et Corycaeus typicus. L’ensemble de ces travaux fragmentaires rejoignent les résultats de Belfquih [39] sur la composition en zooplancton des eaux de la façade atlantique du Maroc.
Des espèces d’eaux froides comme C. helgolandicus, espèce du large dont la distribution est liée au courant des Canaries [49], Calanoides carinatus, espèce d’eaux froides sub-superficielles [50–52] dont la présence à la surface coïncide avec la saison d’upwelling [53] et Ctenocalanus vanus, espèce superficielle des eaux polaires et tempérées froides [54,55], ont été identifiées principalement en avril et en juin. Ces résultats sont en accord avec ceux obtenus pour les paramètres physicochimiques et témoignent d’une nette remontée d’eaux froides.
L’espèce A. clausi est considérée comme néritique [39,52,56]. En effet, lors de notre étude, cette espèce enregistre des densités côtières très élevées. Cependant, des abondances importantes ont été rencontrées au large, au sud et au nord de Cap Ghir. Ces abondances varient en fonction de la saison, témoignant ainsi, d’une dérive qui peut être engendrée par le filament. La forte abondance d’A. clausi est à mettre en relation avec son affinité pour les eaux organiquement chargées [57–59], son adaptation à toute sorte de nourriture [60] et sa large tolérance aux variations des facteurs du milieu, particulièrement celles de la salinité [61,62]. En l’occurrence, cette espèce est considérée comme espèce sténotherme [63,64]. Sa présence plus au large témoigne clairement d’un déplacement des masses d’eaux. Ce déplacement est dévié vers le sud en février et en avril et vers le nord en juin et en octobre.
L’analyse numérique a permis de visualiser des assemblages de stations variant dans le temps et dans l’espace. Différents groupements de stations ont été distingués. Les stations côtières présentent en avril une certaine ressemblance avec les stations situées au sud de Cap Ghir. En juin et en octobre, ces stations ont des affinités avec les stations situées au nord. Cela est en relation avec les conditions environnementales qui sont liées principalement à la dynamique du filament et aux tourbillons associés. Plusieurs concepts ont été avancés sur les filaments [65]. Dans un certain nombre de cas, il s’agit d’une déformation du jet côtier pour faire un méandre de la taille d’environ 100–300 km [3]. Les filaments constituent alors la partie du méandre allant vers le large. Ils peuvent également être générés par le champ de tourbillons de mésoéchelle dans les régions où le champ de vitesse est dirigé vers le large. Dans le cas de notre étude, deux tourbillons de sens opposés génèrent ce filament et contribuent à la formation ou au maintien d’un jet intense qui entraîne l’eau froide vers le large, au moins jusqu’à 13°W [12,33].
Plusieurs études ayant traités d’autres filaments ont montrés que les biomasses du mésozooplancton [66] et les nutriments [67] sont importants dans tous les espaces touchés par le filament. Ce dernier contribue donc de façon très significative au transport vers le large. À travers cette étude, des extensions ont été mises en évidence par les images satellites de la chlorophylle « a ». La distribution des différentes espèces de copépodes et les analyses multivariées ont permis également de visualiser le trajet du filament en différentes périodes. La distribution de l’espèce A. clausi, espèce néritique recensées au large, témoigne en conséquence de cette dynamique. Ainsi, le schéma de distribution de ces paramètres biologiques suppose qu’ils suivent les deux tourbillons qui gênèrent ce filament [12,33]. Ces structures sont responsables de la dispersion du phytoplancton et du zooplancton, vers le nord et le sud de Cap Ghir.
En conclusion, il est clair que l’impact du filament de Cap Ghir sur la distribution des caractéristiques hydrologiques est considérable. Par ailleurs, les conséquences sur la distribution des composantes biologiques, surtout celle du plancton mérite plus d’études et à des échelles plus fines vu la grande variabilité spatiale et temporelle de ce genre de structure.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.


