Abridged English version
The Algerian freshwater ecosystem is represented mainly by lakes, ponds, small dams, dams and some major wadis. In addition to a significant deficit in water, the ecosystem undergoes major disturbances due to various kinds of pollution, evaporation and water pumping. Under these extreme conditions, the survival of fish stocks becomes difficult. As a result, the Algerian freshwater ichtyofauna is restricted to species adapted to a long drought period.
Algerian inland waters are endowed with a fish fauna that has generated, particularly in recent years, many studies related to its biology, reproduction, growth. For the freshwater Barbus setivimensis, almost no study is done on its parasites hosts. This involves placing the parasite in an ecological context that is influenced by all biotic and abiotic.
In this study, we were interested in the cestodes Ligula intestinalis (Cestoda: pseudophyllidea), an endoparasite of B. setivimensis (Cypriniformes: Cyprinidae), an Algerian endemic freshwater fish. We considered the ecological aspect of the parasite using parasitic ecological indices (prevalence, parasite abundance and intensity) and highlighted the impact of the parasite on fish growth.
Sixty-four specimens of B. setivimensis out of 613 examined were infected with a total of 118 parasites (L. intestinalis), thus an average of two parasites per fish. The results show that the parasite develops generally in the female's abdominal cavities. The prevalence, the abundance and the average parasitic intensity were 10.44%, 0.197 and 1.89 respectively. These results are similar to those obtained in Africa, especially in Egypt (Nile) and in Sudan where the prevalence varies between 7 and 10%.
At the beginning of our study (in June), the prevalence was low (4.54%); it increased gradually to 15.78% in August and reached finally 20.75% in September. This indicates that the number of plerocercoid larvae is higher in mid-summer. The breeding period of B. setivimensis takes place between April and June, which explains the decrease of the prevalence. At that time, the fish population are mature, thus difficult to be infested.
The increase of the prevalence in autumn is probably due to the abundance of the intermediate parasite's host (Mesocyclops) with a density of 148 ind.l−1 on the one hand and to the abundance of young fish, which are easy to parasitize on the other.
The results obtained on the distribution of the parasite's indices in function of the fishes’ size showed that all size classes may be affected at different levels. However, it is the class size [14–18], corresponding to 2 and 3 years, which is the most infested (prevalence: 16.89%) and contains the largest number of parasitic tapeworms. The prevalence decreased to a minimum (3.03%) in the class size [30–34] where only two individuals were infested. This result confirms that infections are high mainly in the early stages of the host's life cycle. No infected fish reaches a length of more than 31.5 cm.
The distribution of the index of parasitation of L. intestinalis, in function of the weight of B. setivimensis, varies between 1.30% and 9.04%, respectively for the weight of 136.5 g and 57.11 g.
The correlation is negative between the index of parasitation and the weight. The Mann-Whitney test carried out between infested B. setivimensis specimens and healthy ones was significant. The index of parasites was more frequent in the lower age groups (83% for age classes 2–3 years and 16% for age classes 4–5 years). L. intestinalis parasites the young fish whose weight does not exceed 150 g, those whose weight is higher than 150 g are less infested.
The physicochemical analysis of the water explained the distribution of the specimens into different categories in the dam of Keddara. This late follows the first two factorial axes of the ACC, representing 78.34% of inertia. This relationship is clearly according to the parameters such as sulfates, magnesium, transparency and conductivity in one side, and the infested fishes on the other side. In contrast, healthy fish are in an intermediate position in relation to the environmental parameters.
Biometrical analysis of the specimens explained the projection of the species on the first two factorial axes of the ACC, corresponding to 94.63% of inertia. In the present study, this analysis showed that the infested fishes are opposed as compared to the size; By contrast, the healthy fish are not correlated with any biometric parameter.
We could not evaluate the effect of the parasite on fish behavior, but several authors have shown that infected fish move to areas with high predation risk. Infested fishes move on the shallow littoral zone or on the surface layers of water.
Our study site is close to the shore (ideal site for harvesting fish) where accumulated fish waste attracts many fish-eating birds, which concentrate on the shore to feed. These birds can easily detect the fish in clear water and lay down their fecal material containing the eggs of parasites that will be ingested by the first intermediate host: Mesocyclops. This condition is fulfilled in our study area: the waters are very clear (materials in suspension very low) and shallow.
The infestation rate varies however depending on many factors: temperature, oxygen content, the mineral composition of water, the species, the age and condition of the specimens. This distribution corresponds to the presence of other factors than the abiotics ones such as: availability of two intermediate hosts, effectiveness of the predation with birds, the transparency (3 to 4 m) and depth (< 13 m) of water.
1 Introduction
En Algérie, l’écosystème dulçaquicole est constitué de lacs, d’étangs naturels, de retenues collinaires, de barrages et de quelques grands oueds. En effet, en plus des conditions climatiques avec un déficit important au niveau hydrique [1], cet écosystème subit de grandes perturbations dues à la pollution de différentes natures, à l’évaporation et au pompage de l’eau. Tous ces paramètres constituent des conditions difficiles pour la survie des ressources halieutiques. De ce fait, l’ichtyofaune des eaux douces algériennes est restreinte aux espèces les plus résistantes qui s’adaptent aux conditions de l’environnement due à la sécheresse estivale. Nous citons comme exemples : l’anguille [2], le Barbeau [3], et la Carpe [4]. Mais ces poissons sont très exposés aux maladies parasitaires. L’habitat confiné, favorisant la transmission rapide des parasites et l’apparition de parasitoses intenses.
Ligula intestinalis est un important cestode parasite de poisson cyprinidae dans les lacs et les réservoirs [5–8]. En Afrique, nous citons l’infection des poissons par les larves cestodes en Egypte (le Nil) et au Soudan et les lacs de l’est Africain [9–12]. Dans le Maghreb, ce parasite est présent chez le gardon en Tunisie [13].
Les eaux continentales algériennes sont dotées d’un faune ichtyologique qui a suscité, notamment ces dernières années, de nombreux travaux se rapportant à sa biologie, sa reproduction, sa croissance. En revanche, sur le plan parasitologique, on peut considérer que toute recherche concernant ces hôtes dulcicoles est presque inexistante sur B. setivimensis.
Il s’agit de placer le parasite dans un contexte écologique, à savoir l’influence de tous les facteurs biotiques, abiotiques, compétitions parasitaires, etc.
Dans le cadre de cette étude, nous nous sommes intéressés aux cestodes pseudophyllidae L. intestinalis endoparasite de B. setivimensis (poissons Cyprinidae), poisson endémique des eaux douces Algériennes.
Nous traitons l’aspect écologique du parasite en utilisant des indices écologiques parasitaires (prévalence, abondance et intensité parasitaire) et faisons ressortir l’impact du parasite sur la croissance du poisson.
L. intestinalis (L., 1758) est un pseudophyllidea cestode qui, au stade plerocercoide, infeste une gamme d’espèces de poissons d’eau douce [14], en particulier les Cyprinidae comme second hôte d’accueil après le copépode de genre Mesocyclops [15]. Elle a une large diffusion dans tout l’hémisphère nord [16]. Le stade plerocercoide infectieux est d’une grande association avec les poissons et les oiseaux qui servent d’hôte définitif.
La présence de ce parasite au stade plerocercoide a été démontrée par de nombreux chercheurs qui l’ont associée à certains effets pathologiques dans le poisson hôte [17–19]. Ces effets pathologiques comprennent principalement l’inhibition de développement des gonades dans le poisson hôte [19]. Ainsi, Ligula peut jouer un rôle dans le règlement de leurs poissons hôtes et peut créer des modifications morphologiques et comportementales dans le poisson infesté. Le parasite Ligula présente d’excellentes compétences de dispersion et peut être amené dans d’autres lacs par les oiseaux migrateurs.
2 Milieu d’étude
Le barrage de Keddara est définit par les coordonnées Lambert de 36°38′59,06′′ de latitude nord et 3°25′01,38′′ de longitude est (Fig. 1) [20], et 1047 m d’altitude, est situé au pied nord de l’extrémité est de l’Atlas Mitidjien [21].
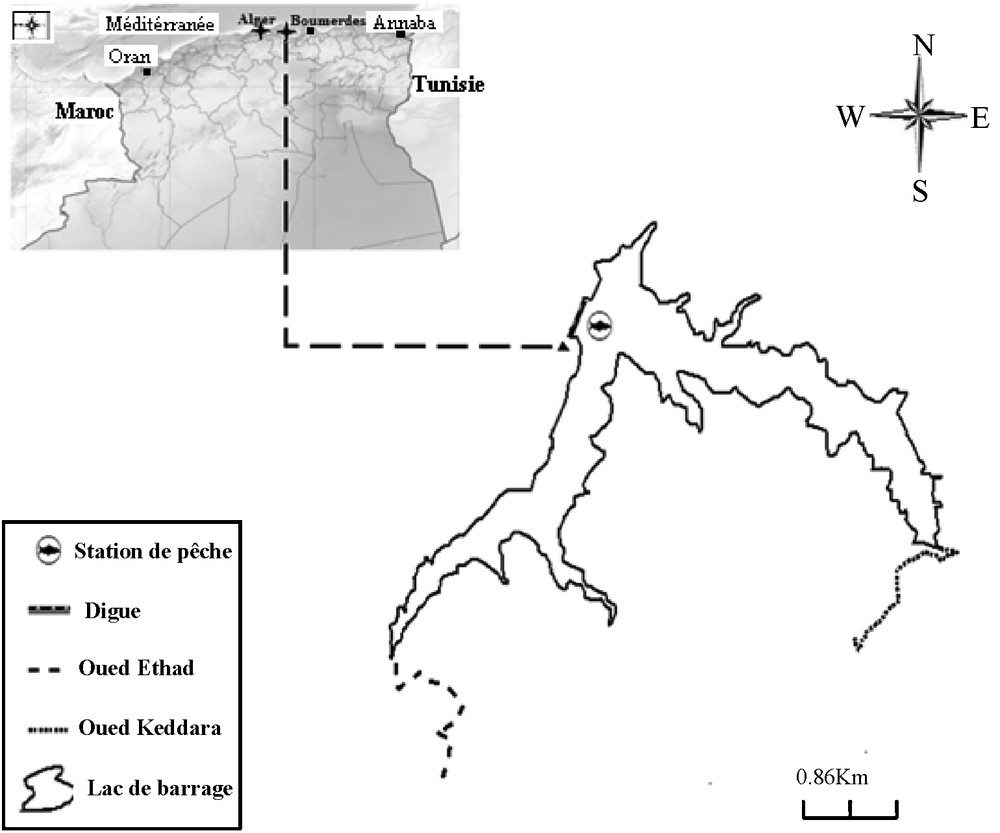
Situation géographique du barrage Keddara, échelle 1/50 000.
Le barrage de Keddara est alimenté à partir de trois sources : les affluents des oueds Keddara, El Haad, et Isser, les transferts des eaux excédentaires du barrage Hamiz, et les transferts pompés du barrage Beni-Amrane [22].
La surface du bassin versant est de 93 km2, la superficie de la retenue est de 3,76 km2, la profondeur moyenne est de 28 m et la maximale est de106 m.
La période sèche s’étale de la fin du mois de mai jusqu’à la mi-octobre, tandis que la période humide, elle s’étend de la mi-octobre jusqu’à la fin du mois de mai. Le barrage de Keddara est situé dans l’étage bioclimatique Sub-humide à hivers frais. Le mois le plus chaud est le mois d’août (32,65 °C) et le mois le plus froid est le mois de février (5,36 °C).
3 Matériels et méthodes
3.1 Prélèvement et échantillonnage
Des prélèvements mensuels ont été effectués durant une année (juin 2006–mai 2007). La pêche a été effectuée à l’aide de deux filets trémail. Chaque filet est caractérisé par une longueur de 50 m et une hauteur de 1,50 m. Les sorties sur les terrains ont été effectuées pendant deux jours ; le premier jour a été réservé à la mise en place des filets dans la station d’étude, le soir avant le coucher du soleil ; le second jour a été réservé à la récupération des poissons, le matin au lever du soleil.
Parallèlement, à l’échantillonnage du matériel biologique, le prélèvement d’eau a été effectué pour réaliser des études physicochimiques tels que : température (°C), pH, salinité (%), conductivité électrique (μs/cm), potentiel redox et l’oxygène dissous (mg/l) sont réalisés in situ à l’aide d’un analyseur multiparamètre (de type Multi 340 i Set wtw). La transparence et la profondeur (m) ont été mesurées avec le disque de Secchi. Pour les MES et les paramètres chimiques tels les chlorures (mg/l), calcium (mg/l), magnésium (mg/l), sels nutritifs (mg/l) : nitrates, nitrites, sulfates et phosphores, les méthodes classiques (gravimétrique, titrimétrique, etc.) ont été utilisées [23].
3.2 Traitement des échantillons
3.2.1 Poissons
Les poissons pêchés ont été étudiés le même jour de la récolte. Pour chacun des poissons récoltés, les mensurations : longueur totale (LT), longueur à la fourche (LF), longueur standard (LS), poids total (WT), poids éviscéré (We), poids des gonades (Wg) et poids des parasites (Wp) ont été enregistrés et le sexe a été déterminé par l’examen macroscopique des gonades. L’estimation de l’âge a été effectuée par scalimétrie sur des écailles prélevées. La détermination spécifique des poissons a été effectuée à l’aide des documents [24,25].
3.2.2 Parasites
Pour prélever les parasites, nous avons incisé les poissons au niveau de l’orifice ano-urogénital jusqu’à la ceinture scapulaire. Nous avons dégagé le parasite de la cavité abdominale (au niveau des gonades), le nombre de larves a été comptabilisé et ces dernières mesurées : le poids, la longueur et la largeur. Les parasites ont été conservés dans des piluliers contenant de l’alcool à 70°. Les cestodes ont été identifiés selon Van Dobben [26].
Pour cette étude, nous avons utilisé les indices parasitaires qui ont été définis par Kennedy et Burrough, Bush et al. et Margolis et al. [27–29].
3.2.2.1 Prévalence (P)
Rapport du nombre d’hôtes infestés par une espèce donnée de parasite sur le nombre d’hôtes examinés ; elle est exprimée en pourcentage : P = n/h, où h = l’effectif de l’échantillon d’hôte ; n = nombre d’hôtes parasités.
3.2.2.2 Abondance parasitaire (A)
Rapport du nombre total d’individus d’une espèce de parasite (p) dans un échantillon d’hôtes sur le nombre total d’hôtes (infestés ou non infestés) dans l’échantillon (h). C’est le nombre moyen d’individus d’une espèce de parasite par hôte examiné : A = p/h.
3.2.2.3 Intensité parasitaire moyenne (I)
Rapport du nombre total d’individus d’une espèce de parasite dans un échantillon d’hôtes (p) sur le nombre d’hôtes infestés dans un échantillon (n). C’est donc le nombre moyen d’individus d’une espèce parasite par hôte parasité dans l’échantillon : I = p/n.
3.2.2.4 Indice de parasitation (parasitation index) PI
C’est le rapport entre le poids du parasite (Wp) sur le poids du poisson (W) moins le poids de parasite (WP) ; il est exprimé en pourcentage [30] : PI = [WP/(W–WP)].
3.3 Analyse des données
Le traitement des données a été analysé par des méthodes statistiques. L’étude des populations de poissons sains et parasités a pour but d’analyser certaines variables morphologiques (poids, taille) afin de comparer ces deux populations.
3.3.1 Test de Mann-Whitney
Le test de Mann-Whitney est un test non paramétrique d’identité portant sur deux échantillons indépendants issus de variables numériques ou ordinales. Ces deux échantillons peuvent contenir des nombres différents d’observations ou même faire référence à deux variables différentes.
3.3.2 Analyses statistiques
Afin de préciser cette relation entre facteurs écologiques et distribution des poissons, nous avons réalisé une analyse canonique des correspondances (ACC), afin de mettre en évidence des axes d’ordination qui maximisent directement les relations éventuelles entre la composition des espèces et l’environnement du site :
- • relation poissons : paramètres qualitatifs (ou biométriques) ;
- • relation poissons : paramètres abiotiques environnementaux.
4 Résultats
Dans cette étude, un total de 613 poissons (B. setivimensis) a été examiné dont 64 individus sont parasités avec un effectif de 118 parasites (L. intestinalis). Généralement, les résultats obtenus démontrent que le parasite se développe dans les cavités abdominales femelles. La prévalence est de 10,44 % de l’ensemble de l’échantillon de B. setivimensis, l’abondance est de 0,19 et l’intensité moyenne parasitaire est de 1,89 (Tableau 1).
Prévalence, abondance et intensité parasitaire de Ligula intestinalis chez Barbus setivimensis.
| Parasite | Nombre de poissons examinés : h | Nombre de poissons parasités : n | Nombre de parasites : p | Prévalence n/h × 100 |
Abondance parasitaire p/h |
Intensité parasitaire p/n |
| Ligula intestinalis | 613 | 64 | 118 | 10,44 % | 0,197 | 1,89 |
4.1 Variations mensuelles des indices parasitaires
4.1.1 Prévalence
L’analyse de la variation mensuelle de la prévalence parasitaire est présentée dans le Tableau 2.
Fluctuations mensuelles et saisonnières des indices parasitaires de Ligula intestinalis chez Barbus setivimensis dans le Barrage de Keddara et répartition de cet indice en fonction du poids.
| h | n | p | n’ | P % | A | I, P | Poids | I.P% | |
| Juin | 44 | 2 | 5 | 42 | 4,54 | 0,11 | 2,5 | 136,5 | 1,30 |
| Juillet | 47 | 3 | 6 | 44 | 6,38 | 0,12 | 2,0 | 57,11 | 9,04 |
| Aout | 38 | 6 | 6 | 32 | 15,78 | 0,15 | 1,0 | 91,5 | 1,53 |
| Septembre | 53 | 11 | 18 | 42 | 20,75 | 0,33 | 1,63 | 114 | 3,05 |
| Octobre | 76 | 09 | 16 | 67 | 11,84 | 0,21 | 1,77 | 93,6 | 2,49 |
| Novembre | 53 | 5 | 14 | 48 | 9,43 | 0,26 | 2,8 | 90,4 | 6,72 |
| Décembre | 50 | 6 | 14 | 44 | 12,00 | 0,28 | 2,33 | 94 | 8,22 |
| Janvier | 42 | 7 | 15 | 35 | 16,66 | 0,35 | 2,14 | 82,57 | 5,40 |
| Février | 76 | 5 | 9 | 71 | 6,57 | 0,11 | 1,8 | 82,4 | 4,29 |
| Mars | 43 | 5 | 6 | 38 | 11,62 | 0,13 | 1,2 | 136 | 2,8 |
| Avril | 45 | 3 | 6 | 42 | 6,66 | 0,13 | 2,0 | 110,23 | 5,80 |
| Mai | 46 | 2 | 3 | 44 | 4,34 | 0,06 | 1,5 | 73,6 | 6,62 |
| Total | 613 | 64 | 118 | 549 | – | – | – | – | – |
| Été | 129 | 11 | 17 | 118 | 08,52 | 0,13 | 1,54 | 95,03 | 3,95 |
| Automne | 182 | 25 | 48 | 157 | 13,73 | 0,26 | 1,92 | 99,33 | 4,08 |
| Hiver | 168 | 18 | 38 | 150 | 10,71 | 0,22 | 2,11 | 86,32 | 5,91 |
| Printemps | 134 | 10 | 15 | 124 | 07,46 | 0,11 | 1,50 | 113,27 | 5,06 |
La prévalence de 100 % indique un très fort taux du parasitisme. L’échantillon étant important, nous pouvons affirmer que tous les Barbeaux du barrage ne sont pas parasités. En effet, l’effectif récolté (613 individus) durant une année nous laisse supposer que les poissons infestés sont très faibles par rapport au total des poissons pêchés. Au début de notre étude (mois de juin), la prévalence était de 4,54 %, puis elle a augmenté progressivement pour atteindre un maximum de 20,75 % au mois de septembre, durant les mois qui suivent, la prévalence a diminué. Au mois de janvier, la prévalence a augmenté jusqu’à 16,66 %, ensuite elle a rechuté pour les mois suivants pour atteindre 4,34 % au mois de mai.
Ainsi, la variation saisonnière de la prévalence parasitaire indique un maximum en automne avec une valeur de 13,73 % et un minimum au printemps avec une valeur de 7,46 %.
4.1.2 Abondance
Les abondances mensuelles suivent la même allure que les prévalences (Tableau 2), le maximum apparaît au mois de janvier avec une valeur de 0,35, et le minimum au mois de mai avec une abondance de 0,06.
4.1.3 Intensité parasitaire
Les résultats obtenus montrent que l’intensité parasitaire moyenne oscille entre 1 et 2,80 (Tableau 2), ce qui indique qu’il existe en moyenne 2 parasites par poisson infesté.
L’intensité parasitaire varie d’un mois à un autre. En effet, on a enregistré la plus grande valeur au mois de novembre (2,80) et la plus petite au mois d’août (1). Ces variations sont probablement dues à la disponibilité importante des poissons parasités pour le premier mois et à la réduction de l’effectif pour le second.
4.2 Variations saisonnières des indices parasitaires
L’examen des indices parasitaires (Tableau 2) montre qu’ils sont nettement plus importants en automne et en hiver. À l’exception de la prévalence, qui est nettement supérieure en automne (13,73 %) par rapport aux autres saisons, nous constatons que les deux indices parasitaires (abondance et indice parasitaire) sont très proches entre les saisons hiver et automne avec respectivement 0,22 et 0,26 pour le premier indice et 2,11 et 1,92 pour le second. Généralement, les indices parasitaires atteignent leur maximum en hiver, a un degré moindre l’automne, ensuite l’été et enfin, le printemps qui présente les plus faibles valeurs.
Le nombre de parasites atteint son maximum pendant la saison automnale, où nous avons récolté 48 parasites contre seulement 15 parasites au cours de la saison printanière.
4.3 Variation de la prévalence parasitaire
4.3.1 Variation de la prévalence parasitaire en fonction des classes de taille
Pour l’appréciation de l’âge des poissons, nous avons opté pour la méthode classique qui consiste à distinguer les différentes classes de tailles. Les prévalences de L. intestinalis sont plus fortes chez les échantillons de la classe de taille [14–18], où il atteint son maximum de prévalence de 16,89 % (Tableau 3). Il diminue pour atteindre son minimum avec une valeur de 3,03 %, à la classe de taille [30–34], où seulement deux individus sont parasités. Ainsi, nos résultats montrent que les infections sont élevées principalement dans les premières phases de la vie de l’hôte (Fig. 3a). Aucun poisson infecté n’atteint une longueur de plus de 31,5 cm.
Répartition des abondances et des prévalences de Ligula intestinalis par classes de taille chez Barbus setivimensis.
| h | n | n’ | p | P% | A | |
| [14–18] | 148 | 25 | 123 | 51 | 16,89 | 0,34 |
| [18–22] | 220 | 18 | 202 | 31 | 8,18 | 0,14 |
| [22–26] | 125 | 15 | 110 | 28 | 12 | 0,22 |
| [26–30] | 68 | 5 | 63 | 6 | 7,35 | 0,08 |
| [30–34] | 33 | 1 | 32 | 2 | 3,03 | 0,06 |
| [34–38] | 12 | 0 | 12 | 0 | 0 | 0 |
| [38–42] | 5 | 0 | 5 | 0 | 0 | 0 |
| [42–46] | 1 | 0 | 1 | 0 | 0 | 0 |
| [46–50] | 0 | 0 | 0 | 0 | 0 | 0 |
| [50–54] | 1 | 0 | 1 | 0 | 0 | 0 |
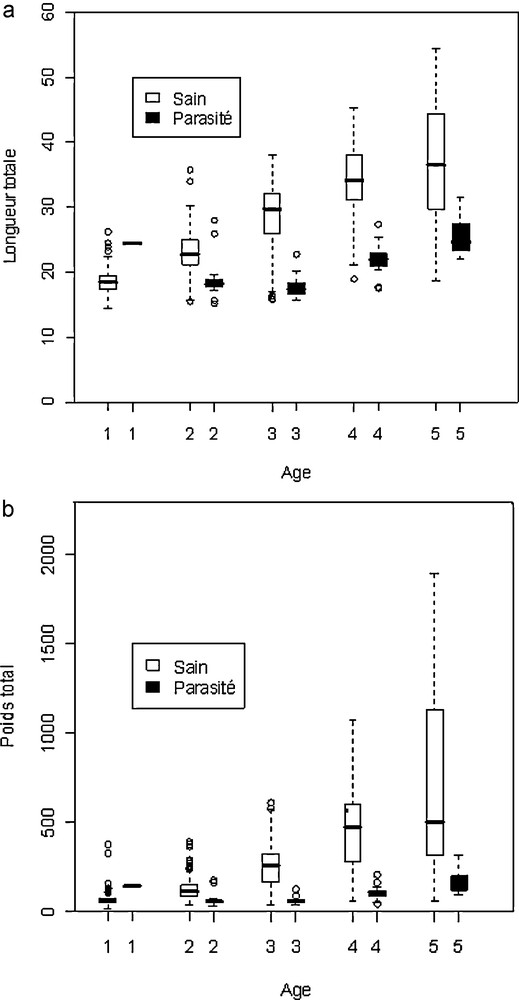
a : comparaison de la longueur entre B. setivimensis parasités et sains. Les tests entre B. setivimensis parasités et sains de chaque année sont significatifs (Mann-Whitney test) ; b : comparaison du poids entre B. setivimensis parasités et sains. Les tests entre B. setivimensis parasités et sains de chaque année sont significatifs (Mann-Whitney test).
D’après la Fig. 3a, le test de Mann-Whitney montre que la différence est significative entre les deux catégories de poissons, les individus de petite taille sont plus exposés au parasitisme que les grands spécimens.
4.3.2 Variation de la prévalence parasitaire en fonction du poids : Indice de parasitation (PI)
La répartition de l’indice de parasitation de L. intestinalis en fonction du poids de B. setivimensis présente des valeurs qui varient entre 1,30 % et 9,04 % respectivement pour les poids 136,5 g et 57,11 g. La corrélation est négative entre l’indice de parasitation et le poids (Fig. 2). Le test de Mann-Whitney réalisé entre B. setivimensis parasités et sains est significatif (Fig. 3b). Le poids de tous les poissons parasités varie entre 57,11 et 136,5 g, au-delà de 150 g, les poissons n’ont pas été infectés par L. intestinalis. L’indice de parasitation est plus fréquent dans les groupes d’âges inférieurs (83 % pour les classes d’âge deux à trois ans et 16 % pour les classes d’âge quatre à cinq ans). L. intestinalis parasite les jeunes poissons dont le poids ne dépasse pas 150 g, ceux dont le poids est supérieur sont moins infestés.
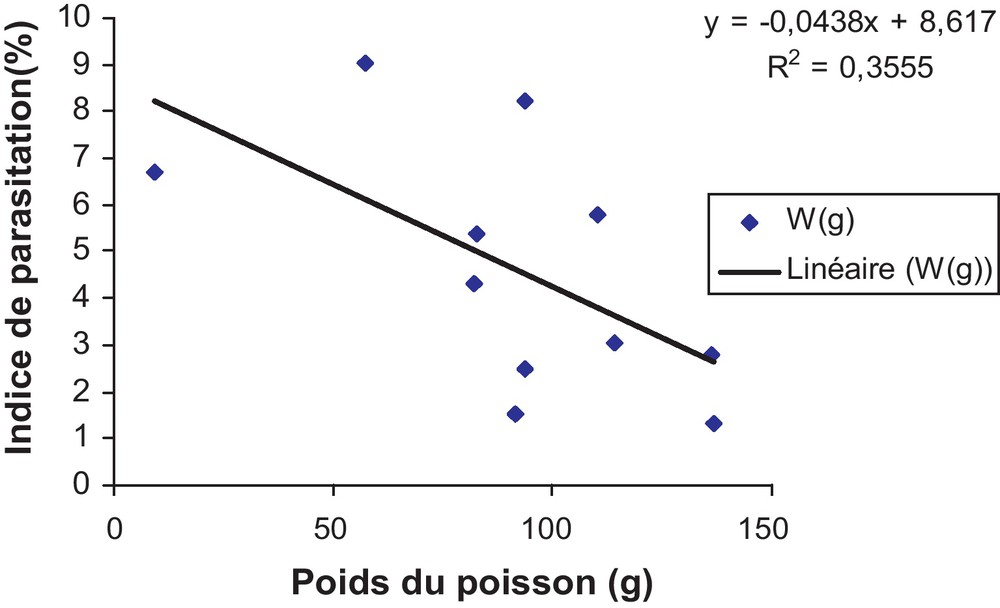
Corrélation entre l’indice de parasitation (PI) de Ligula intestinalis et le poids du Barbus setivimensis infesté dans le barrage de Keddara.
4.4 Relation poissons–paramètres environnementaux
L’analyse des paramètres physicochimiques de l’eau permet d’expliquer la répartition des différentes catégories d’individus dans le barrage de Keddara, qui se fait selon les deux premiers axes factoriels de l’ACC, représentant 78,34 % d’inertie (Fig. 4).
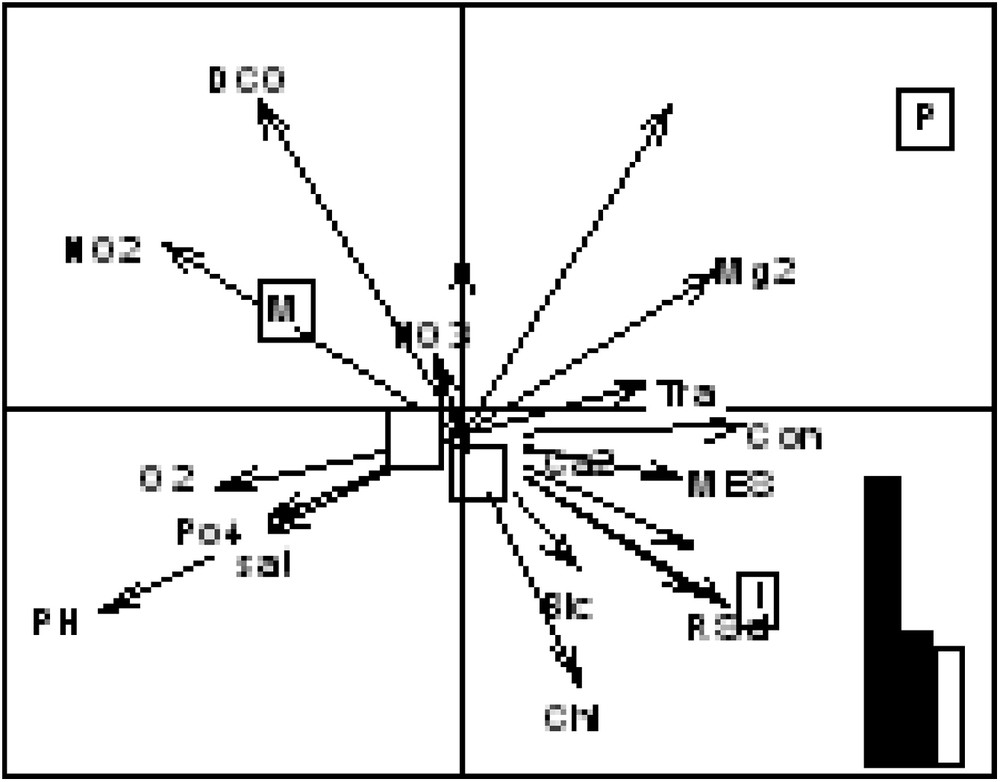
Diagramme d’ordination de l’analyse canonique des correspondances (ACC). Distribution des poissons par rapport aux paramètres environnementaux avec un pourcentage d’inertie de 78,34 %.
Cette relation apparaît correctement avec, d’une part, les sulfates, le magnésium, la transparence et la conductivité et, d’autre part, avec les poissons parasités.
En revanche, les poissons sains se trouvent dans une position intermédiaire par rapport aux paramètres environnementaux.
4.5 Relation poissons–paramètres biométriques
L’analyse des paramètres biométriques des individus permet d’expliquer la distribution des espèces, qui se fait selon les deux premiers axes factoriels de l’ACC, correspondant à 94,63 % d’inertie (Fig. 5).
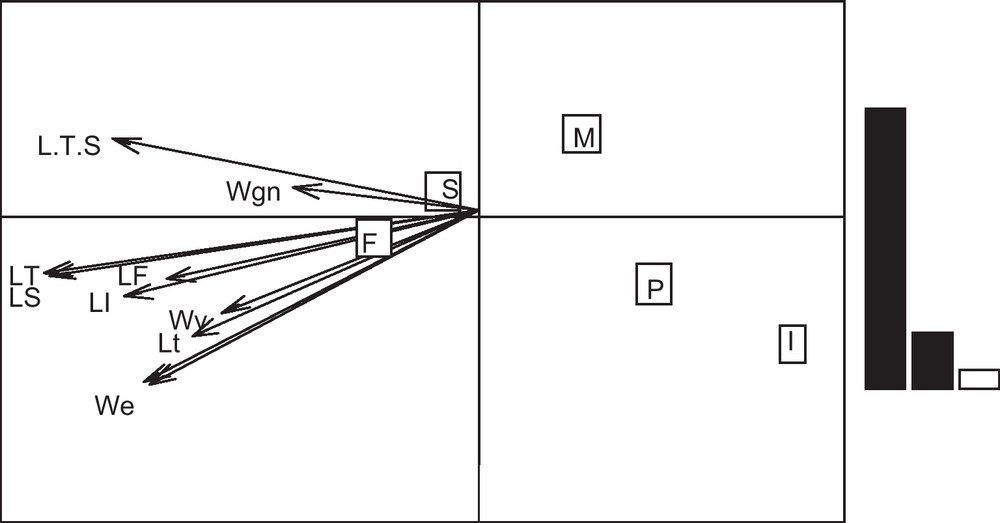
Diagramme d’ordination de l’analyse canonique des correspondances (ACC). Distribution des poissons par rapport aux paramètres biométriques avec un pourcentage d’inertie de 94,63 %.
Dans notre étude, cette analyse permet de constater que les poissons parasités sont opposés par rapport à la taille, en revanche, les poissons sains ne sont pas corrélés avec aucun paramètre biométrique.
5 Discussion
L. intestinalis a été enregistrée dans plusieurs poissons hôtes, les données disponibles sur les paramètres (prévalence, abondance et intensité) de parasitisme au stade plerocercoide sont limitées. Les données disponibles de l’infection de la larve cestode par le poisson en Égypte (le Nil) et le Soudan montrent une prévalence allant de 7 à 10 % [9], ce qui concorde avec nos résultats.
Ce parasite est connu par son infestation de nombreuses ressources en eau douce [14]. Il se trouve dans la cavité abdominale du cyprinidé B. setivimensis et inhibe la reproduction à la fois des mâles et des femelles. La présence de la larve plerocercoide a été démontrée par de nombreux chercheurs qui confirment son association avec certains effets pathologiques dans le poisson hôte [17–19]. Les gonades sont présentes mais restant dans un état immature. Ce phénomène a été signalé à plusieurs reprises par Arme et Owen [18], Mahon [31], Sweeting [32], Bean et Winfield [33], mais le mécanisme de l’action de ce parasite reste inconnu.
La forte dispersion de L. intestinalis par les oiseaux migrateurs dans un lac [34] provoque une augmentation rapide de la population si les conditions sont adéquates, qui à son tour induit un taux de mortalité élevé [35]. Au cours du temps [34], il y aura une diminution de la population à cause du parasite. Au début de notre étude, qui correspond au mois de juin, la prévalence est faible 4,54 %, ensuite on a enregistré une augmentation progressive qui atteint 15,78 % au mois d’août et 20,75 % au mois de septembre, ce qui pourrait indiquer que l’acquisition de larves plerocercoides est plus élevée au milieu de l’été, résultat qui se rapproche de celui de Harris et Weeler [4].
La forte diminution de la prévalence du mois d’avril au mois de juin est peut-être due à la période de reproduction, confirmée par Dejen et al. [36] et de ponte où les individus sont déjà matures donc moins parasités. Nos résultats concordent avec ceux de Kennedy et Fitzmaurice [37], où les infections sont élevées principalement dans les premières phases de la vie de l’hôte, cela est probablement dû au faible effectif des oiseaux qui fréquentent ce site.
L’élévation de la prévalence pendant la saison automnale est probablement due, d’une part, à la disponibilité de l’hôte intermédiaire (Mesocyclops) dont la densité est importante (148 ind/l) durant cette période et qui représente le principal régime alimentaire [38,39] et [40] pour les petits individus et, d’autre part, à l’abondance des jeunes poissons faciles à parasiter.
La diminution progressive de cet indice de l’automne au printemps coïncide avec la période de reproduction [41] où les individus sont matures et aptes à se reproduire, par conséquent, les changements hormonaux peuvent également influer sur L. intestinalis.
Les résultats obtenus concernant l’intensité moyenne (variant entre 1,00 et 3,08) se rapprochent de ceux de Ergonul et Altindag [14].
L’effectif des poissons parasités est maximum en automne (Tableau 2). Les poissons existants durant cette saison sont plus faciles à être infestés, cela correspond au stade plerocercoide. Ce taux élevé d’infestation est probablement dû aux conditions climatiques et, par conséquent, trophiques durant l’année 2006–2007 où l’automne était très chaud par rapport à l’été.
Les résultats de l’étude de la distribution des indices parasitaires en fonction de la taille des barbeaux révèlent que toutes les classes de taille peuvent être touchées à des degrés variables. Cependant, ce sont les barbeaux de classe de taille [14–18] qui sont les plus infestés et abritent le plus grand nombre de vers parasites. Ce résultat confirme que ce sont les petits individus qui sont plus exposés au parasitisme.
Les taux d’infestation de L. intestinalis au sein des classes de taille de l’hôte concordent avec ceux de Kennedy et Fitzmaurice [37], Llyod Morgan [42], Okedi [10] et Ergonul et Altindag [14]. Comme cela a été noté précédemment par Kennedy et al. [34], Loot et al. [8,35], Harris et Weeler [35], nos données suggèrent que L. intestinalis peut avoir un effet inhibiteur sur le développement des gonades (poids moyen des gonades 0,9 g contre 2,67 pour les individus sains), la longueur, le poids des jeunes poissons (deux ans). Cette inhibition n’a pas été observée chez les poissons les plus âgés qui ont atteint la maturité sexuelle ; résultat confirmé par Wotten et Waddell [43] et Whalen et Parrish [44].
Au niveau de notre barrage d’étude, L. intestinalis parasite les jeunes poissons dont le poids ne dépasse pas 150 g, supérieur à ce poids, les individus sont moins infectés. Les travaux de Yavuzcan et al. [45] ont montré que les valeurs varient entre 2,72 et 5,55 %, ceux de Barus et Prokes [46] ont signalé des valeurs de 0,4 à 17,7 %, En revanche, ceux de Ergonul et Altindag [14] ont fluctué entre 0,1 et 7,60 %. Nos résultats sont similaires à ceux rapportés par Ergonul et Altindag [14] et Yavuzcan et al. [45]. À cet effet, les individus à faible poids sont plus exposés au parasitisme que les gros poissons et par conséquent, plus le poids augmente plus le parasitisme diminue.
La Fig. 4 (illustrant la relation des paramètres piscicoles et physicochimiques) a montré une corrélation positive entre, transparence, sulfates, magnésium, conductivité et les poissons parasités, en revanche, les poissons sains sont indifférents pour tous les paramètres. En général, l’analyse des paramètres physicochimiques indique que les eaux de barrage de Keddara sont favorables au développement des cyprinidés [47].
Le taux élevé de Mg2+ est probablement dû à la présence suffisante des sulfates [48]. L’augmentation de la température entraîne l’augmentation de salinité et de la conductivité électrique [49–51]. Ces trois derniers paramètres sont proportionnels entre eux. L’augmentation excessive de la conductivité provoque une perturbation du milieu, elle influe sur la pression atmosphérique qui cause des problèmes chez les organismes aquatiques sensibles [52].
Nous n’avons pas pu évaluer l’effet du parasite sur le comportement des poissons, mais plusieurs auteurs ont démontré que les poissons infectés se déplacent vers des zones à fort risque de prédation. Le poisson infesté s’attarde à la surface [11,53]. Les individus infestés se déplacent sur la zone littorale peu profonde ou sur les couches superficielles de l’eau [54,55]. Notre site d’étude est proche de la rive (site idéal pour la récolte des poissons) où sont accumulés les déchets des poissons qui attirent de nombreux oiseaux piscicoles, qui se concentrent sur le rivage pour se nourrir. Ces oiseaux peuvent facilement détecter les poissons dans l’eau claire [4], et déposent leurs matières fécales accompagnées des œufs des parasites qui seront ingérés par le premier hôte intermédiaire : le Mesocyclops. Cette condition coïncide avec l’état de notre site où les eaux sont très claires (matières en suspension très faibles) et non profondes.
Le taux d’infestation varie toutefois suivant de nombreux facteurs dont la température, la teneur en oxygène, la composition minérale de l’eau, l’espèce, l’âge et l’état des sujets [56]. Cette distribution correspond à la présence de facteurs autres qu’abiotiques tels que : disponibilité des deux hôtes intermédiaires, efficacité de la prédation par rapport aux oiseaux, la transparence (3 à 4 m) et la profondeur (<13 m) de l’eau [11]. Ces observations peuvent résulter d’interaction d’ordre trophique.
6 Conclusion
L’examen des cavités abdominales des barbeaux peuplant le barrage de Keddara révèle la présence de 118 parasites appartenant à l’espèce L. intestinalis infestant 64 B. setivimensis.
Les indices parasitaires relevés au printemps sont, néanmoins, plus faibles que ceux notés en automne. Par ailleurs, la distribution des indices parasitaires en fonction de la taille de l’hôte montre l’existence d’une hétérogénéité dans la colonisation de l’hôte.
La saison automnale semble être la période idéale où toutes les conditions sont réunies pour qu’il ait infestation. Un développement important de parasites en automne est en relation avec l’abondance du premier hôte intermédiaire : les copépodes, d’une part, et, d’autre part, la disponibilité des jeunes individus faciles à parasiter.
L’apparition du parasitisme à partir de la classe [14–18] montre que les infections sont élevées principalement chez les jeunes poissons. En effet, dès les premières phases de leur vie, le parasite s’installe dans la cavité abdominale de l’hôte intermédiaire avant que ce dernier n’atteigne sa maturité sexuelle et les gonades ne se soient encore développées.
L’impact du parasite L. intestinalis sur B. setivimensis apparaît par un retard dans le développement des gonades chez les poissons infectés, même les plus grands spécimens avaient des gonades immatures. Nos résultats ont démontré que L. intestinalis a un effet inhibiteur sur les gonades, la longueur et le poids des jeunes poissons. L’indice de parasitation montre qu’il existe une corrélation négative entre le poids de l’hôte et celui du parasite. L’analyse mensuelle et saisonnière montre une vulnérabilité des poissons parasités vis-à-vis des conditions défavorables du milieu, aux prédateurs et à la pêche.
Le taux d’infection est probablement dû à plusieurs facteurs, liés, d’une part, aux hôtes intermédiaires et définitifs (âge, taille, physiologie de reproduction, régime alimentaire, et, d’autre part, au parasite (durée des différentes étapes de développement entre autre).
Nous avons ainsi déterminé la contribution relative des facteurs abiotiques ou autres au taux d’infection de la faune ichtyologique. Parmi tous les facteurs étudiés, ce sont la température, l’oxygène, la conductivité et la nature géologique du milieu liés aux conditions favorables adéquates à l’apparition du parasitisme.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Remerciements
Nous remercions le Laboratoire « Évolution et diversité biologique », pour sa contribution à la réalisation de cet article.


