1 Introduction
Dans le milieu aquatique, l’un des groupes d’organismes les plus utilisés de nos jours comme bio-indicateurs est le macrobenthos [1–3]. De nombreux avantages, tels que l’ubiquité, la sédentarité, le nombre élevé d’espèces et le cycle de vie relativement long de ces organismes benthiques leur confèrent la meilleure qualité d’intégrateurs continus des conditions du milieu dans lesquelles ils vivent [4,5]. Leur étude permet d’évaluer les répercussions réelles de la pollution et de l’altération des habitats aquatiques et riverains [3]. Un déficit d’informations sur la variabilité de cette faune constitue un handicap dans l’élaboration et la mise en œuvre des politiques de développement durable et de la protection de la qualité des écosystèmes aquatiques [3,5].
Au Bénin, malgré des travaux déjà menés [6,7], l’importance du benthos demeure peu connue. Le présent travail révèle les variations spatiales et saisonnières du peuplement par les organismes benthiques, les paramètres qui expliquent cette distribution et l’état écologique de la lagune de Porto-Novo (LPN).
2 Matériel et méthodes
2.1 Milieu d’étude
La LPN est située au sud du Bénin entre 6°25′–6°30′ N et 2°30′–2°38′ E (Fig. 1). Elle couvre une superficie de 20 à 30 km2 et s’étend sur 6 km de long et de 2 à 4 km de large. À l’est, elle est reliée à la lagune Lagos et, à l’ouest, au lac Nokoué par le canal Totchè. Elle est reliée au système fluvial par le delta de l’Ouémé. Le climat est de type équatorial : une grande saison pluvieuse (GSP) de mi-mars à mi-juillet, une petite saison pluvieuse (PSP) de mi-septembre à mi-novembre, une grande saison sèche (GSS) de mi-novembre à mi-mars et une petite saison sèche (PSS) de mi-juillet à mi-septembre. La température annuelle moyenne est de 27,8 °C. La pluviométrie est de 245 mm en GSP, de 144 mm en PSP, de 44 mm en PSS. Sur la lagune, la pêche est pratiquée par plus de 5500 personnes qui utilisent divers engins et méthodes dont celle des « acadjas », parcs en branchages implantés dans l’eau. Une deuxième activité en plein essor, l’exploitation du sable lagunaire produit plus de 100 000 t de sable par an. La LPN supporte les déchets de l’usine de fabrication de savon à Agbokou. Une végétation longe la lagune. On note également la présence d’une végétation flottante. Dans le canal de Totchè, on rencontre quelques vestiges de mangrove et des arbres plantés.

Lagune de Porto-Novo et stations d’échantillonnage.
2.2 Échantillonnage du benthos
L’échantillonnage des macroinvertébrés a été réalisé de juillet 2007 à juin 2009, en quatre saisons hydrologiques par an, sur quatre stations (Fig. 1) distantes d’au moins 3 km les unes des autres et regroupant chacune trois points de collecte distribués le long de la LPN, suivant un gradient de salinité et d’intensité des activités anthropiques. De l’amont à l’aval, ces stations sont : le canal Totchè (to1), le débarcadère Djassin (pdj), les Acadjas (Pn5) et Face Douane (pnd).
Les macroinvertébrés benthiques ont été collectés aux 12 points des quatre stations. Ont été utilisés une benne de type Ekman (surface = 0,0225 m2) pour les prélèvements de sédiment au fond de la lagune et un filet de type troubleau, muni d’un manche, pour le prélèvement des sédiments au niveau des zones où les accès sont difficiles. À chaque point de collecte, cinq coups de benne et deux coups de filet ont été donnés. Les prélèvements ont été lavés à l’eau lagunaire dans un tamis (maille : 1 mm). Le refus a été renversé dans un bocal et fixé au formol à 5 %. Les bocaux ont été étiquetés. Au laboratoire, les organismes ont été triés sous une loupe binoculaire et séparés selon leur apparence morphologique. Les organismes séparés ont été conservés dans des piluliers contenant de l’alcool à 70 % et étiquetés.
Par un examen minutieux à la loupe, les taxons ont été déterminés à l’aide des clés d’identification, jusqu’au niveau espèce si possible.
De la même façon, entre six et dix heures, à chaque station, la température, la salinité, l’oxygène dissous, le pH, la transparence, la profondeur, le total dissolved solids (TDS), la conductivité et la vitesse du courant de l’eau ont été mesurés in situ. Le taux d’oxygène dissous et la DBO5 ont été déterminés par la méthode Winkler. La vitesse en surface (Vs) de l’eau a été déterminée comme la distance parcourue (1 m) par un flotteur rapportée au temps moyen (s). Des sédiments collectés et ramenés au laboratoire ont permis de déterminer les fractions du substrat au moyen [8].
2.3 Traitement des données
Les données de présence–absence du peuplement macrobenthique ont été analysées à l’aide des cartes auto-organisatrices self-organizing maps (SOM) ou cartes de Kohonen [9]. Cette technique de classification est capable de montrer des patrons simplifiés à partir des bases de données complexes en identifiant des groupes semblables [10]. À la différence des méthodes conventionnelles telles que l’analyse en composantes principales (ACP), la méthode SOM tient compte des espèces rares souvent contenues dans les bases de données écologiques [11] et la formation des groupes est faite sans hypothèse a priori. Cette méthode a été utilisée pour ordonner les échantillons en fonction des assemblages d’espèces. Une fois la carte obtenue, un algorithme d’analyse de classification hiérarchique (CAH) basée sur la méthode Ward comme critère d’agrégation et la distance euclidienne permet ensuite de mettre en évidence des assemblages d’objets réels sur la carte [12]. Ces regroupements se font sur la base des similarités entre les échantillons projetés dans les cellules de la carte SOM. L’analyse a été effectuée avec l’interface SOM toolbox (version 2) pour MATLAB.
L’analyse factorielle discriminante (AFD) a été appliquée pour identifier les variables abiotiques qui discriminent au mieux les groupes prédéfinis par la typologie obtenue selon SOM. Ensuite, la significativité de l’AFD est testée par le test de permutation de Monte Carlo (999 permutations). Elle a aussi permis d’avoir le pourcentage de prédiction des groupes de stations retenus. Enfin, le leave-one-out est exécuté pour évaluer la capacité du modèle à prédire, pour chaque groupe prédéfini, l’appartenance de chacune des stations. Le pouvoir discriminant de chaque paramètre a été mis en exergue par le test λ de Wilk. Les tests de Kruskal–Wallis et de Mann–Whitney ont été utilisés pour comparer la richesse taxonomique entre les stations, les saisons et les groupes. Le logiciel STATISTICA version 4.5 a été utilisé.
3 Résultats
3.1 Variables environnementales
Les valeurs moyennes et extrêmes des paramètres environnementaux de la LPN sont présentées dans le Tableau 1.
Valeurs moyennes et extrêmes des paramètres physico-chimiques de l’eau et du substrat de la LPN (période de juillet 2007 à juin 2009).
| Variables | Moy (Min–Max) |
| Transparence (cm) | 34,9 (10–80) |
| Profondeur (m) | 1,8 (0,3–6,0) |
| Température (°C) | 28,1 (25–31,4) |
| pH | 7,2 (5,0–10,2) |
| Salinité (g/L) | 2,3 (0,0–13,3) |
| Conductivité (mS/cm) | 5,3 (0,05–54,8) |
| TDS (g/L) | 2,2 (0,02–10,4) |
| O2 dissous (mg/L) | 5,2 (0,6–13,5) |
| DBO5 (mg/L) | 4,9 (1,8–8,7) |
| Vitesse (cm/s) | 8,9 (0,0–40,0) |
| Sable (%) | 38,7 (0,0–88,2) |
| Argile-Limon (%) | 56,8 (7,4–10) |
3.2 Composition faunistique
La macrofaune de la LPN est composée de 150 espèces réparties en 26 ordres, 91 familles et 131 genres. Trois groupes zoologiques ont constitué 78,5 % des familles et 48,5 % des espèces récoltées (Fig. 2).

Diversité taxonomique de la macrofaune benthique de la lagune de Porto-Novo (période de juillet 2007 à juin 2009).
Dans la LPN, 68 taxons à to1, 65 à pdj, 68 à pn5 et 55 à pnd sont récoltés. Aux stations to1, pdj, pn5 et pnd, la richesse taxonomique a respectivement varié de 12 à 33, 9 à 31, 12 à 49 et 10 à 36 taxons (Fig. 3a) et aucune différence significative (Kruskal–Wallis : p > ,05) n’a été notée. Au cours des saisons PSP, GSP, PSS et GSS, 92, 69, 48 et 55 taxons sont respectivement enregistrés. Les valeurs de la richesse taxinomique ont été différentes (Kruskal–Wallis : p < 0,05) d’une saison à l’autre, sauf entre PSS et GSS (Mann–Withney, p > 0,05) (Fig. 3b).

Variations spatiales (a) et saisonnières (b) de la richesse taxonomique des communautés de macroinvertébrés benthiques récoltées dans la lagune de Porto-Novo. p est la probabilité du test de Kruskal–Wallis.
3.3 Structure du peuplement benthique de la lagune de Porto-Novo
Une carte SOM de 20 cellules (cinq lignes × quatre colonnes) (Fig. 4a) a été retenue pour projeter les 32 échantillons (quatre stations × quatre saisons × deux ans). Le résultat de la CAH a permis de regrouper ces 20 cellules en quatre groupes (I à IV) (Fig. 4b). Chaque groupe (Fig. 4c) est constitué d’échantillons ayant des compositions taxonomiques semblables. Les groupes I et II, pauvres en taxons, sont isolés des groupes III et IV, les plus riches. Le groupe I est composé de 11 échantillons, dont neuf sont issus de la PSP. Le groupe II comprend neuf échantillons issus de PSS et GSS. Le groupe III est composé de quatre échantillons issus de la PSS et le groupe IV de huit échantillons de PSP et GSP. Les groupes I, II, III et IV regroupent respectivement 19, 16, 24 et 38 taxons (Fig. 4d). Ces groupes sont significativement différents les uns des autres (Mann–Whitney : p < 0,01), sauf les groupes III et IV (p > 0,05). Ils sont respectivement prédits à 90 %, 88,9 %, 50 % et 57,1 %, soit globalement à 75 % des échantillons.
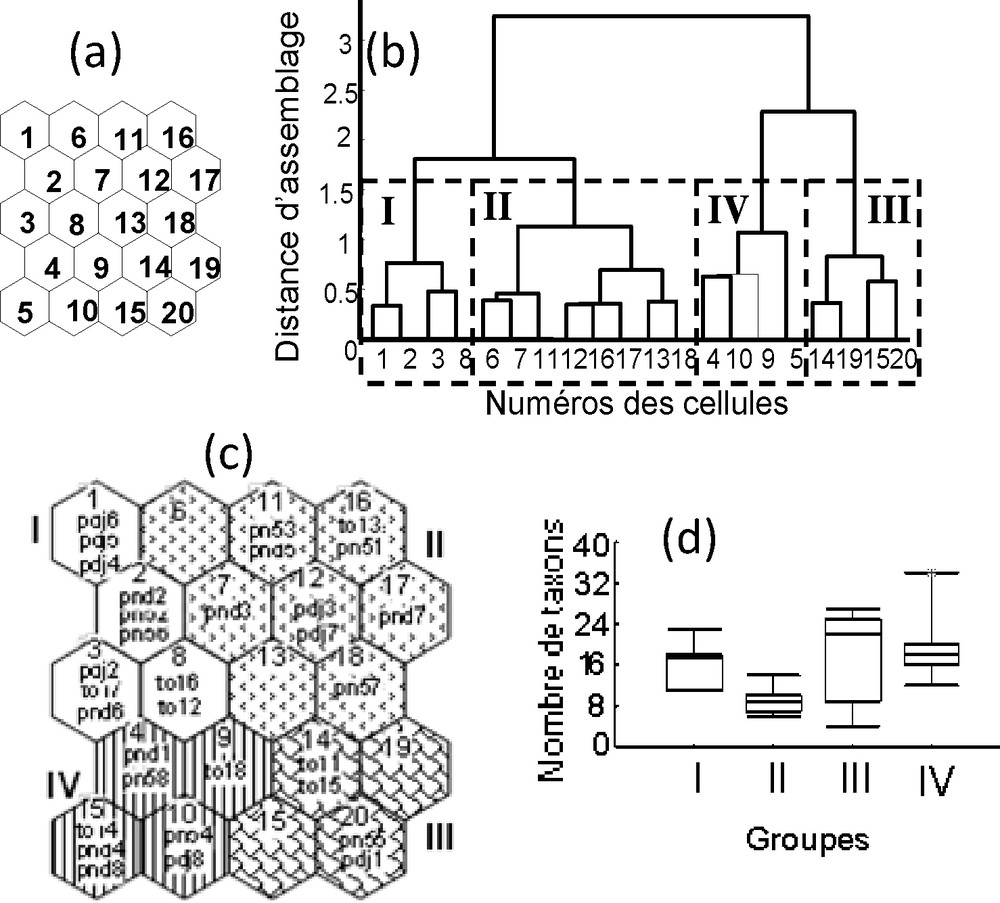
Carte auto-organisatrice de Kohonen (a) et classification hiérarchique des cellules de la carte (b) distribution des échantillons (c) et richesse taxonomique des différents groupes de la lagune de Porto-Novo. Un à 20 correspondent aux numéros de cellules de la carte ; les chiffres romains (I à IV) représentent les groupes retenus.
3.4 Paramètres discriminants
Le groupe I est caractérisé par des valeurs élevées de pH, de profondeur et de DBO5. Le groupe II est défini par les paramètres de minéralisation tels que la conductivité, la salinité et le TDS, d’une part, et la vitesse du courant et la température, d’autre part. Le groupe III se distingue des autres par un substrat à dominance sableuse. Enfin, le groupe IV a regroupé des échantillons avec des concentrations en oxygène dissous plus élevées et des substrats riches en sable.
4 Discussion
La distribution observée révèle deux catégories d’échantillons au premier niveau de la classification, où l’effet saisonier, est plus marqué, avec des échantillons à faible richesse taxonomique (groupes I et II) et des échantillons qui sont riches en taxons (groupes III et IV). Au second niveau de la classification, la structure des communautés macrobenthiques de la lagune se trouve plus influencée par les paramètres de minéralisation et la granulométrie, mettant en exergue un gradient de stress sur les organismes, avec une faune bien différenciée dans les groupes soumis aux perturbations. Ainsi, les échantillons du groupe IV, provenant des stations en amont durant les pluies, regorgent de taxons polluo-sensibles comme les crustacés (Macrobrachium sp.), les mollusques (Corbula trigona, Sphaerium sp., Pisidium sp.), les insectes (Baetis sp., Notonurus sp.) et les Néréides [3,7]. En fait, l’amont est caractérisé par un bon renouvellement des eaux et une bonne oxygénation [13]. Le groupe II regorge de taxons typiques des milieux estuariens. Quant aux groupes I et III de la lagune, constitués des échantillons issus du débarcadère pdj et de l’aval pnd, leur composition taxonomique reflète celle des stations plus perturbées avec une faune riche en taxons polluo-tolérants. En effet, ces stations, proches des lieux d’habitation, sont les lieux enrichis en matières organiques avec les valeurs de DBO5 les plus élevées et, de ce fait, regorgent d’espèces caractéristiques telles que les Polychètes Cirratulidae, les Achètes Glossiphoniidae et les Chironomidae. En réalité, la modification du socle sédimentaire par les bio-dépôts issus des différentes activités anthropiques perturbe les communautés benthiques et la répartition des espèces [4,14]. Toutefois, la présence d’autres taxons polluo-tolérants (Excirolana latipes, Sphaeroma terebrans, Iromura powerly, Tympanotonus fuscatus radula, Tellina sp., Donacia sp., etc.) témoigne d’un milieu stressé au niveau de ces groupes de stations (pdj, pnd), conséquence d’une concentration plus importante de nutriments dans ces zones.
Aussi le nombre de taxons varie-t-il peu d’une station à une autre dans la LPN. Ces résultats traduisent une certaine stabilité de la composition taxonomique de la macrofaune de cette lagune et d’autres [15]. Dans la LPN, les plantes aquatiques sont en permanence présentes et les organismes se sont adaptés au milieu. Mais aussi, du fait de l’anthropisation (exploitation du sable surtout) plus poussée dans cette lagune pendant les périodes de basses eaux, on assiste à une disparition de taxons surtout polluo-sensibles que sont les Crustacés Décapodes, la prolifération de groupes polluo-tolérants tels que les Chironomidae et l’émergence de taxons saprophiles comme les Physidae, les Hydrobiidae, les Bythiniidae et les Lumbricidae [16]. Selon [1], les espèces sensibles sont réduites quand la qualité de l’eau se détériore. Le changement de la bathymétrie de la LPN, l’implantation anarchique des acadjas et la mariculture engendrent des menaces sur la biodiversité. Comme conséquence, la communauté change de composition selon la nature du milieu plutôt que selon la richesse taxonomique [1].
Les résultats ci-dessus révèlent, le long de la lagune, des perturbations environnementales dont l’intensité est plus forte au niveau des zones proches des lieux d’habitations.
Déclaration d’intérêts
Les auteurs n’ont pas transmis de déclaration de conflits d’intérêts.


