Abridged English version
Coastal lagoons are considered to be highly productive ecosystems, but are vulnerable to human disturbance as a result of their semi-enclosed situation and their proximity of the sources of terrestrial effluents. Monitoring surveys are therefore necessary to implement effective management and conservation measures. The Merja Zerga lagoon, located on the Moroccan Atlantic coast, is an example of this type of vulnerable ecosystem concerning a number of environmental issues that have been raised recently. The aim of this study was to assess the quality and the health of the ecosystem using the benthic macrofauna as a bioindicator. Two complementary approaches, based on ecological groups of species, were used here: etho-trophic groups to assess the functional biodiversity and species grouped according to their sensibility to organic enrichment (ecological groups) in order to estimate the intensity of perturbation of these communities. The study involved seasonal sampling in both intertidal and subtidal zones over one year. Sands, muddy sands and sandy muds were the three dominant sedimentary habitats in the lagoon. Among the 147 taxa sampled, most of them were identified to the species level. Eighty-six percent of these species were newly recorded for the site. The sedimentary habitats of the subtidal zone were more diversified than the intertidal, which is an original feature for this type of lagoonal environment. The macrofaunal assemblages were more diversified and structured in sandy muds habitats, both in intertidal and subtidal zones. All the trophic group types were present in the lagoon, but suspension and surface deposit feeders dominated all through the year. Within these two groups, the Bivalves Cerastoderma edule and Scrobicularia plana, respectively, were the most abundant species. The specific diversity within one trophic group is considered to be a good indicator of the potential resilience of the system.
In this study, only species that were both dominant and common were considered; this avoids taking into account the occasional marine species which are unable to develop permanent populations because they are not adapted to estuarine conditions. In Merja Zerga, the number of dominant and common species grouped by trophic guilds showed that the trophic organization of the benthic fauna was dominated by only a few species. Such a feature is a global characteristic of lagoonal communities, which leads to their consideration as perturbed. The reduced representation of the micrograzers and the herbivores could be a weak point of the ecosystem, especially in the case of eutrophication. The disturbance of the macrobenthic assemblages was performed using biotic indices where the Hily (1984) and Borja et al. (2002) models were tested. This study was the occasion to compare these two methods in an Atlantic ecosystem located in a Southern area of the Gibraltar straight. At Merja Zerga, the two models gave the same results. No heavy pollution was identified. The values recorded in biotic indices (Ambi = 2) did not showed seasonality, and the opportunistic species remained at low densities all the year round: consequently the Merja Zerga lagoon can be considered as unbalanced. The values of the biotic indices recorded and the dominance of the ecological group III under natural unbalanced conditions could be characteristic of lagoonal communities, in which species must be tolerant to large variations of environmental factors, including organic matter in the sediment. The results suggest that a combined approach analysing both the variability of the relative dominance of the ecological groups and the BC and Ambi indexes could give the best evaluation of the quality of the benthic community, and in particular when surveying the temporal evolution. However, further work is needed to adjust the position of some lagoonal brackish species with the different ecological groups.
Moreover, the benthic macrofauna survey in the Merja Zerga lagoon shows that the trophic-group analyses are useful to understand the structure and the variability and could be a complementary approach for the biotic indexes, being able to identify the weak points of the community structures. These groups are good indicators of the functional diversity. By crossing the two approaches in the Merja Zerga lagoon, it can be deduced that the benthic ecosystem is of a satisfying quality, despite the human activities.
1 Introduction
Les lagunes côtières occupent 13% de la zone côtière du globe et subissent des influences d'origines naturelles et anthropiques [1]. Elles comptent parmi les écosystèmes les plus productifs de la biosphère [2]. Dans ces écosystèmes, les conditions environnementales, régulièrement changeantes, les qualifient d'environnements stressés [3]. Leur proximité du domaine continental les rend tout particulièrement vulnérables aux perturbations d'origine anthropique [4].
Face à de telles contraintes, la faune macrobenthique est reconnue comme un outil biologique de choix pour tenter de mettre en évidence les perturbations qui affectent les écosystèmes côtiers [5]. C'est en particulier un bon indicateur des conditions écologiques qui règnent à l'interface eau–sédiment, où s'accumulent fréquemment les effets d'un enrichissement organique ou d'une perturbation plus importante du milieu [6].
La lagune de Merja Zerga, située sur le littoral atlantique marocain, constitue un exemple de ces zones côtières vulnérables, puisque de nombreux problèmes environnementaux sont apparus récemment ou risquent de se poser dans un futur proche. Ils sont liés à l'utilisation des ressources naturelles, aux aménagements agricoles dans le bassin versant, aux vidanges des eaux de rizières dans la lagune et aux extensions du village balnéaire de Moulay Bousselham. La faune macrobenthique y occupe une place particulière, puisqu'elle constitue une ressource alimentaire pour les oiseaux limicoles et qu'elle présente pour les poissons un intérêt socio-économique, de par les activités de pêche pratiquées. Un suivi écologique de la composante macrozoobenthique de cet écosystème lagunaire a permis d'établir un état de référence pour ces peuplements et d'identifier les facteurs environnementaux régissant la structure et le fonctionnement des communautés [7,8]. Trois communautés ont été identifiées : les communautés à Cerastoderma edule et à Scrobicularia plana, localisées à la fois en zones intertidale et subtidale et la communauté à Tapes decussata présente, uniquement en zone subtidale. Ces communautés se distribuent le long d'un gradient écologique sans stade de transition et sont contrôlées davantage par les facteurs édaphiques en zone intertidale et par les facteurs hydrologiques en zone subtidale.
La présente étude se fixe l'objectif de caractériser physiquement l'habitat sédimentaire de la lagune de Merja Zerga et d'apporter des données nouvelles sur la composante biotique. Une évaluation écologique des communautés benthiques est conduite en croisant les approches par groupes trophiques et groupes écologiques, en considérant la variabilité spatiotemporelle de la faune benthique [9,10].
2 Matériel et méthodes
2.1 Site d'étude
La lagune côtière de Merja Zerga se situe sur la façade atlantique du Maroc, à 120 km au nord de Rabat (Fig. 1). Elle présente une forme elliptique et recouvre une superficie d'environ 27 km2. Les eaux de la lagune sont un mélange des eaux océaniques apportées par les marées et des eaux douces apportées par l'oued Drader, à l'est, et du canal du Nador, au sud. Le remplissage et la vidange de la lagune se font par l'intermédiaire d'un réseau de chenaux permanents : le chenal principal (chenal I), les chenaux secondaires (chenal II) et les chenaux tertiaires (chenal III) (Fig. 1). Les eaux continentales représentent, en moyenne annuelle, 1 à 2% des eaux qui transitent par la lagune [11]. Les températures des eaux de la lagune varient de 13 à 15 °C en hiver et de 27 à 28 °C en été. Deux principaux ensembles sédimentaires sont reconnus dans la lagune [12]. Le premier, sableux, est d'origine marine. Il est lié à l'action de la houle et des courants de marée et la sédimentation s'effectue essentiellement pendant le flot, dans les zones où le niveau énergétique reste élevé. Le deuxième, de nature envasée, est d'origine continentale et est transporté par l'oued Drader et le canal du Nador. Il se localise dans les zones à faible énergie.
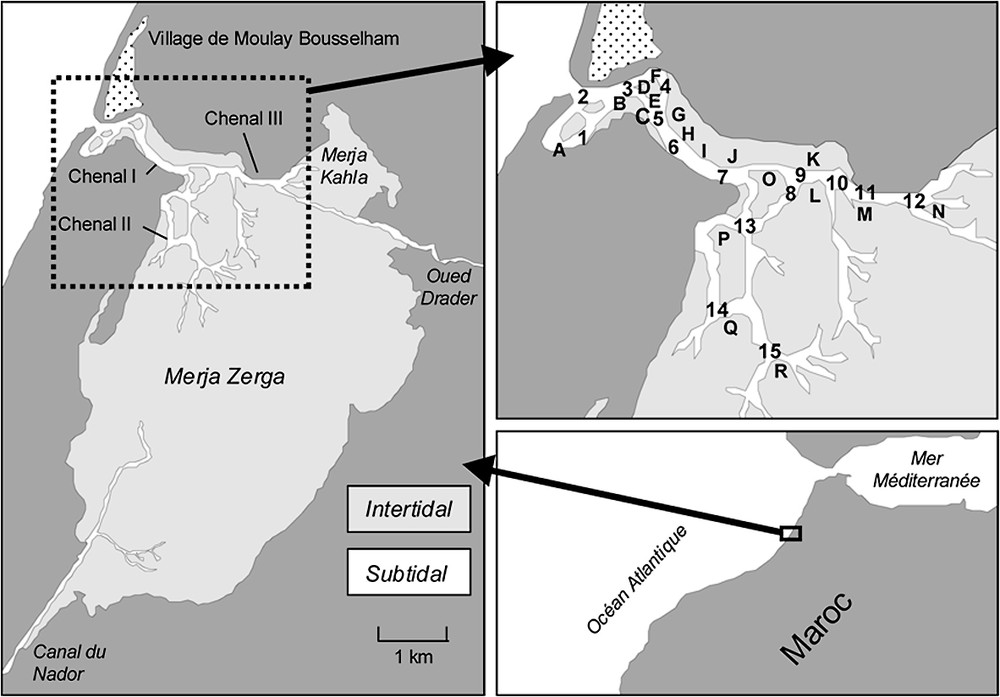
Présentation du site et localisation des stations de prélèvement de la macrofaune et du sédiment. Les lettres de A à R désignent les stations intertidales, les chiffres de 1 à 15 les stations subtidales.
2.2 Échantillonnage et analyses des prélèvements
L'échantillonnage de la macrofaune benthique des substrats meubles a été réalisé en avril 1994 (printemps), juillet 1994 (été), octobre 1994 (automne) et janvier 1995 (hiver). En zone intertidale, 18 stations (A à R) (Fig. 1) ont été échantillonnées à l'aide d'une bêche, sur une surface de 0,25 m2 jusqu'à une profondeur de 20 cm. En zone subtidale, 15 stations (1 à 15) ont été échantillonnées à l'aide d'une drague d'un modèle équivalent à celui employé par Picard [13]. Le tamisage a été effectué sur une maille de 1 mm2. Le refus du tamis est fixé au formol à 8%. Au laboratoire, les refus sont triés et la macrofaune isolée, identifiée et ensuite comptée. La diversité est exprimée suivant le modèle DiMo (Diversity Monitoring) de Quinghong [14], qui tient compte de la richesse spécifique , de la diversité et de l'équitabilité .
Les échantillons de sédiment ont été également prélevés. Les fractions sédimentaires ont été identifiées en utilisant les principes de classification biosédimentaire de Chassé et Glémarec [15]. La matière organique a été estimée par la méthode de perte au feu.
L'étude de la biodiversité fonctionnelle se base sur la classification adoptée par Grall et Glémarec [16], qui repose sur la nature et l'origine de la nourriture, son mode de collecte et le microhabitat exploité : herbivores (H), nécrophages (N), détritivores (Dt), carnivores (C), microbrouteurs (μB), suspensivores (S), déposivores de surface (Ds) et déposivores de sub-surface (Dss). Chaque espèce récoltée a été classée dans l'un des groupes trophiques indiqués ci-dessus, en prenant en considération les données de la littérature [16–25].
Dans chaque groupe trophique, les espèces dominantes (abondance totale > 1%) [26] et les espèces communes (présentes dans plus de 50% des prélèvements temporels) [27] sont utilisées comme indicateurs du groupe.
L'état de dégradation des peuplements a été évalué par la méthode des groupes écologiques et des indices biotiques [22] et par la méthode de Borja et al. [28]. Dans les deux cas, les différentes espèces sont réparties en cinq groupes dits « groupes écologiques », dont les réactions respectives vis-à-vis de l'enrichissement du milieu en matière organique sont considérées comparables (GE I, II, III, IV et V). La définition des indices biotiques (IB) repose sur les proportions respectives de chacun des groupes écologiques (Tableau 1) [22] et [6] et sur le calcul d'un coefficient biotique (Tableau 2) [28].
Définition des indices biotiques (IB 0 à 6) en fonction des pourcentages des groupes écologiques (I à V). Un double indice (0–2 ou 0–4) indique une importance équivalente de deux groupes écologiques [6]
| Groupes écologiques | Indices biotiques | |||||
| 0 | 0–2 | 2 | 0–4 | 4 | 6 | |
| I | >40% | 20–40% | 20–40% | 20–40% | <20% | |
| III | 20–40% | 20–40% | >40% | <20% | 20–40% | <20% |
| IV | <20% | <20% | <20% | 20–40% | >40% | 20–40% |
| V | >40% |
Définition des indices biotiques et des indices biotiques d'après Borja et al. (2000)
| Degré de pollution | Coefficient biotique | Indice biotique | GE dominant | État de santé du peuplement benthique |
| Non pollué | 0,0<BC⩽0,2 | 0 | I | Normal |
| Non pollué | 0,2<BC⩽1,2 | 1 | III | Appauvri |
| Légèrement pollué | 1,2<BC⩽3,3 | 2 | IV–V | Déséquilibré |
| Moyennement pollué | 3,3<BC⩽4,5 | 3 | V | Transition vers pollué |
| Moyennement pollué | 4,5<BC⩽5,0 | 4 | Azoïque | Pollué |
| Fortement pollué | 5,0<BC⩽5,5 | 5 | Transition vers très pollué | |
| Fortement pollué | 5,5<BC⩽6,0 | 6 | Fortement pollué | |
| Extrêmement pollué | Azoïque | 7 | Azoïque |
3 Résultats
3.1 Habitat sédimentaire
Trois catégories sédimentaires sont identifiées : sables (pélites < 10%), sables vaseux (10% < pélites < 30%), vases sableuses (30% < pélites < 80%) et vases (pélites > 80%).
Les sables, sables vaseux et vases sableuses sont les trois types sédimentaires rencontrés dans la lagune de Merja Zerga (Tableau 3). Dans la zone intertidale, les sables sont répartis le long du chenal I. Les sables vaseux et les vases sableuses se rencontrent le long des chenaux I et II. Dans la zone subtidale, les sables sont mieux représentés et se situent au niveau des chenaux I et II. Les sables vaseux et les vases sableuses se localisent dans les chenaux I et II. Les sédiments de la zone subtidale sont plus grossiers que ceux de la zone intertidale.
Caractérisation de l'habitat sédimentaire en fonction des saisons. Les stations indiquées en gras n'ont pas changé de nature sédimentaire durant la période d'étude. Les lettres et les chiffres correspondent respectivement aux stations intertidales et subtidales
| Saison | Types sédimentaires | Stations | Médiane min–max | Pélites (%) min–max | Matière organique min–max |
| Avril 1994 | Sables | A, B, C, D, E, F, H, O | 180–340 | 0,19–3,86 | 1,46–1,92 |
| 1, 2, 3, 4, 6, 8, 9, 12, 13, 15 | 150–380 | 0,25–4,89 | 1,44–2,16 | ||
| Sables vaseux | I, L, N | 115–205 | 11,83–27,40 | 2,52–3,89 | |
| 10, 11 | 120 | 18,20–20,9 | 3,87–6,74 | ||
| Vases sableuses | G, J, K, M, P, Q, R | <63–120 | 36,75–73,42 | 3,89–8,90 | |
| 5, 14 | <63–110 | 39,21–84,6 | 9,87–14,60 | ||
| Juillet 1994 | Sables | A, B, C, D, E, F, H, I, O | 160–370 | 0,45–4,02 | 1,23–2,03 |
| 1, 2, 3, 4, 6, 8, 13, 15 | 180–950 | 0,71–15,1 | 1,48–3,60 | ||
| Sables vaseux | G, N, Q | 115–150 | 17,49–34,06 | 3,25–5,18 | |
| 7, 9, 10, 11 | 135–215 | 1,39–37,1 | 2,35–4,91 | ||
| Vases sableuses | J, K, L, M, P, R | <63–120 | 31,90–72,91 | 5,86–12,60 | |
| 5, 12, 14 | 105–210 | 21,40–42,8 | 7,13–12,20 | ||
| Octobre 1994 | Sables | A, B, C, D, F, H, I, O | 220–325 | 0,66–5,32 | 1,52–2,08 |
| 1, 2, 3, 4, 6, 7, 8, 9, 12, 13, 15 | 150–500 | 0,52–8,17 | 1,18–2,72 | ||
| Sables vaseux | E, G, L, N, Q | 120–205 | 12,32–28,54 | 2,48–5,79 | |
| 8, 10 | 125–140 | 10,50–13,20 | 3,00–3,04 | ||
| Vases sableuses | J, M, K, P, R | <63–120 | 46,73–74,61 | 6,20–12,23 | |
| 5, 11, 14 | <63–115 | 42,20–70,50 | 7,36–13,30 | ||
| Janvier 1995 | Sables | A, B, C, D, E, F, H, I, O | 190–425 | 0,65–6,35 | 1,49–2,02 |
| 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 15 | 140–800 | 0,96–5,27 | 1,10–2,11 | ||
| Sables vaseux | G, L, N | 120–150 | 18,93–23,16 | 3,77–5,38 | |
| 14 | 110 | 34,6 | 6,13 | ||
| Vases sableuses | J, K, M, P, Q, R | <63–120 | 32,77–71,73 | 4,66–10,42 | |
| – | – | – | – |
Selon l'évolution temporelle de la nature sédimentaire, deux groupes de stations peuvent être distingués. Le premier groupe renferme des stations dont la nature sédimentaire est restée stable. Il s'agit en zone intertidale des stations A, B, C, D, F, H et O (sables), des stations K, M, P, R (vases sableuses). En zone subtidale, ce groupe renferme les stations 1, 2, 3, 4, 6, 13, 15 (sables). Le deuxième groupe est constitué de stations dont la nature sédimentaire a changé. Sont inclus dans ce groupe les stations intertidales E, I, L, N (nature sédimentaire variant de sables à sables vaseux) et les stations subtidales 7, 8, 9, 10 (nature sédimentaire variant de sables à sables vaseux), 5, 11, 12 (nature sédimentaire variant de sables à sables vaseux et à vases sableuse) et la station 14 (nature sédimentaire variant de sable vaseux à vase sableuse). Logiquement, les plus fortes valeurs en matière organique totale se situent dans les sédiments les plus envasés.
3.2 Caractéristiques biocénotiques des habitats
Cent quarante-sept taxons sont présents dans les 132 prélèvements biologiques réalisés (Tableau 4). Le modèle DIMO (Fig. 2) permet d'illustrer de manière synthétique l'évolution spatiale et temporelle de la richesse spécifique , de la diversité et de l'équitabilité. Les peuplements intertidaux montrent une dynamique de type 2 (type eveness), où les modifications observées dans la diversité sont en rapport avec les changements de la richesse spécifique, tandis que l'équitabilité reste stable. Les peuplements subtidaux ont à la fois des richesses spécifiques plus élevées et des indices Q plus forts, et montrent une situation de type 4 « non type » où les trois paramètres changent.
Abondances (en %) des espèces dans différents habitats sédimentaires de Merja Zerga ainsi que leur groupes trophiques (CT) et groupes écologiques (GE). Les espèces dominantes et régulières sont respectivement soulignées et suivies du symbole †. Les astérisques indiquent les espèces nouvellement signalées pour le site. Les chiffres 4, 7, 10 et 1 correspondent respectivement à avril 1994, juillet 1994, octobre 1994 et janvier 1995. Les abréviations utilisées pour les CT et GE sont expliquées dans le texte
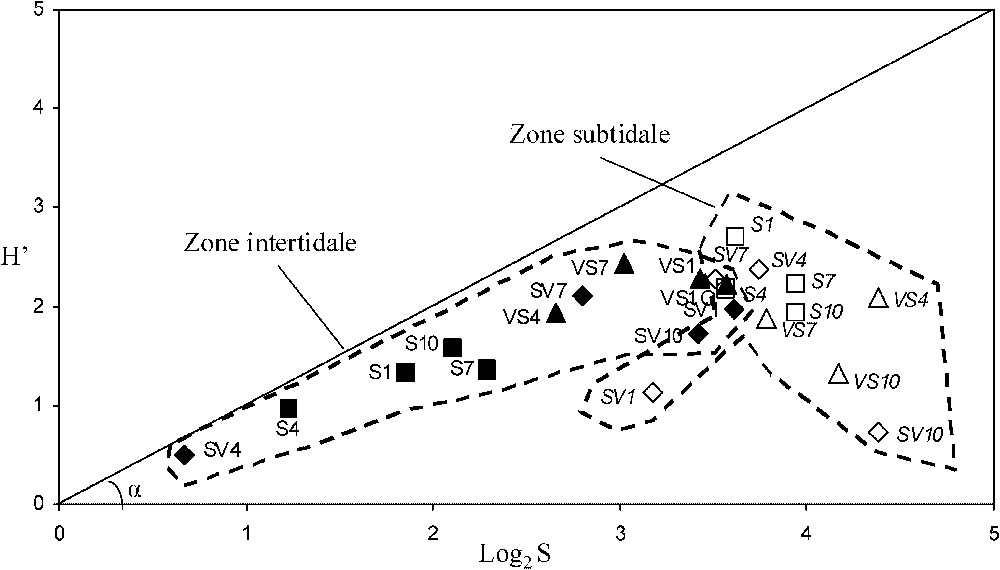
Représentation simultanée de la richesse spécifique , de l'indice de Shannon et de l'équitabilité (angle formé par la droite reliant l'origine et chacun des points « habitats »). Chaque point représente le barycentre du nuage des points « habitats » appartenant à la même catégorie sédimentaire. Chiffres 4 = avril 1994, 7 = juillet 1994, 10 = octobre 1994, 1 = janvier 1995 ; S = sables (carreaux) ; SV = sables vaseux (triangles) ; VS = vases sableuses (losanges) ; figurés pleins = zone intertidale ; figurés clairs = zone subtidale.
En termes d'habitats sédimentaires de la zone intertidale, les vases sableuses hébergent des peuplements plus riches et mieux structurés que ceux des sables vaseux et des sables. En zone subtidale, c'est la situation inverse, avec des sables plus riches et mieux structurés que les sables vaseux et vases sableuses.
L'évolution temporelle des peuplements au sein de chaque habitat sédimentaire (Fig. 3a et b) montre que les richesses spécifiques et abondances totales sont nettement supérieures pour la zone subtidale. En zone intertidale, les peuplements des sables vaseux se caractérisent par un maximum en octobre ; les sables et les vases sableuses montrent des maxima respectivement en juillet et en janvier. En zone subtidale, les abondances totales sont maximales entre juillet et octobre ; les richesses spécifiques sont maximales en octobre pour les sables, en juillet et octobre pour les sables vaseux et en avril pour les vases sableuses.
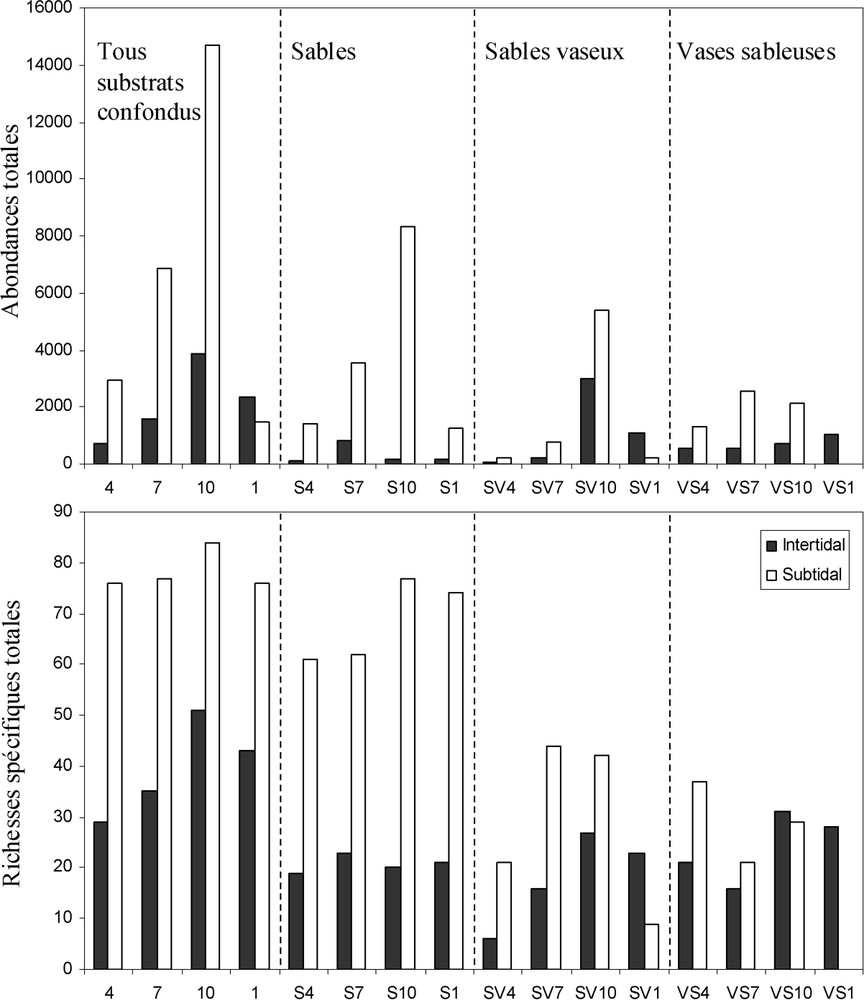
Évolution temporelle des abondances totales et richesses spécifiques totales en fonction des saisons et de l'habitat sédimentaire pour les zones intertidale et subtidale. Les chiffres 4, 7, 10 et 1 correspondent respectivement à avril 1994, juillet 1994, octobre 1994 et janvier 1995. S = sables ; SV = sables vaseux et VS = vases sableuses.
3.3 Structure trophique
Pour un même habitat sédimentaire, le nombre de groupes trophiques qui coexistent est en moyenne de 5 (Tableau 5). Le nombre de groupes trophiques ainsi que leurs abondances relatives sont en moyenne plus élevées en zone subtidale qu'en zone intertidale. Toutefois, seulement un ou deux groupes trophiques dominent (abondance relative supérieure à 25%) au niveau d'un habitat sédimentaire donné. Les suspensivores (S) et/ou les déposivores de surface (Ds) sont dominants. Les suspensivores prédominent généralement au niveau des sables et occasionnellement au niveau des sables vaseux en octobre (zone intertidale) et des vases sableuses en juillet (zone subtidales). Les déposivores de subsurface sont mieux représentés au niveau des sables vaseux et des vases sableuses et occasionnellement au niveau des sables, tout particulièrement au mois d'octobre. Localement et/ou temporairement, d'autres groupes augmentent leur dominance : les déposivores de subsurface (Dss), les détritivores (Dt) et les carnivores (C) en zone intertidale, et les nécrophages (N) en zone subtidale (Tableau 5).
Abondance relative et richesse spécifique totale des différents groupes trophiques par habitat et par saison pour les peuplements benthiques des zones intertidale et subtidale. 4 = Avril 94 ; 7 = juillet 1994 ; 10 = octobre 94 ; 1 = janvier 95. Dans chaque cellule, l'abondance est le chiffre en haut à gauche, le nombre d'espèce est le nombre en bas à droite
La richesse spécifique dans chaque groupe trophique varie, en zone intertidale, entre 2 et 11 pour les sables, entre 1 et 8 pour les sables vaseux et entre 1 et 10 pour les vases sableuses. En zone subtidale, le nombre total d'espèces par groupe trophique fluctue entre 1 et 17 pour les sables, entre 1 et 9 pour les sables vaseux et entre 1 et 14 pour les vases sableuses. Les espèces qui sont à la fois dominantes et communes au sein de chaque habitat (Tableau 4) se répartissent dans six groupes trophiques (carnivores, suspensivores, déposivores de surface et de subsurface, nécrophages et détritivores). Leur nombre par groupe trophique reste faible, puisqu'il varie entre 0 et 4. Il s'agit essentiellement du bivalve suspensivore Cerastoderma edule et du bivalve déposivore de surface Scrobicularia plana, qui sont numériquement les mieux représentés.
3.4 Bioévaluation des structures benthiques
La Fig. 4 illustre les variations des abondances des groupes écologiques GI à GV par type d'habitat et par saison. Les valeurs des indices biotiques obtenues à partir des modèles de Hily (1984) et Borja et al. (2000) ne montrent, ni périodicité, ni saisonnalité, que ce soit pour l'intertidal ou le subtidal, tandis qu'aucun état de pollution évident n'y est défini. Cependant, on note une large dominance des espèces du groupe III (espèces tolérantes) dans tous les habitats sédimentaires. Le modèle de Hily [22] donne des indices biotiques égaux à 2 pour tous les types sédimentaires. Les coefficients biotiques (BC), calculés à partir du modèle de Borja et al. [28], varient entre 1,42 et 3 en zone intertidale et entre 1,87 et 2,92 en zone subtidale. Les indices biotiques qui en résultent sont partout égaux à 2 (Fig. 4). La prise en compte de la dominance respective des cinq groupes écologiques permet de mieux visualiser les rapports entre les différentes situations. Il faut remarquer que les taux de matière organique varient selon le type de sédiment, passant de 1,6 à 2,1 pour les sables fins, de 3,1 à 6,1 pour les sables vaseux et de 6,4 à 12,2 pour les vases (Fig. 4). Par ailleurs, pour un même sédiment, les valeurs sont en moyenne plus élevées en subtidal qu'en intertidal.
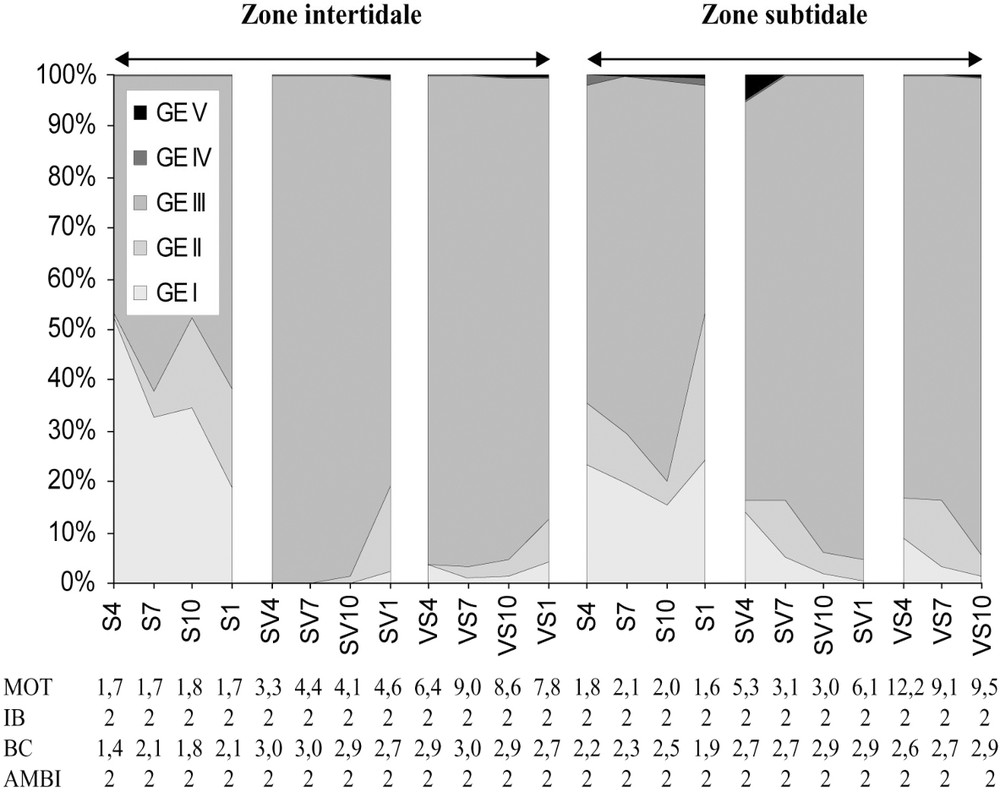
Pourcentages des groupes écologiques (I à V) de la matière organique totale (MOT) et de l'indice biotique (modèle d'Hily) de l'indice biotique (BC) et de l'AMBI de Borja et al. par habitat sédimentaire et par saison au niveau des zones intertidale et subtidale. Les chiffres 4, 7, 10 et 1 correspondent respectivement à avril 1994, juillet 1994, octobre 1994 et janvier 1995. S = Sables ; SV = sables vaseux et VS = vases.
4 Discussion
Les lagunes, milieux de transition à fortes fluctuations environnementales, comportent naturellement des espèces tolérantes (rassemblées dans le groupe III pour les calculs d'indices biotiques), mais le nombre total d'espèces y est faible à modéré. Dans ce contexte, on peut considérer que les peuplements à Merja Zerga sont particulièrement riches au niveau diversité spécifique, mais aussi fonctionnelle. En effet, les huit groupes trophiques coexistent au sein d'un même habitat sédimentaire. Par ailleurs, au sein des groupes trophiques, le nombre total d'espèces recensées est plus élevé en zone subtidale qu'en zone intertidale. Cette situation a déjà été notée dans l'estuaire du Bou Regreg sur cette côte atlantique marocaine 120 km au sud de Merja Zerga, mais elle est originale par rapport à la plupart des observations réalisées ailleurs dans ce type de milieu, pour lesquels les milieux subtidaux sont globalement plus pauvres qu'en zone intertidale : estuaire de Mondego [29], lagune d'Arcachon [30], estuaire de l'Escaut [31]. C'est aussi au niveau de la zone subtidale que les abondances dans les principaux groupes trophiques (carnivores, déposivores de surface, détritivores et suspensivores) sont les plus élevées. Les peuplements apparaissent donc mieux structurés en subtidal.
Les déposivores de surface et les suspensivores dominent respectivement dans les sédiments à teneurs élevées et à teneurs faibles en éléments fins. Chacun de ces deux groupes sont très largement dominés numériquement par une espèce de Bivalve, Scrobicularia plana, pour les déposivores, et Cerastoderma edule, pour les suspensivores. Ce sont deux espèces euryèces pouvant coloniser plusieurs types sédimentaires. Ces deux Mollusques montrent des stratégies démographiques considérées comme un ajustement permanent des stratégies de reproduction dans un environnement variable. En effet, aux fluctuations régulières et élevées des facteurs édaphiques, hydrologiques et hydrodynamiques, les deux populations répondent en développant des recrutements quasi continus, en relation avec un rallongement de la période de reproduction [7].
La dominance relative des suspensivores ou des déposivores de surface résulterait de l'action de l'hydrodynamisme et de la granulométrie [19,20,22–25,32,33]. De manière générale, la prépondérance des déposivores de surface est généralement observée dans les peuplements côtiers et lagunaires se trouvant sous l'influence d'apports sédimentaires continentaux [19,34] ou bien dans des zones intertidales [35].
La diversité fonctionnelle observée à Merja Zerga constitue un témoin de la disponibilité et de la diversité des ressources trophiques. Les prédateurs contrôleraient les autres groupes en maintenant leurs densités respectives au-dessous d'un seuil autorisant des processus d'exclusion compétitive favorisant la diversité. Ce concept de Gause [36] a été largement évoqué en milieu intertidal rocheux [37], en milieu abyssal [38], pour les fonds de maërl [16] et pour les herbiers de Zostères [39].
La prise en compte des espèces présentes régulièrement (c'est-à-dire des espèces constantes) dans le peuplement, même si elles sont de faible abondance, intègre les particularités environnementales des milieux lagunaires, limitant considérablement le nombre d'espèces suffisamment adaptées pour développer des populations abondantes. C'est ainsi que si la richesse spécifique dans les différents groupes trophiques est relativement élevée, le nombre d'espèces qui sont à la fois dominantes et communes au sein de chaque groupe trophique reste faible. L'hypothèse explicative est que les individus de ces espèces régulières de faibles abondances seraient issus des flux de larves émises régulièrement par les populations extérieures à la lagune, introduites par le jeu des courants de marée dans la lagune, mais qui n'arriveraient pas à y constituer de véritables populations pérennes. Les résultats montrent ainsi que l'organisation trophique des peuplements benthiques de Merja Zerga n'est conditionnée que par un nombre restreint d'espèces qui dominent quantitativement. Cette caractéristique, assez classique dans les peuplements lagunaires, tend à les rapprocher, en termes de structure, des peuplements marins en milieu perturbé [40].
La faible représentation en nombre d'espèces et en abondance de certains groupes trophiques (microbrouteurs, herbivores et déposivores de subsurface (en subtidal essentiellement)) tend à affaiblir la résistance de la structure fonctionnelle des peuplements. Dans ce contexte il y a dans la lagune une réelle menace. En effet l'eutrophisation, reconnue comme étant l'une des menaces majeures pour les écosystèmes marins côtiers à l'échelle du globe [41], entraîne dans la lagune un développement de macrophytes, entéromorphes essentiellement, qui ne peut pas être contrôlé par les herbivores. Une très faible proportion de ces algues est évacuée en mer ouverte au jusant. Ces algues se dégradent donc majoritairement sur place, les détritivores constituant alors un des seuls points potentiels de résistance de la communauté. De même, les microbrouteurs, qui se nourrissent majoritairement de microphytobenthos et des très jeunes algues macrophytes, sont très peu abondants et ne peuvent donc contrôler ce processus. Dans une étude de la structure trophique des communautés macrobenthiques des côtes portugaises, les herbivores représentaient 23% de l'abondance des habitats meubles lagunaires et 45% de l'habitat estuarien [42]. L'atout majeur de la lagune pour résister à ces phénomènes de « marées vertes », et plus largement à l'eutrophisation, est donc très probablement le fort taux de renouvellement journalier des eaux, qui permet une évacuation en mer d'une majeure partie des sels nutritifs, limitant ainsi l'induction de la production primaire sur place.
Les deux méthodes de bioévaluation (Borja et al. [28] et Hily [22]) conduisent à des résultats comparables. L'avantage du modèle de Borja et al. [28], utilisant un calcul de l'indice biotique issu d'une mesure de valeurs discrètes, rend cette méthode plus précise. Cependant, la représentation graphique de la dominance relative des différents groupes est plus sensible et identifie plus précocement les épisodes de perturbation. Au niveau méthodologique, l'approche la plus performante serait donc de compléter le calcul de BC et de l'Ambi par cette représentation graphique, qui est en quelque sorte l'explication des variations observées de l'indice. Dans la lagune, en absence de zones en condition normale (IB 0), aucun état de pollution évident n'est défini (IB 4 et/ou 6). Les peuplements benthiques de la lagune montrent des états de déséquilibre, avec une prépondérance d'espèces tolérantes (groupe III) qui semble être une caractéristique naturelle des milieux à forte variabilité physicochimique hébergeant des espèces saumâtres tolérant bien des surcharges en matière organique [16,28]. La comparaison des indices, en relation avec les taux de matière organique (Fig. 4), met bien en évidence le fait que les indices biotiques, qui ont été définis pour révéler le niveau de surcharge en matière organique, doivent impérativement être replacés dans leur contexte sédimentaire précis. Il est en effet normal de trouver des taux de matière organique plus élevés dans une vase que dans un sable. L'indice 2 (et un BC variant de 2,1 à 2,5) peut donc logiquement se trouver dans un sable avec un sédiment contenant seulement 1,5 à 2,1% de matière organique totale, tandis qu'il est associé dans une vase à des taux de matière organique de 9 à 12%. Ces résultats soulignent également l'importance de disposer d'états de référence non perturbés, avec des valeurs des paramètres de l'environnement couplées aux paramètres des peuplements pour chaque type sédimentaire. C'est un élément essentiel pour une utilisation pertinente des indices biotiques. Ainsi, dans l'estuaire de Montego, des vases sables eutrophes présentaient des taux de MOT de 3,7%, alors qu'ils étaient de 6,8% dans des herbiers non perturbés [43]. Dans les milieux lagunaires, dans lesquels la marée ne peut évacuer efficacement les particules fines, la matière organique peut constituer une fraction très importante du sédiment, jusqu'à 25 ou 30% en poids sec [44]. De même, l'absence de saisonnalité et la relative stabilité observée dans les valeurs des indices biotiques suggèrent que le système benthique de la lagune de Merja Zerga n'est pas profondément perturbé, malgré le niveau 2 de l'indice. Cette stabilité de la structure trophique en milieu lagunaire a déjà été soulignée dans les milieux à faible niveau d'eutrophisation [45]. Cependant, bien que l'utilité de la méthode des groupes écologiques et des indices biotiques dans la bioévaluation des structures benthiques soit bien établie, son utilisation pour une évaluation directe de l'état de santé d'un milieu lagunaire devra intégrer la forte capacité naturelle des espèces à supporter des conditions environnementales très variables. Ces capacités de résistance aux différents types de stress que ces espèces ont développées les rendent moins sensibles à l'action des perturbations anthropiques, en général, et à l'enrichissement en matière organique, en particulier. La plupart des espèces dominantes naturellement dans ce type de milieu sont « tolérantes », et donc classées dans ce groupe écologique, les indices qui en découlent risquant donc de conduire à des diagnostics surévaluant l'état réel d'enrichissement organique du milieu benthique. De plus, les caractéristiques sédimentaires perdent leur rôle déterminant à mesure que l'influence marine s'atténue [34,46,47]. Des efforts de recherche sont donc à mener dans le futur pour mieux ajuster ces indices biotiques, qui ont été mis au points sur les milieux marins côtiers, aux milieux estuariens et lagunaires.
L'étude de la macrofaune benthique de Merja Zerga souligne l'intérêt de croiser les approches par groupes écologiques avec celle des groupes trophiques dans les programmes de suivi écologique. Les résultats obtenus ont révélé que les peuplements benthiques ne sont pas profondément perturbés et semblent donc bien tolérer les pressions anthropiques actuelles. Le renouvellement régulier des eaux de Merja Zerga, permis par l'ouverture de la lagune sur l'océan, est un atout naturel limitant les problèmes d'eutrophisation liés à la production primaire et l'accumulation sur place de la matière organique. Néanmoins, il serait nécessaire d'intégrer cette composante dans le cadre d'un programme de surveillance à long terme du site pour parvenir à une gestion durable et à une bonne conservation du milieu.


