Abridged English version
Introduction
Among North African rodents, Meriones shawii constitutes one of the most abundant species in its range and it is present in all countries from South Morocco to Egypt [1–4]. Its distribution is limited in the South by arid environments and the Sahara. It has been declared an agricultural pest and a host of rodent-borne diseases [5–22], but its taxonomy is not yet stabilized. Different morphological revisions [23–25] have attempted to clarify the generic and specific taxonomy, but failed to reach a consensus in the so-called species complex M. shawii–grandis. Different authors have proposed the existence of at least two valid species within the complex: M. grandis Cabrera, 1907 and M. shawii Duvernoy, 1842 [23–26], while many species or subspecies names are available in the literature. Both species had been put in synonymy until a morphometric revision by Pavlinov [27] who considered M. grandis as valid and present in Morocco to Egypt in sympatry with M. shawii. Other authors limit M. grandis to western Morocco. The morphological variability of M. grandis was explored based upon small samples [27–29] while for M. shawii no extensive study throughout its distribution area has yet been performed. In Morocco, a recent molecular and population genetic study has described two close molecular clades in Morocco and one in Algeria and those clades were considered respectively as M. grandis in Morocco and M. shawii in Algeria–Tunisia, the two main clades being sympatric in the Oriental region of Morocco close to the Algerian border [30]. The aim of the present work is to better explore the morphological variability among specimens of the species complex by using a classical morphometrics approach (size and shape with log-shape ratio method [31]) in a large sample from Morocco, Tunisia, Algeria, based upon distances calculated from craniometric measurements. Some of these specimens employed here have been molecularly typed. We will attempt to clarify the morphological characters characterizing the two species.
Material & methods
In total, 159 adult specimens characterized by dental wear stages 3 to 6 [32] from 18 localities were selected including 67 that were molecularly sequenced [30] (Table 1, Fig. 1). Some specimens are housed in the MNHN collections, while others are stored in El Bayadh (Algeria) and provisionally housed at the MNHN (cf. Appendix). Nine skull distances were selected following previous studies [33] Our classical multivariate morphometric analyses were conducted on log transformed skull distances, while log-shape ratios [34] were calculated in order to separate isometric size from shape and to thereby explore allometric patterns [35–38]. Isometric size differences between localities and sexual dimorphism were tested with two factor ANOVA and Fisher LSD tests. The visualization of the isometric size variability per localities was made through boxplot graphs [39–42]. Sexual dimorphism and geographic variation were also tested with MANOVA on size and shape characters. A principal component (PCA) on log-shape ratios allowed us to visualize the global variability trends of the data set. A discriminant analysis (noted AFD) based upon log-shape ratios allowed us to verify specific attributions in regard with molecular information and cross-validation [31]. Finally, a UPGMA was performed to visualize Euclidian distances between populations and build a phenetic tree. The morphometrical analyses were performed by using Statistica software version 10.0.228.2.
Détail des spécimens analysés dans cette étude (N = nombre de spécimens) par localité.
| Numéro de localité | Localité | Pays | Espèce | N | Acronyme |
| 1 | Laayoun | Maroc | M. cf. grandis | 1 | LAY |
| 2 | Tan-Tan | Maroc | M. cf. grandis | 1 | TAN |
| 3 | Tata | Maroc | M. cf. grandis | 2 | TAT |
| 4 | Zagora, Haut Draa | Maroc | M. cf. grandis | 10 | ZAG |
| 5 | Ourzazate | Maroc | M. cf. grandis | 4 | ORZ |
| 6 | Goulmima | Maroc | M. cf. grandis | 1 | GLM |
| 7 | Sour’El’Az | Maroc | M. cf. grandis | 19 | SAZ |
| 8 | Ben Guerir | Maroc | M. cf. grandis | 21 | BEG |
| 9 | Ouled Boughadi | Maroc | M. cf. grandis | 18 | OBG |
| 10 | Azrou, Midelt | Maroc | M. cf. grandis | 1 | AZM |
| 11 | Ifrane | Maroc | M. cf. grandis | 1 | IFR |
| 12 | Aïn Sefra, Ouassenis | Algérie | M. shawii | 2 | ASF |
| 13 | El Bayadh/Cheguig | Algérie | M. shawii | 54 | BAY |
| 14 | Guelt es-Stel | Algérie | M. shawii | 1 | GLS |
| 15 | M'sila | Algérie | M. shawii | 13 | MSL |
| 16 | Redeyef | Tunisie | M. shawii | 4 | RDY |
| 17 | Gafsa | Tunisie | M. shawii | 1 | GFS |
| 18 | Tataouine | Tunisie | M. shawii | 5 | TIN |

Carte de répartition des différentes localités sources des spécimens étudiés. 1, Laayoun (LAY) ; 2, Tan-Tan (TAN) ; 3, Tata (TAT) ; 4, Zagora, Haut Draa (ZAG) ; 5, Ourzazate (ORZ) ; 6, Goulmima (GLM) ; 7, Sour’El’Az (SAZ) ; 8, Ben Guerir (BEG) ; 9, Ouled Boughadi (OBG) ; 10, Azrou, Midelt (AZM) ; 11, Ifrane (IFR) ; 12, Aïn Sefra, Ouassenis (ASF) ; 13, El Bayadh/Cheguig (BAY) ; 14, Guelt es-Stel (GLS) ; 15, M'sila (MSL) ; 16, Redeyef (RDY) ; 17, Gafsa (GFS) ; 18, Tataouine (TIN). En pointillé, la rivière Moulouya.
Results
Isometric size analysis
The ANOVA on the isometric size shows the absence of sexual dimorphism so that we could combine male and females in the same analyses. There is a significant variation of isometric size between the localities (Fig. 2). No relation was found between sex and geographical variability. The test LSD Fischer confirmed that the specimens situated in localities in western Morocco are significantly larger than those situated in the East (Algerian and Tunisian specimens) (Fig. 2).
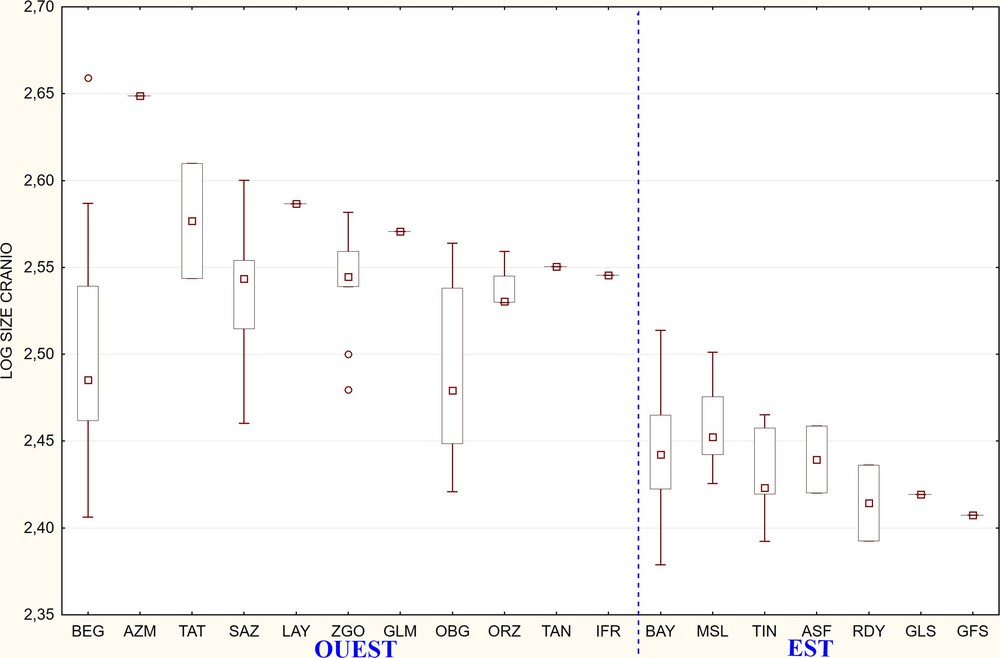
Représentation graphique des logs de taille isométrique de chaque localité (boîtes à moustache). Le petit carré au centre représente la médiane, les marges de la boîte sont de 25 et 75 %, les barres d’extension indiquent 5 et 95 % et les cercles sont les valeurs atypiques. La ligne discontinue sépare les localités de l’Ouest (Maroc) et de l’Est (Algérie–Tunisie).
Shape analysis
The MANOVA on log-shape ratios (isometric size removed) confirms the absence of sexual dimorphism and recovers a difference of conformation (skull shape) between localities. The principal component analysis (PCA) on log-shape ratios also shows along axis 1 (39.32%) two different groups (Fig. 3) and the variables best contributing to 90% are the upper and lower molar row lengths and tympanic bullae length (RMI, RMS, BT, HC). In the group situated in positive values of axis 1, the Moroccan localities are all gathered, while in the negative part of axis 1, we find the Algerian-Tunisian localities. The upper and lower dental row lengths are larger in Moroccan populations while the tympanic bullae are smaller. The discriminant analysis (AFD) accounts for 84.3% of correctly classified specimens within the clade M. shawii against 99% in the clade M. grandis after cross validation. (Table 2). Finally, the phenetic tree (Fig. 4) confirms the existence of two well geographically discriminated groups.
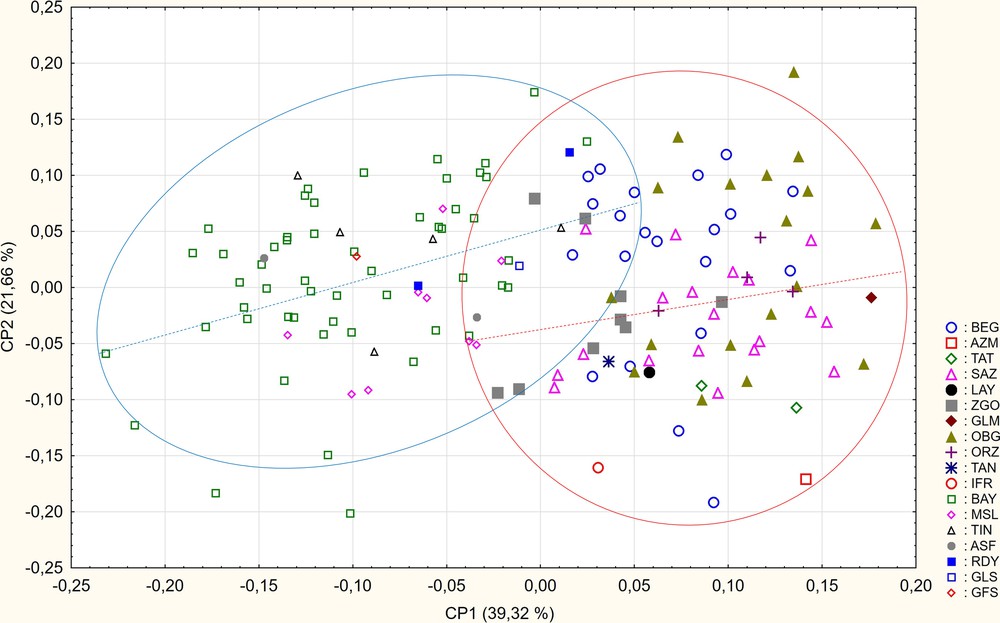
Graphe des deux premiers axes de l’analyse en composantes principales (ACP) des ratios de conformation des caractères craniométriques. Les ellipses à 95 % séparent les spécimens à l’ouest de la rivière Moulouya à droite (bleu) de ceux à l’est de la rivière Moulouya à gauche (rouge). Les droites de corrélation ont été ajoutées pour chaque groupe.
Détail du classement des individus en fonction de l’apprentissage liée à l’identification moléculaire (Clades A (assimilés à M. grandis Maroc) et C (assimilés à M. shawii, Algérie) suite à l’analyse factorielle discriminante basée sur les ratios de conformation et de validation croisées.
| % de bon classement en Apprentissage | % de bon classement en validation croisée | |
| Spécimens typés Clade C M. shawii, N = 9 | 100 | 84,3 |
| Spécimens typés Clade A M. grandis, N = 58 | 100 | 99 |
| Spécimens non typés, N = 86 | 91,8 |
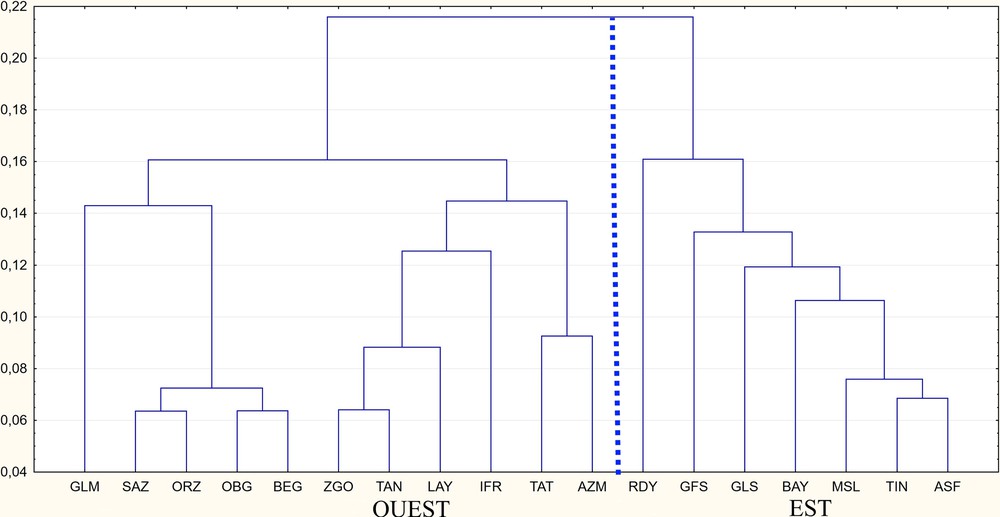
Dendrogramme phénétique des localités à partir des distances euclidiennes entre les moyennes des log-ratios de conformation des neuf variables crâniennes. La ligne discontinue sépare les localités de l’Ouest (Maroc) et de l’Est (Algérie–Tunisie).
Discussion–Conclusion
With this study, we highlighted the important morphological variability of adult M. grandis–shawii populations throughout the geographic distribution of this species complex, both in terms of size and shape and we also confirmed the absence of sexual dimorphism. This confirms previous works in Egypt or including Asiatic species [43,44]. M. shawii in Guelmine (Morocco) presented a dimorphism [11] that may be either related to a different method of age estimation or to the use in our work of distinct populations geographically distant [45]. Such an approach considering respectively size and shape has previously been applied to the Tunisian gerboa [40], but here we do not find significant differences between localities of a same country, but between Moroccan and Algerian ones. We here confirm with a larger sample compared to a previous work [27] that the specimens from west Morocco (OBG, SAZ, BEF, AZM, GLM, IFR, LAY, ORZ, TAN, TAT, ZGO) are larger than those of Algeria and Tunisia (ASF, BAY, GFS, GLS, MSL, RDY, TIN) [2,18,20,33]. It is well known that size is highly variable with the environmental variable and may not be sufficient to allow taxonomic conclusions [2,3,30,46]. But, during this study we also highlighted shape differences, especially in terms of molar row length and tympanic bullae length that could discriminate between specimens from Algeria and Tunisia and those from Morocco (Fig. 3). In fact, specimens from western Morocco have relatively small tympanic bullae, large dental rows, and narrow braincase, while those form Algeria and Tunisia are characterized by large tympanic bullae, small dental rows and wide braincase. These shape differences could be related to differences in habitat and diet between the two taxa. It is well known, as an example, that enlarged tympanic bulla are a characteristic of Gerbillinae living in arid environments. By correcting for the age effect within our sample, we refute the previously suggested hypothesis about a possible ontogenetic basis for recorded intraspecific differences [2,34] and we reinforce some conclusions about the validity of the two species in North Africa [10,13,18,20,35]. However, our sampling may be biased by the large diversity of sampled habitats in Morocco versus the more uniform habitats represented by captures from the semi-arid Algerian high plateau. Specimens from more southern arid localities seem smaller than those from northern localities. Further investigations based on a larger sample remain necessary to confirm this result. Moreover, in this study we have not incorporated the type specimens of all available names, nor specimens from the contact zone in eastern Morocco [36], nor specimens from a second molecular clade present in central Morocco [30].
Finally, the results of the discriminant analysis (DFA) indicate that the size and shape differences observed in this study may not result only from ecological differences, but are also due to genetic ones [30]. By the fact, the incorporation of 67 molecularly typed specimens allows us to correctly classify 90.8% of the specimens as belonging either to clade A (assigned to M. grandis) or clade C (assigned to M. shawii). Such score of good classification is close to the ones observed for other rodent species complexes for which the 100% value is never reached [47–49]. The two genetic clades correspond to the geographic distinction observed here in all types of analyses. According to Lalis et al. [30], the Moulouya River has been a barrier preventing exchanges between the two clades, as it is also for other taxa. In the oriental region of Morocco (to the east of the Moulouya River), these authors found the presence of the two clades in sympatry [30] and some experimental hybridization tests have been performed [4], but our sample of specimens from this region did not allow us to characterize the individuals from the contact zone. Further studies are now required to verify in eastern Morocco as well as in Algeria and with a larger dataset the extension of the sympatric zone and potential hybridisation as hypothesized by genetic analyses. These studies will allow us to clarify the ecological and behavioral characteristics and behavior of these cryptic species for their better management in terms of control.
1 Introduction
En Afrique du Nord, la mérione de Shaw (Meriones shawii) est un des rongeurs les plus abondants [1–4]. Cette espèce endémique à la région méditerranéenne est liée aux biotopes relativement riches en végétation [46]. Elle est rencontrée depuis des localités côtières jusqu’à environ 500 km à l’intérieur des terres, du nord-ouest du Maroc à l’Égypte (à l’ouest du Nil), en passant par l’Algérie, la Tunisie et la Libye [5]. En raison de ses explosions démographiques périodiques, qui ont été enregistrées au Maroc, en Algérie et en Tunisie, cette espèce est classée comme nuisible [6–8]. M. shawii s’attaque à une large gamme de plantes herbacées et d’arbustes, et peut causer de grandes pertes aux cultures. Cette dernière a un régime alimentaire diversifié et apparaît comme une espèce généraliste et opportuniste qui peut se maintenir dans des zones à forte hétérogénéité végétale [9–13]. Cette espèce est aussi le principal réservoir de leishmaniose cutanée causée par Leishmania major [14–16]. Cette zoonose touche tous les pays du Maghreb ; elle a été considérée comme un problème de santé publique durant cette dernière décade [17–22]. Depuis sa découverte en 1842 par Duvernoy à Oran, la taxonomie de la mérione de Shaw a fait l’objet de révisions successives, sans aboutir à un consensus concernant le nombre d’espèces présentes au Maghreb. Longtemps considérée comme une espèce unique distribuée dans toute l’Afrique du Nord et au Moyen Orient, plusieurs travaux ont proposé l’existence d’au moins deux espèces valides pour l’Algérie et le Maroc. Dès sa description initiale sous le nom de Gerbillus shawi, une différence morphologique entre un spécimen d’Oran (Ouest de l’Algérie) et un autre de Sétif (Est de l’Algérie) a été signalée [23]. De plus, dans ses divers habitats, M. shawii présente d’assez grandes variations de taille, de couleur, de qualités du poil et même de forme du crâne [24]. Ceci a conduit à la description d’une première sous-espèce appelée M. shawi laticeps Lataste, 1885, possédant des bulles tympaniques relativement réduites, un crâne robuste, des arcades zygomatiques épaisses et élargies. Une deuxième variété, dénommée M. shawi longiceps Lataste, 1885, possède un crâne robuste, mais plus allongé. La dernière variété, appelée M. shawi crassibulla Lataste, 1885, présente un crâne de taille intermédiaire entre les deux autres sous-espèces et des bulles tympaniques plus développées [24,25]. Lataste avait également décrit une autre espèce, M. auziensis Lataste, 1882, qui présente un crâne plus grêle et une livrée plus obscure. Enfin, il signale une dernière espèce qu’il appelle M. albipes Lataste, 1882, qui se rattache à M. s. crassibulla par le développement de ses bulles, mais son crâne est grêle comme celui de M. s. albipes ou comme celui du jeune M. s. crassibulla [25]. Au Maroc, l’espèce Meriones grandis Cabrera 1907 a été décrite comme semblable à M. shawii, mais de taille beaucoup plus grande, avec une coloration rouge au niveau du cou et du ventre et une ligne sombre tout au long de la queue. Le crâne de M. grandis est long et de largeur faible par rapport à celui de M. shawii. Les bulles tympaniques de M. grandis sont proportionnellement plus petites et une suture frontonasale curviligne ayant la forme d’une clé placée horizontalement représente un caractère distinctif de cette espèce [25]. M. grandis a cependant depuis été mise à plusieurs reprises en synonymie avec M. shawii [26]. Dans cette même étude, trois sous-espèces ont été distinguées : Meriones shawi shawi (Duvernoy, 1842), M. shawi laticeps (Lataste, 1882), M. shawi longiceps (Lataste, 1882), M. shawi grandis (Cabrera, 1907), plus une sous-espèce indéterminée. Une nouvelle révision, se basant toujours sur des données morphologiques, conserve trois sous-espèces, dont M. shawii grandis, M. shawii tristrami Thomas, 1892 et M. shawii shawii, cette dernière regroupant tous les noms des formes nord-africaines (M. auziensis Lataste, 1882, M. albipes Lataste, 1882 M. isis Thomas, 1919, M. trouessarti Lataste, 1882, M. richardii (Loche, 1867), M. sellysii (Pomel, 1856) et trois variétés M. shawi laticeps, M. shawi longiceps et M. shawi crassibula) [50]. Selon Petter [51], M. shawi shawi (Duvernoy, 1842) représente le type moyen de l’espèce. Puis M. shawi trouessarti (Lataste, 1882) est décrite comme étant la forme subdésertique de l’espèce et M. shawi grandis (Cabrera, 1907) est caractérisée comme celle dont les adultes sont « géants » [51]. La dernière sous-espèce serait M. shawi isis (Thomas, 1919) en tant que la forme orientale de l’espèce [51]. Ensuite, la population marocaine est revue et cartographiée comme M. shawii [52] ; puis M. grandis est réhabilitée [27–29]. Selon Pavlinov, Musser et Carleton, M. grandis est présente au Maroc occidental tandis que M. shawii s’étale du delta du Nil jusqu’au Maroc oriental [27]. Cette dernière regroupe les sous-espèces M. shawi selysii, M. s. trouessarti et M. s. laticeps.
Un récent travail de biologie moléculaire semble confirmer la présence de trois clades en Afrique du Nord, dont deux d’entre eux (clades C et A) correspondraient respectivement à Meriones shawii et M. grandis [30]. Le clade B est présent au Maroc dans l’Orientale et il semble peu distinct génétiquement du clade A. Lalis et al. rapportent que, dans la plupart de ces cas, la rivière Moulouya et/ou la large extension de vallée aride le long d’une grande partie de la rivière (sauf près de l’estuaire) aurait joué un rôle de barrière géographique intermittente responsable de cette structuration. Cependant, pour certains auteurs, M. grandis est distribuée du Maroc à la Tunisie [27,29] et les deux espèces sont sympatriques.
Afin de mieux comprendre la distribution et le statut des Meriones de cette zone, le présent travail a pour objectif l’étude morphologique du complexe shawii-grandis au Maroc, en Algérie et en Tunisie à l’aide de techniques de morphométrie traditionnelle [31]. Ainsi, en se basant sur les distances craniométriques d’un grand nombre de spécimens de ces régions, dont certains ont fait l’objet d’analyses moléculaires (clades A et C), nous tenterons de mieux définir la variabilité au sein du complexe afin de clarifier l’existence de limites morphologiques en intra et/ou interspécifique.
2 Matériel et méthodes
Le matériel d’étude provient de 18 localités (Tableau 1, Fig. 1) et de différentes collections. Les rongeurs de la collection du Muséum national d’histoire naturelle de Paris (MNHN) ont été collectés par F. Petter au Maroc, en Algérie et en Tunisie (115 individus). Plusieurs spécimens (91 individus) ont été collectés dans trois localités de la région de Marrakech (Sour El’Az, BenGuerir, Ouled Boughadi) lors du projet ANR ‘MOHMIE’ au Maroc (en 2010 et 2011). D’autres spécimens algériens ont été capturés en 2012 à Msila, dans l’Est algérien (13 individus) et 81 individus ont été capturés en 2007 à Cheguig (à El Bayadh) dans l’Ouest algérien.
Au total, 159 individus adultes avec la troisième molaire supérieure sortie (âge > 21 jours) et aux stades d’usure dentaire 3 à 6 [32] ont été utilisés pour les analyses morphométriques. Sur ces 159 spécimens, 67 ont été typés moléculairement [30]. Neuf mesures crâniennes et dentaires ont été prises à l’aide d’un pied à coulisse Mitutoyo calibré à 0,01 mm suivant un protocole classique [33]. Les différentes distances craniométriques utilisées dans ce travail sont :
- • LTC : longueur totale du crâne ;
- • LNas : longueur du nasal ;
- • IO : constriction interorbitaire ;
- • LC : largeur du crâne au niveau pariétal ;
- • LOP : longueur du condyle occipital au bord postérieur du palais ;
- • LFI : longueur du foramen incisif ;
- • RMS : longueur de la rangée des molaires supérieures ;
- • BT : longueur de la bulle tympanique ;
- • HC : hauteur maximale du crâne ;
- • RMI : longueur de la rangée des molaires inférieures.
2.1 Analyse morphométrique
Notre étude se base sur une analyse multivariée classique (distances crâniennes transformées en log) utilisant l’approche des ratios de conformation [34] afin d’observer les allométries et de partitionner la forme dans ses composantes de taille et de conformation [35]. Suivant cette méthode, pour chaque individu, la taille isométrique a été calculée comme la moyenne géométrique de toutes les mesures transformées en log et chaque mesure a été divisée par la taille isométrique pour obtenir les ratios de conformation [36–38]. Les logs-ratios de conformation ont été utilisés pour des analyses ultérieures, ce qui permet de distinguer la variabilité de la taille isométrique et de la conformation [39–41]. En premier lieu, une ANOVA à deux facteurs avec interaction est réalisée sur la taille isométrique, afin de vérifier l’existence éventuelle d’un dimorphisme sexuel ou d’une variabilité géographique et leur relation. Les résultats sont visualisés à l’aide de graphes boîtes à moustache [42]. La différence entre les localités prises deux à deux a été testée à travers le test LSD de Fisher.
Concernant la conformation, deux MANOVA successives ont été réalisées, la première pour tester la présence probable d’un dimorphisme sexuel basé sur la conformation et la deuxième pour vérifier la variabilité entre les localités. En second lieu, une analyse en composantes principales (ACP) a été exécutée sur les neufs ratios de conformation de la matrice de covariance pour l’ensemble des individus afin de visualiser les tendances globales de l’ensemble des données [40]. Nous avons également effectué une MANOVA sur les scores des facteurs de l’ACP pour vérifier encore une fois la signification des différences de conformation [42]. Enfin, à l’aide d’une analyse discriminante (AFD) basée sur les logs ratios de conformation, nous avons vérifié le pourcentage de bonne classification des individus par rapport à leur identification de départ. Dans ce cas, nous avons utilisé une approche de validation croisée où nous avons différencié le bon classement en apprentissage utilisant les spécimens typés moléculairement appartenant à deux clades génétiques différents et les spécimens non typés comme groupe à tester. Une seconde AFD est ensuite utilisée avec un critère de classification a priori de la position des localités de part et d’autre de la rivière Moulouya. Le dendrogramme phénétique des distances entre échantillons a été produit pour vérifier les affinités morphologiques entre les différents groupes étudiés. Il est calculé par la méthode UPGMA (méthode paire–groupe non pondérée utilisant des moyennes arithmétiques) construite à partir des distances euclidiennes entre les moyennes des log-ratios de conformation des neuf variables crâniennes.
Les analyses morphométriques et statistiques ont été réalisées à l’aide de STATISTICA version 10.0.228.2.
3 Résultats
3.1 La taille isométrique
L’ANOVA effectuée sur les logs de taille isométrique révèle l’absence d’un dimorphisme sexuel significatif (d.d.l. Fn1/n2 = 2/136 ; Fsexe = 0,00 ; p = 0,96), donc le sexe n’influe pas sur les différences qui peuvent exister entres les individus de différentes localités. Cela nous permet de combiner les mâles et les femelles pour les analyses statistiques qui suivent. En revanche, l’ANOVA signale la présence d’une variation significative de taille isométrique (d.d.l. Fn1/n2 = 17/141 ; Flocalité = 15,10 ; p < 0,00) entre les différentes localités (Fig. 1). Selon les résultats de l’ANOVA, aucune relation n’existe entre le sexe et la variabilité géographique (d.d.l. Fn1/n2 = 16/116 ; Flocalité × sexe = 0,77 ; P < 0,61). Du point de vue de la taille isométrique, le test LSD de Fisher indique que les spécimens des localités de l’Ouest de la Moulouya qui sont des localités marocaines (OBG, SAZ, BEG, AZM, GLM, IFR, LAY, ORZ, TAN, TAT, ZGO) sont significativement plus grands (d.d.l. Fn1/n2 = 1/157 ; F = 137,10 ; p= 0,00) que ceux de l’Est de la Moulouya (ASF, BAY, GFS, GLS, MSL, RDY, TIN) (Fig. 2).
3.2 La conformation
L’analyse multivariée de la variance (MANOVA) des log-ratio de conformation (sans la taille isométrique) appliquée sur le sexe n’indique aucune différence significative (d.d.l. Fn1/n2 = 9/128 ; Fsexe = 1,09 ; p = 0,37). En revanche, elle révèle la présence d’une différence significative de conformation entre les différentes localités (d.d.l. Fn1/n2 = 153/1081,61 ; Flocalité = 4,62 ; p< 0,00).
La visualisation des deux premiers axes de l’analyse en composantes principales (ACP) effectuée à partir des logs-ratios de conformation permet de distinguer nettement deux groupes différents situés de part et d’autre de l’axe 1 (qui représente 39,32 % de la variance totale) (Fig. 3). Les variables RMI (39 %), RMS (22 %), BT (20 %) et HC (10 %) contribuent pour plus de 90 % à la formation de l’axe 1. Le premier groupe est situé dans les coordonnées positives de la CP1 (OBG, SAZ, BEG, AZM, GLM, IFR, LAY, ORZ, TAN, TAT, ZGO) et le second groupe dans les valeurs négatives (ASF, BAY, GFS, GLS, MSL, RDY, TIN). Les deux groupes semblent donc se distinguer par la morphologie des rangées dentaires (RMI, RMS), où la moyenne du groupe des localités marocaines est significativement supérieure par rapport au groupe algéro-tunisien. En revanche, les moyennes du groupe marocain pour les variables caractérisant les bulles tympaniques (BT, HC) sont significativement plus faibles en les comparant au groupe algéro-tunisien. Le deuxième axe de l’ACP (CP2 = 21,66 %) ne permet pas une bonne distinction entre les localités. Les variables LFI (24 %), LNas (17 %), LOP (13 %) et HC (11 %) contribuent à hauteur de 65 % à la formation de l’axe 2. La MANOVA réalisée sur les scores des facteurs de l’ACP confirme la présence d’une différence significative de conformation entre les différentes localités (d.d.l. Fn1/n2 = 34/280 ; Flocalité = 14,01 ; p < 0,00).
4 Discussion
La présente étude vise à décrire la variabilité au niveau de la forme (taille et conformation), au sein de spécimens du groupe shawii–grandis venants de localités différentes de l’Ouest du Maroc, d’Algérie et de Tunisie. En n’intégrant que des individus adultes à l’étude [38], on élimine tout biais éventuel dû à la différence d’âge [42]. Les résultats montrent une variabilité importante, tant en taille qu’en conformation, ainsi qu’une absence de dimorphisme sexuel entre les spécimens des différentes localités. Les présents résultats concordent avec ceux obtenus pour Meriones shawii en Égypte [43] et une étude plus large qui a considéré 14 espèces du genre Meriones incluant Meriones shawii et Meriones grandis [44]. Tous ces travaux confirment l’absence de dimorphisme sexuel au niveau des caractères externes et craniométriques. En revanche, chez des spécimens de Meriones shawii venant tous de Guelmime (Maroc), les mâles présentaient des dimensions crâniennes supérieures à celles des femelles [11]. Ce résultat différent est peut-être dû au fait que tous les spécimens provenaient d’une seule localité ou que les auteurs se sont basés sur le poids corporel et non sur le degré d’usure dentaire comme étant un paramètre de différenciation des adultes. Ces spécimens de Guelmine n’ont pas pu être intégrés à notre étude et aucune donnée éthologique n’est disponible. La sélection d’individus d’une même classe d’âge par localité peut également influer sur les résultats. Plusieurs études ont montré que pour chaque grande classe d’âge (juvénile, sub-adulte, adulte) il existe de fortes différences et que la structure d’âge et de composition des populations non isolées d’une même espèce de rongeurs est très variable [45]. Lalis et al. ont également démontré les différences d’interprétation quant à la structure des populations en termes de classes d’âges, en fonction des méthodes utilisées pour déterminer l’âge des individus [45].
Notre étude est la première qui propose, par l’observation distincte de la taille isométrique et de la conformation, de tenter de caractériser les deux espèces en éliminant la part allométrique. Ce type de travail avait également été utilisé pour caractériser des populations de gerboises tunisiennes dans un but de comparaison intraspécifique [40]. Ainsi, ici, l’étude de la taille isométrique des individus confirme l’existence d’une variabilité géographique importante. Contrairement à l’étude des gerboises de Tunisie, on n’observe pas de différences significatives entre localités d’un même pays, malgré des différences environnementales fortes [40]. En revanche, l’étude de la taille isométrique par localité montre des différences hautement significatives entre deux grands groupes d’individus. Le premier réunit les individus venant des localités marocaines (OBG, SAZ, BEG, AZM, GLM, IFR, LAY, ORZ, TAN, TAT, ZGO), qui sont de plus grande taille, tandis que le second regroupe les spécimens d’Algérie et de Tunisie qui ont une taille relativement plus petite (ASF, BAY, GFS, GLS, MSL, RDY, TIN). Ces résultats sont en accord avec les observations précédentes qui ont montré que les populations de Meriones shawii du Maroc présentent des molaires significativement plus grandes que celles d’Algérie (de taille moyenne), alors que les populations tunisiennes présentent les plus petites valeurs [53]. En revanche, nous n’avons pas pu tester ici l’hypothèse que les populations de Meriones shawii du Nord de l’Algérie seraient de plus grande dimension que celles du Sud [2,3,46]. De plus, la taille des populations du complexe M. shawii pourrait varier au fil du temps à cause des changements environnementaux causés par les humains ou aux changements climatiques qui sont sans rapport avec les activités humaines [30]. La présence d’une variabilité significative ne se limite pas à la taille, car les individus de ces deux grands groupes présentent également des différences hautement significatives de conformation (notamment en ce qui concerne la longueur des rangées dentaires et de la bulle tympanique). Ces résultats renforcent l’hypothèse de l’existence de deux groupes de Meriones au sein de ce complexe et confirment que la différence entre les populations marocaine et algéro-tunisienne n’est pas seulement une différence liée à la taille ou à un écart d’âge entre les individus étudiés, comme le signalaient certains auteurs [2]. Les nombreuses sous-espèces décrites de M. shawii seraient probablement liées à des différences d’âge ou de couleur en fonction de l’écologie de ces rongeurs. En effet, il est bien connu que les individus des milieux plus arides ont tendance à avoir des pelages plus clairs que ceux des milieux plus humides. Ainsi, les spécimens de Bou Saada attribués par Lataste (1882) à la sous-espèce M. s. trouessarti vivant dans la zone saharo-steppique en bordure du Sahara présentaient une plus petite taille, un pelage plus clair et des bulles tympaniques plus développées que ceux attribués à M. shawii shawii d’Oran [46].
La présente étude révèle une forte discrimination pour la conformation entre les individus des différentes populations et l’AFD permet de bien classer 100 % des individus, de part et d’autre de la rivière Moulouya. Les variables qui contribuent le plus à la discrimination sont les suivantes, par ordre décroissant :
- • BT ;
- • LCT ;
- • RMS ;
- • HC ;
- • LC.
Ceci confirme, avec un échantillon géographique large, les travaux qui ont réhabilité M. grandis sur la base des grandes dimensions de son crâne, de la largeur étroite de la boîte crânienne et des bulles tympaniques relativement petites [27,54]. En revanche, M. shawii se caractérise par un petit crâne, une largeur de la boîte crânienne large et des bulles tympaniques développées. Ce qui confirme, sur un échantillon plus important, les travaux précédents [44,53,55]. En plus de ces différences, la présente étude signale une différence de longueur au niveau des rangées molaires. Elle prouve que les populations marocaines ont des rangées dentaires supérieures et inférieures significativement plus grandes que celles des populations algéro-tunisiennes.
Les différences de taille isométrique et de conformation observées dans le cadre de ce travail ne semblent pas correspondre à des différences écologiques, mais bien à des différences génétiques. En effet, nous observons que les spécimens utilisés dans cette étude, typés génétiquement comme appartenant aux clades A et au clade C définis par [30], se groupent en deux ensembles bien classés et que les spécimens non typés se classent également en validation croisée correctement (84,3 % pour le clade shawii et 99 % pour le clade grandis, 90,8 % pour l’ensemble), ce qui confirme la validité des deux espèces [30]. Il est rarement possible d’obtenir des scores de 100 % dans la délimitation d’espèces jumelles de rongeurs en raison de leur forte variabilité intraspécifique, qui peut souvent être supérieure à l’interspécifique. Cette observation a été faite à plusieurs reprises pour des analyses en morphométrie classique des espèces jumelles de rongeurs du genre Mastomys [47] ainsi que pour des analyses en géométrie morphométrique pour d’autres genres de Rongeurs [48,49]. Nous retrouvons clairement ces différences sur le dendrogramme phénétique, qui distingue nettement les deux clades :
- • un groupe occidental marocain :
- ∘ OBG,
- ∘ SAZ,
- ∘ BEG,
- ∘ AZM,
- ∘ GLM,
- ∘ IFR,
- ∘ LAY,
- ∘ ORZ,
- ∘ TAN,
- ∘ TAT,
- ∘ ZGO ;
- • un groupe oriental algéro-tunisien :
- ∘ ASF,
- ∘ BAY,
- ∘ GFS,
- ∘ GLS,
- ∘ MSL,
- ∘ RDY,
- ∘ TIN.
Au sein du groupe occidental, la variabilité morphologique semble plus importante qu’au sein du groupe oriental. Les travaux moléculaires ont montré la présence de deux clades sympatriques au sein du groupe marocain, ce qui pourrait expliquer cette variation [30]. Selon ces mêmes auteurs, l’hypothèse de l’existence de deux espèces sœurs de Meriones du complexe shawii-grandis en Afrique du Nord ayant toujours une possibilité d’hybridation nécessite d’être étayée par des analyses supplémentaires au moyen d’un nombre accru de spécimens et de marqueurs génétiques [30]. Certains auteurs ont pu obtenir au laboratoire des hybrides fertiles entre M. shawii et M. grandis [4]. Néanmoins, ces expériences n’ont pas été reproduites en laboratoire avec des spécimens typés moléculairement, tandis que, dans la nature, aucun hybride n’est connu à ce jour. Nous n’avons échantillonné dans ce travail que des spécimens attribuables aux deux clades majeurs A et C (séparés par la plus grande distance génétique). Les spécimens du clade moléculaire B sont peu nombreux et proviennent de localités de l’Ouest et du centre du Maroc ; ils n’ont pas pu être analysés en morphométrie. Un seul individu capturé au Maroc était typé moléculairement comme appartenant au clade C algéro-tunisien. Il provenait de la région orientale du Maroc ou étaient présents également des spécimens du clade A. Ces spécimens étaient trop peu nombreux et marqués par la présence de nombreux subadultes pour être pris en compte dans une analyse de morphométrie classique. Des captures et des analyses génétiques supplémentaires seront nécessaires pour améliorer notre compréhension de la taxonomie des Meriones de la région orientale du Maroc, où semblent coexister les deux espèces. Enfin, la grande diversité des habitats échantillonnés au Maroc (allant de l’aride au semi-aride et des plaines côtières aux montagnes de l’atlas), par opposition à la relative uniformité des milieux de captures algéro-tunisiens sur les hauts plateaux en contrebas de l’Atlas, pourrait être à l’origine de ces différences de taille et de conformation importantes au sein de ce groupe occidental. Il semble nécessaire d’augmenter la taille des échantillons analysés pour détecter les causes de cette variabilité.
La présente étude, basée sur la morphométrie traditionnelle, confirme ainsi la présence de différences prononcées de taille et de conformation crânienne entre les individus venant de différentes localités du Maroc, d’Algérie et de Tunisie, et renforce les données moléculaires concernant la présence de deux espèces distinctes au sein du groupe shawii–grandis. Cette constatation nécessite à l’avenir des analyses moléculaires et morphométriques plus poussées de populations provenant des localités types d’Oran (Algérie) pour Meriones shawii Duvernoy (1848) et de Marrakech (Maroc) pour Meriones grandis Cabrera (1907), ainsi que dans l’Orientale, afin d’apporter un nouvel éclairage sur cette question.
Notre travail confirme la présence du groupe shawii en Algérie et Tunisie et du groupe grandis, au moins dans l’Ouest du Maroc. En attendant que les problèmes de systématique soient résolus au sein de ce complexe, les études d’écologie devront préciser la distribution géographique, les habitats spécifiques, la physiologie et le régime alimentaire de ces taxons encore trop mal connus. La mise en évidence de différences éventuelles de comportement, de vie sociale entre les différentes formes, surtout en ce qui concerne leur degré de nuisance pour l’agriculture et la santé, est cruciale pour la mise au point de stratégies de lutte efficaces.
Remerciements
Plusieurs organismes ont contribué au financement de ces travaux. Certaines collectes et analyses moléculaires ont été réalisées dans le cadre du projet CMEP TASSILI MDU 09MDU755 TASSIL, et nous remercions Idir Bitam, Salahedine Doumandji, Karim Souttou, Makhlouf Sekhour et Violaine Nicolas. Les collectes au Maroc ont été rendu possible grâce à la collaboration avec l’Institut scientifique de Rabat (A. El Hassani, M. Fekhaoui, A. Mataame, H. El Brini), le département de zoologie de la faculté des sciences de l’université Mohamed-V de Rabat (T. Benazzou, A. Benhoussa) et le Haut-Commissariat aux eaux et forêts et lutte contre la désertification. Le projet ANR 6e extinction ANR-09-PEXT-004, MOHMIE, Modern Human installation in Morocco, Influence on the small terrestrial vertebrate biodiversity and Evolution (CD) a permis de capturer certains spécimens marocains, de les génotyper et de préparer les crânes pour les analyses morphométriques (A. Delapré, A. Mataamé, H. El Brini). Nous remercions Stéphane Aulagnier pour sa lecture attentive et ses suggestions, ainsi que Peter Taylor pour l’amélioration de la version en anglais de cet article.
Annexe Détail des spécimens utilisés dans ce travail.
| Numéro du catalogue | Numéro du terrain | Typage | Pays | Localité | Latitude | Longitude | Sexe |
| CG 1983 N 682 | / | N | Algérie | Aïn Sefra, Ouassenis | – | – | F |
| CG 1986 N 65 | / | N | Algérie | Aïn Sefra, Ouassenis | – | – | M |
| CG 1956 N 646 | / | N | Maroc | Azrou, Midelt | – | – | M |
| / | MA078 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA097 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA106 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA107 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA108 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA109 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA110 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA116 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA127 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA128 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA130 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA135 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA136 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA137 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA138 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA139 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA140 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA141 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | MA143 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA144 | T | Maroc | BenGuerir | 32,219 | –7,970 | F |
| / | MA145 | T | Maroc | BenGuerir | 32,219 | –7,970 | M |
| / | C1 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C101 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C102 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C12 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C13 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C14 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C18 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C2 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C20 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C21 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C23 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C24 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C28 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C3 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C31 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C36 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C37 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C4 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C40 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C44 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C47 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C48 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C49 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C5 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C50 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C51 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C57 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C6 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C64 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C69 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C7 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C71 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C72 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C80 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C84 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C85 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C87 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C88 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C9 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C90 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | C92 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C94 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C98 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | C99 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | R1 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | R10 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | R11 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | R12 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | R2 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | M |
| / | R3 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | R6 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | R7 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | R8 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| / | R9 | N | Algérie | El Bayadh/Cheguig | 34,033 | 1,133 | F |
| CG 1983 N 829 | / | N | Tunisie | Gafsa | – | – | F |
| CG 1992 N 67 | / | N | Maroc | Goulmima | – | – | M |
| CG 1955 N 753 | / | N | Algérie | Guelt er-Stel | – | – | – |
| CG 1958 N 264 | / | N | Maroc | Ifrane | – | – | |
| CG 1992 N 66 | / | N | Maroc | Laayoun | – | – | F |
| / | IP11 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP12 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP13 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP14 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP15 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP16 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP17 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP18 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP19 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP2 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP20 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP21 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | IP3 | T | Algérie | M'sila | 35,702 | 4,547 | – |
| / | MA899 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA903 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA904 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA905 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA912 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA914 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | M |
| / | MA915 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA920 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA923 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | M |
| / | MA924 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA927 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA928 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA929 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA931 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | M |
| / | MA932 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA933 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA934 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| / | MA935 | T | Maroc | Ouled Boughadi | 33,067 | –6,723 | F |
| CG 1974 N 233 | / | N | Maroc | Ourzazate | – | – | F |
| CG 1974 N 236 | / | N | Maroc | Ourzazate | – | – | F |
| CG 1974 N 243 | / | N | Maroc | Ourzazate | – | – | M |
| CG 1975 N 99 | / | N | Maroc | Ourzazate | – | – | M |
| CG 1952 N 359 | / | N | Tunisie | Redeyef | – | – | – |
| CG 1952 N 360 | / | N | Tunisie | Redeyef | – | – | – |
| CG 1952 N 364 | / | N | Tunisie | Redeyef | – | – | M |
| CG 1953 N 432 | / | N | Tunisie | Redeyef | – | – | M |
| / | MA849 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA850 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA851 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA853 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA854 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA856 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA861 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA866 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA869 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA870 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA871 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA879 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA883 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA884 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA885 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA886 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | F |
| / | MA887 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA891 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| / | MA892 | T | Maroc | Sour’El’Az | 31,848 | –7,016 | M |
| CG 1992 N 65 | / | N | Maroc | Tan-Tan | – | – | F |
| CG 1982 N 783 | / | N | Maroc | Tata | – | – | F |
| CG 1990 N 724 | / | N | Maroc | Tata | – | – | F |
| CG 1978 N 225 | / | N | Tunisie | Tataouine | – | – | M |
| CG 1978 N 226 | / | N | Tunisie | Tataouine | – | – | M |
| CG 1978 N 228 | / | N | Tunisie | Tataouine | – | – | M |
| CG 1978 N 231 | / | N | Tunisie | Tataouine | – | – | M |
| CG 1978 N 233 | / | N | Tunisie | Tataouine | – | – | F |
| CG 1973 N 747 | / | N | Maroc | Zagora, Haut Draa | – | – | M |
| CG 1973 N 749 | / | N | Maroc | Zagora, Haut Draa | – | – | M |
| CG 1973 N 752 | / | N | Maroc | Zagora, Haut Draa | – | – | F |
| CG 1973 N 754 | / | N | Maroc | Zagora, Haut Draa | – | – | F |
| CG 1973 N 755 | / | N | Maroc | Zagora, Haut Draa | – | – | F |
| CG 1974 N 234 | / | N | Maroc | Zagora, Haut Draa | – | – | M |
| CG 1974 N 235 | / | N | Maroc | Zagora, Haut Draa | – | – | – |
| CG 1974 N 237 | / | N | Maroc | Zagora, Haut Draa | – | – | F |
| CG 1974 N 241 | / | N | Maroc | Zagora, Haut Draa | – | – | F |
| CG 1975 N 96 | / | N | Maroc | Zagora, Haut Draa | – | – | – |


