1. Introduction
L’antibiorésistance (ABR) désigne la capacité des microorganismes à résister aux effets des agents antimicrobiens (antibiotiques, désinfectants, biocides, etc.). Ce phénomène s’est accéléré depuis 15 ans du fait de l’usage intensif des antibiotiques (ATB) en médecine humaine et animale. Ce qui s’est accompagné d’une augmentation de la résistance clinique et d’une contamination diffuse de l’environnement par des antibiotiques et des bactéries résistantes aux antibiotiques (BRA), mettant en danger le contrôle des maladies infectieuses et la qualité de l’environnement [1]. Selon l’Organisation Mondiale de la Santé (OMS), l’ABR est l’une des plus graves menaces pesant sur la santé mondiale du XXIe siècle. Les estimations actuelles rapportent que l’ABR cause 700 000 décès chaque année dans le monde. Ce chiffre pourrait atteindre 10 millions en 2050, en l’absence de mesures fortes [2].
Cette problématique pluridisciplinaire est liée à l’activité humaine et doit être appréhendée de façon holistique [3]. Il est donc important d’apprécier la contribution de chaque activité (santé humaine et animale, production agricole et élevage, assainissement, etc.), afin de déterminer les « hotspots » et de définir les mesures adaptées pour limiter le risque global. La gestion des eaux usées et des boues associées pourraient jouer un rôle important dans la sélection et la propagation de la résistance microbienne [4]. En effet, les communautés microbiologiques trouvées dans des environnements contaminés par un ou plusieurs ATB et autres agents sélectifs ont la capacité d’enrichir leur patrimoine génétique en gènes de résistances (GRA) et sont souvent considérées comme des réservoirs d’ABR. Le risque associé à la présence de l’ABR dans les eaux est encore difficile à évaluer du fait (i) du nombre limité d’études ; (ii) du manque de connaissance et de compréhension des mécanismes favorisant l’ABR, en particulier en assainissement ; (iii) de l’absence de méthodes standardisées et de seuils d’interprétation des risques sanitaires et environnementaux.
Jusqu’à récemment, l’apport en GRA et BRA dans les compartiments environnementaux (eaux, biofilms, boues, sols, sédiments) et leur dynamique d’évolution spatio-temporelle étaient peu étudiés, laissant de nombreuses questions en suspens. Des GRA présents dans des communautés microbiennes des eaux usées et des boues peuvent-ils être transférés à l’homme ? L’enrichissement du milieu aquatique en GRA peut-il s’accompagner d’un transfert vers d’autres bactéries pathogènes ou environnementales ? Quel est l’impact sur les bactéries présentes en station d’épuration, d’une exposition continue à des produits pharmaceutiques, biocides, et des GRA ?
Cet article aborde les connaissances actuelles sur le rôle de la filière d’assainissement dans la lutte contre l’antibiorésistance. Il revient sur les sources d’émissions des bactéries et des gènes de résistance. Il rappelle le rôle d’une station d’épuration et ses obligations réglementaires générales en matière d’assainissement et fait le point sur les conditions propices à la propagation de l’antibiorésistance. Enfin, il aborde le devenir des indicateurs de l’antibiorésistance et les produits pharmaceutiques pendant le traitement des eaux usées.
2. Sources d’émissions de l’antibiorésistance
Il est admis que l’utilisation des ATB en médecine humaine et vétérinaire est le facteur initial de l’apparition de la résistance chez les bactéries du microbiote intestinal. Entre 30 et 90 % des antibiotiques ingérés sont excrétés sous forme active dans les fèces et les urines. Ainsi l’UNEP distingue cinq grandes sources de l’ABR [5]. D’une part, les effluents urbains liés à la consommation d’ATB (à domicile ou dans les centres de soins). D’autre part, les effluents industriels (industrie pharmaceutique). Et enfin, les rejets directs vers l’environnement, tels que les rejets humains en cas d’infrastructures d’assainissement limitées, les effluents d’élevages (lisiers, fumiers) et les produits phytosanitaires utilisés en agriculture.
Les stations d’épuration urbaines (STEU) se trouvent à l’intersection des flux de pollution majeurs en ATB que sont les effluents hospitaliers, urbains, industriels (Figure 1). Ces effluents sont considérés comme des réservoirs de BRA et GRA du fait de la présence simultanée d’un mélange d’agents antimicrobiens et de bactéries d’origine humaine, animale et environnementale dont certaines sont pathogènes et déjà résistantes. Ils présentent également des conditions favorables à leur survie (environnement riche en nutriments et matière organique). Par ailleurs, plusieurs études montrent que l’abondance de BRA et GRA est supérieure au niveau des points de rejets de STEU et présents dans les sédiments situés à proximité [6]. C’est pourquoi, ces rejets sont désignés comme des vecteurs majoritaires de transfert de résidus pharmaceutiques, BRA et GRA vers le milieu aquatique [4, 7].
Principales sources de contamination par les ATB, les BRA et les GRA. D’après “Water, sanitation, hygiene and wastewater treatment influences on antimicrobial resistance” [8, p. 4], © World Health Organization (WHO), Food and Agriculture Organization of the United Nations (FAO) and World Organisation for Animal Health (OIE), tous droits réservés. Les stations d’épuration représentent un organe de traitement et de transfert vers le milieu aquatique.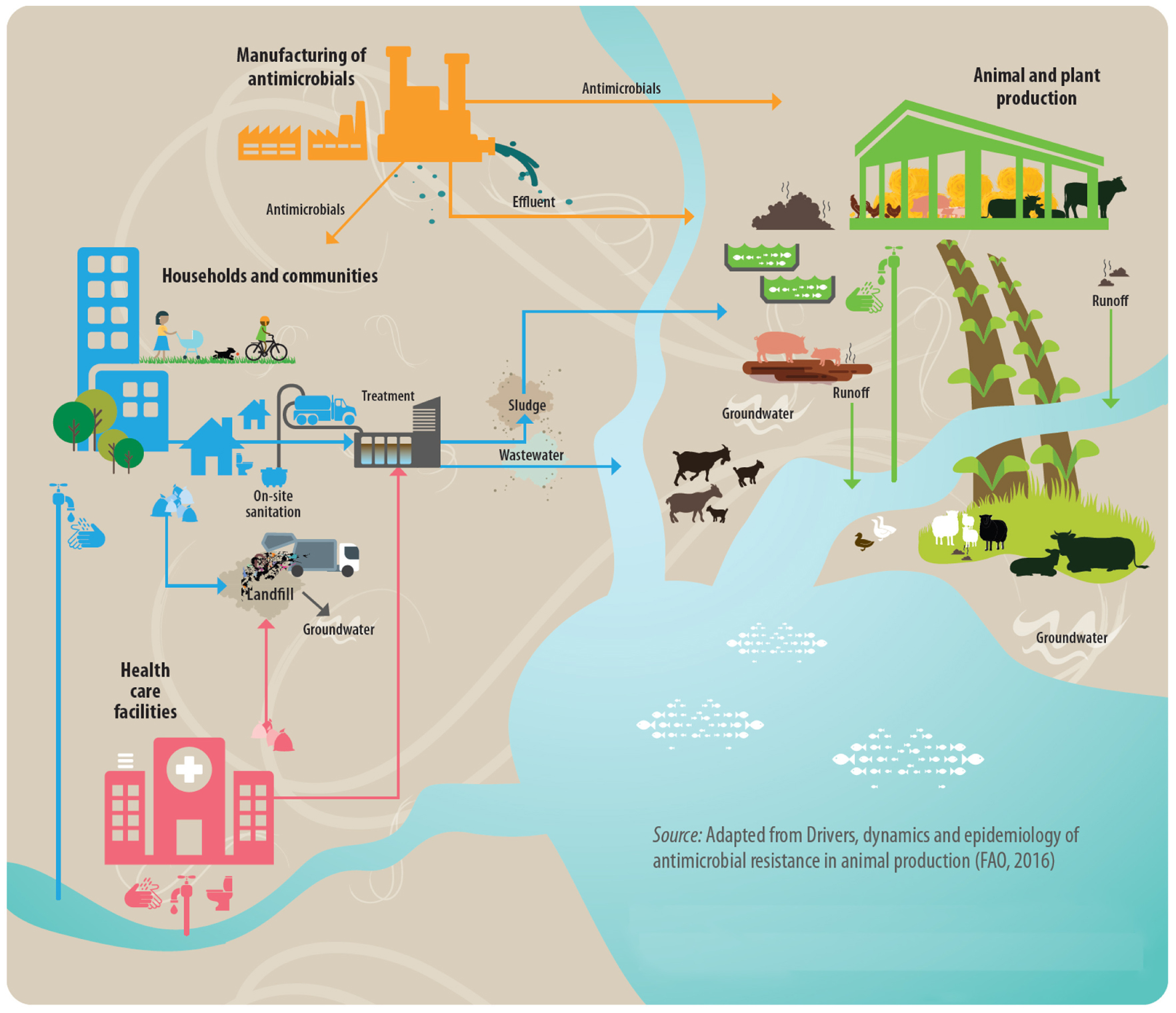
3. Stations d’épuration et antibiorésistance
3.1. Importance des stations d’épuration et obligations
L’assainissement a pour fonction de collecter, transporter et traiter les eaux usées et pluviales avant de rejeter l’eau épurée dans le milieu naturel. Les procédés d’assainissement conventionnels comportent un traitement primaire (procédés physico-chimiques) visant à éliminer par décantation une forte proportion des matières en suspension et un traitement secondaire, souvent biologique, afin d’éliminer les matières polluantes solubles (carbone, phosphore et azote). Les boues d’épuration obtenues par clarification sont incinérées ou épandues. Le choix des filières de traitement dépend des conditions locales notamment du type d’eaux usées brutes, de la capacité de la STEU, de la qualité du milieu récepteur et des activités sensibles en aval. Si l’eau usée est rejetée dans une zone sensible, des traitements d’affinage et/ou une désinfection peuvent être requis conformément aux exigences des autorités sanitaires. Ces stations sont conçues pour éliminer la pollution organique (Carbone, Azote, Phosphore) afin de préserver l’environnement (Directive 91/271/CEE).
Plus de 56 % des eaux usées domestiques et industrielles, dans le monde, sont rejetées dans l’environnement avec peu ou pas de traitement [9]. Une étude à l’échelle internationale montre que les systèmes d’assainissement et le processus d’épuration jouent un rôle important dans l’atténuation de l’ABR. Ainsi, les niveaux d’ABR mesurés sont supérieurs dans les pays de faible niveau socio-économique ayant un faible accès à l’eau et à l’assainissement [10]. Le manque d’infrastructures d’assainissement constitue donc le principal facteur de développement de l’ABR [11].
Une autre étude européenne confirme qu’une consommation d’ATB supérieure favorise l’ABR et se concrétise par des concentrations et une diversité de GRA plus importante [12]. La taille de la STEU, la présence d’hôpitaux avec une abondance en GRA deux à dix fois supérieures, sont également des facteurs d’influence [13]. Ceci souligne l’importance de la performance de la filière d’assainissement dans la dissémination de l’antibiorésistance.
D’un point de vue réglementaire, en France, le fonctionnement d’une STEU est vérifié par des critères physico-chimiques représentatifs de la charge organique polluante globale et du rendement épuratoire (MES, DBO5, DCO, Azote et Phosphore en zone sensible). Dans certains cas, des critères microbiologiques peuvent être exigés sur les eaux usées traitées (par exemple : rejet en zone à usage sensible, seuils d’E. coli et d’Entérocoques fixés via arrêté préfectoral) ou dans les boues traitées (par exemple : valorisation agricole et compostage ; arrêté du 8 janvier 1998 et NFU 44-095).
A ce jour, il n’existe aucune réglementation spécifique sur l’antibiorésistance en Europe et même dans le monde. Cependant, ces paramètres pourraient faire l’objet d’une surveillance plus accrue dans le futur. La directive européenne de traitement des eaux résiduaires, en cours de révision, mentionne la possibilité de vérifier l’efficacité des traitements vis-à-vis de composés pharmaceutiques et de mettre en place une surveillance de l’ABR dans les eaux usées (proposition d’octobre 2022 de révision de la directive 91/271/CEE).
3.2. Stations d’épuration « hotspots » de l’antibiorésistance ?
Les mécanismes de propagation de l’ABR en STEU sont encore mal compris. Des échanges de matériel génétique existent entre souches bactériennes, notamment à partir d’éléments génétiques mobiles (plasmides, intégrons, phages, etc.). Ces échanges permettent un brassage génétique rapide et efficace surtout dans des écosystèmes complexes contenant déjà un patrimoine génétique riche en GRA, comme c’est le cas dans l’environnement. Ce transfert génétique horizontal représenterait un moyen d’acquisition de nouvelles formes de résistance par les bactéries (y compris pathogènes) et serait amplifié sous l’influence d’une pression de sélection exercée par des agents sélectifs (par exemple : ATB, biocides, éléments traces métalliques, etc.). Ainsi, plusieurs études montrent que la sélection de BRA et l’apparition de nouveaux GRA peut se produire à de très faibles concentrations en ATB (inférieures à la concentration minimale inhibitrice) telles que celles retrouvées en assainissement et certaines eaux de surface polluées. Les environnements favorisant le maintien, la propagation et le transfert de gènes sont qualifiés de « hotspots » (Figure 2), il s’agit principalement, selon la littérature, des eaux usées ou en cours de traitement, du système de digestion anaérobie des boues, du ruissellement agricole et des biofilms du réseaux des eaux usées recyclées [14].
Cartographie des hotspots de l’ABR dans le cycle de l’eau, d’après
la figure “Environmental pathways of AMR showing sanitation as critical control points (red arrows)
for dissemination of ARBs and ARGs” [14, p. 8]. CC-BY-SA 3.0.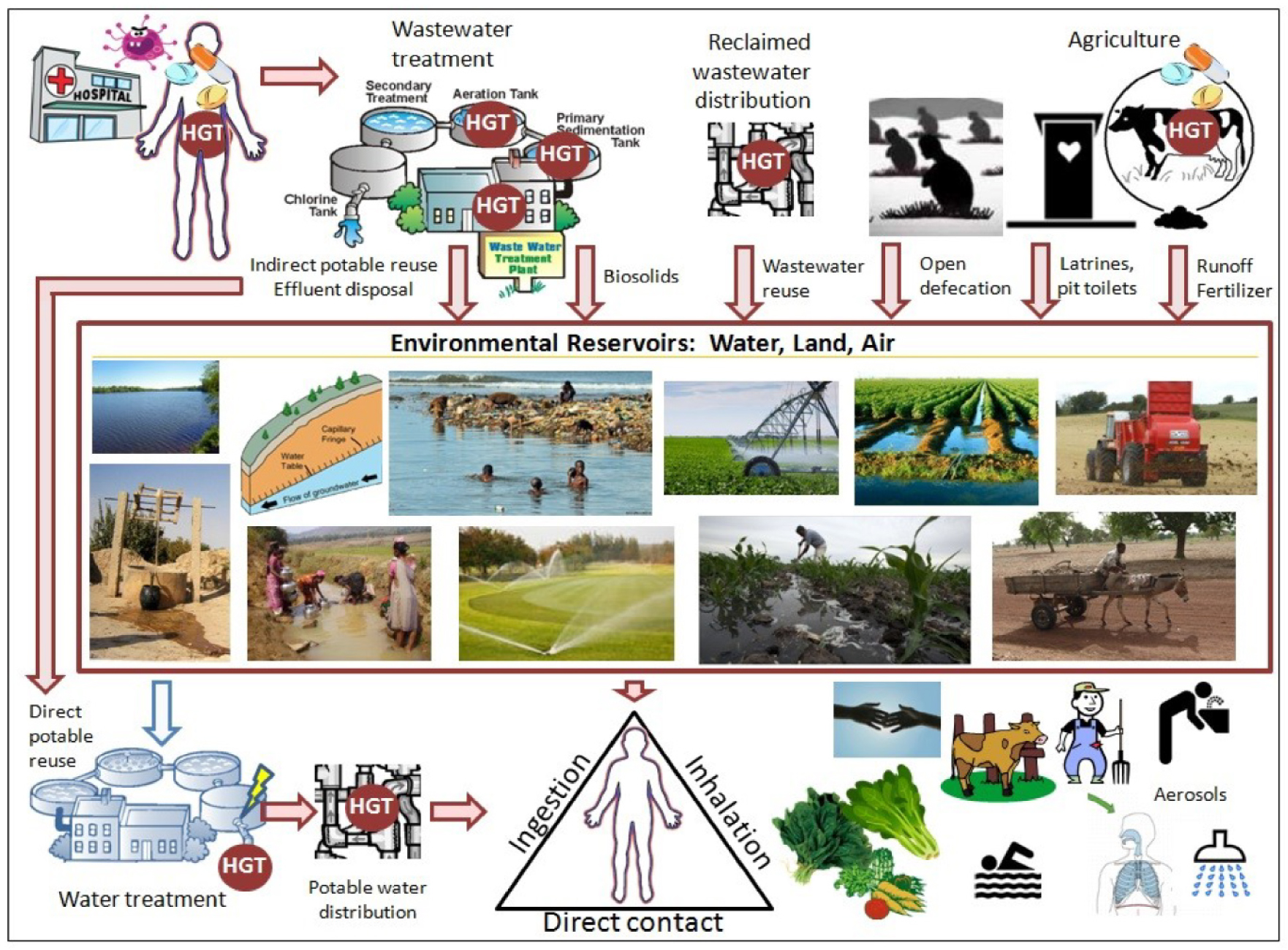
Il est encore difficile de hiérarchiser leurs importances relatives et d’identifier les facteurs favorables à la dissémination de l’ABR. De plus, en l’absence de niveau de contamination de référence dans les matrices environnementales et de seuils réglementaires, les risques sanitaires et environnementaux associés à la présence des indicateurs de l’ABR sont difficiles à évaluer pour les différentes activités en lien avec l’assainissement.
Les experts de l’Anses ont défini les trois conditions favorables au transfert génétique horizontal dans un écosystème environnemental donné [15]. Tout d’abord, la présence de résidus ATB et d’autres micropolluants actifs en quantité suffisante pour exercer une pression de sélection continue sur les communautés bactériennes. Deuxièmement, la structure de la communauté microbiologique en elle-même, sa diversité, les taux de croissance et densités cellulaires et les interactions entre souches. Enfin, la présence de GRA multiples portés par des éléments génétiquement mobiles facilement transférables.
D’un point de vue opérationnel, il faut également prendre en compte les caractéristiques de fonctionnement de la STEU et son procédé de traitement, comme facteur complémentaire. En effet, le niveau d’oxygénation, l’alternance des séquences de traitement, la température, le temps de séjour hydraulique, l’âge des boues peuvent avoir un impact sur la survie, la croissance des bactéries et le temps de contact avec les agents sélectifs et donc sur l’ABR [16]. La contribution d’une STEU à l’ABR est donc fortement dépendante de ses caractéristiques de fonctionnement, de la technologie de traitement employée mais aussi des conditions de rejets (taux de dilution en rivière).
4. Surveillance de l’antibiorésistance et assainissement
Afin de surveiller l’évolution de l’ABR dans l’environnement, quatre scénarios peuvent être envisagés : (i) l’évaluation de la qualité des produits finis (eaux usées traitées, recyclées, boues), (ii) l’épidémiosurveillance dans les eaux usées brutes, (iii) l’évaluation de la performance globale de la filière d’assainissement avec détermination des GRA/BRA qui échappent au traitement, (iv) l’évaluation de la dynamique d’évolution de l’ABR d’un traitement unitaire spécifique ou d’une combinaison. Les approches analytiques peuvent varier selon le scénario appliqué.
4.1. Mesure des indicateurs de l’antibiorésistance
Il n’existe pas de méthode normalisée pour la recherche de BRA et GRA dans des échantillons environnementaux, contrairement aux échantillons cliniques. D’une part, parce qu’il n’y a pas d’obligation réglementaire, et d’autre part, parce qu’il est difficile de sélectionner les bactéries et gènes les plus représentatifs à cibler. Compte tenu de la complexité de ce type d’échantillons, cela implique également l’emploi d’une méthodologie d’échantillonnage adaptée (prélèvements moyennés sur 24 h) et d’une préparation spécifique pour limiter les interférences et optimiser la sensibilité de détection.
Trois catégories de méthodes analytiques matures sont disponibles en recherche pour le suivi des BRA et GRA dans les matrices environnementales [17, 18]. Elles apportent des renseignements complémentaires sur la présence et les niveaux de prévalence des différentes composantes de l’ABR, ce qui est nécessaire pour avoir une vision globale sur cette problématique complexe. Ces méthodes sont :
- Des méthodes de culture basées sur la capacité des bactéries à se développer sur un milieu de culture sélectif en présence d’ATB. Elles permettent de détecter et quantifier les types de bactéries viables et les formes de résistances associées. Ce sont les méthodes de référence pour évaluer un risque sanitaire. Cependant, la sélection d’une bactérie et d’un type de résistance de référence qui soient représentatifs du risque d’infection via l’environnement est particulièrement délicate compte tenu du manque de cultivabilité des souches environnementales, des états « viables non cultivables » et de la présence de flore interférente. Plusieurs cibles bactériennes prometteuses sont discutées au sein de groupes d’experts [15, 19, 18]. Les plus couramment citées sont des bactéries à Gram négatif telles que des Entérobactéries, Coliformes et Escherichia coli car déjà suivies en tant qu’indicatrices de contamination fécale et d’efficacité de traitement. La recherche d’Entérobactéries ou de E. coli à bêta-lactamases à spectre élargi (BLSE) est recommandé par l’OMS pour faire le lien avec la santé animale et humaine [20, 21]. Les entérocoques fécaux constituent un indicateur complémentaire intéressant et représentatif des bactéries à Gram positif et d’autres catégories d’antibiotiques (Vancomycine). Des genres bactériens tels que Pseudomonas et Aeromonas sont aussi évoqués en tant qu’indicateurs d’une dissémination de gènes vers les eaux de surface du fait de leur abondance en assainissement, de leur survie supérieure en eaux douces et du portage potentiel de GRA [15, 18].
- Des méthodes de qPCR (de l’anglais : polymerase chain reaction) basées sur l’identification et la quantification de gènes à l’origine de la résistance ont été appliquées avec succès sur des matrices environnementales [22]. La sélection des gènes à cibler reste un challenge pour aboutir à une liste suffisamment informative à un coût raisonnable. La liste peut inclure une combinaison de 3 à 10 gènes dont certains (i) fréquents en assainissement, (ii) abondants et représentatifs des milieux pollués par des résidus pharmaceutiques et co-facteurs (par exemple : intl1, sul1, tetA, etc.), (iii) connus pour être portés par des bactéries pathogènes et agissant comme facteur de virulence (par exemple : vanA, blaCTX ; qnrS, etc.), (iv) possédant des éléments génétiques mobiles facilement échangeables entre bactéries ou associés à de la multirésistance (par exemple : intl1, plasmides, etc.). Les combinaisons de gènes varient de manière importante entre les études selon leur localisation géographique, la nature des eaux usées, le type de STEU (municipales, hospitalières, industrielles, etc.) et l’objectif de surveillance. Des systèmes de détection par PCR quantitative à haut débit (HT-qPCR) ou grâce à la méthode Digitale Droplet PCR (ddPCR) ont été appliqués récemment sur des eaux usées urbaines, hospitalières et des boues [23, 24]. Le fait de suivre plusieurs marqueurs génétiques simultanément par échantillon (jusqu’à 384 cibles pour la HT-qPCR) permet de réaliser une cartographie large des gènes présents, et de sélectionner les plus pertinents à suivre en fonction de l’objectif de la surveillance.
- Des méthodes de séquençage haut débit, comme la métagénomique basée sur l’identification génétique des populations bactériennes et notamment celles porteuses de gènes de résistance. C’est l’approche la plus adaptée pour détecter des gènes ou des bactéries émergentes inconnues [17].
4.2. Harmonisation de la mesure des indicateurs de l’ABR
Plusieurs initiatives récentes ont été mises en place pour harmoniser et faciliter la comparaison et l’interprétation des résultats et leur mise à disposition :
- L’Anses recommande l’emploi d’une sélection (batterie) d’indicateurs incontournables à intégrer dans des études sur l’ABR dans l’environnement (antibiotiques, bactéries fécales résistantes et gènes de résistance) [15] ;
- Plusieurs experts ont établi des listes de BRA et GRA à suivre prioritairement en assainissement [25] et les modalités d’expression des résultats à intégrer dans de futures études [22, 18, 26] ;
- Des initiatives de validation, d’inter-calibration et d’harmonisation des protocoles sont en cours au sein de réseaux de laboratoires spécialisés en métrologie (Norman, LNE) et de projets de recherche nationaux, européens et internationaux (Promise, Water JPI AMR, Water Research Foundation) ;
- Des infrastructures de stockage des données de surveillance et des procédures de traitement des données bioinformatiques générées par séquençage haut débit sont en cours de développement (projet ABRomics) facilitant ainsi l’accès à des données de surveillance à grande échelle et multisectorielles.
Les progrès analytiques effectués depuis 10 ans permettent d’aboutir à des exemples de batteries d’indicateurs déployables et des premières recommandations d’interprétation des résultats. Il reste à les éprouver et à les simplifier pour les rendre plus opérationnelles. Leur déploiement à plus large échelle permettra de fournir des valeurs de référence en BRA et GRA dans les différentes matrices environnementales et des seuils de contaminations acceptables éventuels.
4.3. Suivi des molécules pharmaceutiques responsables des effets sur les bactéries
Le suivi des molécules pharmaceutiques s’effectue par chromatographie en phase liquide couplée à la spectrométrie de masse à partir d’extraits adaptés selon la matrice environnementale. Elle permet de détecter et quantifier simultanément, et de manière ciblée, un large nombre d’ATB (près de 40 composés). Les composés apolaires et volatiles peuvent être recherchés en complément par la chromatographie en phase gazeuse couplée à la spectrométrie de masse. Le panel d’ATB étudiés est très variable selon les études, et il subsiste des molécules encore peu ou pas étudiées à ce jour (soit par difficulté technique, soit par absence de standards analytiques). Une liste minimale de 6 ATB dont une fluoroquinolone (ciprofloxacine), trois macrolides (érythromycine, clarithromycine et l’azithromycine) et deux sulfamides (sulfaméthoxazole et sulfaméthazine) est recommandée par l’Anses [15].
5. Performances des traitements d’assainissement vis-à-vis de l’ABR
Pour agir sur l’antibiorésistance, il convient d’agir à trois niveaux : les antibiotiques, les bactéries résistantes et les gènes de résistance.
5.1. Elimination des ATB des eaux usées
Les STEU recueillent une grande variété de principes actifs pharmaceutiques à usage humain (et leurs métabolites). Leur traitement requiert des étapes spécifiques appelées traitements tertiaires avancés. Ils ciblent les molécules organiques polaires et très solubles dans l’eau. Les principales solutions technologiques sont : les procédés basés sur l’utilisation du charbon actif (Actiflo® Carb chez Veolia), ceux utilisant l’ozonation et ceux par filtration membranaire (nanofiltration). Ces traitements permettent selon la littérature d’atteindre des abattements supérieurs à 80 % [27].
L’efficacité de traitement des produits pharmaceutiques par les STEU conventionnelles est très variable selon les produits pharmaceutiques entrant dans le système, leurs propriétés physico-chimiques et le procédé de traitement. Le taux de traitement des ATB est de l’ordre de 50 % [28]. Le Tableau 1 synthétise des données d’occurrence pour trois antibiotiques dans des STEU sans traitement tertiaire.
Données d’occurrence des ATB dans les rejets de STEU et dans les eaux de surface [29]
| Composé | Niveau de concentration (ng/L) | PNEC (ng/L) | |||||
|---|---|---|---|---|---|---|---|
| Amérique du nord | Europe | Asie & Australie1 | |||||
| Rejet STEU | Eau de surface | Rejet STEU | Eau de surface | Rejet STEU | Eau de surface | ||
| Triméthoprime | <0,5–7 900 | 2–212 | 99–1 264 | 0–78,3 | 58–321 | 4–150 | 1 000 |
| Ciprofloxacine | 110–1 100 | - | 40–3 553 | - | 42–7202 | ND–1 3003 | 20 |
| Sulfaméthoxazole | 5–2 800 | 7–212 | 91–794 | <0,5–4 | 3,8–1 400 | 1,7–2 000 | 20 000 |
Notes : PNEC : predicted no effect concentration ; en gras les concentrations mesurées dans les eaux de surface supérieures au PNEC ; ND : Non Détecté ; Ligne pointillée (-) : donnée non reportée.
1 Les concentrations pour l’Australie sont basées sur une seule étude de Queensland [30].
2 Absence de données pour le ciprofloxacine en Australie.
3 La concentration reportée dans une étude australienne est inférieure à la limite de détection de 1 300 ng/L [31].
Les STEU peuvent donc rejeter des substances pharmaceutiques actives dans l’environnement. Elles sont ainsi considérées comme un vecteur de transfert d’antibiotiques dans les milieux aquatiques. Dans le cadre du projet Global Monitoring of Pharmaceuticals Project, des chercheurs ont mesuré les concentrations de 61 substances pharmaceutiques actives dans 258 rivières de 104 pays [7]. La fréquence de détection du triméthoprime et sulfaméthoxazole était de 40 %. Le triméthoprime a été détecté dans toutes les régions du monde sauf en Antarctique. Le plus grand dépassement a été observé pour un ATB, le métronidazole, au Bangladesh, à proximité d’un rejet direct d’une usine pharmaceutique dans l’environnement. Sa concentration était plus de 300 fois supérieure au PNEC (plus forte concentration de la substance sans risque pour l’environnement).
5.2. Élimination des BRA et GRA des eaux usées
Même si les STEU ne sont pas conçues pour éliminer la pollution liée à l’ABR, le traitement biologique des eaux usées réduit de 1,5 à 2 log la teneur en bactéries fécales résistantes, mais sans les éliminer totalement [15, 22, 32, 33, 34].
Quant aux GRA, les taux d’élimination sont très hétérogènes selon le gène ciblé, les procédés appliqués et la méthode de surveillance. Le procédé de boues activées élimine entre 2 et 4,5 log des GRA aux tétracyclines, entre 1,5 et 3 log des GRA aux sulfamides, et entre 1 à 3 log des GRA aux bêta-lactamases [34, 35]. De plus, plusieurs études montrent que certains GRA peuvent être enrichis ou même apparaître pendant le traitement biologique et être ainsi disséminés dans le milieu aquatique [4]. Les teneurs en GRA restent difficiles à interpréter en l’absence de seuil réglementaire. Les traitements biologiques ont donc tendance à réduire les teneurs en GRA, mais leur réduction reste limitée sans traitement spécifique.
Les traitements spécifiques décrits dans la littérature sont : la désinfection (chloration, UV), l’oxydation avancée (ozone, peroxyde d’hydrogène) et la filtration membranaire (bioréacteur à membrane). Ainsi, la chloration apporte une réduction complémentaire d’environ 0,5 à 1,5 log des coliformes fécaux résistants cultivables [34]. L’élimination des GRA reste toutefois limitée (inférieure à 1,5 log) aux doses habituelles de chloration et très variables selon la qualité d’eau et le type de GRA. Quant aux UV, ils agissent à la fois sur les BRA et les GRA mais avec des efficacités très variables. Les performances rapportées dans les revues varient entre 2 et 4 log pour les coliformes fécaux cultivables résistants et entre 0,5 et 4 log pour les GRA [33, 36]. De plus, une incertitude demeure sur la possibilité de re-croissance et le risque potentiel lié au rejet d’ADN libre après désinfection.
Les traitements d’oxydation avancée, tels que l’ozonation, ou le peroxyde d’hydrogène sont prometteurs car les radicaux libres réagissent rapidement avec les ATB, les cellules et le matériel génétique. Leur efficacité est comprise entre 1,25 et 6 log selon la dose, le type de GRA, la qualité de l’eau (taux de matière organique et d’ammonium). Enfin, les technologies de séparation physique par filtration membranaire sont décrites comme étant particulièrement efficaces pour les BRA et GRA. Les réductions de GRA peuvent atteindre 7 log. En l’état des connaissances actuelles, il est difficile de statuer sur la contribution réelle des STEU. L’absence de comparaison de différents procédés existants à partir d’une même eau brute empêche de conclure sur les performances relatives des différents procédés et d’en déduire les facteurs opérationnels permettant de limiter la propagation de l’ABR. Des travaux de R&D complémentaires sont donc nécessaires pour acquérir des données de prévalence entrée/sortie pour différents procédés et conditions opératoires représentatives (par exemple : temps de rétention hydraulique, taux d’aération, âge des boues, etc.). Il est par ailleurs préférable de suivre une batterie de plusieurs GRA pour observer l’effet de réduction de l’abondance gène par gène mais aussi pour évaluer la proportion de GRA éliminés et enrichis. Ce travail d’investigation permettra aux industriels de l’eau et aux régulateurs de classer le risque de dissémination de l’ABR par rapport aux autres et de décider de la nécessité d’optimiser les filières de traitement des eaux.
5.3. Traitement des boues d’épuration
En Europe, 60 % des boues d’épuration sont recyclées, dont la moitié est compostée avec des déchets verts [37]. Par définition, elles concentrent les bactéries et certains ATB et sont donc considérées comme les principaux apports en ABR des sols, avec les lisiers/fumiers [14]. Des BRA et GRA peuvent y être présents avec des quantités attendues supérieures à celles des eaux usées traitées [16]. Certains auteurs montrent que l’épandage de boues ou l’irrigation avec des eaux usées traitées peuvent entraîner une augmentation de la diversité et de l’abondance des GRA dans les sols, les organismes terrestres et les plantations agricoles [38, 39, 40]. Les BRA diminuent rapidement après épandage mais ce phénomène est peu documenté [15]. Les GRA sont plus stables et pourraient persister de quelques jours à plusieurs mois selon leur nature, le type de sols et les pratiques d’épandages/irrigation [40, 41]. Une méta-analyse et une étude de l’ADEME montrent que les dynamiques d’évolution des communautés microbiologiques des sols et l’ABR dépendent des procédés subis par les boues et que certains seraient plus performants pour réduire la teneur en BRA et GRA. Ainsi, le compostage et la digestion anaérobie thermophile permettraient d’atteindre des taux de réduction moyens de 85 % et 51 % respectivement [32]. Ces deux procédés agissent sur une majorité de GRA, un couplage entre les deux étant encore plus performant [24]. Par ailleurs, le sol jouerait un rôle d’atténuation des GRA agissant de manière complémentaire pour des procédés d’efficacité moindre [24].
Ainsi, le fait de promouvoir la limitation de l’utilisation des ATB et de favoriser les ATB biodégradables et moins persistants constituent une première ligne de défense. Si les études préliminaires montrent que certains traitements éliminent significativement l’ABR, il convient de poursuivre les études sur ce sujet pour confirmer et comprendre l’influence des paramètres opérationnels.
6. Conclusions et perspectives
En conclusion, les STEU agissent comme un réservoir d’ATB, GRA et BRA en raison des activités humaines situées en amont et peuvent jouer un rôle dans la dissémination de l’ABR dans l’environnement. La première ligne de défense contre l’ABR consiste à promouvoir la limitation de l’utilisation des ATB à la source. Même s’ils ne sont pas conçus pour éliminer la pollution liée à l’ABR, les traitements conventionnels des eaux usées réduisent les teneurs en BRA, GRA et ATB. Une meilleure élimination peut être obtenue avec des technologies plus spécifiques (adsorption charbon pour les ATB, désinfection par chloration ou UV pour les BRA, oxydation avancée et filtration membranaire pour les BRA et ATB). D’autres travaux en recherche et développement sont nécessaires pour mieux comprendre le devenir et le transfert de l’ABR dans les écosystèmes des STEU et pour aider à freiner sa propagation. Ainsi pour continuer à progresser sur le sujet de l’ABR en assainissement, il est possible d’agir à 4 niveaux :
- Réduire autant que se peut, à la source, le flux de produits pharmaceutiques, de biocides et désinfectants, afin de limiter la charge entrante sur les STEU et ce surtout pour les principaux contributeurs ;
- Améliorer les connaissances sur le devenir des marqueurs ABR en assainissement et dans le milieu naturel, afin d’évaluer la résilience du milieu et identifier des solutions. Participer à des travaux d’harmonisation sur les méthodologies de surveillance de l’ABR dans les matrices environnementales pour les rendre opérationnelles et anticiper une future réglementation ;
- Mieux caractériser la contribution de l’assainissement (traitement des eaux usées, épandage des boues, réutilisation des eaux usées traitées) dans la sélection et la dispersion de l’ABR. Mieux connaître les points critiques et l’impact via des campagnes d’analyses sur des installations représentatives afin de décider si un post-traitement est nécessaire ;
- Évaluer les performances de différents procédés (et combinaisons) de traitement des eaux usées, pluviales et des boues pour réduire la contamination de l’ABR. Déterminer les facteurs opératoires propices à l’atténuation de l’ABR, optimiser les solutions de traitement en vue de limiter la présence d’ATB, BRA et GRA dans les rejets et les promouvoir.
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêt à déclarer.




 CC-BY 4.0
CC-BY 4.0