1. Introduction
La crise actuelle de la biodiversité est le plus souvent illustrée par les extinctions d’espèces. Il est maintenant admis que nous sommes entrés dans la sixième crise d’extinction et on estime que disparaissent entre 17 000 et 100 000 espèces par an à l’échelle du globe [1]. À titre d’exemple, chez les plantes, une espèce sur huit est menacée d’extinction. La particularité de cette sixième crise d’extinction est le rôle majeur d’une espèce, Homo sapiens, dans ces phénomènes d’extinction, que l’on désigne sous le terme de changements globaux. Derrière ce terme, on entend en particulier les changements d’usages des terres liés à l’agriculture — notamment l’utilisation de pesticides —, la déforestation, le réchauffement climatique, l’urbanisation ou encore les invasions biologiques liées à l’internationalisation des échanges. Le domaine de l’écologie des communautés a largement documenté l’effet des changements globaux sur la composition en espèces ou l’assemblage des espèces. Les invasions biologiques, où une espèce envahissante supplante des espèces locales avec une niche écologique proche, sont souvent citées en exemple [2].
L’évolution de l’histoire de la vie sur le temps long nous enseigne que, paradoxalement, les crises d’extinction sont aussi des périodes de renouveau de la biodiversité. L’exemple emblématique de l’extinction des dinosaures, lors de la crise crétacé-tertiaire, il y a 60 millions d’années, a permis la radiation des mammifères, déjà présents à l’époque des dinosaures mais écologiquement dominés par ces derniers [3]. Ainsi, la crise de la biodiversité ne doit pas se mesurer seulement en termes d’espèces perdues, les espèces étant vues comme des entités statiques, mais comme un bouleversement global de la biodiversité, c’est-à-dire de la diversité des écosystèmes (et des interactions entre espèces), de la diversité en espèces et de la diversité à l’échelle infraspécifique. Depuis plus de cinquante ans, les travaux en biologie des populations et en génétique des populations ont montré que les espèces ne sont pas uniformes. Au-delà de la diversité génétique neutre largement décrite dans les années 1990 [4], les populations possèdent dans la plupart des cas de la variance génétique sur des traits d’histoire de vie [5, 6], ce qui a priori leur permet de répondre aux régimes de sélection qui s’exercent sur les populations. Ainsi, les populations s’adaptent aux conditions climatiques locales et à leur changement dans le temps. Par exemple, la date de floraison varie en général sur un gradient de température dans les populations naturelles [7]. L’adaptation peut être le fait de la plasticité, lorsqu’un génotype produit une réponse phénotypique adaptée à l’environnement, ou de l’évolution, lorsqu’un remplacement successif de génotypes adaptés aux conditions environnementales survient. Toutefois, la rapidité des changements environnementaux actuels a conduit à d’abord s’intéresser aux remplacements d’espèces à l’échelle des communautés, les espèces étant en première approximation considérées comme fixes. Cette vision d’une évolution lente est héritée de Darwin, géologue de formation, qui envisageait l’évolution comme imperceptible sur des temps courts. Dans L’Origine des espèces (1859), il écrit : “We see nothing of these [evolutionary] slow changes in progress, until the hand of time has marked the long lapse of ages”. Cela a été récemment remis en cause. En effet, les travaux d’évolution expérimentale en laboratoire, d’abord chez des organismes à temps de génération court [8], et plus récemment chez des organismes à temps de génération plus longs [9, 10], ont démontré la rapidité des processus d’évolution. Ainsi, en neuf générations seulement, des évolutions florales significatives ont été obtenues en modifiant expérimentalement l’environnement de pollinisation [10]. Dès lors, la question de l’adaptation des organismes par sélection naturelle, face aux changements globaux récents, devient pertinente.
Dans le domaine des changements globaux, la question de l’adaptation au changement climatique domine la littérature. Face aux projections climatiques du GIEC, une question centrale est de savoir de savoir si les organismes s’adapteront et surtout assez rapidement pour échapper à l’extinction. Ainsi, l’avancée de la phénologie observée chez de nombreux organismes [11] est considérée comme une adaptation qui pourrait empêcher l’extinction des populations. Si la démonstration d’un échappement de l’extinction par évolution a été faite en conditions expérimentales, nous disposons de très peu d’informations dans les populations naturelles [12]. Par exemple, l’extinction du bourdon Bombus distinguendus en Angleterre et en Irlande est considérée comme un effet direct du changement climatique auquel il ne se serait pas adapté, mais ces interprétations restent sujettes à discussion.
Chez les plantes, un impact majeur des changements globaux est le déclin des pollinisateurs. Celui-ci est maintenant bien décrit dans de nombreuses parties du globe [13, 14] ; il est susceptible d’affecter la relation plantes-pollinisateurs et par là, la reproduction des plantes. Si le rôle et les services de la biodiversité sont parfois mal identifiés dans leur globalité, le cas du déclin des pollinisateurs apparait comme emblématique. En effet, les pollinisateurs sauvages permettent la pollinisation de 70 % des espèces cultivées en agriculture à l’échelle de la planète. En 2009, le coût de ce service avait été estimé à plus de 150 millions d’euros [15].
Dans cet article, nous nous intéresserons à l’impact des changements globaux, et plus particulièrement à l’impact du déclin des pollinisateurs, sur les systèmes de reproduction des plantes. Ces systèmes sont divers, puisqu’il existe des espèces à sexes séparés, hermaphrodites ou présentant un mélange de ces différents types au sein des populations [16]. Néanmoins, l’hermaphrodisme est le type dominant chez les plantes. Il présente l’avantage d’allier fécondation croisée et/ou autofécondation, ce qui peut constituer une stratégie adaptée en l’absence de pollinisateurs. Dans cet article, nous analyserons comment les plantes peuvent s’adapter à un changement de régime de pollinisation lié au déclin des pollinisateurs. À travers l’exemple d’une petite plante annuelle, la pensée des champs (Viola arvensis), nous montrerons comment l’évolution peut impacter les phénotypes des populations de plantes et, par là, déstabiliser les espèces avec lesquelles elles sont en interaction dans l’écosystème.
2. Impacts des changements globaux sur les systèmes de reproduction chez les plantes
2.1. Observations de terrain et limitation pollinique
Selon l’IPBES, plus de 300 000 espèces végétales bénéficient des insectes pour leur reproduction, soit 87,5 % de la flore totale [17]. Nous pouvons donc faire l’hypothèse que les changements dans la communauté des pollinisateurs affectent la communauté végétale. Curieusement, l’effet du déclin des pollinisateurs a été peu étudiée en écologie des communautés chez les plantes [18], celle-ci s’étant majoritairement intéressée aux traits fonctionnels (morphologie, physiologie, phénologie) et de manière anecdotique aux régimes de reproduction (ou systèmes de pollinisation). Pourtant, et de manière assez inattendue, le système de reproduction se révèle un trait pertinent structurant les communautés végétales. Par exemple, le caractère « type sexuel » (dioïque versus hermaphrodite) s’est révélé être le meilleur prédicteur du stade de succession dans les forêts tropicales en Centrafrique [19]. En utilisant un jeu de données de plus de 600 000 arbres et des informations historiques documentant les zones récemment colonisées, Rejou-Méchain et Cheptou [19] ont montré que les espèces dioïques étaient surreprésentées dans les jeunes stades de succession.
En 2006, un article important sur l’influence mutuelle des pollinisateurs et des plantes dans un contexte de déclin des pollinisateurs a été publié [13]. Dans leur étude, les auteurs ont comparé la composition en plantes à la composition en abeilles et en syrphes en Grande-Bretagne et dans les Pays-Bas, à plusieurs décennies d’intervalle (avant et après 1980). Ils ont observé un déclin parallèle des pollinisateurs et des plantes pollinisées par les insectes, démontrant ainsi que la composition en plantes et celle en pollinisateurs sont interdépendantes dans les écosystèmes. Il serait tentant de conclure que le déclin des pollinisateurs (causé par des facteurs externes) est la cause des changements observés dans la communauté végétale. Cependant, les auteurs concluent que leurs données ne permettent pas d’affirmer que le déclin des plantes pollinisées par les insectes précède la perte des pollinisateurs associés ou inversement. Dans une étude en milieu urbain Brys et Jacquemin ont comparé des populations urbaines fragmentées (où l’activité de pollinisation est faible) aux populations rurales non fragmentées (où l’activité des pollinisateurs est élevée) de l’espèce Centaurium erythreae [20]. Ils ont observé que les plantes provenant d’environnements fragmentés présentaient une plus faible distance entre les anthères (fonction mâle) et les stigmates (fonction femelle) — c’est-à-dire une herkogamie réduite — et une plus grande capacité d’autofécondation que les plantes issues de populations non fragmentées (Figure 1), suggérant une évolution rapide du système de reproduction liée aux conditions urbaines. Par ailleurs, dans une synthèse bibliographique portant sur une vingtaine d’espèces présentes en milieux perturbés et en milieux plus « naturels », il a été montré que, pour chaque espèce, les populations des milieux perturbés exhibaient un taux d’autofécondation plus élevé que celles des milieux naturels [21]. Bien que l’on n’ait aucune idée des facteurs précis affectant le taux d’autofécondation dans cette étude, ce résultat a le mérite de montrer que, d’une manière générale, la situation perturbée est moins favorable à la fécondation croisée (allogamie) que la situation ancestrale naturelle.
Réduction de la distance anthère-stigmate chez Centaurium erythreae dans les populations urbaines. A gauche (a), dans les populations rurales, la forme de la fleur montre une séparation spatiale des organes mâles (étamines) et femelle (pistil) favorisant l’allogamie, tandis que dans les populations urbaines (à droite, b) la proximité des organes mâles et femelles favorise l’autofécondation (modifié de [20]).
2.2. Élements de théorie sur l’évolution des systèmes de reproduction et l’influence de la pollinisation
L’écologie de la pollinisation a développé des mesures pour estimer la limitation par le pollen dans les populations naturelles. Les paramètres de pollinisation, ainsi que la manipulation de la pollinisation pour y parvenir, sont résumés dans [21]. La mesure de la capacité à produire des graines des fleurs auxquelles on a retiré la fonction mâle (émasculation), et la comparaison avec celle de fleurs non manipulées, permet d’évaluer la capacité à l’autofécondation autonome (assurance de la reproduction). L’assurance de reproduction induite par l’autofécondation est un paramètre clé dans l’évolution de cette autofécondation (voir [22]). D’une manière générale, cette évolution est régie par trois facteurs : la limitation de production de graines par une pollinisation incomplète (limitation pollinique), le coût de l’allofécondation (ou l’avantage automatique de l’autofécondation [23], qui favorise l’autofécondation, et la dépression de consanguinité, c’est-à-dire la baisse relative de la survie (ou de la croissance) des produits d’autofécondation par rapport aux produits d’allofécondation, qui contre-sélectionne l’autofécondation. Le coût de l’allofécondation traduit le fait que la transmission des gènes d’un génotype autogame est plus efficace que celle d’un génotype allogame car le génotype autogame met deux copies (contre une seule pour le génotype allogame) dans chacune de ses graines. Si on fait l’hypothèse que les deux types de génotypes envoient du pollen de manière égale pour polliniser les ovules dans la population, il en résulte un avantage de 3/2 pour l’autofécondation relativement à l’allofécondation. La valeur sélective d’un génotype pratiquant un taux s d’autofécondation dans une population pratiquant un taux moyen peut s’écrire comme suit :
| (1) |
Où f est le nombre d’ovules par plante, 𝛿 la dépression de consanguinité, et e le taux de pollinisation en allofécondation (0 < e < 1).
L’analyse de ce modèle montre que l’autofécondation est sélectionnée si 𝛿 < 1 − e/2 [22]. On voit que l’autofécondation évolue d’autant plus facilement que la limitation pollinique est grande (e faible). Ainsi, si le déclin des pollinisateurs se traduit par une limitation plus élevée du pollen, nous pouvons faire la prédiction générale que la pression de sélection vers l’autofécondation devrait être plus forte que dans la situation « avant déclin ».
3. Évolution rapide d’un syndrome d’autofécondation (ou la rupture de la relation plante-pollinisateur) chez Viola arvensis
3.1. L’écologie de la résurrection comme méthode d’investigation de l’évolution rapide
Une méthodologie récente appelée « écologie de la résurrection » a été développée au cours des dix dernières années afin d’étudier l’évolution rapide, c’est-à-dire opérant sur quelques dizaines de générations. Le principe de la méthode est d’exploiter et d’amplifier la conservation de formes dormantes, vivantes (kystes, spores, graines, etc.). Ceci permet d’avoir accès aux phénotypes issus de génotypes anciens. Ceux-ci peuvent alors être comparés à leurs descendants, échantillonnés dans la même population, des dizaines d’années plus tard [25]. En comparant les génotypes anciens et actuels de manière synchrone dans un même environnement, cette méthode permet d’exclure le rôle de la plasticité dans les différences phénotypiques observées (composante environnementale du phénotype) et accéder à la différenciation génétique entre phénotypes anciens et actuels, c’est-à-dire l’évolution. Il convient de souligner que l’utilisation du terme « résurrection » (traduit de l’anglais), qui suggère que l’on ressuscite un organisme façon Jurassic Park (film réalisé par S. Spielberg en 1993), est abusif dans la mesure où les formes utilisées ne sont pas mortes mais en vie ralentie avec un métabolisme très bas. L’utilisation de marqueurs génétiques neutres permet de retracer l’histoire de la population étudiée, notamment de savoir si la population actuelle est effectivement constituée de descendants de la population ancêtre, et dans quelle mesure ces descendants sont affectés pas les flux de gènes, les goulets d’étranglement, et éventuellement la recolonisation. De manière formelle, la comparaison des différenciations neutres (FST) et des traits quantitatifs potentiellement sous sélection (QST) entre génotypes anciens et récents permet de conclure à l’existence d’une sélection directionnelle ou stabilisante sur les traits phénotypiques d’intérêt des organismes étudiés. L’écologie de la résurrection a été utilisée chez les crustacés [26] et la méthode commence à être utilisée chez les plantes [27]. Chez les plantes, le facteur limitant est le plus souvent la disponibilité de graines anciennes. Cependant, en France, la présence de Conservatoires botaniques nationaux sur l’ensemble du territoire a permis la constitution de banques de graines ex situ, qu’il est possible d’utiliser pour ces études d’écologie de la résurrection [28, 29, 30, 31].
Dans l’une de ces études, quatre populations de la pensée des champs (Viola arvensis) ont été étudiées en Île de France (Tableau 1) [24]. C’est une espèce annuelle, diploïde (2n = 34) qui est présente majoritairement dans les cultures d’hiver (blé, orge, colza, etc.). Elle est décrite comme partiellement autogame [31].
Populations de Viola arvensis de l’Île de France étudiées dans l’étude [24] : situations géographique (ligne 1) et taux d’autofécondation dans les populations ancestrales, collectées entre 1991 et 2000 (ligne 2) et récentes, collectées en 2021 (ligne 3)
| Population | Commeny (Co) | Crouy (Cr) | Guernes (Gu) | Lhuis (Lh) |
|---|---|---|---|---|
| Coordonnées | (49° 7′37.11′ ′N, 1° 53′46.30′ ′E) | (49° 24′24.31′ ′N, 3° 22′20.73′ ′E) | (49° 1′10.75′ ′, 1° 38′46.82′ ′E) | (49° 16′35.40′ ′N, 3° 32′58.52′ ′E) |
| Taux d’autofécondation ancestral réalisé (I.C) | 0.77 (0.68–0.82) | 0.66 (0.60–0.76) | 0.44 (0.34–0.61) | 0.33 (0.21–0.47) |
| Taux d’autofécondation récent réalisé (I.C) | 0.89 (0.85–1) | 0.70 (0.65–0.76) | 0.81 (0.73–0.86) | 0.88 (0.81–0.94) |
3.2. Mesure de l’autofécondation ancestrale et actuelle
L’utilisation de marqueurs neutres co-dominants (microsatellites, Cheptou et al. [31]) a permis de déterminer l’autofécondation réalisée, dans les populations naturelles, par les populations anciennes et leur population récente correspondante. La mesure de l’hétérozygotie et de l’écart à l’hétérozygotie attendue à l’équilibre d’Hardy-Weinberg (FIS) permet d’évaluer le régime d’autofécondation. Dans une population à l’équilibre, le taux d’autofécondation, s = 2 ⋅ FIS/(1 + FIS) [32]. Le Tableau 1 fournit les données d’autofécondation pour les quatre populations. Il apparait que, dans chacune des populations, l’autofécondation a augmenté entre la date de premier échantillonnage et 2021. L’autofécondation était en moyenne de 50 % dans les populations ancestrales, elle est d’environ 75 % en 2021. Cette augmentation de l’autofécondation peut être le résultat d’une activité plus faible des pollinisateurs en 2021, cohérente avec le déclin des pollinisateurs (plasticité). Elle peut aussi être le résultat d’une évolution des traits favorisant l’autofécondation chez la pensée (évolution), les deux hypothèses n’étant pas mutuellement exclusives. La mise en évidence d’une évolution de traits nécessite la comparaison des génotypes en environnement commun (voir sous-section suivante).
3.3. Évolution du syndrome d’autofécondation
Ces traits ont été mesurés en environnement commun, dans les serres du terrain d’expérience du Labex CEMEB [24]. Dans ce genre d’expérimentation, deux générations de cultures sont effectuées afin de minimiser les effets maternels et ainsi isoler la composante de génétique quantitative des traits mesurés avant de conclure à une éventuelle évolution de ces traits. En effet, si, par hasard, les conditions environnementales (météorologiques par exemple) sont très différentes aux deux dates d’échantillonnage, il est possible que les variations de traits que l’on observe soient liées à l’environnement maternel de la graine et non à la constitution génétique des individus. Une première génération, dite de rafraîchissement, est faite en laissant les individus (n = 32 par lot) se reproduire librement à l’intérieur des lots. Elle permet de produire des graines dans un environnement commun tout en conservant l’intégrité du patrimoine génétique de chaque lot. En 2021, les plantes ont été cultivées en jardins communs et pollinisées librement au sein de chaque lot par des bourdons (Bombus Terrestris, Natupol Koppert, France). Les graines ainsi produites ont été cultivées en serre dans un dispositif comprenant 20 familles par lot et 5 plantes par famille, soit un total de 800 plantes.
Au printemps 2022, la date de floraison a été mesurée et une batterie de traits floraux a été mesurée : affichage floral (nombre de fleurs ouvertes simultanément), taille des corolles, taille des sépales, déhiscence, quantité de nectar produite, etc. (voir [24] pour les détails). Le résultat général de l’étude est que de nombreux traits floraux ont évolué entre les ancêtres et les descendants. Ces changements sont globalement cohérents : ils indiquent que la pensée est en cours d’évolution vers un syndrome d’autofécondation. De manière frappante, les tailles de fleurs ont diminué d’environ 10 % et la production de nectar a chuté de 20 % (voir Figure 2). Les traits non-floraux mesurés (taille de rosette ou taille du calice) n’ont pas montré de variation cohérente. Ceci permet aux auteurs de conclure que c’est bien les traits floraux, impliqués dans l’interaction plante-pollinisateur, qui ont évolué de manière directionnelle. Les auteurs ont ensuite effectué des expériences de choix par les pollinisateurs Bombus terrestris en plaçant un bourdon face à un mélange de génotypes anciens et actuels (dans les mêmes proportions) de la même population. De manière intéressante, les bourdons visitent significativement plus fréquemment les fleurs des génotypes anciens.
Évolution des traits floraux chez Viola arvensis (a) Taille des fleurs et (b) production de nectar (sommée sur trois fleurs par individu) pour les quatre populations d’Île de de France de Viola arvensis (Co = Commeny ; Cr = Crouy ; Gu = Guernes ; Lh = Lhuys). « A » (▴) population ancestrale et « 21 » (●) population actuelle.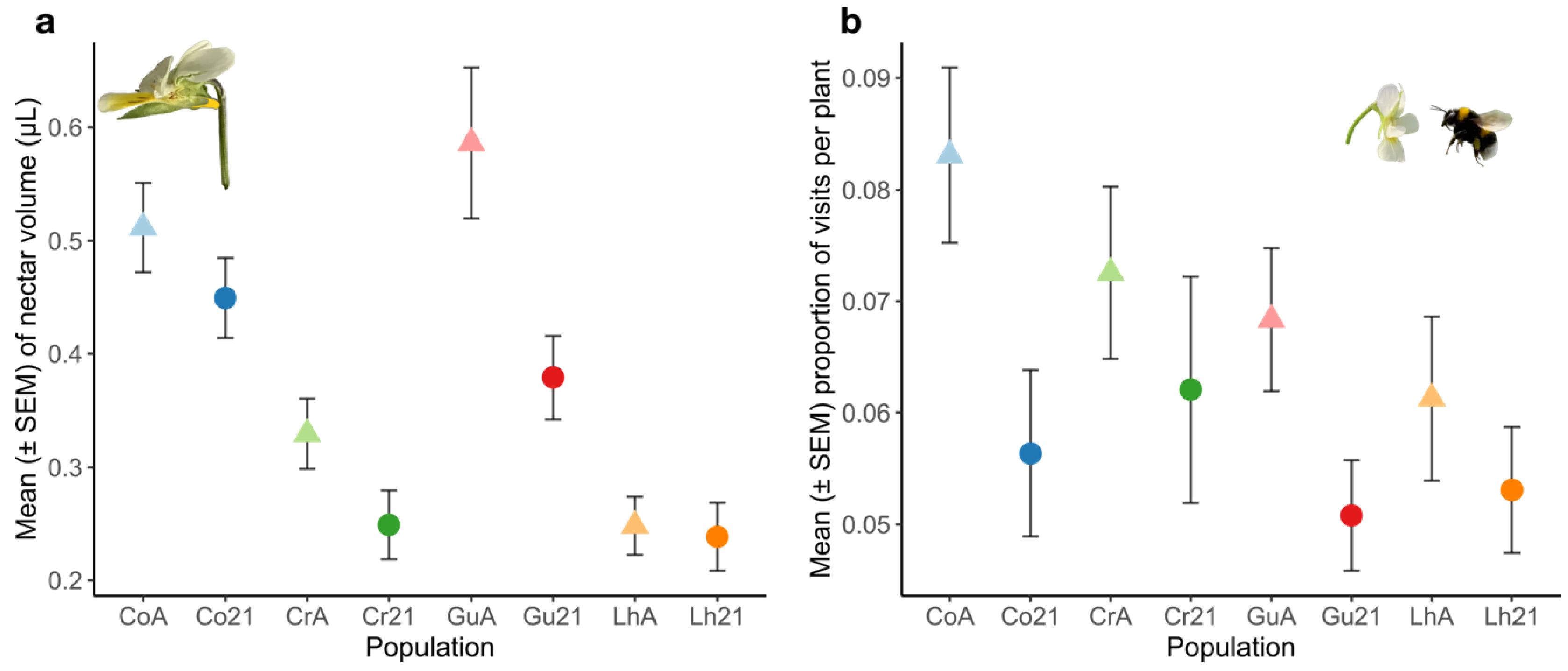
Cela démontre que les populations de Viola arvensis sont en cours d’évolution vers une rupture de l’interaction plante-pollinisateur et l’étude suggère que le déclin des pollinisateurs serait la cause de cette évolution.
4. Dynamique éco-évolutive et modèle de sauvetage évolutif : l’évolution rapide permet-elle aux populations d’échapper à l’extinction ?
L’exemple de l’évolution des traits floraux constitue un cas d’école pour étudier les bouleversements au sein des écosystèmes. À l’échelle intraspécifique, en modifiant le régime de consanguinité de l’espèce, elle est susceptible d’induire des changements dans la valeur sélective des descendants (dépression de consanguinité), et éventuellement d’affecter sa capacité à s’adapter dans le futur [33]. À l’échelle des écosystèmes, dans la mesure où les interactions plantes-pollinisateurs constituent une relation trophique fondamentale, cette évolution est susceptible d’affecter les cascades trophiques au sein de ces derniers.
4.1. Évolution de l’interaction plante-pollinisateur
La relation plante-pollinisateur est une des caractéristiques fondamentales des angiospermes, dont l’évolution a débuté il y a quelque cent millions d’années [34]. Les insectes constituent la grande majorité des pollinisateurs avec plus de 80 % des interactions de pollinisation. C’est, dans le cas général, une relation à bénéfice réciproque, où l’insecte se nourrit du pollen et du nectar tandis qu’il transporte les gamètes mâles (dans le grain de pollen) des plantes, permettant ainsi la reproduction croisée. L’évolution du syndrome d’autogamie, avec une production réduite de nectar de 20 %, met en danger la stabilité de la relation plantes-pollinisateurs. Si on fait l’hypothèse que l’évolution de ce syndrome a été causée par le déclin des pollinisateurs rapporté depuis plusieurs décennies, nous pouvons faire l’hypothèse que la réduction de la production de nectar pourrait à son tour accélérer le déclin des pollinisateurs, et par là l’évolution du syndrome d’autofécondation. Nous décrivons donc une boucle de rétroaction positive (Figure 3) dont l’issue serait la rupture totale de l’interaction. En tant que producteur primaire, l’évolution des plantes pourrait ainsi affecter les populations de pollinisateurs et éventuellement se répercuter dans les niveaux trophiques supérieurs (oiseaux, etc.). À ce stade, il est donc important de savoir si ce résultat est général chez les plantes à fleurs en étudiant d’autres taxons, éventuellement dans des milieux où la pollinisation est plus ou moins affectée (voir [35]).
Scénario hypothétique de l’emballement du déclin des pollinisateurs et du syndrome d’autofécondation chez les plantes. Le déclin des pollinisateurs induit une sélection vers une reproduction par autofécondation chez les plantes qui se traduit en particulier par une baisse de la récompense aux pollinisateurs (nectar), laquelle renforce le déclin des pollinisateurs et par là le syndrome d’autofécondation (boucle de rétroaction positive).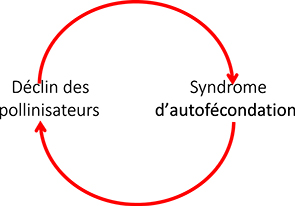
La déstabilisation de la relation plantes-pollinisateurs mise en évidence par l’évolution chez Viola arvensis pourrait avoir des conséquences importantes sur les services de pollinisation à l’agriculture. Il est en effet avéré que les plantes adventices permettent le maintien des populations de pollinisateurs [36]. Une baisse importante des services de pollinisation aurait des conséquences importantes sur la production agricole (par ex : colza, tournesol, vergers [35]).
Si les effets du déclin des pollinisateurs ont d’abord été envisagés à l’échelle des assemblages d’espèces [13], l’exemple de Viola arvensis montre que les processus évolutifs sur des temps courts (moins de 30 ans) ont des conséquences non-négligeables sur le fonctionnement des écosystèmes. De manière intéressante, une étude a porté sur la variation de la production de nectar à l’échelle d’une prairie au cours du temps, liée au changement des communautés [37]. Les auteurs concluent à des variations, en général à la baisse, de 10 à 20 % de la production de nectar sur une trentaine d’années, soit l’ordre de grandeur que l’on retrouve du fait de l’évolution à l’échelle infra-spécifique. L’évolution de Viola arvensis constitue un exemple frappant de rétroaction éco-évolutive, où l’évolution ne peut pas être négligée dans le fonctionnement des systèmes écologiques.
4.2. Modèle de sauvetage évolutif : l’évolution de l’autofécondation face au déclin des pollinisateurs
Si l’évolution rapide face aux changements environnementaux récents a été maintenant bien documentée sur le plan empirique [39, 40], la question de savoir si cette évolution constitue un rempart contre l’extinction est clairement bien moins documentée, excepté en conditions expérimentales de laboratoires, en général sur des microorganismes [8]. Sur le plan théorique, le modèle de sauvetage évolutif est un modèle conceptuel récent qui permet d’appréhender cette question [38]. L’idée de ce modèle est que, face à un changement environnemental (hausse des températures, fragmentation, pollution …), l’adaptation génétique (c’est à dire l’évolution) peut permettre un évitement de l’extinction pour des populations qui, sans elle, seraient vouées à l’extinction (voir Figure 4). Ce modèle met en lumière plusieurs conditions au sauvetage. D’abord, l’évolution n’est possible que s’il existe une variance génétique sur les caractères phénotypiques susceptibles d’évoluer dans les populations. Ceux-ci peuvent préexister aux changements, mais peuvent aussi être le fait de mutations de novo dans le génome qui vont générer de nouveaux phénotypes. La quantité de variation conditionne la vitesse d’adaptation des populations aux nouvelles conditions. La taille de la population est aussi importante. En effet, une grande taille de population augmentera la probabilité d’obtenir une mutation favorable. Par ailleurs, pour les petites populations, la baisse transitoire de la taille de la population peut aussi engendrer une extinction par hasard (stochasticité démographique), alors qu’une population présentant les mêmes caractéristiques mais plus grande aurait échappé à l’extinction. Les expériences réalisées essentiellement en laboratoire ont globalement validé le modèle théorique : le sauvetage est d’autant plus probable que les populations sont grandes et que la variation génétique est substantielle dans les populations considérées [12]. Dans une étude d’écologie de la résurrection chez le bleuet (Cyanus segetum) [30], les auteurs ont montré que l’évolution de l’avancée de la floraison et l’évolution d’une plus grande taille de capitules se traduisaient par une meilleure production de graines par les individus, ce qui suggère que l’évolution de la phénologie et la taille des capitules pourraient produire un sauvetage évolutif pour les populations de bleuet (Figure 5).
Modèle du sauvetage évolutif (d’après [38]). Après un changement environnemental (par exemple, un changement climatique, une pollution, etc.). Sur le graphique de gauche, une population incapable de s’adapter au nouvel environnement (sans évolution) est vouée à une extinction certaine (déterministe). Sur le graphique de droite, l’adaptation rapide de la population au nouvel environnement (évolution) peut permettre de recouvrer une population viable (courbe du haut). En cas d’adaptation moins rapide (courbe du bas), la taille de la population peut être fortement réduite. Au-dessous du seuil critique Nc, la population peut éventuellement disparaître de manière stochastique durant la période à risque.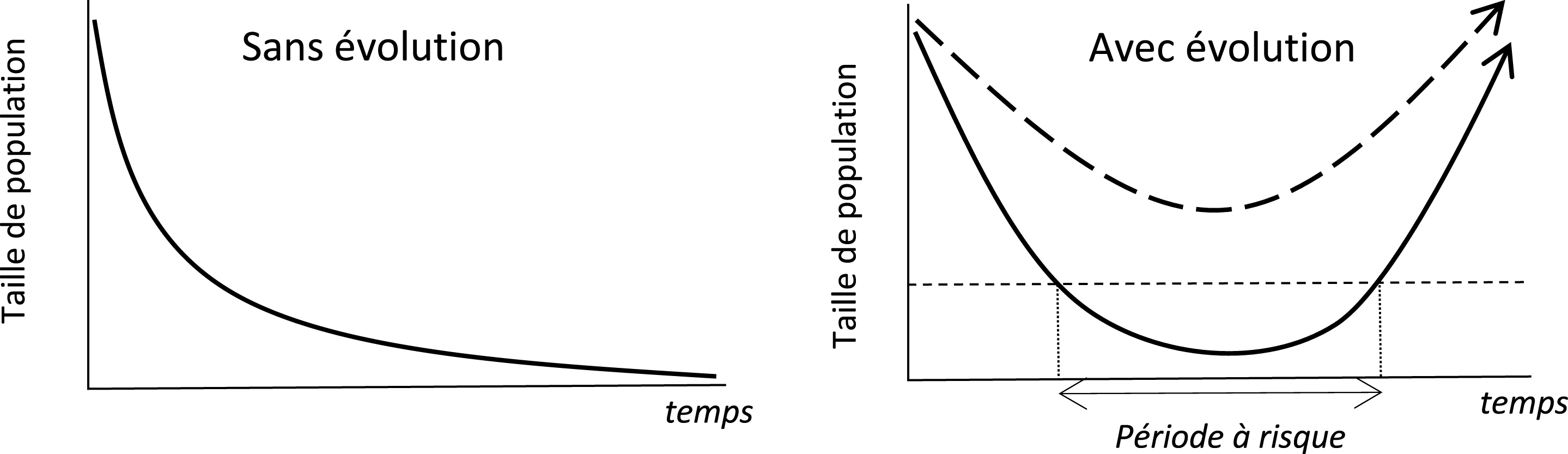
Relations d’une part entre la phénologie de floraison et la valeur sélective (A), et d’autre part entre la taille des capitules et la valeur sélective (B) chez le bleuet (Cyanus segetum), mesurées en jardin commun dans le sud de la France. Les trois courbes correspondent à 3 populations originaires du sud, de l’ouest et du nord de la France. Les gradients de sélection ont été calculés en estimant la valeur sélective comme le nombre moyen de graines multiplié par le nombre de capitules. Les zones ombrées indiquent l’écart type à 95 % (modifié de [30]).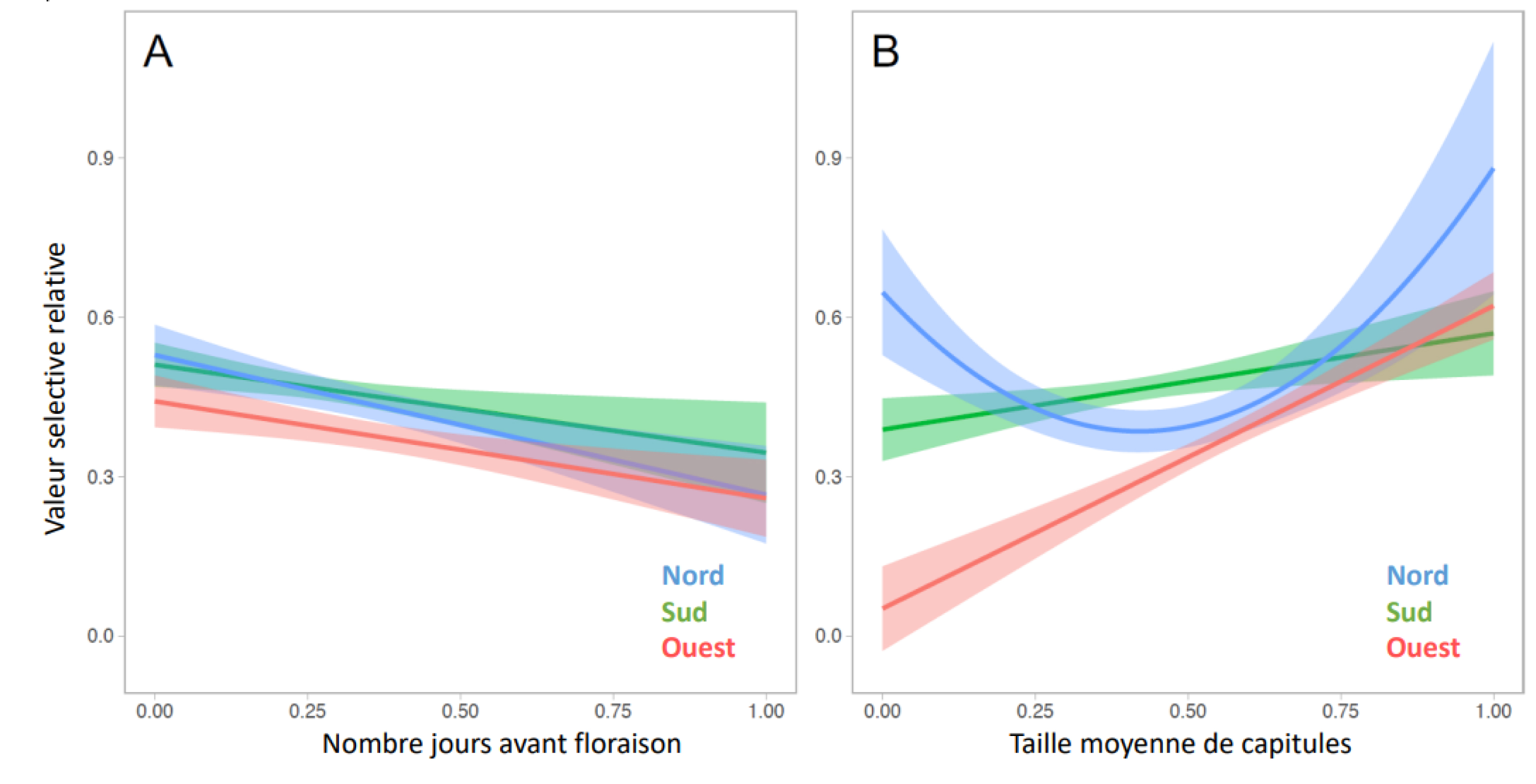
Cependant, le modèle de sauvetage évolutif fait l’hypothèse implicite que toute adaptation par sélection naturelle entrainera un renforcement de la démographie. Cela est vrai pour un certain nombre de caractères phénotypiques pour lesquels la sélection optimise la démographie. Cependant, pour certains caractères gouvernés par une sélection fréquence-dépendante, c’est-à-dire par le fait que la valeur sélective d’un individu dépend des traits des individus de la population, ce résultat n’est, en général, pas vrai [41]. Dans ce cas, le trait sélectionné n’est pas le trait optimal pour la population mais celui qui ne peut être envahi par des stratégies alternatives (Stratégie Evolutivement Stable, Maynard Smith [42]). L’exemple du jeu « faucon-colombe » illustre de manière imagée ce point. Dans ce jeu, issu de la théorie des jeux, John Maynard Smith modélise le comportement de partage des ressources dans une population. Les acteurs peuvent jouer soit la stratégie « colombe », stratégie pacifique, partageant les ressources, soit la stratégie « faucon », stratégie agressive pour la préemption des ressources, sans partage. On comprend que la stratégie faucon peut facilement s’imposer parmi les colombes. Une population composée de colombes fournit néanmoins de meilleures performances, favorables à l’ensemble de la population. Ainsi, la stratégie colombe est envahissable par la stratégie faucon, menant l’ensemble de la population vers la stratégie faucon, non envahissable mais non optimale [42]. Le cas de l’évolution de l’autofécondation illustre en partie ce cas. Face au déclin des pollinisateurs, il apparait intuitif de penser qu’une évolution vers un régime d’autofécondation, qui permet la production de graines de façon autonome, permet le sauvetage évolutif des populations. Darwin avait d’ailleurs émis cette hypothèse et supposait que même si les effets de la consanguinité liés à l’autofécondation sont délétères, produire des graines par autofécondation apparait la stratégie adaptée en l’absence de pollinisateurs [43]. L’examen plus précis de cet argument montre que ce n’est pas forcément le cas [44]. La raison réside dans le fait que l’évolution de l’autofécondation est régie par une sélection fréquence-dépendante, c’est-à-dire que la valeur sélective d’un individu dépend de la stratégie d’autofécondation adoptée par les autres individus dans la population. En effet, dans l’équation (1) on voit que la valeur sélective individuelle dépend du taux d’autofécondation moyen . L’équation (1) montre que le critère d’évolution de l’autofécondation est 𝛿 < 1 − e/2.S’il l’on ecrit le taux d’accroissement d’une population partiellement autogame, celui-ci s’écrit :
| (2) |
Évolution de l’autofécondation et ses conséquences sur la démographie. L’évolution de l’autofécondation est basée sur le modèle fondateur développé par David Lloyd [22] où l’évolution est déterminée par le coût de l’allofécondation, la dépression de consanguinité (δ) et le taux de pollinisation (e) (voir texte principal). La ligne noire épaisse sépare la zone d’évolution de l’autofécondation de la zone d’évolution de l’allofécondation dans l’espace des paramètres e, δ. La ligne noire fine sépare la zone où le taux d’accroissement de la population augmente avec la stratégie d’autofécondation sélectionnée de la zone où le taux d’accroissement diminue avec la stratégie d’autofécondation sélectionnée.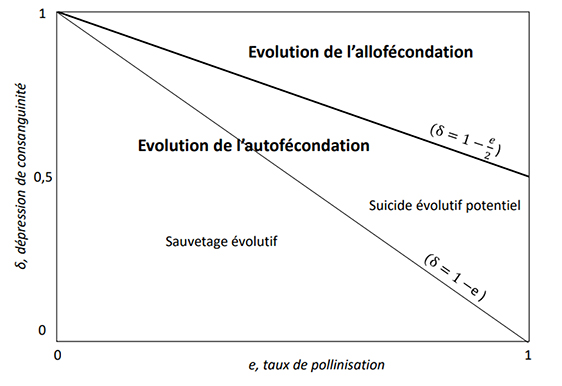
Ainsi, l’évolution du syndrome d’autofécondation mis en évidence chez Viola arvensis ne garantit pas que celle-ci permettra un sauvetage évolutif. Une étude démographique comparant les populations récentes plus autogames aux populations anciennes permettrait d’évaluer la possibilité d’un sauvetage évolutif par l’autofécondation chez Viola arvensis.
5. Reflexions sur l’évolution rapide et ses approches dans une période de crise écologique
5.1. Rien n’a de sens en évolution, sauf à la lumière de la biologie
Les résultats obtenus chez Viola arvensis fournissent une image assez claire de l’évolution récente : en développant des traits favorables à l’autofécondation, l’espèce est en cours d’évolution vers une rupture d’interactions avec les pollinisateurs. Ce résultat est-il généralisable à toute espèce de plante hermaphrodite subissant le déclin des pollinisateurs ? Actuellement, le trop faible nombre d’études sur le sujet ne permet pas de répondre à cette question. Cependant, il est important de noter qu’un résultat inverse, c’est-à-dire une sélection vers le renforcement de traits d’attraction des pollinisateurs, a été montré chez le Bleuet (Cyanus segetum). Dans une étude d’écologie de la résurrection, Thomann et al. [28, 29] ont montré que le bleuet avait évolué vers des tailles de capitules plus importantes et un affichage floral plus important, deux caractères qui favorisent l’attraction des pollinisateurs. Selon les auteurs, la raison tient dans le fait que le bleuet est une espèce strictement allogame, auto-incompatible, pour laquelle il n’existe probablement pas de variant capable d’autofécondation. Dans cette situation, la sélection favorise l’augmentation de l’attraction [46]. Il est en effet généralement admis que les systèmes d’auto-incompatibilité chez les plantes sont des systèmes avec une architecture génétique complexe. Les cas de rupture de systèmes d’incompatibilité sont possibles mais en général sur des temps long [47]. On voit à travers cet exemple que la réponse adaptative au déclin des pollinisateurs dépend de la biologie de l’espèce à laquelle on s’intéresse. Si l’espèce est capable d’autofécondation, il est raisonnable de penser que le déclin des pollinisateurs sélectionnera un syndrome d’autofécondation. Si l’espèce est strictement allogame et auto-incompatible, on peut faire l’hypothèse que, à court terme, nous n’observerons pas d’évolution de syndrome d’autofécondation.
5.2. Evolution expérimentale versus écologie de la résurrection
Comme dit en introduction, l’évolution expérimentale a émergé depuis une vingtaine d’années dans les sciences de l’évolution, en partie du fait de la préoccupation de l’adaptation au changement climatique. Ces études ont fait émerger un nouveau paradigme : l’évolution par sélection naturelle peut être perceptible après un petit nombre de générations. Ainsi, des programmes d’évolution expérimentale ont été engagés sur des plantes annuelles, ou des plantes au cycle modifié pour boucler l’ensemble du cycle de vie en quelques semaines (ex : fast cycling Brassica rapa, [10]). Dans ces expériences, le grand avantage de la méthode est que l’environnement est parfaitement contrôlé, et le plan d’expérience permet de conclure de manière formelle à l’influence de tel ou tel facteur. A contrario, les études de résurrection se présentent comme des observations d’évolution dans la nature où le biologiste ne contrôle pas la présence ou l’absence de tel ou tel facteur. Il s’agit donc d’une démarche inférentielle où l’on peut a posteriori tester l’influence supposée d’un facteur environnemental, par exemple, le réchauffement climatique. Dans une période de crise et d’urgence écologique, la méthode de résurrection présente l’immense intérêt de montrer une image fidèle des adaptations sur les dernières décennies. Les travaux d’évolution expérimentale simulent un effet supposé, souvent simplifié, des changements environnementaux. L’extrapolation à l’évolution en milieu naturel est souvent difficile. À titre d’exemple, simuler un réchauffement moyen de 2,5 °C dans une serre ne traduit pas l’ensemble des facteurs afférents telles que l’hétérogénéité temporelle, la modification des mouvements de convexion qui, de toute évidence, affectent la physiologie des plantes. Ainsi, nous sommes face à deux approches, une approche rassurante scientifiquement, issue de la tradition hypothético-déductive, qui à mon sens dit peu des changements dans la nature, et une approche inférentielle, dont les facteurs de sélection sont sujet à interprétation, mais fidèles aux changements réels. Cette dernière approche bouscule l’approche hypothético-déductive qui s’est imposée dans les sciences écologiques depuis 50 ans. Si l’évolution expérimentale peut parfaitement être associée à des études d’évolution en milieux naturels, il m’apparait important de ne pas s’éloigner de l’évolution in natura. À ce titre, lors du congrès de Société Européenne d’Évolution à Prague en 2022, il était notable que l’évolution expérimentale prenait clairement le pas sur les études en populations naturelles (observation personnelle). Il y a là, à mon sens, un risque inquiétant de déconnexion avec le monde réel dans une période où nous avons besoin de documenter les évolutions de la biodiversité et leurs impacts sur les écosystèmes.
5.3. Bases biologiques des changements observés
Reconnaitre que les processus évolutifs peuvent agir sur de courtes échelles de temps constitue un changement de paradigme dans les sciences de l’évolution. En quelque sorte, ce résultat défie le paradigme classique en évolution. En effet, nous attendons que les traits phénotypiques sous forte sélection stabilisante (phénologie, traits d’histoires de vie) ne présentent plus de variance génétique additive [48]. Or, les systèmes empiriques montrent que la sélection opère sur ces traits et même de manière assez efficace et rapide [5]. Dans une expérience d’évolution expérimentale chez Mimulus guttatus [9], il a même été montré que, après 5 générations de sélection, la variance génétique additive des traits floraux a augmenté. Si ce type de résultats n’est pas fondamentalement en désaccord avec la théorie de la génétique quantitative, il suggère toutefois que des mécanismes autres que la simple variation de séquence ADN pourraient être à l’œuvre dans l’évolution rapide. Il a notamment été montré [49] que la plasticité transgénérationnelle, c’est-à-dire l’héritage d’un caractère généré par l’environnement (plasticité), peut se transmettre à la génération suivante, facilitant ainsi l’évolution rapide [50]. Ces phénomènes épigénétiques, dont la méthylation de l’ADN constitue l’une des bases biologiques, pourraient être déterminants dans l’évolution rapide et constituent à mon sens un champ d’investigation important pour le futur. L’héritabilité de l’épigénétique n’est sans doute pas aussi stricte que l’héritabilité de la séquence d’ADN mais peut parfois se maintenir sur quelques dizaines de générations [51], facilitant ainsi l’évolution à court terme.
6. Conclusion
Face aux changements environnementaux récents, nous avons maintenant de plus en plus de preuves que les organismes peuvent s’adapter par évolution en quelques dizaines de générations. Ceci constitue un résultat important pour les sciences de l’évolution et l’écologie. Classiquement, on a considéré que l’échelle des temps écologiques (dynamique démographique, assemblage des communautés) était courte par rapport à l’échelle des temps évolutifs (évolution darwinienne). Nous voyons que ces deux échelles de temps sont probablement plus imbriquées que nous le considérions par le passé. Ainsi, à l’image de l’évolution des traits floraux de Viola arvensis affectant la relation plante-pollinisateur, nous voyons que l’évolution est susceptible d’affecter les relations fonctionnelles au sein des écosystèmes.
Dans le cadre du changement climatique, l’idée que les espèces puissent s’adapter est considérée comme la possibilité pour les espèces de se maintenir dans l’environnement futur. Ceci n’est pas nécessairement le cas. D’abord, l’évolution d’une espèce est susceptible de déstabiliser les interactions entre espèces et ainsi de mettre en danger les espèces en interactions. Ensuite, adaptation darwinienne ne signifie pas nécessairement amélioration des performances démographiques et échappement de l’extinction à long terme [41]. En effet, certains traits soumis à une sélection fréquence-dépendante peuvent être sélectionnés positivement mais peuvent entrainer une diminution du taux d’accroissement de la population.
À travers l’exemple de Viola arvensis, on voit comment les trois composantes de la biodiversité : la diversité écologique, la diversité spécifique et la diversité génétique intraspécifique sont interdépendantes. Ainsi, tout stratégie de conservation doit intégrer, dans la mesure du possible, cette interdépendance.
Déclaration d’intérêts
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne reçoivent pas de fonds d’une organisation qui pourrait tirer profit de cet article, et n’ont déclaré aucune autre affiliation que leurs organismes de recherche.




 CC-BY 4.0
CC-BY 4.0