Are the tiger mosquito (Aedes albopictus), the giant tick (Hyalomma marginatum), the biting midge Culicoides imicola and the meadow spittlebug (Philaenus spumarius), all still unknown in Southern France a few years or decades ago, our new plagues of Egypt?
These four species of arthropods are related to vector-borne diseases (VBDs). The superlatives sometimes associated with these new scourges concerning the health of humans, animals and plants, reflect the concerns they generate in the general population, among livestock breeders, farmers and among decision-makers.
Enemies needing surveillance or a fight, against which we seem to be quite helpless, these vectors used as examples give us the opportunity to ask the following questions: how did we get there? What has led these arthropods and pathogens to become a threat?
Beyond the stereotypes on very real phenomena with serious consequences such as climate change, environmental modifications, changes in agricultural practices, urbanization, intensification of world trade, it is often the conjunction of a set of events, most of the time with a low probability of occurrence, which leads to the emergence of the transmission of a pathogen by a vector: insect, mite, mollusc, nematode (see definition below). In other words, the worst is never sure, but it is the worst that holds our attention as humans, when we are directly concerned.
For humans only, the World Health Organization (WHO) estimates that vector-borne diseases (such as malaria, dengue, Chagas disease, leishmaniosis, human African trypanosomiasis) account for more than 17% of infectious diseases and are responsible for more than 700,000 deaths per year worldwide. Economic costs of human VBDs (surveillance, medical and non-medical costs, vector control, productivity losses) account for billions of euros annually.
Moreover, the economic consequences of some of these vector-borne diseases on agriculture and livestock production are colossal. They have key direct macro-economic impacts: morbidity of livestock, economic losses such as reduced production and farm income, ban on livestock and semen trade, imposed quarantine, costs of biological tests, surveillance and control measures. For example, in Germany and in the Netherlands [1, 2], the impact of Bluetongue on cattle was estimated upwards of hundreds of million Euros. In the field of plant health, Citrus greening (Huanglongbing disease, HLB) caused by Candidatus Liberibacter spp. transmitted by psyllids, is the most destructive citrus pathosystem worldwide with an estimated cost for Florida of $8.92 billion in revenue and $4.62 billion in gross domestic product between the 2006/2007 and 2010/2011 crop productions [3]. Sharka, caused by Plum pox virus transmitted by Aphididae, is the most devastating disease of stone fruit trees. It generates annual losses accounting for hundreds of millions of euros [4].
In addition, there are also indirect socio-economic impacts that concern any VBDs affecting plants animals or humans: inability of breeders, farmers, workers to achieve daily demands, disruption of market chains, and concerns of consumers and citizens regarding health threats and environmental issues (concerns of contracting disease, change in consumption habits, public authorities questioned on use of insecticides, vaccines, massive culling, environmental and sanitary side effects), costs of surveillance and tests for the (early) detection of the disease to avoid large outbreaks etc.
Risk assessment, prevention and control of these emerging diseases or their invasive vectors are major health, ecological, social and economic challenges. The most problematic recent examples in metropolitan France concern dengue fever, Zika disease, chikungunya, West Nile fever, arboviruses transmitted by sandflies, Lyme disease, as far as humans are concerned; Bluetongue, Crimean-Congo hemorrhagic fever although it is a zoonosis, African swine fever, anaplasmosis, for livestock; numerous viral (e.g. Sharka, tomato leaf curl New Delhi virus), phytoplasma (e.g. flavescence dorée) and bacterial (e.g. Xylella fastidiosa, Citrus greening) diseases for wild and cultivated plant species. In the absence of effective control measures (curative treatments, biocides, vaccines), prevention, reduction, and risk mitigation requires the identification of colonization routes, the early detection of introduction, and an efficient control of vectors. Currently, vector control is mostly based on the use of polluting chemical insecticides against which arthropods develop resistance. A dramatic change in approaches and practices is needed and requested by society that wants healthier environment and better health. This is an objective of many French Regions, of the European Union with the Green deal, and of the United Nations in a “One Health” strategy integrating sustainable development goals.
However, years of research and development efforts have not been able to entirely solve the problems and there is a perpetual arms race between humans, vectors and pathogens. New tools are being developed (not all of them are consensual), or are yet to be invented: diagnostics, treatments, green chemistry, plant-based insecticides, traps, competitors, parasites, predators, sterile insect techniques, transgenesis, transmission-blocking vaccines, insect densoviruses, Wolbachia endosymbionts, microbiota, repellents, but also education, behavioral approaches, participatory sciences and risk modeling. An effort is also needed to better understand processes of emergence for better prediction and prevention.
We will take some historical and contemporary examples, particularly from the south of France (the Mediterranean coast from the Spanish to the Italian borders, covering two regions: Occitanie and Provence-Alpes-Côte-d’Azur), regarding human, animal and plant health to illustrate how and why an arthropod or a pathogen emerges from anonymity and becomes a public enemy. From these models, we will see the conditions necessary for these emergences to occur, and speculate on the future.
Definition of a vector
A vector is any organism that actively transmits an infectious agent from one host to another (either animal or plant).
The concept of active transmission requires that the vector, through its behaviour, allows the transmission of an infectious agent by taking it from one host and transmitting it to another host. The infectious agent may or may not multiply in the vector. This definition therefore excludes most intermediate hosts that passively release infectious agents into the environment.
1. Spreading of primate Flaviviruses by Aedes aegypti and Aedes albopictus mosquitoes
Yellow fever (YF) was among the most devastating mosquito borne diseases, in Africa, in the Americas and even in some European ports, during centuries. Its story sheds light on the mechanisms of the emergence, establishment and spread of a zoonosis from African forests to American cities. Unfortunately, what happened five centuries ago can happen again, as the following examples show.
Natural history of yellow fever in Africa has been deciphered decades ago [5]. The YF virus circulates in African forests from monkey to monkey, transmitted by forest mosquitoes belonging to the genus Aedes (Ae. africanus, Ae. luteocephalus, Ae. furcifer, Ae. simpsoni s.l., Ae. opok, etc.), with incursions into villages where rural domestic anthropophilic Ae. aegypti are established, and able to replicate and transmit YF virus [6]. The virus, once in humans, is introduced through the movement of humans into African cities, where it finds urban Ae. aegypti populations able to generate outbreaks.
This human-adapted yellow fever virus and urban Ae. aegypti, were introduced into tropical America, via infected people and/or Ae. aegypti transported on ships, during the triangular slave trade, which started in the 16th century [7, 8]. Upon arrival to the Central and South American rainforests, the virus found both susceptible New World monkeys and new competent endemic mosquitoes from two genera, Sabethes sp. and especially Haemagogus sp. Yellow fever virus thus had two events of cross species transmission: African monkeys to American monkeys, African Aedes mosquitoes to American mosquitoes. New cycles of jungle yellow fever have thus developed, involving South American primates and tree-dwelling Haemagogus mosquitoes. Phylogenetically, the genus Haemagogus seems to be quite close to Aedes [9], which may explain the ability of Haemagogus species to often transmit the same viruses: yellow fever, dengue [10], Zika [11], and chikungunya [12], all introduced into South America.
At the same time, Ae. aegypti adapted to American cities, and even non-tropical locations were subject to yellow fever epidemics, such as the well-known Philadelphia epidemic in 1793 (5000 deaths).
This combination of both a sylvan and an urban cycle for yellow fever in the Americas regularly fuelled epidemics that greatly affected the history of colonization of the New World [13]. These cycles have spread throughout South and Central America, where they are still active, as shown by the 2016–2018 yellow fever epidemic in Brazil, with more than 700 deaths [14].
Interestingly, endemic yellow fever has never been reported in Asia, Madagascar or other Indian Ocean islands, for reasons that are still poorly understood. Primates (monkeys and humans) from these regions are susceptible, and Ae. aegypti and other experimentally competent Aedes mosquitoes are present there [15, 16, 17]. Importantly, Haemagogus sp. and Sabethes sp. are absent from Africa, the Indian Ocean and Asia.
Arthropod vectors of human, animal and plant diseases. A. Aedes (Stegomyia) albopictus, female ©Nil Rahola, IRD. B. Hyalomma marginatum ©F Stachurski, CIRAD. C. Culicoides nubeculosus, female ©JB Ferré, EID méditerranée. D. Philaenus spumarius ©Jean-Yves Rasplus, INRAE.
Aedes albopictus (Figure 1), a mosquito phylogenetically closed to the YF mosquito, Ae. aegypti, has recently become a real nuisance and increasingly a public health problem in the world, including south of France. Although it has been present for more than 100 years in the French department of La Reunion Island in the Indian Ocean, it only arrived in continental France in 2004 [18]. Aedes albopictus is now established in 58 departments of metropolitan France (data French ministry of Health, Santé publique France).
In Southern France, all the 13 departments of the Occitanie Region are now colonized by Ae. albopictus and 10 departments have more than 40% of their population in contact with Ae. albopictus. In this région the Ministry of Health reported 124 imported cases of Chikungunya, dengue or Zika (8 CHIK, 114 DEN, 2 ZIKA) in 2019 and “only” 79 dengue imported cases in 2020 (a year with much less travel). In 2020, for metropolitan France, the Ministry of Health reported 545, 5 and 1 imported cases of dengue, chikungunya and Zika respectively, and 11 dengue autochthonous cases, all in southern France. Indigenous cases have been observed almost every year for the last decade, and this trend will increase. (data Santé Publique France: https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-a-transmission-vectorielle/chikungunya/articles/donnees-en-france-metropolitaine/chikungunya-dengue-et-zika-donnees-de-la-surveillance-renforcee-en-france-metropolitaine-en-2020).
Aedes albopictus was really neglected until the 1980’s, when it was gradually discovered on all continents outside Asia and caused a chikungunya pandemic [19, 20, 21, 22]. Aedes albopictus takes blood from many vertebrate species [23], its life expectancy is about one month (which is quite long for a mosquito) [24], and it can transmit more than 40 viruses naturally or experimentally [22]. Aedes albopictus therefore perfectly fulfils the necessary criteria to be an excellent vector of virus to humans.
Aedes albopictus is considered to be native to Southeast Asia [19]. This assumption is based on the fact that this mosquito is present everywhere in the forested areas of this region and that many species close to the Albopictus subgroup (members of the Scutellaris group) are present in Southeast Asia. However, the notoriety of Ae. albopictus, compared to its relatives, comes from the fact that it has moved out of its area of origin, becoming worldwide in 50 years, adapting perfectly to urbanization, temperate climates, and international transport, as well as being involved in several dengue and chikungunya epidemics [25].
In tropical Southeast Asia, the five morphologically closely related species of the Albopictus subgroup live in forests (Aedes novalbopictus, Aedes patriciae, Aedes seatoi, Aedes subalbopictus and Aedespseudalbopictus) and lay their eggs in tree holes and bamboo stumps [26, 27]. These species are likely to be vectors of arboviruses to vertebrates from which they take blood. These forest-confined viruses are largely unknown, but may emerge through increased contact with humans or domestic animals. They could then be transmitted by vectors established in villages and cities, such as Ae. aegypti and Ae. albopictus, in a pattern similar to the emergence of the yellow fever virus in Africa from forests to villages and towns [5].
Based on current knowledge, it seems that Aedes albopictus is the species that has been the most successful in adapting to modern human settings among the Albopictus subgroup. In some Asian countries, such as Laos, Ae. albopictus is reported from deep natural forest [28], rubber forest and secondary forest [29], as well as in towns and villages, while in other countries, like in Malaysia, Ae. albopictus is rare in forests [30]. In Yunnan Province, China, if Ae. albopictus is sometimes more abundant than Ae. pseudalbopictus in bamboo forests, it is often absent from deep forests [27].
Mogi et al. [27], suggest that the spread of Ae. albopictus from its original tropical forest region was possible following evolution from an ancestral wild species, due to adaptation to man-made habitats and then migration with humans to temperate climate regions, where Ae. albopictus developed a winter diapause. In most introduced localities, it probably encountered only limited competition from native mosquitoes and when it did, Ae. albopictus proved to be a robust competitor, e.g., with Ae. aegypti [31]. It is likely that the ancestral wild species was already a vector of forest vertebrate arboviruses, for example, dengue-like flaviviruses, or chikungunya-like alphaviruses, which are monkey viruses [32].
In both its native range Asia and recently invaded South America [33] and Africa (like in Gabon, Paupy, pers. com.), Ae. albopictus has retained its ancestral capacity to colonize forest environments, however most of the time on the ecotone edges, laying eggs in natural pools of water and taking blood from non-domestic vertebrates. It is logical to think that under these conditions, Ae. albopictus populations would take blood from vertebrates carrying as yet unknown viruses, such as from monkeys, terrestrial mammals, birds or reptiles, and then be excellent bridge vectors from animals to humans allowing the emergence of forest viruses. We can speculate that this is most likely to occur in Asia. In comparison, in Africa, Ae. aegypti has already brought many, perhaps most, human adapted viruses from the forest to human habitats, such as yellow fever, dengue, chikungunya, and Zika viruses [6].
From regions recently colonized by Ae. albopictus, “modern” populations, highly adapted to the urban environment and excellent vectors, spread to all continents. It is likely that invasive populations re-invaded regions where ancestral populations already existed, such as in Asia and the Indian Ocean. These ancestral populations then found themselves in unfavourable competition and modern Ae. albopictus replaced them [34].
In the coming years, geographical distribution of Ae. albopictus will likely increase, especially in temperate regions and its control by insecticides will become more difficult due to the emergence of resistance. Likewise, Ae. albopictus-vectored epidemics are almost certain to increase. In addition to dengue, chikungunya and Zika, it could be responsible for yellow fever epidemics, or of currently unknown viruses transmitted by forest edge Aedes mosquitoes of South American, South East Asia or Central Africa. A major unknown for Ae. albopictus’ impact in temperate regions is whether arbovirus replication at lower temperatures is selected to be rapid enough to reach saliva before the female dies.
2. Crimean-Congo Hemorrhagic Fever emergence in Southern Europe and Hyalomma ticks: having the right name doesn’t make the vector
Crimean-Congo Hemorrhagic Fever (CCHF) is a zoonotic disease caused by a RNA virus (Nairovirus, Bunyavidae), which results in an acute and potentially fatal infection in humans while it remains asymptomatic in animals. The Crimean-Congo Hemorrhagic Fever virus (CCHFv) is transmitted in the wild through a “tick-non human vertebrate–tick” sylvatic cycle. Human infections occur punctually via a tick bite or from contact with contaminated body fluids of infected livestock or human patients. Only a few human infections lead to typical hemorrhagic symptoms, and are reported as CCHF cases, the tip of the iceberg. Ticks, especially those belonging to the Hyalomma genus, are considered as biological vectors but also reservoirs for CCHFv, as they are able to maintain the virus for several months or years individually or among tick populations [35]. Although the viremia in vertebrate hosts is very short, some hosts, such as lagomorphs, hedgehog, cattle, small ruminants, deer and wild boar in Europe, are able to become a source of infection for tick vectors [36]. CCHF is widespread throughout Eastern Europe, Africa, Asia and Middle East, and is emerging in Western Europe and the Mediterranean Basin [37, 38]. First attempts to correlate CCHF human cases to environmental conditions worldwide with focus on Turkey, showed that the disease likely emerged under warmer temperatures and sufficient number of days >5 °C in April, which probably increased development rate of thermophilous Hyalomma tick vectors and contributed to early activation of adult stages in spring [39, 40]. However, such modelling approaches suggested much more complex multi-factorial situations than only changing climate.
The issue of the suitable conditions for CCHF emergence in humans is particularly crucial in Southern France although the disease has never been reported there. Indeed, the presence of one of the main vectors of CCHFv, Hyalomma marginatum (Figure 1), has been confirmed recently while it was considered absent in the past, except in Corsica [41, 42]. Its northern extension into mainland France may have resulted from natural preexistent tick introduction events through host movements, especially bird migrations, and successful establishment of the tick due to global increase of temperature and drying of habitats under current climate changes [43]. Hyalomma marginatum is continuing its spread throughout Southern France with specimens recorded in localities where it was absent two years earlier. In addition, several hotspots with more or less abundant tick populations have now been identified in seven departments of Occitanie and Provence-Alpes-Côte d’Azur regions in mainland France (Vial, non-published data). Bio-ecological investigations are being conducted to better understand environmental conditions constraining the establishment of such an “invasive” tick, which is assumed to adapt to a relatively large panel of temperature and humidity compared to other Hyalomma species [44]. In addition to the evidence for tick vector extension, CCHFv is suspected to already circulate in Southern France since specific antibodies against CCHFv have been detected in Corsica from 13% and 2–3% of cattle and small ruminants, respectively, with up to 80% of seropositive animals in some infected farms [45]. No data are yet available for mainland France but analyses are in progress. In Spain, scientists have first detected CCHFv in Hyalomma ticks in 2010 [46] and autochthonous human cases have occurred punctually since 2016 [47]. A similar evolution in France could be expected. However, the situation is a bit different. Indeed, although H. marginatum is historically largely distributed in the Iberian Peninsula, CCHF has emerged in humans through the biting of another “unusual” tick, Hyalomma lusitanicum, which is present locally in Iberian forested oak areas and had never been reported before as an efficient CCHFv vector [48]. This specific case proved that H. marginatum could be present, abundant and infected with CCHFv without becoming necessarily an efficient vector. Past CCHF outbreaks from various ecosystems among the world can inform on common patterns or rather local specificities that result in efficient vectorial transmission of CCHFv and disease emergence in humans.
CCHF is occurring punctually but regularly in the Balkans as well as in South and West Africa, suggesting an endemic epidemiological situation. People are used to engaging in outdoor activities with high exposure to infected ticks and livestock. Human cases occur in synchrony with seasonal tick vector dynamics and with an increase in virus transmission in the sylvatic cycle. In these endemic regions, H. marginatum for Balkans and H. rufipes (formerly known as a subspecies of H. marginatum) for Africa have been identified as the main CCHFv tick vectors, at least in humans. As viremia is short and transitory in animal hosts, their likelihood for infecting tick vectors remains low and other transmission modes among ticks without vertebrate hosts are necessary [36]. Moreover, it has been estimated that transovarial transmission of CCHFv from infected females to larval ticks does not occur with sufficient frequency to allow maintaining the virus in the absence of amplification of infection in vertebrate hosts [49]. In this peculiar context, it was shown in Africa the intercession of another “partner of choice”, the tick H. truncatum that was confirmed to be able to amplify CCHFv among ticks through co-feeding transmission on non-viremic animals [50, 51]. As another consequence of low transovarial transmission rate in such “two-hosts” Hyalomma ticks, the infection of immature ticks on small vertebrate hosts constitutes a much more important amplifying mechanism for circulation of the virus than infection of adult ticks on large ungulates [51]. Among the likely hosts for immature stages of H. marginatum and H. rufipes, birds are unable to replicate CCHFv while hares or hedgehogs are considered good amplifiers but remain very scarce in Sahelo-Sudanian environments. However, red-beaked hornbills that are widely distributed in Senegal and frequently infested by H. rufipes immatures, were experimentally infected with CCHFv and succeeded to transmit the virus to tick larvae during blood feeding [52]. In South Africa, ostriches which are often infested by immature and adult Hyalomma ticks were also demonstrated as good CCHFv amplifiers and thus potential sources for infecting large amounts of tick vectors [53]. The intervention of such “helper” hosts could partially explain the emergence of CCHF in Spain through the biting of H. lusitanicum instead of H. marginatum. Hyalomma lusitanicum parasitizes quasi exclusively hares as immatures and red deer as adults, which are both known as very good CCHFv amplifiers. A serological study in the red deer recorded a prevalence twice as high as in domestic ungulates from Corsica [54]. Conversely, H. marginatum infests lagomorphs but also many birds at immature stages, and its adult stages prefer domestic ungulates in particular horses that do not develop sufficient viremia to infect ticks. In France and Spain where hares are rare and horses abundant, this may contribute to maintain a low rate of infection in H. marginatum through what is known in epidemiology as “dilution effect” [55].
The epidemiological situation of CCHF in the former Soviet Union and Turkey is also informative as CCHFv is also transmitted by H. marginatum but the disease shows a very different profile. It emerged in the form of massive outbreaks, in 1944, affecting about 200 Soviet soldiers in the Crimean Peninsula and then followed by smaller recurrences [56], and since 2002 in Turkey with an annual disease incidence reaching a plateau of 700 to 1300 cases/year until recently [57]. In both regions, agriculture lands were abandoned during wartime, terrorist activities, or due to strict prohibition of hunting in some areas, and resulted in an increase of wild fauna and tick populations that favors the amplification of CCHFv natural transmission. Then, militaries or new settlers conducting farming and cattle breeding activities were massively introduced in those regions allowing CCHFv transmission to naïve susceptible humans, through tick bites but also via direct contact with animal infected fluids and nosocomial contaminations between humans. In such regions, apart from suitable conditions increasing the probability of infection for tick vectors, changes in human exposure also contributed to the emergence of CCHF cases. Although H. marginatum is described as particularly “aggressive” among Hyalomma ticks with a strong hunting behavior against its vertebrate hosts [44] and a relatively high affinity for humans at adult stage, we assume that its biting remains rare and needs special conditions to be boosted. Indeed, this tick is large and is thus frequently detected and removed before attaching, as observed during tick sampling in the field. In addition, in France, tick abundances remain lower than in southern countries where H. marginatum has been well established for a long time, and this may much more contribute to a relatively low rate of tick-human meeting.
3. Unexpected vectors, new virus: how Culicoides biting midge species threaten the livestock production worldwide
Culicoides imicola is a biting midge species from the Ceratopogonidae family, responsible for the transmission of viruses of veterinary importance such as the Bluetongue virus in the Afrotropical and Mediterranean regions. Bluetongue is a disease of which etiological agent is a virus of the Orbivirus genus transmitted by species of the Culicoides genus (Figure 1) to domestic and wild ruminants. Culicoides imicola is emblematic for two reasons: the debate on its invasive status and pattern and the role of human activities; and the importance that a supposed invasive exotic species can take at the expense of native species. Bluetongue disease is an emerging disease in Europe, associated with two distinct mechanisms: (i) the settlement of perennial populations of an Afrotropical vector species in the Mediterranean region, and (ii) the transmission of exotic serotypes by competent autochthonous Palearctic species. It is undoubtedly one of the rare cases of emergence of a vector-borne disease for which the link with the global rise of temperatures is also strongly suspected [58, 59].
As of 1998, Southern Europe underwent a new series of emerging cases of Bluetongue disease involving different serotypes (1, 2, 4, 8, 9, 16) mainly in areas where C. imicola was considered to be absent [60]. The first outbreaks were observed on several Greek islands before they rapidly and progressively reached all the regions of the Mediterranean basin. In 1999, outbreaks were reported in North Africa, then between the years 2000 and 2004, in Spain, Continental Greece, Sardinia and in France (Corsica) [60]. Following these outbreaks, given the demonstrated vector role of C.imicola in the Afrotropical region, entomological surveys were led in the regions with outbreaks to highlight the presence of this species. These surveys allowed to quickly draw a map of the distribution of C. imicola in the Mediterranean basin, but it appeared to be absent in the north of Greece and in Bulgaria [60]. At the same time, C. imicola was collected in Italy (mainland, Sicilia and Sardinia). Entomological surveys indicated a northern limit at 44° N (at the north of Toscana), with a relatively rare presence beyond this limit [61]. In 2002, the presence of C. imicola was confirmed in Corsica [62] where populations turned out to be widespread and very abundant (with more than 10,000 insects collected per night) [63]. More entomological surveys followed, which confirmed the presence of the species in the Balearic Islands [64], in the north of Spain and in Catalonia [65]. On the French mainland, the species was collected for the first time in 2003 in the Var department in very low abundances compared to Corsica [63]. After this introduction and up to this day, the entomological surveillance implemented on the Mediterranean coast shows a presence of C. imicola in a limited area [63], (Var and Alpes-Maritimes departments). A second introduction was reported in 2008 in the Pyrénées-Orientales department where entomological surveys showed a limited distribution and low abundance, as was the case in the Var. Since 2005, the Var population is the northernmost population of the species. No individual has been collected in the Pyrénées-Orientales since 2012, and this population is considered as extinct [66]. A positive capture in Switzerland is considered by experts as a roaming individual or a trap artifact (the trap was previously used in Spain).
For a long time, the hypothesis of a recent colonization of Mediterranean territories by C. imicola was the dogma, the observed outbreaks being explained by a dispersal of infected females. This recent invasive status being based on the sole basis of historical observations of its presence in the Mediterranean basin, large sampling efforts were deployed in all the region to find the species. In retrospect, entomological investigations prior to 2000 in Italy (before BTV outbreaks), contained methodological biases (collection sites, type of traps, sampling period), suggesting that they could never have collected C. imicola individuals, even today [61]. Thus, modeling works as well as studies in population genetics and phylogeography were needed to address the hypothesis of an ancient presence of C. imicola in the Mediterranean basin, namely well before the emergence of BTV in this region. The evolutionary history of C. imicola is presented as follows [67, 68, 69].
In the west of the Mediterranean basin, midges reportedly took two routes to colonize the south-west of Europe. At least 200 years ago, Morocco would have served as a source for Spanish and Portuguese populations, while Algeria provided emigrants to France and Italy. The low level of genetic differentiation could demonstrate colonization dynamics with recurring gene flows between populations. Culicoides imicola’s strong capacity to disperse by wind appears to be a fundamental factor of its successful colonization. In this regard, a study combining the modeling of dispersal by wind and population genetics showed that populations established in the Pyrénées-Orientales had a Corsican origin instead of a Catalan origin, as first suggested by the geographical distribution of the species between the two border areas. The modern role of climate change could have contributed to the geographical expansion of C. imicola by increasing the size of populations [58, 59], by creating new suitable habitats for the establishment of the species, or by increasing dispersal by wind. Furthermore, human activities could have helped the establishment and local growth of populations by increasing host availability through the intensification of livestock production during the past centuries. Today, the expansion dynamics of established populations seem, at least partially, regulated by local abundance and their dispersal capacities, as well as the environmental conditions and low abundances at the northern limit. Thus, the northern limit of distribution of C. imicola in the Mediterranean basin has not shown any major variation over the last 20 years.
During the emergence period of the Bluetongue disease in the Mediterranean basin (2000–2005), all eyes turned to the north coast of the Mediterranean Sea, towards C. imicola. Animal health actors and the scientific community supposed at the time that there was a great risk that this species of Afrotropical origin might colonize temperate zones throughout Europe and become responsible for the transmission of several Bluetongue disease serotypes. As it turns out, another story unfolded, which surprised the entire scientific community and highlighted the role, not of an exotic species highly recognized as a vector in its native area, but of autochthonous species thought to be poor vectors.
Thus, surprisingly, serotype 8 of the BTV was introduced in 2006 in the north of Europe, followed by serotype 1, and were intensively transmitted by autochthonous Palearctic Culicoides.Culicoides imicola was meanwhile absent in these areas. This situation had already been observed in the Balkans. In the absence of an authorized vaccine at the time, control measures were not effective to contain the spread of the virus which infected tens of thousands of farms in Europe. France reported approximately 15,000 outbreaks in 2007 and more than 30,000 in 2008 (including around 5000 cases due to serotype 1), before mandatory vaccination campaigns reduced the transmission (83 outbreaks declared in 2009 and only one in 2010). Laboratory studies on vector competence, although methodologically very complicated for the genus Culicoides, confirmed the observed evidence: autochthonous Palearctic Culicoides species (C. obsoletus, C. scoticus, C. chiopterus, C. dewulfi and species of the Pulicaris group) are competent for the transmission of several serotypes of BTV. Their strong competence was also confirmed during the 2011 epizootic outbreak of Schmallenberg virus, a novel orthobunyavirus infection in ruminants in Europe transmitted by Culicoides [70]. Today, the scientific community considers that all abundant species in the Palearctic region are involved in the transmission of the Bluetongue and Schmallenberg viruses at varying levels of importance for which determinants must still be identified (role of saliva, co-evolution virus-vector, endosymbiotic community).
Thus, the Culicoides example shows that health situations can shift in very little time and cause important economic consequences, and that dogmas or hypotheses can be quickly swept away.
What is the future of Culicoides vector-borne diseases? The past 30 years have shown that almost all land areas have Culicoides capable of transmitting viruses which could induce emergences with important consequences for animal production and human populations (emergence of the Schmallenberg virus in 2011, re-emergence of the Bluetongue disease in 2015 in France, outbreak of the Oropouche virus in Guyana in 2020, emergence of African horse sickness in 2020 in Thailand and Malaysia). In total, six serotypes of BTV are reported to be circulating in Europe [71] [https://ec.europa.eu/food/animals/animal-diseases/control-measures/bluetongue_en and require control measures].
Another viral disease transmitted by Culicoides to wild and domestic ruminants is on Europe’s doorstep: the epizootic haemorrhagic disease (EHD) also caused by an Orbivirus. It has never been reported in the European Union (EU), although in recent years outbreaks of this disease caused by EHDv serotypes 6 and 7, previously considered to be non-pathogenic, were observed in neighboring countries of the EU (Morocco, Israel). It poses a significant risk of introduction and establishment of EHDV in the EU. Given that competent vectors are widely distributed and abundant in Europe (the same as for BTV and SBV), the risk for sustainable EHDV circulation, if introduced, is high [72]. Moreover, clinical signs in cattle are similar to those of Bluetongue which emphasizes the need for accurate and specific detection tools, as well as skilled and informed vets and surveillance agencies.
In conclusion, the emergence of Culicoides-borne arboviruses, molecular tracing of strains, empirical laboratory competence data, and saliva-vector-pathogen interactions studies indicate that coevolution between strains of viruses and vector species is not a prerequisite for the spread of arboviruses. Pathogen-vector-host interactions are highly dynamic in Culicoides-borne arbovirus systems, and transmission patterns can be radically altered in response to changes in climate, agriculture, animal trade, animal husbandry practices and human mobility. The numerous possibilities of encounter between different viruses and viral serotypes, circulating with the movement of animals, and the different species and populations of autochthonous Culicoides offer many opportunities for new virus-vector associations which could lead to new emergences.
4. Woe in the meadow: spittlebugs and the (re)emergence of the plant pathogen Xylella fastidiosa
The bacterium Xylella fastidiosa (Xanthomonadaceae, Gammaproteobacteria) is transmitted between plants by xylem-sap feeding insects belonging to several families of Hemiptera (Aphrophoridae, Cercopidae, Cicadellidae, Cicadidae and Clastopteridae). Xylella fastidiosa is associated with diseases of important crops and ornamental plants in the Americas [73, 74] Biofilm-like colonies are formed that can completely occlude vessels of the xylem, thereby blocking water transport. Infected plants exhibit leaf scorch symptoms and can die in case of heavy infection. Xylella fastidiosa is for example involved in Pierce’s disease (annual costs of more than US$100 million for the California grape industry [75]) and Citrus variegated chlorosis disease (about US$120 million loss for the Brazilian citrus industry each year [76]).
By feeding on the xylem sap of an infected plant, insects acquire the bacterium. Xylella fastidiosa multiplies in the cibarium (a pouch in front of the mouth cavity) of the insect but vectors can immediately inoculate the bacterium to a new host without any latence [73]). Thus, the spread of X. fastidiosa in the environment is primarily linked with the abundance and feeding preferences of the vectors.
Before the Italian crisis in 2013 [77], all knowledge about vectors of X. fastidiosa came from the Americas. However, communities of insect vectors that occur in the Americas and in Europe are almost completely different [78]. Knowing that the host-spectrum of X. fastidiosa contains nearly 600 species from more than 80 plant families and given the importance of international plant trade, one can a posteriori wonder if the lack of anticipation to gather knowledge on European vectors was the best modus operandi.
The Italian outbreak killed thousands of olive trees sometimes centuries old. This outbreak and the detection of X. fastidiosa in Corsica [78], Spain [79] and Portugal [80] in the years that followed had the effect of an electric shock in Europe, who was suddenly in a hurry to grant research projects. Unfortunately, projects were mostly conducted on a country basis, with no real intention to get a comprehensive view of X. fastidiosa diversity and distribution throughout Europe to decipher plant-vector trophic networks and assess their potential impact on the spread of X. fastidiosa or to better understand if and where this endophyte constitutes a real threat or why and when it could become one.
At the beginning of the crisis, and, we must say still now, little consideration has been shown for potential vectors of X. fastidiosa. Ironically, what was considered as a significant advance was in fact a rediscovery of the ability of the meadow spittlebug Philaenus spumarius (Aphrophoridae) to transmit the disease [81], which was known since 1950 [82] (Figure 1). From 2014, the meadow spittlebug, that had never been considered as a pest for European agriculture, was pushed to center stage as a public enemy. Later, Philaenus italosignus and Neophilaenus campestris were also proven as effective vectors. Further studies are needed to better understand if other xylem-feeders among the 120 species listed for Europe (52 in France) [78] could play a role in disease spread. Until now, P. spumarius remains the main vectors as it is highly polyphagous, widely distributed in the Palearctic from sea level to high elevation and size of local populations can be large [83]. Notably, it is present everywhere in France including in areas where outbreaks of X. fastidiosa have been detected by plant protection services (Corsica; PACA; Occitanie). Surprisingly, its adult feeding preferences are not the same in Corsica and mainland France. In Corsica, adults feed almost exclusively on Cistus spp. while they seem more polyphagous elsewhere, which suggests that the disease dynamics may be different and that management strategies may have to be adapted on a case-by-case basis [84]. Interestingly, species distribution modelling as well as molecular approaches have shown that this insect would be the perfect sentinel to follow the spread of X. fastidiosa in the environment [84], instead of targeting only symptomatic plants, which is the current preferred strategy for surveillance.
Genetic studies [84, 85] and mechanistic-statistical approaches [86] seem to show that the introduction of X. fastidiosa in Europe is not as recent as 2013 and could date back to the early 90’s. If we consider international plant trade in the last century, these results are not surprising and its introduction may even be older. Furthermore, niche model surveys show that a large part of Europe is climatically suitable for X. fastidiosa [87] and P. spumarius [84]. So, is X. fastidiosa an emerging or a re-emerging disease and what would explain that outbreaks were noticed only recently?
The following scenario is hypothetical and could be contradicted in the next years but it fits well with observations made on the bacterium and its vectors. When bacterial populations are small and sap flow is sufficient (i.e. when weather is not too dry and plants are relatively young), most if not all plants are asymptomatic to X. fastidiosa. Asymptomatic plants might act as reservoirs to the disease [86]. In addition, the bacterium is sensitive to cold and complete recovery of plants after winter is observed [88]. Before the Italian crisis that might have served only as a revelation of the presence of X. fastidiosa, symptoms could have been mistaken with summer drought. In Europe, overwintering of adults of insect vectors is not observed so far. Adults die in winter and species overwinter as eggs. As a consequence, the new generation must re-acquire the bacterium from infected plants, which may slow down bacterial spread. Yet, there is no transmission of the bacterium to the eggs and infectivity is lost between nymphal stages [73]. In addition, it seems that X. fastidiosa multiplies less efficiently in P. spumarius than in American vectors such as the glassy-winged sharpshooter, Homalodisca vitripennis or the blue-green sharpshooter, Graphocephala atropunctata. These elements suggest that climate change (milder winter and harsher drought) could contribute to the re-emergence of X. fastidiosa in Europe. Nevertheless, as vectors seem to feed preferentially on healthy host plants [89], a climate-mediated acceleration in the disease phenology (ie faster incubation or symptom onset) may be counterbalanced by a reduction in disease spread due to vector feeding behavior [90]. We can suppose that we will detect more outbreaks in the future but this will certainly also depend on an increase in our technical capacity to link symptoms with the presence of the bacterium. However, it is hard to believe that we will experience a system’s runaway if the interacting species (vectors + X. fastidiosa) remain the same. The situation in Italy was specific with olive tree monoculture, and grass strips inhabited by thousands of specimens of P. spumarius, which likely favored a quick spread of the disease.
Intensive surveillance effort should be nevertheless set up to ensure that more efficient vectors are not introduced to Europe, which could cause system’s runaway as it was observed in Californian grapevines when the glassy-winged sharpshooter was introduced in the 80’s [91]. Indeed, the dramatic Pierce’s disease crisis was more the consequence of the encounter between this highly polyphagous/efficient vector and X. fastidiosa than the consequence of the bacterium itself, which was already present in California.
Reducing bacterium spread requires acting on a set of different biotic (vectors, plants) and abiotic (climate, landscape) factors [92], which complicates management. No effective solution has been found so far despite important research efforts in the US. If pesticide use can reduce pathogen spread, benefits may take multiple seasons to become apparent and repeated spraying is required to reduce populations of vectors [93], which may result in adverse environmental and health effects. Importantly, a general framework to predict how vector-plant interactions affect the spread of X. fastidiosa is lacking. We still have no idea on how vector behavior (e.g. feeding duration), phenology, fitness, population size, feeding preferences can alter rates of spread. The best option to control the spread of the disease is certainly to keep increasing our knowledge of the pathosystem to, for example, identify entities that are key to plants–X. fastidiosa–vectors interaction network integrity and could be targeted for disease management, identify conditions that could reduce the spread of X. fastidiosa or facilitate plant recovery and propose agro-ecological management strategies to reduce risks (e.g. biocontrol of P. spumarius with egg parasitoids [94]).
Encounter and compatibility filters, the example of yellow fever, from [95], and [25].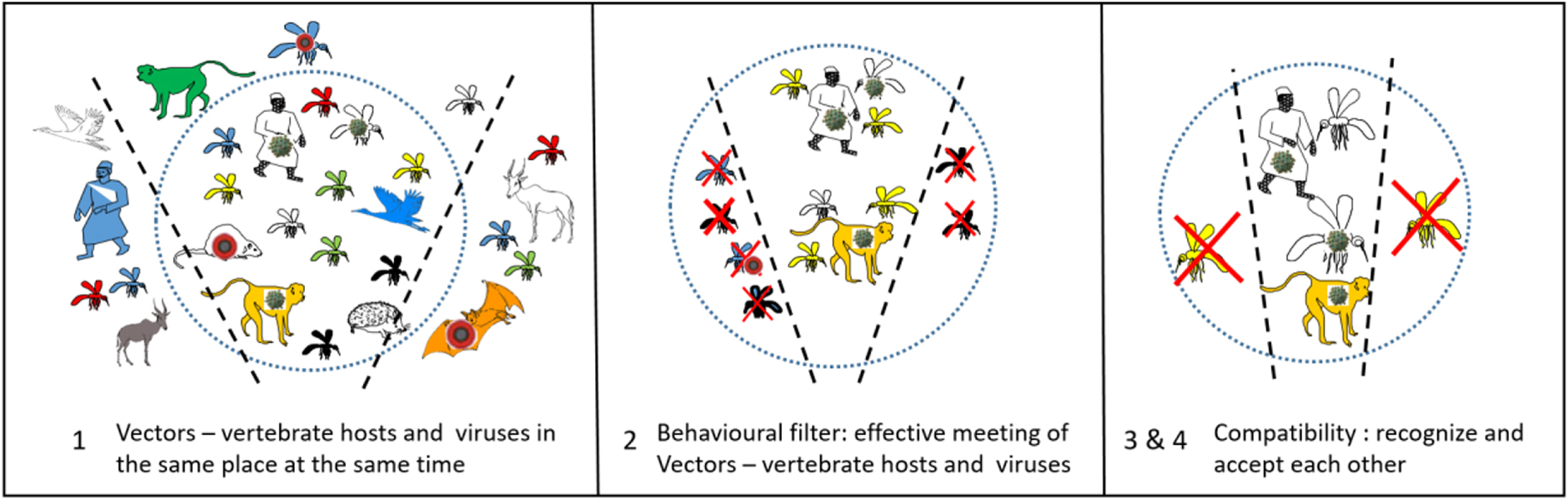
5. To be or not to be a vector?
The previous histories of yellow fever, dengue, Crimean-Congo hemorrhagic fever, Bluetongue diseases and Xylella fastidiosa lead us to consider the factors needed, but not always sufficient, for an arthropod species that was initially of little interest for human, animal and plant health, to become a major concern and an enemy to fight.
First of all, the arthropod, or to be precise, a given population of a given species of an arthropod, must be able to transmit the pathogen (or a given population or genotype of a pathogen), biologically or mechanically. Mechanisms may be different between cycles involving vertebrates and plants.
In the field of veterinary and medical entomology, this ability to transmit a pathogen biologically is called vectorial capacity, which includes vector competence (i.e., the ability of a blood feeding arthropod to become infected after ingestion of an infected blood meal and later transmit the pathogen via its saliva). Both terms, vectorial capacity and vector competence, have been formalized since MacDonald [96], and include parameters related to vector density (m), feeding rate and trophic preferences (a), longevity (p), time necessary for pathogen to complete development in the arthropod from ingestion in midgut to the saliva (n), infectiousness of the vector to the vertebrate host (b), susceptibility of the vertebrate host to the virus (c), and the vertebrate host infectious period (r). Many other factors also contribute such as vectorial transmission of the pathogens between generations, biology of non-biting stages, competition, predation, etc. Knowing the values of these parameters makes it possible to estimate the basic reproductive number of the virus, R0, which is the total number of cases derived from one infective case that the vector population would distribute to vertebrate hosts
The epidemiology of plant pathogens (bacteria, viruses, fungi) is also dependent upon the population dynamics, dispersal, host-selection behavior, and feeding behavior of the vectors [97]. Hemipteran insects are by far the most important vectors of plant pathogens [98]. Nevertheless, as compared to important viral vectors, such as aphids [99] and whiteflies [100], there are still significant gaps in our knowledge of vectors of bacterial pathogens [98]. Hemipterans penetrate plant tissues with their stylet to feed on the mesophyll and vascular system, or exclusively on phloem or xylem. Pathogens can be non-persistent, semi-persistent or persistent [97, 98, 101]. Non-persistent pathogens can be acquired or transmitted in seconds through probing test biting or feeding. Pathogens can be lost quickly and multiple encounters with infected plants are required for vectors to remain infective. For semi-persistent pathogens, acquisition can occur within minutes, but the efficiency increases with longer feeding. The retention period is longer (hours to days) and infectivity is lost after each molt. For persistent pathogens, vectors remain infective until death after a single encounter with an infected plant. In addition, the pathogen can be circulative or not. Non-circulative pathogens are only associated with the stylet or the foregut region of the vectors while circulative pathogens are taken up into vector cells and transported within the vector hemolymph. Consequently, circulative pathogens are generally characterized by a high degree of vector specificity. Finally, pathogens can either multiply (propagative pathogen) within the insect vector or not (non-propagative). Xylella fastidiosa is semi-persistent in immatures, persistent in adults; non-circulative and propagative. Interestingly, only a few species have been reported as efficient vectors for both bacterial and viral plant pathogens. Furthermore, it seems that some groups of Hemiptera are capable of transmitting bacterial pathogens (psyllids), but not viruses and vice and versa (aphids, whiteflies, and scales) [98] a specificity that is not well understood yet.
Just this intrinsic biology of the arthropods is not sufficient to make it a vector. Its environment may, or may not, allow this vector potential to arise. According to Combes [95], the specificity of the vector–pathogen interaction passes through four stages, which he named encounter and compatibility filters (Figure 2). These four stages are: (1) to co-occur in space and time, (2) to meet each other (behavior), (3) to recognize each other (specificity, receptors), and (4) to accept each other (susceptibility, immunity).
All these parameters of the vectorial capacity are subject to genetic drift and selection pressures, and evolve in time and space. An excellent example is the recent Zika fever pandemic, where the virus was transmitted worldwide by very different populations of Ae. aegypti, with invasive populations in America and Asia proving to be better vectors of the Zika virus than ancestral populations in Africa [102].
Recognition, susceptibility and specificity are components of arthropod immunity. It seems that the first observation of an insect immune response dates back to the end of 19th century, when Cuenot observed phagocytosis of insect cells in hemolymph (cited by Munson, 1953 [103]), but it was not until the 1960s that scientists really began to study the immune mechanisms of arthropods [104, 105]. The immune system of arthropods is activated when the arthropod interacts with “non-self” biological agent. This can be an infectious agent of the arthropod (virus, bacterium, fungus, parasite, parasitoid), or a plant or vertebrate pathogen transmitted by the arthropod. Drosophila, a diptera like mosquitoes, was the main model for the study of arthropod immunity. This research domain was recently rewarded by a Nobel Prize to Jules Hoffmann, a French academician. (http://www.academie-francaise.fr/les-immortels/jules-hoffmann).
Most of the time, the immune system is not efficient enough and arthropod-specific infectious agents are lethal to insects and Acari. The pathogens we have taken as examples are vertebrate or plant pathogens that do not kill their vectors, and most of the time have little effect on the fitness of the vector. The infectious agent not only is not destroyed by the arthropod after ingestion, but it replicates in the arthropod’s body, either reaching the salivary glands or remaining in the cibarium, and later is transmitted to another host. Mechanisms of tolerance or escape have therefore been selected both in the infectious agent and in its vector.
Apart from the physical barriers (cuticle; digestive, respiratory, sexual epithelium, …), the main immune mechanisms are either cellular (phagocytosis, nodulation, encapsulation or via molecules produced by hemocytes,) or humoral and responsible for the production of proteins like prophenoloxidase or antimicrobial peptides. The main pathways are Toll, Imd, JAK/STAT, RNAi immune pathways [106, 107, 108]. Differential activation of these pathways depends on the arthropod’s species, and whether the arthropod interacts with fungi, parasites, bacteria or viruses.
All the conditions above needed for efficient transmission are rarely met, and it is therefore understandable why being a vector is an exception. However, considering the very large number of potential vector species and large number of pathogens, while we are presently facing only a limited number of dangerous cycles, this must be a very small fraction of thousands, if not millions, of other potential cycles that have failed. The understanding of the current efficient cycles allows us to conceive possible future cycles.
6. Conclusions: the worst doesn’t always happen but we should keep an eye on it!
The examples of disease emergence that we have taken, in the field of human, animal and plant health, and then the attempt to conceptualize what a vector of infectious pathogen is, make us humble. Most of the generic factors are well identified, relating to the biology and genetics of vectors and pathogens, and a few extrinsic factors, in particular environmental, social and climatic factors. However, the relative weight of these factors, the interactions between variables and the evolutionary aspects of vector systems are still very poorly known. It is therefore difficult to anticipate the unpredictable. Among the very numerous possibilities of encounter and compatibility, if most do not succeed and abort, there is no doubt that transmission cycles will develop or emerge.
In the absence of effective control measures, outbreaks of dengue fever, transmitted by Aedes albopictus, will develop in mainland France, Xylella fastidiosa will continue to spread and possibly wreak havoc on some crops and new outbreaks of human and/or animal diseases due to tick-borne or Culicoides-borne viruses will emerge. Other vector-borne diseases, which we do not even suspect yet, will (re)emerge or will be introduced into France.
Charles Nicolle as early as 1933 had warned us: “diseases will always continue to emerge” [109]. Antoine Béchamp and Louis Pasteur reminded us that “the microbe is nothing, the context is everything”, prefiguring the “One Health” approach that is now becoming the dominant paradigm.
These old, but still very relevant views require a holistic approach, taking into account the complexity of interactions between diseases, microbes, hosts, vectors, environment, and their evolutions. If the worst does not always happen, new diseases always appear or exotic diseases spread to new or unexpected environments. Additionally, it goes without saying, no developed or developing country is fully prepared for epidemics or pandemics, and every country has important gaps to address in terms of disease surveillance and control, vector-borne or not ! Without a doubt, the COVID-19 pandemic, due to SARS-Cov2 virus, has dramatically confirmed this feature.
As a conclusion, the main recommendations, from basic research to implementation, we can make to limit the consequences of new “Egyptian plagues” related to vectors and vector-borne diseases are:
- to better inventory and monitor species and population genetic diversity of potential vectors, infectious agents, plant and animal hosts and to characterize their distribution, their abundance and presence drivers,
- to better understand the interactions between the components of vector systems (vectors, hosts, pathogens, environment) and the evolution of these interactions, including mechanisms of adaptation to new environments,
- to investigate socio-economic and environmental context in which the pathogens circulate or vectors spread,
- to model different scenarios of emergence and spill-over,
- to develop more effective and sustainable tools for disease and vector control,
- to advocate for One Health consideration early in the surveillance or research programs, and to hammer home loss of biodiversity, climate change, exponential increase in intercontinental exchanges as a main cause of emergence,
- to train future epidemiologists, entomologists and health professional or actors to concepts of emergence and to good practices,
- to develop economics and social sciences applied to health issues to understand how socio-economic factors impede early detection, outbreak response, surveillance and control and characterize the impact of vector-borne diseases across actors of the health/agricultural systems,
- to investigate farmers’, breeders’, health actors’ and stakeholders’ perception of the increased risk and promote their participation in the surveillance and early detection of vector-borne diseases,
- to increase the role and engagement of all actors (from institutional organizations to farmer, breeders cooperatives and citizens) in the implementation and design of sustainable tools and strategies for disease management, and to help stakeholders in optimizing and tailoring interventions and surveillance plans to the regional contexts (vectors present, absent, limited abundance).
Acknowledgements
This opinion piece came out in the stimulating frame of the KIM RIVE (Key Initiative Montpellier: Risks and Vectors), supported by MUSE (Montpellier University of Excellence) and défi clé RIVOC, supported by Région Occitanie.
CG would like to thank her colleagues from Cirad, Thierry Baldet, Thomas Balenghien, Maxime Duhayon, Hélène Guis, Karine Huber, Stéphanie Jacquet and Ignace Rakotoarivony, for the good work and the fruitful discussions since 2009. AC would like to thank her colleagues Jean-Yves Rasplus and Jean-Pierre Rossi from the INRAE for staying the course despite the Xylella storm since 2015. DF would like to thank Christophe Paupy for non-published data from Gabon, as well as Anna Cohuet and Jeff Powell for fruitful discussions on vector concepts.
French version
Le moustique tigre (Aedes albopictus), la tique géante (Hyalomma marginatum), le moucheron Culicoides imicola et le cercope des prés (Philaenus spumarius), tous encore inconnus dans le sud de la France il y a quelques années ou décennies, sont-ils nos nouveaux fléaux d’Egypte ?
Ces quatre espèces d’arthropodes sont des vecteurs d’agents infectieux aux humains, aux animaux et aux plantes. Les superlatifs dont ils sont parfois affublés reflètent les préoccupations qu’ils suscitent dans la population générale, chez les éleveurs et agriculteurs ainsi que chez les décideurs.
Ennemis à surveiller et combattre, contre lesquels nous semblons relativement impuissants, ces vecteurs, utilisés à titre d’exemple, nous offrent l’occasion de nous demander comment et pourquoi nous sommes arrivés à ces situations, et les raisons pour lesquelles ces arthropodes et ces agents pathogènes sont devenus une menace pour les humains ou leurs productions.
Au-delà des lieux communs sur des phénomènes bien réels aux conséquences dramatiques tels que le changement climatique, les modifications de l’environnement, les changements de pratiques agricoles, l’urbanisation, l’intensification du commerce mondial, c’est souvent la conjonction d’un ensemble d’événements, la plupart du temps avec une faible probabilité d’occurrence, qui conduit à l’émergence de la transmission d’un agent pathogène par un vecteur : insecte, acarien, mollusque, nématode (voir définition ci-dessous). En d’autres termes, le pire n’est jamais sûr, mais c’est le pire qui retient notre attention en tant qu’humains, lorsque nous sommes directement concernés.
Pour les maladies humaines uniquement, l’Organisation Mondiale de la Santé (OMS) estime que les maladies à transmission vectorielle (MTV) (telles que le paludisme, la dengue, la maladie de Chagas, la leishmaniose, la trypanosomiase humaine africaine) représentent plus de 17% des maladies infectieuses et sont responsables de plus de 700 000 décès par an dans le monde. Les coûts économiques des MTV humaines (surveillance, coûts médicaux et non médicaux, contrôle des vecteurs, pertes de productivité) se chiffrent en milliards d’euros par an.
En outre, les conséquences économiques de certaines de ces maladies à transmission vectorielle sur l’agriculture et l’élevage sont colossales. Elles ont des impacts économiques directs importants : morbidité du bétail, réduction de la production et des revenus agricoles, interdiction du commerce du bétail et du sperme, quarantaine imposée, coûts des tests biologiques, mesures de surveillance et de contrôle. Par exemple, en Allemagne et aux Pays-Bas [1, 2], l’impact de la fièvre catarrhale ovine sur le bétail a été estimé à plusieurs centaines de millions d’euros. Dans le domaine phytosanitaire, la maladie des pousses jaunes ou maladie du dragon jaune (Huanglongbing, HLB) causée par Candidatus Liberibacter spp. transmis par les psylles, est le pathosystème agrumicole le plus destructeur au monde, avec un coût estimé pour la Floride à 8,92 milliards de dollars de recettes et 4,62 milliards de dollars de produit intérieur brut entre les productions végétales de 2006/2007 et 2010/2011 [3]. La sharka, causée par le Plum pox virus transmis par les pucerons Aphididae, est la maladie la plus dévastatrice des arbres fruitiers à noyau. Elle génère des pertes annuelles de plusieurs centaines de millions d’euros [4].
Il existe également des impacts socio-économiques indirects qui concernent toute MTV affectant les plantes, les animaux ou les humains : incapacité de travail des éleveurs, des agriculteurs, des travailleurs, perturbation des chaînes d’approvisionnement, coûts de la surveillance et des tests pour la détection de la maladie et préoccupations des consommateurs et des citoyens concernant les menaces pour la santé et les questions environnementales (craintes de contracter une maladie, suspicion sur les vaccins, changement des habitudes de consommation, utilisation d’insecticides, abattage massif, etc.), etc.
L’évaluation des risques, la prévention et le contrôle de ces maladies émergentes ou de leurs vecteurs invasifs constituent des défis majeurs sur les plans sanitaire, écologique, social et économique. Les exemples récents les plus problématiques en France métropolitaine concernent la dengue, la fièvre Zika, le chikungunya, la fièvre du Nil occidental, les arbovirus transmis par les phlébotomes, la maladie de Lyme, en ce qui concerne l’humain ; la fièvre catarrhale ovine, la fièvre hémorragique de Crimée-Congo (une zoonose), la peste porcine africaine, l’anaplasmose, pour le bétail ; de nombreuses maladies virales (Sharka, tomato leaf curl New Delhi virus), des phytoplasmes (par exemple, la flavescence dorée) et des maladies bactériennes (par exemple, Xylella fastidiosa, la maladie du dragon jaune) pour les espèces végétales sauvages et cultivées. En l’absence de mesures de lutte efficaces (traitements curatifs, biocides, vaccins), la prévention, la réduction et l’atténuation des risques nécessitent l’identification des voies de colonisation, la détection précoce de l’introduction et un contrôle efficace des vecteurs. Actuellement, la lutte contre les vecteurs repose essentiellement sur l’utilisation d’insecticides chimiques polluants contre lesquels les arthropodes développent une résistance. Un changement radical des approches et des pratiques est nécessaire et demandé par la société qui souhaite un environnement plus sain et une meilleure santé. C’est un objectif de nombreuses régions françaises, de l’Union Européenne dans le cadre de son « green deal », et des Nations Unies dans une stratégie « Une seule santé » intégrant des objectifs de développement durable.
Cependant, des années d’efforts de recherche et de développement n’ont pas permis de résoudre entièrement les problèmes et il existe une course perpétuelle aux armements entre les humains, les vecteurs et les agents pathogènes. De nouveaux outils sont en cours de développement (tous ne sont cependant pas consensuels), ou restent à inventer : diagnostics, traitements, chimie verte, insecticides à base de plantes, répulsifs, pièges, compétiteurs, parasites, prédateurs, techniques de l’insecte stérile, transgénèse, vaccins bloquant la transmission, densovirus d’insectes, endosymbiontes Wolbachia, microbiote, mais aussi éducation, approches comportementales, sciences participatives et modélisation des risques. Un effort est également nécessaire pour mieux comprendre les processus d’émergence afin de mieux anticiper et prévenir les risques.
Nous prendrons quelques exemples historiques et contemporains, notamment dans le sud de la France (Occitanie et Provence-Alpes-Côte-D’azur (PACA)), en matière de santé humaine, animale et végétale pour illustrer comment et pourquoi un arthropode ou un agent pathogène sort de l’anonymat et devient un ennemi public. À partir de ces modèles, nous verrons les conditions nécessaires pour que ces émergences se produisent, et nous réfléchirons à l’avenir.
Définition d’un vecteur
Un vecteur est tout organisme qui transmet activement un agent infectieux d’un hôte à un autre (animal ou végétal).
Le concept de transmission active exige que le vecteur, par son comportement, permette la transmission d’un agent infectieux en le prenant chez un hôte et en le transmettant à un autre hôte. L’agent infectieux peut, ou non, se multiplier dans le vecteur. Cette définition exclut donc la plupart des hôtes intermédiaires qui libèrent passivement des agents infectieux dans l’environnement.
1. Diffusion des flavivirus de primates par les moustiques Aedes aegypti et Aedesalbopictus
La fièvre jaune (FJ) a été l’une des maladies humaines transmises par les moustiques les plus dévastatrices, en Afrique, en Amérique et même dans certains ports européens, pendant des siècles. Son histoire éclaire les mécanismes d’émergence, d’installation et de propagation d’une zoonose depuis les forêts africaines jusqu’aux villes américaines. Malheureusement, ce qui s’est passé il y a cinq siècles peut se reproduire, comme le montrent les exemples suivants.
L’histoire naturelle de la fièvre jaune en Afrique a été comprise il y a plusieurs décennies [5]. Le virus de la fièvre jaune circule dans les forêts africaines de singe à singe, transmis par des moustiques de forêt appartenant au genre Aedes (Ae. africanus, Ae. luteocephalus, Ae. furcifer, Ae. simpsoni s.l., Ae. opok, etc.), avec des incursions dans les villages où sont présents des moustiques Ae. aegypti anthropophiles domestiques, capables de répliquer et transmettre le virus de la fièvre jaune aux villageois [6]. Le virus est ensuite introduit par des individus virémiques dans les villes africaines, où il trouve des populations urbaines d’Ae. aegypti capables de générer des épidémies.
Arthropodes vecteurs de maladies humaines, animales et végétales. A. Aedes (Stegomyia) albopictus, female ©Nil Rahola, IRD. B. Hyalomma marginatum ©F Stachurski, CIRAD. C. Culicoides nubeculosus, female ©JB Ferré, EID méditerranée. D. Philaenus spumarius ©Jean-Yves Rasplus, INRAE.
Ce virus de la fièvre jaune adapté à l’humain et des populations d’Ae. aegypti urbains ont été introduits en Amérique tropicale, par l’intermédiaire de personnes infectées et/ou d’Ae. aegypti transportés sur des navires, au cours de la traite triangulaire des esclaves, qui a débuté au 16ème siècle [7, 8]. À son arrivée dans les forêts tropicales d’Amérique centrale et du Sud, le virus a trouvé à la fois des singes du Nouveau Monde sensibles et de nouveaux moustiques endémiques de deux genres, Sabethes sp. et surtout Haemagogus sp., compétents pour permettre sa réplication et sa transmission. Le virus de la fièvre jaune a donc connu simultanément deux événements de transfert inter-espèces : de singes africains à des singes américains, de moustiques Aedes africains à des moustiques américains. De nouveaux cycles forestiers de fièvre jaune se sont ainsi développés, impliquant des primates sud-américains et des moustiques Haemagogus, dont les larves se développent dans les creux d’arbres. Phylogénétiquement, le genre Haemagogus parait être assez proche du genre Aedes [9], ce qui pourrait expliquer la capacité des Haemagogus à souvent transmettre les mêmes virus : fièvre jaune, dengue [10], Zika [11], et chikungunya [12], tous introduits en Amérique du Sud.
Parallèlement, Ae. aegypti s’est adapté aux villes américaines, et même les régions non tropicales ont subi des épidémies de fièvre jaune, comme la célèbre épidémie de Philadelphie en 1793 (5000 morts).
Cette combinaison d’un cycle sylvestre et urbain de la fièvre jaune en Amérique a permis l’émergence d’épidémies qui ont sévèrement affecté l’histoire de la colonisation du Nouveau Monde [13]. Ces cycles se sont étendus à toute l’Amérique du Sud et Centrale, où ils sont toujours actifs, comme le montre l’épidémie de fièvre jaune de 2016–2018 au Brésil, avec plus de 700 décès [14].
Il est intéressant de noter que la fièvre jaune endémique n’a jamais été signalée en Asie, à Madagascar ou dans d’autres îles de l’océan Indien, pour des raisons encore mal comprises. Les primates (singes et humains) de ces régions y sont sensibles, et on y trouve Ae. aegypti et d’autres moustiques Aedes expérimentalement compétents [15, 16, 17]. Les genres Haemagogus sp. et Sabethes sp. sont absents d’Afrique, de l’océan Indien et d’Asie.
Aedes albopictus (Figure 1), un moustique phylogénétiquement proche d’Ae. aegypti, est devenu récemment une véritable nuisance pour l’humain et de plus en plus un problème de santé publique planétaire, y compris dans le sud de la France. Bien qu’il soit présent depuis plus de 100 ans dans le département français de l’île de la Réunion, dans l’océan Indien, il n’est arrivé en France continentale qu’en 2004 [18]. Aedes albopictus est aujourd’hui implanté dans 58 départements de la France métropolitaine (données de Santé publique France). Dans le sud de la France, les 13 départements de la région d’Occitanie sont désormais colonisés par Ae. albopictus, et 10 départements ont plus de 40% de leur population en contact avec ce moustique. Dans cette région, le ministère de la Santé a signalé 124 cas importés de Chikungunya, de dengue ou de Zika (8 CHIK, 114 DEN, 2 ZIKA) en 2019 et « seulement » 79 cas importés de dengue en 2020 (une année avec beaucoup moins de déplacements). En 2020, pour la France métropolitaine, le ministère de la Santé a signalé respectivement 545 — 5 et 1 cas importés de dengue, chikungunya et Zika, et 11 cas autochtones de dengue, tous dans le sud de la France. Des cas autochtones ont été observés presque chaque année au cours de la dernière décennie, et cette tendance va s’accentuer (Données Santé publique France : https://www.santepubliquefrance.fr/maladies-et-traumatismes/maladies-a-transmission-vectorielle/chikungunya/articles/donnees-en-france-metropolitaine/chikungunya-dengue-et-zika-donnees-de-la-surveillance-renforcee-en-france-metropolitaine-en-2020).
Aedes albopictus a été réellement négligé jusque dans les années 1980, quand il a été progressivement découvert sur tous les continents en dehors de l’Asie et lorsqu’il a été responsable d’une pandémie due au virus chikungunya [19, 20, 21, 22]. Aedes albopictus pique de nombreuses espèces de vertébrés, avec une préférence pour l’humain [23], son espérance de vie est d’environ un mois, ce qui est assez long pour un moustique [24], et il peut transmettre plus de 40 virus naturellement ou expérimentalement [22]. Aedes albopictus remplit donc parfaitement les critères nécessaires pour être un excellent vecteur de virus pour l’humain.
Aedes albopictus est considéré comme originaire d’Asie du Sud-Est [19]. Cette hypothèse est basée sur le fait que ce moustique est présent partout dans les zones forestières de cette région et que de nombreuses espèces proches du sous-groupe Albopictus (membres du groupe Scutellaris) sont présentes en Asie du Sud-Est. Cependant, la notoriété d’Ae. albopictus, par rapport aux espèces proches, vient du fait qu’il a quitté sa zone d’origine et s’est mondialisé en 50 ans, s’adaptant parfaitement à l’urbanisation, aux climats tempérés et aux transports internationaux, et en étant impliqué dans plusieurs épidémies de dengue et de chikungunya [25].
En Asie tropicale du Sud-Est, les cinq espèces morphologiquement proches du sous-groupe Albopictus vivent dans les forêts (Aedes novalbopictus, Aedes patriciae, Aedes seatoi, Aedessubalbopictus et Aedes pseudalbopictus) et pondent leurs œufs dans les trous des arbres et les tiges de bambou coupées [26, 27]. Ces espèces sont susceptibles d’être des vecteurs d’arbovirus pour les vertébrés sauvages dont elles prélèvent le sang. Ces virus en général confinés à la forêt sont largement inconnus, mais peuvent émerger par un contact accru avec les humains ou les animaux domestiques. Ils pourraient alors être transmis par des vecteurs établis dans les villages et les villes, tels que Ae. aegypti et Ae. albopictus, selon un schéma similaire à l’émergence du virus de la fièvre jaune en Afrique, des forêts vers les villages et les villes [5].
Aedes albopictus est l’espèce qui a le mieux réussi à s’adapter aux environnements humains modernes parmi le sous-groupe Albopictus. Dans certains pays asiatiques, comme le Laos, Ae. albopictus est signalé dans les forêts naturelles profondes (28), les forêts d’hévéa et les forêts secondaires (29), ainsi que dans les villes et les villages, tandis que dans d’autres pays, comme en Malaisie, il est rare dans les forêts (30). Dans la province du Yunnan, en Chine, si Ae. albopictus est parfois plus abondant que Ae. pseudalbopictus dans les forêts de bambous, il est souvent absent des forêts profondes [27].
Mogi et ses collègues [27] suggèrent que la propagation d’Ae. albopictus à partir de sa région forestière tropicale d’origine a été possible suite à l’évolution d’une espèce sauvage ancestrale, en raison de l’adaptation aux habitats anthropisés puis de sa migration à cause d’activités humaines vers les régions à climat tempéré, où Ae. albopictus a développé une diapause hivernale. Dans la plupart des localités où il a été introduit, il n’a probablement rencontré qu’une concurrence limitée de la part des moustiques autochtones et lorsqu’il l’a fait, Ae. albopictus s’est révélé être un redoutable compétiteur, par exemple avec Ae. aegypti [31]. Il est probable que l’espèce sauvage ancestrale était déjà un vecteur d’arbovirus de vertébrés des forêts, par exemple, de flavivirus de type dengue, ou d’alphavirus de type chikungunya, qui sont des virus de singes [32].
Dans son aire de répartition d’origine, l’Asie, mais aussi en Amérique du Sud [33] et en Afrique (comme au Gabon, Paupy, com. pers.), Ae. albopictus a conservé sa capacité ancestrale à coloniser les milieux forestiers, mais la plupart du temps plutôt dans les écotones, en pondant des œufs dans des petites accumulations d’eau naturelles et en piquant des vertébrés non domestiques. Il est logique de penser que dans ces conditions, ces Ae. albopictus néo-forestiers pourraient piquer des vertébrés sauvages porteurs de virus encore inconnus, tels que des singes, des mammifères terrestres, des oiseaux ou des reptiles, et seraient ensuite capable de les transmettre, lors d’un repas ultérieur, aux humains pénétrant leurs milieux, permettant ainsi l’émergence de nouveaux virus. On peut supposer que cela se produira très probablement en Asie. En comparaison, en Afrique, Ae. aegypti a déjà favorisé dans le passé l’émergence de virus de la forêt aux habitats humains, comme les virus de la fièvre jaune, de la dengue, du chikungunya et du Zika [6].
A partir des régions récemment colonisées par Ae. albopictus, des populations « modernes », très adaptées à l’environnement urbain et excellents vecteurs, se sont répandues sur tous les continents. Il est également probable que des populations invasives ont réinvesti des régions où des populations ancestrales existaient déjà, comme en Asie et dans l’océan Indien. Ces populations ancestrales se sont alors retrouvées en concurrence défavorable et l’Ae. albopictus moderne les a remplacées [34].
Dans les années à venir, la répartition géographique d’Ae. albopictus devrait continuer de croître, notamment dans les régions tempérées, et la lutte par les insecticides deviendra plus difficile en raison de l’émergence de résistances et de l’opposition croissante aux biocides. De même, il est presque certain que les épidémies dont Ae. albopictus sera responsable vont augmenter. Outre la dengue, le chikungunya et le Zika, il pourrait être responsable d’épidémies de fièvre jaune, ou de virus actuellement inconnus transmis par des moustiques Aedes de lisière de forêt d’Amérique du Sud, d’Asie du Sud-Est ou d’Afrique centrale. Une inconnue majeure de l’impact d’Ae. albopictus dans les régions tempérées concerne l’éventuelle sélection de phénotypes viraux capables de se répliquer suffisamment vite pour atteindre la salive de la femelle de moustique avant sa mort.
2. Emergence de la Fièvre Hémorragique de Crimée-Congo en Europe et tiques Hyalomma : avoir le bon nom d’espèce ne garantit pas d’être un bon vecteur
La Fièvre Hémorragique de Crimée-Congo (FHCC) est une maladie zoonotique causée par un virus à ARN (Nairovirus, Bunyavidae). Elle se manifeste par des signes cliniques hémorragiques sévères, et peut être fatale chez l’humain, alors que les animaux infectés restent asymptomatiques. Le virus de la Fièvre Hémorragique de Crimée-Congo (FHCCv) se transmet dans la nature au sein d’un cycle sylvatique « tique-vertébré non humain-tique ». L’infection humaine est un événement occasionnel qui intervient soit par la piqûre d’une tique infectée soit par contact avec les fluides biologiques d’animaux infectés ou de patients malades. Seule une petite proportion d’infections donne lieu chez l’humain à des symptômes hémorragiques caractérisés et est ainsi comptabilisée dans les cas de FHCC; c’est la partie émergée de l’iceberg. Les tiques, en particulier celles du genre Hyalomma, sont considérées comme de « bons » vecteurs biologiques et réservoirs de FHCCv, étant donné qu’elles sont capables de maintenir le virus pendant plusieurs mois, voire plusieurs années, soit chez des individus soit au sein de la population de tiques, avant de le retransmettre à un hôte vertébré [35]. A l’inverse, la virémie chez les hôtes vertébrés est généralement courte, de l’ordre d’une dizaine de jours. Elle semble toutefois suffisante chez certains animaux comme les lagomorphes, les hérissons, les bovins, les petits ruminants, les cerfs ou les sangliers en Europe pour permettre l’infection de nouvelles tiques lorsque celles-ci se gorgent [36]. La FHCC est largement répartie en Europe de l’Est, en Asie, en Afrique et au Moyen-Orient. Elle a émergé récemment dans le bassin méditerranéen et en Europe de l’Ouest [37, 38]. Certains scientifiques ont essayé de corréler l’occurrence des cas humains de FHCC aux conditions environnementales planétaires et plus particulièrement en Turquie où la maladie sévit sous forme épidémique depuis presque deux décennies. Leurs modèles montrent une probabilité d’émergence de FHCC plus forte lorsque les températures augmentent et que le mois d’avril comptabilise suffisamment de jours avec une température moyenne supérieure à 5 °C. Ces hausses de température agissent favorablement sur le cycle de développement de la tique vectrice H. marginatum (Figure 1) et permettent une activation plus précoce de la tique après la diapause hivernale [39, 40]. Cependant, certaines incohérences ne s’expliquent pas et suggèrent des situations d’émergence multi-factorielles, bien plus variées et complexes que du simple fait des variations climatiques.
La compréhension des facteurs d’émergence de la FHCC chez l’humain est d’autant plus cruciale dans des pays apparemment indemnes de FHCC, comme la France continentale. En effet, la présence d’un des vecteurs majeurs de FHCCv, la tique H. marginatum, a été récemment confirmée sur le territoire alors qu’on la croyait absente jusque dans les années 1980, excepté en Corse [41, 42]. Son extension vers le continent est très certainement le fruit d’introductions répétées par des mouvements d’animaux, en particulier les migrations d’oiseaux à travers la Méditerranée, mais également en raison de conditions climatiques devenues favorables, ce qui permet aujourd’hui son installation pérenne [43]. Hyalomma marginatum continue sa diffusion dans le sud de la France. Des localités qui étaient encore indemnes de cette tique il y a seulement deux ans et se retrouvent maintenant infestées. Ainsi, plusieurs « hotspots » de H. marginatum ont été décrits dans sept départements d’Occitanie et de Provence-Alpes-Côte d’Azur (Vial, données non publiées). Des études bio-écologiques visent à mieux comprendre les conditions environnementales biotiques et abiotiques favorisant l’installation de cette tique dite « invasive », car elle semble s’adapter à une large gamme de températures et d’humidité comparée à d’autres espèces de Hyalomma, ce qui expliquerait en partie sa vaste distribution géographique [44]. Enfin, la circulation du virus de la FHCC a récemment été suspectée en France suite à une enquête sérologique menée en Corse, où 13% des bovins et 2–3% des petits ruminants présentaient des anticorps contre le FHCCv, avec jusqu’à 80% d’animaux séropositifs dans certaines fermes [45]. Aucune donnée n’est encore disponible pour le continent mais des analyses sont en cours. En Espagne, le FHCCv a été détecté dans des tiques Hyalomma en 2010 [46] et les premiers cas humains autochtones ne sont apparus que quelques années plus tard, à partir de 2016 [47]. Une évolution similaire pourrait se produire en France, bien que la situation espagnole soit malgré tout différente. Alors que H. marginatum est très largement présente en Espagne et ce, depuis longtemps, les cas humains de FHCC rapportés depuis quelques années dans ce pays sont tous (si ce n’est un qui est le fruit d’une infection nosocomiale) dûs à la piqûre d’une tique à laquelle on ne se s’attendait pas, Hyalomma lusitanicum, qui est restreinte aux forêts de chênes et n’a jamais été décrite comme pouvant transmettre le FHCCv [48]. Ce cas d’école prouve bien qu’il ne suffit pas à H. marginatum d’être présente, abondante et en contact avec des hôtes virémiques au FHCCv pour devenir un vecteur local de FHCCv. L’étude des foyers de FHCC à travers le monde, dans des socio-écosystèmes variés, permet d’identifier certains facteurs communs ou au contraire certaines conditions locales spécifiques aboutissant à la transmission efficace de FHCCv et l’émergence de cas cliniques chez l’humain.
La FHCC apparaît ponctuellement mais régulièrement dans les Balkans et en Afrique du Sud et de l’Ouest, suggérant une situation endémique. Les malades sont souvent des personnes ayant des activités de plein air, en contact avec des tiques et le bétail. Les cas humains apparaissent de façon synchrone avec la dynamique d’activité des tiques vectrices et l’augmentation saisonnière de circulation virale au sein du cycle sylvatique de transmission. Dans ces régions, H. marginatum pour les Balkans et H. rufipes en Afrique (anciennement connue comme une sous-espèce de H. marginatum) ont été identifiés comme les vecteurs majeurs de FHCCv, au moins pour l’humain. Etant donnée la virémie courte et transitoire chez les hôtes vertébrés, la probabilité que ces derniers puissent infecter une tique reste faible et d’autres modes de transmission de tique à tique doivent se mettre en place [36]. Toutefois, des recherches ont estimé le taux de transmission transovarienne de FHCCv de femelles infectées vers leurs descendants et il s’avérait être trop faible pour maintenir la circulation virale en l’absence d’amplification par des hôtes vertébrés [49]. C’est dans ce contexte particulier qu’il a été démontré en Afrique l’intervention possible de certains « partenaires de choix » comme la tique Hyalomma truncatum, même si elle ne constitue pas un vecteur majeur de FHCCv, par son aptitude à amplifier le virus au sein des populations de tiques par le biais de la transmission par « cofeeding » sur animaux non virémiques [50, 51]. Hyalomma marginatum étant une tique à deux hôtes (la larve et la nymphe se gorgent sur le même hôte et l’adulte sur un autre), l’infection des stades immatures sur les petits vertébrés est une étape cruciale en termes d’infection et d’amplification virale qui permet d’obtenir des stades adultes infectants [51].
Parmi les hôtes préférentiels des stades immatures de H. marginatum et H. rufipes, les oiseaux sont incapables de répliquer le FHCCv alors que les lièvres sont considérés comme de très « bons » amplificateurs de virus mais sont rares en milieux Sahélo-soudaniens. Toutefois, en Afrique de l’Ouest, le calao à bec rouge (Tockus erythrorynchus), qui est abondant et fréquemment infesté par des stades immatures de H. rufipes, a pu être expérimentalement infecté par FHCCv et s’est avéré capable de transmettre le virus à des larves de tiques lorsque celles-ci ont été mises à gorger sur lui [52]. En Afrique du Sud, les autruches qui peuvent être infestées par les immatures et les adultes de H. rufipes ont aussi été identifiées comme de « bons » hôtes amplificateurs de FHCCv et donc de potentielles sources d’infection pour les tiques vectrices [53]. L’intervention de ce type d’hôtes vertébrés « amplificateurs » pourrait expliquer en partie l’émergence de FHCC en Espagne. En effet, les stades immatures d’H. lusitanicum parasitent quasi exclusivement les lièvres et les stades adultes de la tique parasitent les cerfs. Or, ces deux hôtes sont supposés être de « bons » amplificateurs de virus ; une étude sérologique menée chez des cerfs espagnols a ainsi montré des séroprévalences chez ces ongulés deux fois supérieures à celles observées chez les bovins corses [54]. A l’inverse, H. marginatum parasite des lagomorphes mais aussi de nombreux oiseaux aux stades immatures, et ses stades adultes préfèrent les ongulés domestiques, et particulièrement les chevaux qui ont des virémies trop faibles pour infecter des tiques. En France et en Espagne où les populations de lièvres sont assez rares ou localisées et les chevaux au contraire très abondants, il se pourrait que cela contribue à maintenir un taux d’infection des tiques H. marginatum suffisamment faible pour ne pas voir émerger de cas humains, par ce qu’on appelle « l’effet dilution » [55].
La situation épidémiologique de la FHCC en ex-URSS et en Turquie est aussi très informative pour comprendre les facteurs d’émergence de cette maladie, d’autant que le FHCCv dans ces régions est également transmis par la tique H. marginatum. La maladie présente par contre un profil très différent puisqu’elle se caractérise par des épidémies massives, en particulier celle observée en 1944 chez des soldats soviétiques en Crimée, qui s’est ensuite poursuivie de nombreuses années avec toutefois des récurrences plus faibles [56], et l’épidémie qui sévit actuellement en Turquie depuis 2002 avec une incidence annuelle atteignant 700 à 1 300 cas par an jusqu’à récemment [57]. Dans ces deux régions, des zones agricoles avaient été abandonnées pendant plusieurs années du fait de la guerre, de mouvements terroristes, ou encore d’une politique stricte de prohibition de la chasse, ce qui a permis la pullulation des vertébrés et des tiques, et par voie de conséquence l’augmentation de la circulation naturelle de FHCCv. Ultérieurement, des militaires et de nouveaux arrivants ont investi massivement ces territoires pour y développer l’agriculture et l’élevage et ont ainsi permis l’émergence de FHCCv chez des humains immunologiquement naïfs. Dans ce contexte, la conjonction de conditions favorisant la circulation virale sauvage et l’infection de tiques vectrices, et l’augmentation des contacts humains — tiques a contribué à l’émergence de cas humains de FHCC. Bien que H. marginatum soit décrite comme une tique particulièrement « agressive » au sein du genre Hyalomma, avec un comportement chasseur exacerbé envers ses hôtes vertébrés [44] et une certaine affinité de ses stades adultes pour l’humain, nous pensons que sa piqûre et la transmission du CCHFv restent malgré tout un événement rare chez l’humain en France. En effet, les densités de H. marginatum sont encore faibles par rapport aux pays du sud de la Méditerranée où cette tique existe depuis des siècles. C’est de plus une tique assez grosse au stade adulte (d’où son nom médiatique de tique géante), que l’on détecte généralement facilement à la surface de la peau avant qu’elle ne s’accroche, et qu’elle puisse transmettre un agent infectieux.
3. Des vecteurs inattendus, un nouveau virus pour la science : comment les moucherons du genre Culicoides menacent les ruminants domestiques partout sur la planète
Culicoides imicola est une espèce de moucheron piqueur de la famille des Ceratopogonidés, responsable de la transmission de virus d’importance vétérinaire tels que le virus de la fièvre catarrhale ovine (FCO) dans les régions afrotropicales et méditerranéennes. La fièvre catarrhale ovine est une maladie dont l’agent étiologique est un virus du genre Orbivirus transmis par des espèces du genre Culicoides (Figure 1) aux ruminants domestiques et sauvages.
L’exemple de C. imicola est assez emblématique à deux titres : le débat sur le statut invasif, le tempo d’invasion et le rôle des activités humaines, ainsi que la réputation qu’une espèce supposée envahissante prend au détriment des espèces autochtones. La fièvre catarrhale ovine est une maladie émergente en Europe, associée à deux mécanismes distincts : (I) l’installation en Méditerranée de populations pérennes d’une espèce vectrice afrotropicale, et (II) la transmission de sérotypes exotiques par des espèces paléarctiques autochtones compétentes. C’est sans doute l’un des seuls cas d’émergence d’une maladie vectorielle pour lequel le lien avec l’augmentation globale des températures est aussi fortement suspecté [58, 59].
A partir de 1998, l’Europe du Sud subit une série inédite d’émergences de FCO impliquant différents sérotypes (1, 2, 4, 8, 9, 16) majoritairement dans des zones où C. imicola était considéré comme absent [60]. Les premiers foyers sont observés sur plusieurs îles grecques, avant d’atteindre progressivement et rapidement toutes les régions du bassin méditerranéen. En 1999, des foyers sont décrits au Maghreb, puis entre 2000 et 2004, en Espagne, en Grèce continentale, en Sardaigne et en France (Corse) [60]. Suite à ces foyers et sachant le rôle vecteur démontré de C. imicola en région afrotropicale, des enquêtes entomologiques sont menées dans les régions où sont signalés des foyers pour mettre en évidence la présence de C. imicola. Ces enquêtes permettent rapidement de dresser la carte de distribution de l’espèce dans le bassin méditerranéen. En 2000, l’espèce est ainsi observée pour la première fois sur les îles grecques de Samos, Kos et Leros, et dans plusieurs localités en Grèce continentale, mais semble absente au nord de la Grèce et en Bulgarie. A la même période, C. imicola est collecté en Italie (partie continentale, Sicile et Sardaigne). Les enquêtes entomologiques indiquent une limite septentrionale au niveau de la latitude 44° N (au nord de la Toscane), avec une présence relativement rare au-delà de cette limite [61]. En 2002, C. imicola est confirmé en Corse [62] où les populations se révèlent largement répandues et très abondantes (avec plus de 10 000 insectes collectés par nuit) [63]. Suivent des enquêtes entomologiques qui confirment la présence de l’espèce dans les îles Baléares [64], dans le nord de l’Espagne et en Catalogne [65]. En France continentale, l’espèce est collectée pour la première fois dans le département du Var en 2003 avec des abondances très faibles par rapport aux populations corses [63]. La surveillance entomologique mise en place sur le littoral méditerranéen suite à cette introduction et jusqu’à aujourd’hui, montre une distribution sur une zone limitée [63], (départements du Var et des Alpes-Maritimes, dans les plaines littorales des golfes de Fréjus et de Saint-Tropez). Une deuxième introduction est reportée en 2008 dans le département des Pyrénées-Orientales où les enquêtes entomologiques montrent comme dans le Var une distribution et des abondances limitées. Depuis 2005, la population présente dans le département du Var est la plus septentrionale de l’espèce. La population dans les Pyrénées Orientales n’a donné lieu à aucune capture depuis 2012, et est considérée comme disparue [66]. Un point positif de capture en Suisse est présent dans la littérature mais est considéré par les spécialistes comme un individu erratique ou un artefact de piégeage (piège utilisé précédemment en Espagne).
Longtemps, l’hypothèse d’une colonisation très récente des territoires méditerranéens par C. imicola a été le dogme, avec des dispersions de femelles infectées expliquant les foyers observés. Ce statut invasif récent était appuyé sur la seule base des observations historiques de présence dans le bassin méditerranéen et de larges efforts d’échantillonnages déployés dans toute la région pour trouver l’espèce recherchée. Rétrospectivement, les enquêtes entomologiques antérieures à 2000 en Italie (précédant les épidémies de FCO), comportaient des biais méthodologiques (sites de collectes, type de pièges, période de collecte), suggérant que ces méthodes de collectes n’auraient pas permis de collecter des individus de C. imicola, même aujourd’hui [61]. Ainsi, il a fallu des travaux de modélisation, de génétique des populations et de phylogéographie pour confirmer l’hypothèse d’une présence ancienne de C. imicola dans le bassin méditerranéen, bien avant l’émergence de la FCO dans cette région. L’histoire évolutive de C. imicola est présentée comme suit [67, 68, 69].
A l’ouest du bassin méditerranéen, les moucherons auraient emprunté deux routes pour coloniser le sud-ouest de l’Europe. Il y a au moins 200 ans, le Maroc aurait servi de source aux populations espagnoles et portugaises, tandis que l’Algérie aurait fourni des émigrants à la France et à l’Italie. La différenciation génétique faible attesterait d’une dynamique de colonisation avec des flux géniques récurrents entre les populations. La forte capacité de C. imicola à se disperser par les vents apparaît fondamentale dans le succès de la colonisation des régions méditerranéennes. A ce titre, une étude combinant modélisation de la dispersion par les vents et génétique des populations a démontré que les populations installées dans les Pyrénées Orientales avaient une origine corse et non catalane comme pouvait le laisser penser la distribution géographique de l’espèce entre les deux régions frontalières. Le rôle du réchauffement climatique contemporain pourrait avoir contribué à l’expansion géographique de C. imicola en augmentant la taille des populations [58, 59], en créant de nouveaux habitats favorables à l’installation de l’espèce, ou en augmentant sa dispersion par le vent. D’autre part, les activités humaines pourraient avoir facilité l’établissement et l’accroissement local des populations en augmentant la disponibilité en hôtes via l’intensification des élevages au cours des siècles derniers. Aujourd’hui, la dynamique d’expansion des populations installées semble, au moins partiellement, régie par les abondances locales et leurs capacités de dispersion, les conditions environnementales et les faibles abondances à la limite septentrionale qui contribuent aussi à limiter ces expansions. Ainsi, la limite de distribution septentrionale de C. imicola est certainement atteinte à l’heure actuelle dans le bassin méditerranéen et n’a pas présenté de variations majeures depuis les années 2000.
Pendant la période d’émergence de la FCO dans le bassin méditerranéen (2000–2005), les regards sont tournés vers la côte nord de la Méditerranée et C. imicola. Les acteurs de la santé animale et la communauté scientifique supposent alors que le risque est grand que cette espèce d’origine afrotropicale colonise toute l’Europe tempérée et soit responsable de la transmission de plusieurs sérotypes de FCO. C’est une autre histoire qui se déroula, surprenant toute la communauté scientifique et mettant en lumière non pas une espèce exotique largement reconnue comme vectrice dans son aire d’origine, mais des espèces de Culicoides autochtones supposées faiblement vectrices.
Ainsi, avec surprise, le sérotype 8 de la FCO est introduit en 2006 dans le nord de l’Europe, suivi du sérotype 1, et ils sont transmis intensément par des espèces paléarctiques autochtones, C. imicola étant absent de ces zones. Cette situation avait déjà été observée dans les Balkans mais peu étudiée. En l’absence de vaccin autorisé, les mesures de lutte se sont révélées inefficaces pour contenir la progression du virus qui a infecté des dizaines de milliers d’élevages en Europe. La France a déclaré environ 15 000 foyers en 2007 et plus de 30 000 en 2008 (dont environ 5000 dus au sérotype 1), avant que les campagnes de vaccination obligatoires ne réduisent la transmission (83 foyers déclarés en 2009 et un seul en 2010). Les études de compétence vectorielle, bien que méthodologiquement très compliquées pour le genre Culicoides, ont confirmé l’évidence observée : les espèces autochtones de Culicoides paléarctiques sont compétentes pour la transmission de plusieurs sérotypes de la FCO. Leur forte compétence sera aussi confirmée lors de l’épizootie du virus de Schmallenberg en 2011, autre virus transmis par les Culicoides aux ruminants [70]. Aujourd’hui, la communauté scientifique s’entend pour considérer que toutes les espèces abondantes en région paléarctique sont impliquées dans la transmission des virus de la FCO et de Schmallenberg avec des niveaux plus ou moins importants pour lesquels il reste encore à identifier les déterminants (rôle de la salive, co-évolution virus-vecteur, communauté endosymbiotique, immunité des insectes, etc.).
A quoi faut-il s’attendre pour les prochaines décennies ? Les 30 dernières années ont montré que presque toutes les terres émergées ont une faune de Culicoides capable de transmettre des virus et sont donc des zones à risque d’émergence avec des conséquences pour les productions animales et les populations humaines (émergence du virus Schmallenberg en 2011, réémergence de la fièvre catarrhale ovine en 2015 en France, foyers du virus Oropouche en Guyane en 2020, émergence de la peste équine en 2020 en Thaïlande et en Malaisie). Aujourd’hui, le front de distribution nord de C. imicola semble stable, avec les populations les plus septentrionales situées dans le département du Var, avec de faibles abondances.
Fin 2020, six sérotypes de FCO circulent en Europe [73]. Un autre virus du genre Orbivirus transmis par les Culicoides aux ruminants sauvages et domestiques est aux portes de l’Europe et responsable de la maladie hémorragique épizootique ou maladie hémorragique des cervidés (EHD). Il n’a jamais été signalé dans l’Union européenne (UE), bien que ces dernières années des foyers causés par les sérotypes 6 et 7, auparavant considérés comme non pathogènes, aient été observés dans les pays voisins de l’UE (Maroc, Israël). Le virus présente un risque important d’introduction et d’installation dans l’UE. Étant donné que les vecteurs compétents sont largement répandus et abondants en Europe (les mêmes que ceux de la FCO et du virus de Schmallenberg), le risque de circulation durable de la maladie hémorragique épizootique, s’il est introduit, est élevé [74]. De plus, les signes cliniques chez les bovins sont semblables à ceux des animaux touchés par la fièvre catarrhale ovine, ce qui souligne la nécessité d’utiliser des outils de détection précis et spécifiques, ainsi que d’informer et former les acteurs de la surveillance.
L’épidémiologie moléculaire des souches circulantes, les données empiriques de compétence vectorielle et les études sur les interactions hôtes-vecteurs-pathogènes indiquent que la coévolution entre les souches de virus et les espèces vectrices n’est pas une condition préalable à la propagation de ces arbovirus. Les interactions pathogènes-vecteurs-hôtes sont très dynamiques dans le modèle Culicoides, et les niveaux de transmission peuvent être radicalement modifiés en réponse aux changements climatiques, pratiques agricoles et d’élevage, commerce des animaux et à la mobilité humaine. Les nombreuses possibilités de rencontre entre différents virus et sérotypes viraux, circulant avec le mouvement des animaux, et les différentes espèces et populations de Culicoides offrent de nombreuses opportunités pour de nouvelles associations virus-vecteurs qui pourraient conduire à de nouvelles émergences.
Ainsi le modèle Culicoides nous montre qu’en très peu de temps, des situations sanitaires peuvent basculer avec des conséquences économiques importantes et que les dogmes ou hypothèses peuvent vite être balayés.
4. Le malheur est dans le pré : cicadelles et (ré)émergence de la bactérie phytopathogène Xylella fastidiosa
La bactérie Xylella fastidiosa (Xanthomonadaceae, Gammaproteobacteria) est transmise aux plantes par des insectes appartenant à plusieurs familles d’Hémiptères (Aphrophoridae, Cercopidae, Cicadellidae, Cicadidae et Clastopteridae) qui se nourrissent de sève brute (xylème). Aux Amériques, cette bactérie est associée à de graves maladies sur plantes cultivées et ornementales [73, 74]. Les colonies bactériennes forment des biofilms qui bouchent les vaisseaux du xylème empêchant ainsi le transport d’eau. Les plantes infectées montrent des symptômes de brûlures foliaires et peuvent mourir en cas d’infection importante. Xylella fastidiosa est entre autres responsable de la maladie de Pierce (qui engendre des coûts annuels de plus de 100 millions de dollars pour l’industrie de la vigne et du vin en Californie [75]) et de la chlorose panachée des agrumes (pertes annuelles d’environ 120 millions de dollars au Brésil [76]).
En se nourrissant sur une plante infectée, les insectes acquièrent la bactérie qui va ensuite se multiplier dans leur cibarium (cavité antérieure de la bouche dont la paroi musclée agit comme une pompe). Cependant, ils peuvent transmettre la bactérie à un nouvel hôte sans période de latence [73]. La propagation de la bactérie dans l’environnement est donc principalement liée à l’abondance et aux préférences alimentaires de ses vecteurs.
Avant la crise italienne de 2013 [77], les connaissances sur les vecteurs de X. fastidiosa provenaient d’études menées sur le continent américain. Or, les communautés de vecteurs rencontrées en Europe sont presque complètement différentes [78]. Etant donné que le spectre d’hôte de X. fastidiosa comprend près de 600 espèces de plantes de plus de 80 familles et au regard de l’importance du commerce international, on peut se demander si ce manque d’anticipation pour accumuler des connaissances sur les vecteurs européens était le meilleur modus operandi. Le foyer italien a entraîné la mort de milliers d’oliviers parfois centenaires. Cette crise puis la détection de X. fastidiosa en Corse [78], en Espagne [79] et au Portugal [80] ont eu l’effet d’un électrochoc en Europe qui s’est retrouvée à devoir financer des projets de recherche dans l’urgence. Malheureusement, ces projets étaient la plupart du temps construits à l’échelle des pays membres, sans réelle intention d’obtenir une vue d’ensemble de la distribution de X. fastidiosa et de la diversité des souches qui pourraient se trouver en Europe. Peu d’intérêt a également été accordé à une meilleure compréhension des réseaux trophiques insectes /plantes afin de mieux comprendre la diffusion de la bactérie dans l’environnement ou pour déterminer si cet endophyte constituait une réelle menace et dans quelles conditions il pourrait le devenir.
Au début de la crise et encore aujourd’hui, peu de considération a paradoxalement été donnée aux vecteurs potentiels de la bactérie. Ironiquement, ce qui a été considéré comme une avancée significative est la redécouverte de la capacité du cercope des prés Philaenus spumarius (Aphrophoridae) (Figure 1) à transmettre la bactérie [81], capacité établie dès 1950 [82]. A partir de 2014, P. spumarius qui n’avait jamais été considéré comme un important ravageur en Europe s’est retrouvé sur le banc des accusés. Plus tard, il a été montré que Philaenus italosignus et Neophilaenus campestris étaient également des vecteurs efficaces. Des études supplémentaires sont cependant nécessaires afin de déterminer si d’autres insectes se nourrissant de xylème (120 espèces répertoriées en Europe, 52 en France) [78] pourraient jouer un rôle dans la propagation de X. fastidiosa. Actuellement, P. spumarius est encore considéré comme le vecteur principal de la bactérie en Europe du fait de sa polyphagie, de sa large distribution et de l’abondance locale de ses populations [83, 84]. Il est notamment présent partout en France, en particulier dans les régions où des foyers de X. fastidiosa ont été mis en évidence par les services de surveillance de l’Etat (Corse, PACA, Occitanie). De manière surprenante, les préférences alimentaires des adultes de P. spumarius semblent différentes entre la Corse, où ils paraissent se nourrir exclusivement de Cistus spp., et le continent, où ils sont beaucoup plus polyphages [84]. Ceci suggère que la dynamique de la bactérie et les mesures de contrôle pourraient différer selon les régions. De manière intéressante, les études de modélisation et les approches moléculaires ont montré que P. spumarius serait une sentinelle parfaite pour suivre la propagation de la bactérie dans l’environnement [84]. Un suivi vectoriel pourrait ainsi venir compléter efficacement la surveillance traditionnelle qui cible exclusivement les plantes, principalement symptomatiques.
Les études de génétique [84, 85] et les approches mécanistico-statistiques [86] semblent montrer que l’introduction de X. fastidiosa en Europe pourrait en fait dater du début des années 90. Si on considère l’importance des échanges commerciaux mondiaux du siècle dernier, ces résultats ne sont pas surprenants et l’introduction pourrait même être plus ancienne. En outre, les approches de modélisation montrent qu’une large partie de l’Europe est climatiquement favorable à la bactérie [87] et à son principal vecteur P. spumarius [84]. On peut donc se demander si X. fastidiosa est une bactérie émergente ou ré-émergente. Mais, dans ce dernier cas, comment expliquer que les foyers d’infection n’aient été identifiés que récemment ?
Le scénario suivant est hypothétique et pourrait être contredit dans les années qui viennent mais il coïncide bien avec les observations faites sur la bactérie et ses vecteurs. Lorsque les populations bactériennes sont faibles et que les flux de sève sont suffisants (i.e. lorsque le temps n’est pas trop sec et que les plantes sont plutôt jeunes), la plupart, voire toutes les plantes sont asymptomatiques à X. fastidiosa [74]. Ces plantes asymptomatiques auraient pu servir de réservoirs au fil des ans [86]. En outre, la bactérie est sensible au froid et une guérison même totale a déjà été observée chez certaines plantes après l’hiver [88]. La crise italienne et les suivantes auraient pu servir de révélateurs de la présence de X. fastidiosa en Europe et les symptômes précédant ces crises auraient pu être confondus avec des symptômes dus à la sécheresse. Jusqu’à maintenant, les insectes vecteurs européens meurent en hiver et les cicadelles vectrices passent l’hiver à l’état d’œufs qui ne contiennent pas la bactérie [73]. La nouvelle génération de vecteurs doit donc ré-acquérir la bactérie à partir de plantes infectées, ce qui pourrait ralentir la propagation de cette dernière dans l’environnement. Il semble également que X. fastidiosa se multiplie de manière moins efficace dans P. spumarius que dans les vecteurs américains tels que la cicadelle pisseuse Homalodisca vitripennis ou la cicadelle bleu-vert Graphocephala atropunctata. Ces éléments suggèrent que le changement climatique (hivers plus doux et sécheresses plus sévères) pourrait contribuer à la ré-émergence de X. fastidiosa en Europe. Néanmoins, comme les vecteurs semblent se nourrir préférentiellement sur des plantes en bonne santé et turgescentes [89], une accélération dans la phénologie de la maladie due au climat (i.e. incubation et apparition des symptômes plus rapides) pourrait être contrebalancée par une réduction de la propagation de la bactérie en raison du comportement des vecteurs [90].
Il est possible que de nouveaux foyers soient détectés dans le futur grâce notamment au développement de nos capacités techniques pour associer la bactérie aux symptômes observés. Pourtant, il est difficile de croire que le pathosystème puisse s’emballer si les espèces en présence (vecteurs + bactérie) restent les mêmes. La situation italienne apparaît spécifique ; avec une monoculture d’oliviers parfois âgés sous lesquels des bandes enherbées abritant des milliers de P. spumarius ont pu favoriser la propagation rapide de la bactérie. Dès lors, les efforts de surveillance devront être maintenus afin de s’assurer que des vecteurs plus efficaces ne soient introduits en Europe. En effet, l’emballement du pathosystème en Californie dans les années 80 est principalement lié à l’arrivée d’Homalodisca vitripennis, vecteur extrêmement polyphage et efficace, plus qu’à X. fastidiosa elle-même qui y était déjà présente [91].
Réduire la propagation de la bactérie nécessite d’agir sur de nombreux facteurs biotiques (vecteurs, plantes) et abiotiques (climat, paysage) [92], ce qui complique son contrôle. Aucune solution de lutte efficace n’a encore été trouvée malgré les efforts de recherche aux USA. Si l’utilisation des pesticides peut réduire la propagation de la bactérie, de multiples épandages sont nécessaires, ce qui a des effets délétères sur la santé et l’environnement pour des bénéfices qui peuvent n’apparaître qu’après plusieurs saisons [93]. Il faut souligner que le cadre général qui permettrait de prédire comment les interactions vecteurs-plantes affectent la propagation de la bactérie est très loin d’être établi. Nous disposons encore de peu d’éléments sur la manière dont le comportement des vecteurs (durée d’alimentation), leur phénologie, leur compétence, la taille des populations ou encore leurs préférences alimentaires peuvent influer sur la vitesse de transmission. La meilleure option pour contrôler cette bactérie reste de continuer à parfaire nos connaissances sur ce pathosystème, pour, par exemple, tenter d’identifier des acteurs clefs des réseaux d’interactions plantes–X. fastidiosa–vecteurs qui pourraient être ciblés pour briser les chaînes de transmission ou favoriser la guérison des plantes en proposant par exemple des moyens de lutte durable (e.g. lutte biologique contre P. spumarius en utilisant des parasitoïdes oophages [94]).
5. Etre ou ne pas être un vecteur ?
L’histoire des émergences de la fièvre jaune, de la dengue, de la fièvre hémorragique de Crimée-Congo, de la fièvre catarrhale ovine et de Xylella fastidiosa nous conduisent à considérer les facteurs nécessaires, mais pas toujours suffisants, pour qu’une espèce d’arthropode, initialement négligeable pour la santé humaine, animale et végétale, devienne une préoccupation majeure et un ennemi à combattre.
Tout d’abord, l’arthropode, ou plus précisément une population donnée d’une espèce donnée d’arthropode, doit être capable de transmettre biologiquement ou mécaniquement l’agent infectieux (ou une population ou un génotype de cet agent pathogène). Les mécanismes impliqués dans la vection peuvent varier d’un vecteur à l’autre et selon que les cycles de transmission concernent des vertébrés ou des plantes.
Filtres de rencontre et de compatibilité, l’exemple de la fièvre jaune, d’après [95] et [25].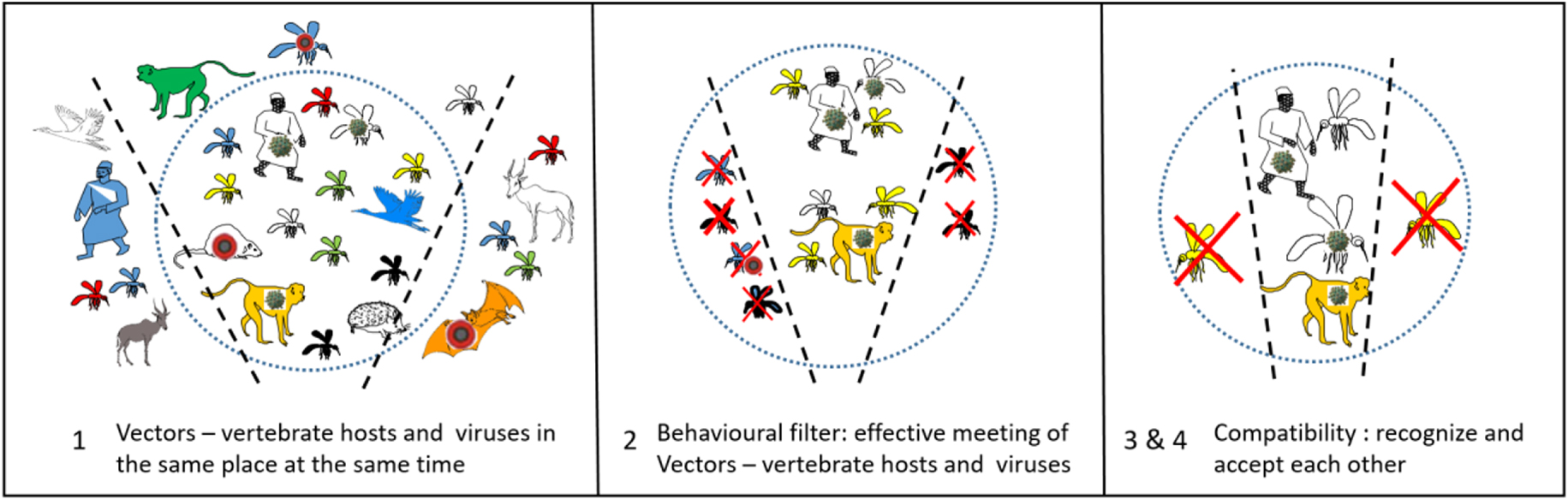
Dans le domaine de l’entomologie vétérinaire et médicale, cette aptitude à transmettre biologiquement un agent pathogène est appelée capacité vectorielle. La capacité inclut la compétence vectorielle, qui est le fait qu’un arthropode s’infecte lui-même après l’ingestion d’un repas de sang infecté, puis transmette ultérieurement l’agent pathogène, généralement par sa salive. Les deux termes, capacité vectorielle et compétence vectorielle, ont été formalisés depuis MacDonald [96], et comprennent des paramètres liés à la densité du vecteur , à la fréquence des repas sanguins et aux préférences trophiques (a), à la longévité (p), au temps nécessaire à l’agent infectieux pour achever son développement chez l’arthropode, de l’ingestion (n), à l’infectiosité du vecteur pour l’hôte vertébré (b), à la sensibilité de l’hôte vertébré au pathogène (c) et à la durée infectieuse de l’hôte vertébré (r). De nombreux autres facteurs y contribuent également, tels que la transmission des agents pathogènes entre les générations, la biologie des stades non hématophages, la compétition, la prédation, etc. La connaissance des valeurs de ces paramètres permet d’estimer le nombre de reproduction de base du virus, R0, qui est le nombre total de cas dérivés d’un cas infectieux que la population de vecteurs distribuerait à des hôtes vertébrés.
L’épidémiologie des maladies vectorielles de plantes (dues à des virus, bactéries, phytoplasmes, champignons) dépend également de la dynamique des populations, de la dispersion, du comportement de sélection des hôtes et du comportement alimentaire des vecteurs [97]. Les insectes hémiptères sont de loin les vecteurs les plus importants d’agents phytopathogènes (97). Il existe encore des lacunes importantes dans notre connaissance des vecteurs de bactéries (97) par rapport aux vecteurs de virus, tels que les pucerons (98) et les aleurodes (99). Les hémiptères pénètrent dans les tissus végétaux avec leur stylet pour se nourrir dans le mésophylle et le système vasculaire, ou exclusivement dans le phloème ou le xylème. Les agents infectieux peuvent être non persistants, semi-persistants ou persistants [97, 98, 101]. Les agents pathogènes non persistants peuvent être acquis ou transmis en quelques secondes lors d’une piqûre d’épreuve dans les tissus superficiels ou par insertion des pièces buccales dans les tissus plus profonds. Les agents pathogènes non persistants peuvent disparaître rapidement chez le vecteur et il faut de multiples rencontres avec des plantes infectées pour que les vecteurs restent infectieux. Pour les agents pathogènes semi-persistants, l’acquisition peut se faire en quelques minutes, mais l’efficacité augmente avec une alimentation plus longue. La période de rétention est plus longue (de quelques heures à quelques jours) et l’infectiosité est perdue après chaque mue. Pour les agents pathogènes persistants, les vecteurs restent infectieux jusqu’à leur mort après une seule rencontre avec une plante infectée. En outre, l’agent pathogène peut être circulant ou non. Les agents pathogènes non circulants ne sont associés qu’à la région du stylet ou de l’intestin antérieur des vecteurs, tandis que les agents pathogènes circulants sont transportés dans l’hémolymphe du vecteur.
Par conséquent, les agents phytopathogènes circulants sont généralement caractérisés par un degré élevé de spécificité pathogène-vecteur. Enfin, les agents pathogènes peuvent se répliquer (agent pathogène multipliant) au sein de l’insecte vecteur ou non (non multipliant). Xylella fastidiosa est semi-persistante chez les immatures, persistante chez les adultes; non circulante et multipliante.
Il est intéressant de noter que seules quelques espèces ont été signalées comme des vecteurs efficaces de bactéries et de virus. En outre, il semble que certains groupes d’Hémiptères soient capables de transmettre des bactéries (psylles), mais pas des virus et vice versa (pucerons, aleurodes et cochenilles) [98], une spécificité qui n’est pas encore bien comprise.
Ces caractères biologiques intrinsèques des arthropodes ne sont pas suffisants pour en faire des vecteurs. Des facteurs environnementaux permettent, ou non, au potentiel vectoriel de se développer. Selon Combes [95], la spécificité de l’interaction vecteur-pathogène passe par quatre étapes, qu’il a nommées filtres de rencontre et de compatibilité (Figure 2). Ces quatre étapes sont les suivantes : (1) coexister dans l’espace et le temps, (2) se rencontrer (facteurs comportementaux), (3) se reconnaître (spécificité, récepteurs), et (4) s’accepter (sensibilité, immunité).
Tous ces paramètres de la capacité vectorielle sont soumis à la dérive génétique et à des pressions de sélection, et évoluent dans le temps et l’espace. Un excellent exemple est la récente pandémie de fièvre Zika, dont le virus a été transmis dans le monde entier par des populations très différentes d’Aedes aegypti, les populations invasives (en Amérique et Asie) se révélant de meilleurs vecteurs du virus Zika que les populations ancestrales d’Afrique [102].
La reconnaissance, la susceptibilité et la spécificité sont des composantes de l’immunité des arthropodes. Il semble que la première observation d’une réponse immunitaire des insectes remonte à la fin du 19e siècle, lorsque Cuenot a observé la phagocytose de cellules d’insectes dans l’hémolymphe (cité par Munson, 1953 [103]), mais ce n’est que dans les années 1960 que les scientifiques ont réellement commencé à étudier les mécanismes immunitaires des arthropodes [104, 105]. Leur système immunitaire est activé lorsque l’arthropode interagit avec un agent biologique « non-soi ». Il peut s’agir d’un agent infectieux de l’arthropode (virus, bactérie, phytoplasmes, champignon, parasite, parasitoïde), ou d’un agent pathogène de plantes ou de vertébrés transmis par l’arthropode, qui est alors vecteur. La drosophile, un diptère comme les moustiques, a été le principal modèle pour l’étude de l’immunité des arthropodes. Ce domaine de recherche a récemment été récompensé par un prix Nobel décerné à Jules Hoffmann, académicien français. (http://www.academie-francaise.fr/les-immortels/jules-hoffmann).
La plupart du temps, le système immunitaire n’est pas assez efficace et les agents infectieux spécifiques aux arthropodes sont mortels pour les insectes et les acariens. Les pathogènes que nous avons pris comme exemples sont des agents pathogènes de plantes et de vertébrés qui ne tuent pas leurs hôtes arthropodes, et la plupart du temps n’ont que peu d’effet sur le vecteur (sa valeur sélective). De plus, non seulement l’agent infectieux n’est pas détruit par l’arthropode après ingestion, mais il peut se répliquer dans son corps, atteignant parfois les glandes salivaires ou en restant dans le cibarium, et est ensuite transmis à un autre hôte. Des mécanismes de tolérance ou d’échappement ont donc été sélectionnés tant dans l’agent infectieux que dans son vecteur.
En dehors des barrières physiques (cuticule, épithélia digestif, respiratoire, sexuel, …), les mécanismes immunitaires sont soit cellulaires (phagocytose, nodulation, encapsulation ou via des molécules produites par les hémocytes), soit humoraux et responsables de la production de protéines comme la prophénoloxydase ou les peptides antimicrobiens. Les principales voies immunitaires sont Toll, Imd, JAK/STAT, RNAi [106, 107, 108]. L’activation différentielle de ces voies dépend de l’espèce d’arthropode et de son interaction avec des champignons, des parasites, des bactéries, des phytoplasmes ou des virus.
Toutes les conditions ci-dessus nécessaires à une transmission efficace sont rarement réunies, et on comprend donc pourquoi le fait d’être un vecteur est une exception. Compte tenu du très grand nombre d’espèces de vecteurs potentiels et du très grand nombre d’agents pathogènes, nous ne sommes finalement confrontés qu’à un nombre limité de cycles dangereux. Ces cycles qui ont réussi (du point de vue du pathogène) ne sont qu’une toute petite fraction des milliers, voire des millions, d’autres cycles potentiels qui ont échoué. La compréhension des cycles efficaces actuels nous permet ainsi de concevoir les futurs cycles possibles.
6. Conclusions : le pire n’est pas toujours sûr, mais il ne faut pas l’exclure !
Les exemples d’émergence de maladies que nous avons pris, dans le domaine de la santé humaine, animale et végétale, puis la tentative de conceptualiser ce qu’est un vecteur d’agent pathogène infectieux, nous obligent à la modestie. La plupart des facteurs génériques sont bien identifiés, liés à la biologie et à la génétique des vecteurs et des agents pathogènes, et quelques facteurs extrinsèques, notamment environnementaux, sociaux et climatiques sont également pris en considération. Cependant, le poids relatif de ces facteurs, les interactions entre les variables et les aspects évolutifs des systèmes vectoriels sont encore très mal connus. Il est donc difficile d’anticiper l’imprévisible. Parmi les très nombreuses possibilités de rencontre et de compatibilité, si la plupart ne réussissent pas et avortent, il ne fait aucun doute que de nouveaux cycles de transmission se développeront et émergeront.
En l’absence de mesures de lutte efficaces, des foyers de dengue, transmise par Aedes albopictus, se développeront en France métropolitaine, Xylella fastidiosa continuera à se propager et pourrait faire des ravages sur certaines cultures et de nouveaux foyers de maladies humaines et/ou animales dues à des virus transmis par des tiques ou des Culicoïdes apparaîtront. D’autres maladies à transmission vectorielle, que nous ne soupçonnons même pas encore, (ré)apparaîtront ou seront introduites en France.
Dès 1933, Charles Nicolle nous avait mis en garde : « des maladies continueront toujours d’apparaître » [109]. Antoine Béchamp et Louis Pasteur nous rappelaient que « le microbe n’est rien, le milieu est tout », préfigurant l’approche « One Health » qui devient aujourd’hui le paradigme dominant.
Ces opinions anciennes, mais toujours très pertinentes, nous obligent à une approche holistique, prenant en compte la complexité des interactions entre les maladies, les microbes, les hôtes, les vecteurs, l’environnement et leurs évolutions respectives. Si le pire n’arrive pas toujours, de nouvelles maladies apparaissent toujours ou des maladies exotiques se propagent dans des environnements nouveaux ou inattendus. En outre, il va sans dire qu’aucun pays développé ou en développement n’est totalement préparé aux épidémies ou aux pandémies, et chaque pays a d’importantes lacunes à combler en termes de surveillance et de contrôle des maladies, qu’elles soient à vecteur ou non ! Sans aucun doute, la pandémie COVID-19, due au virus SRAS-Cov2, a confirmé cette assertion de manière spectaculaire.
En conclusion, les principales recommandations que nous pouvons faire pour limiter les conséquences des nouvelles « plaies d’Egypte » liées aux vecteurs et aux maladies à transmission vectorielle sont les suivantes, depuis la recherche fondamentale jusqu’à l’implémentation :
- Mieux inventorier et surveiller la diversité génétique des espèces et des populations de vecteurs potentiels, d’agents infectieux, de plantes et d’animaux hôtes et décrire leur distribution, leur abondance et les facteurs associés,
- Mieux comprendre les interactions entre les composantes des systèmes vectoriels (vecteurs, hôtes, agents pathogènes, environnement) et l’évolution de ces interactions, y compris les mécanismes d’adaptation à de nouveaux environnements,
- Etudier le contexte socio-économique et environnemental dans lequel les agents pathogènes circulent et où les vecteurs se propagent,
- Modéliser différents scénarios d’émergence et de propagation,
- Développer des outils plus efficaces et plus durables pour la lutte contre les maladies et les vecteurs,
- Plaider pour la prise en compte d’une approche « one health » dès le début des programmes de surveillance ou de recherche, et insister sur la perte de biodiversité, le changement climatique, l’augmentation exponentielle des échanges intercontinentaux comme principale cause d’émergence,
- Former les futurs épidémiologistes, entomologistes et professionnels ou acteurs de la santé aux concepts d’émergence et aux bonnes pratiques,
- Développer les sciences économiques et les sciences sociales appliquées aux questions de santé afin de comprendre comment les facteurs socio-économiques entravent la détection précoce, la réaction aux épidémies, la surveillance et le contrôle
- Caractériser l’impact des maladies à transmission vectorielle sur les acteurs des systèmes de santé et les systèmes agricoles,
- Etudier la perception qu’ont les agriculteurs, les éleveurs, les acteurs de la santé et les parties prenantes de l’augmentation du risque vectoriel et promouvoir leur participation à la surveillance et à la détection précoce des maladies à transmission vectorielle,
- Accroître le rôle et l’engagement de tous les acteurs (des organisations institutionnelles aux agriculteurs, aux coopératives d’éleveurs et aux citoyens) dans la mise en œuvre et la conception d’outils et de stratégies durables de gestion des maladies,
- Aider les parties prenantes à optimiser et à adapter les plans de surveillance et les interventions aux contextes régionaux (vecteurs présents, absents, abondance limitée).



 CC-BY 4.0
CC-BY 4.0