On November 9, Pfizer and BioNTech announced that their CoV-2-SARS vaccine consisting of the virus’ spicule messenger RNA conferred 90% protection against the occurrence of Covid-19, based on interim results from a Phase III clinical trial [1]. This announcement, whose media impact for a time overshadowed the presidential election of the new U.S. president and the state of the pandemic, illustrates the exceptional nature of this race for a vaccine. It began only 10 months ago when the sequence of the virus was published. It becomes even more important when properly evaluated (see below) in the context of an uncontrolled pandemic that has caused more than 1.3 million deaths worldwide to date, caused by a virus for which no effective medication exists at this time, despite ongoing research. On November 16, Moderna announced that its RNA vaccine has a short-term efficacy of 94.5%, confirming with a second preparation the first results provided by Pfizer and BioNtech. In addition, Moderna’s vaccine appears stable at +4 °C for 30 days, which will facilitate its distribution and use.
1. The race for vaccines
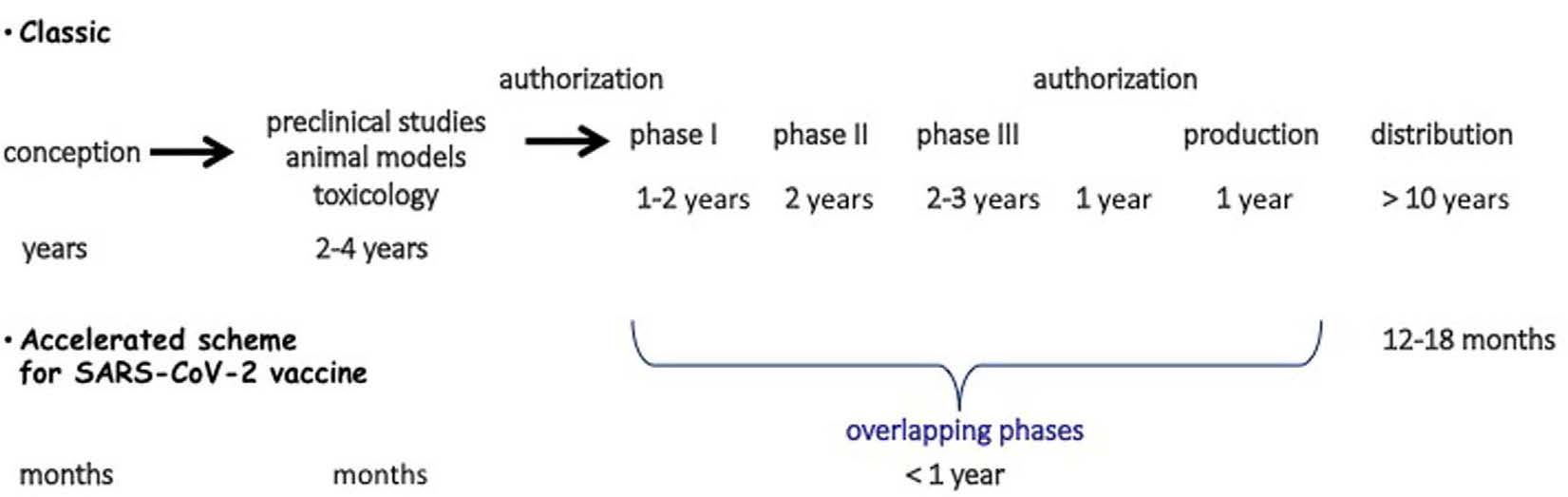
There has been an exceptional mobilization of the scientific, industrial, political, governmental, international and non-governmental worlds to try to obtain in record time one or more vaccines that would make it possible to stop or at least slow down this pandemic. Typically, it takes at least 10 years to develop a vaccine (Figure) [2, 3]. Because of the many stages: from concept, through pre-clinical trials, animal models, toxicology studies, and then phase I clinical trials evaluating tolerance and dose, to phase II and III trials evaluating efficacy and safety of use, to production, licensing, and distribution, it is conceivable that the timeline will be similarly long. In Covid-19, the challenge was to produce a vaccine in 12–18 months. How is this possible without derogating from the strict rules of evaluation of these products? The development of new technologies (see below) that considerably accelerate vaccine production, combined with the overlapping time of the different stages and a risk-taking approach by anticipating vaccine production are at the origin of this attempt to reduce the delays. To some extent, the experience of Ebola vaccine development has served as a model, both technically and logistically, but with a consequent change in scale. The clinical phases were started very early and “nested”. The potential industrial risk was largely offset by the massive investment by some governments to finance vaccine development and production. This is undoubtedly the case in China and especially in the United States. The government set up the “Warp Speed” operation, which has financed the development of 6 vaccines to date for more than 8 billion dollars, with the objective of obtaining vaccines for 300 million US citizens [4]. In addition, many states, as well as the European community, have placed pre-orders for vaccines to allow their citizens rapid access to vaccines when available, while providing guarantees to the companies involved in this race. As a result, more than 200 projects have been launched. Their stage of development varies widely, but more than 40 are in clinical trials and 10 are in Phase III trials, the first of which began in late July. This proliferation of vaccine projects has benefited from technological advances and the development of new vaccine formulations. In total, there are seven forms of vaccines, ranging from traditional to novel strategies.
2. The different types of vaccines (Figure 1)
- A classical approach is the use of inactivated viruses, from viruses produced in cell culture, which is a well-known technology, used in particular for the influenza vaccine. They require the use of an adjuvant. This approach is particularly implemented by Chinese industries with preparations in phase III clinical evaluation [5].
- Another classical approach is the preparation of live attenuated vaccine by producing non-pathogenic modified viruses. This is the technique used for measles vaccine, for example. The need for preclinical optimization studies—particularly to ensure the genomic stability of the virus—increases the time required for development.
- An innovative technique is the use of messenger RNA from the virus spicule [6, 7, 8]. It is the genetic information coding for the antigens that is provided. The choice of the spicule is linked to the fact that it is the viral protein that binds to the cell receptor (ACE-2) and allows the entry of the virus. The neutralizing antibodies detected in infected patients are mainly directed against the spicule. This RNA is placed in lipidic nanovesicles that allow its cellular incorporation, translation into proteins and ultimately immunization. This is the technique used by the Pfizer laboratory associated with BioNTech as well as by the company Moderna. This technique allows a completely acellular production and is accelerated. However, its innovative nature requires particular attention to its safety of use. Finally, these RNAs are fragile and vaccines must be stored at −20 °C or −70 °C depending on the preparations. However, Moderna has just announced that they can be stored at +4 °C for 30 days. An improved strategy (new generation) would be the use of a self-replicating RNA that would reduce the amount of RNA to be injected; however, such vaccines must be carefully evaluated for possible risks of not controlling this amplification in vivo [9].
- The vaccine may consist of DNA coding for the spicule in the form of plasmids. Again, mass production is relatively easy, but immunogenicity appears to be lower and injection modalities more complex [10].
- Another solution is the use of viral vectors in which the genetic information—the spicule gene—has been added. Viral vectors incapable of replication are the subject of major research efforts in vaccination. These are essentially adenoviruses, either naturally infecting primates or humans, but are of low prevalence to avoid the possible neutralizing effect of pre-immunization against the vector. Several candidate vaccines of this type are in clinical evaluation (phase III) after obtaining rather positive preclinical results [11, 12, 13].
- A related strategy is the use of replicative vectors based on vesicular stomatitis virus [14] or the attenuated measles virus used for vaccination against this virus, in which the SARS-CoV-2 spicule gene is placed. These vaccines are in early clinical testing.
- Finally, an attractive strategy consists in the use of recombinant spicule protein produced in cell lines and associated with a lipid adjuvant [15, 16]. This vaccine can take the form of pseudo viral particles, an effective strategy in the context of vaccination against hepatitis B virus. Modifications have been made to the protein to stabilize it in its a priori most immunogenic trimeric form. Various preparations are currently under clinical evaluation. Novavax’s product induces a high titer of neutralizing antibodies in vaccine subjects in Phase I trials [2].
3. Outstanding issues
It is very difficult to predict which strategy(s) will ultimately be the most efficient. We can only be delighted with the diversity of approaches which of course increases the chances of success. At this stage, it is known that several of these vaccines induce in humans the production of antibodies neutralizing the viral infection as measured in vitro, at titres apparently comparable to those of the sera of convalescent subjects of Covid-19 [2, 3, 17]. They also induce at least a CD4 T response of the Tfh (follicular helper) type required for antibody production, and of the TH1 but not TH2 type, which could contribute to better protection over time and avoid deleterious effects of TH2 type responses (anaphylaxis, inflammation) [18].
It should be noted, however, that no correspondence could yet be established between possible clinical efficacy and neutralizing antibody titer (or T-response function). The kinetics of decrease in antibody titers are also unknown. Will it be similar to that in infected subjects (rather slow in sick subjects, rapid in asymptomatically infected subjects)? [19].
The strategies developed so far are based on intramuscular injections of vaccines, which are therefore unlikely to induce mucosal immunity, although their importance in immunity against respiratory viruses is well known [20]. Some types of preparation could be used by inhalation, and this will probably be the subject of further studies in the future. Finally, almost all vaccines in preparation (apart from whole viruses) use as antigens the spicule, the protein of the virus that allows it to bind to its cellular ACE-2 receptor. This approach is logical because the neutralizing antibodies found in infected patients are directed against this protein and in particular (but not exclusively) against the receptor-binding domain. The use of complementary antigens as a source of a protective immune response cannot be ruled out. This can be examined in a second step.
4. Criteria for success
Widespread use of an SARS-CoV-2 vaccine requires that it meets a set of efficacy and safety criteria that cannot be deviated from despite potential pressures. The World Health Organization, the United States Academy of Sciences [21] and especially the regulatory authorities that issue the authorizations for use: FDA (food and drug administration in the United States), EMA in Europe have issued very precise recommendations. Many points need to be considered: in addition to the quality of the vaccine product, first and foremost are safety issues: is the immediate reaction (“reactogenicity”) tolerable and what is the risk of serious adverse events? There is the question of an aggravation of the disease by the effect of non-neutralizing antibodies which could either facilitate the infection of macrophages or facilitate an exacerbated inflammatory response. TH2 type T lymphocytes could also contribute to this. This risk is not only theoretical since it has been observed in second infection with dengue virus (arbovirosis) and in the testing of a dengue vaccine [18] and experimentally with vaccine preparations against other coronaviruses. However, a number of factors suggest that this risk is low in the context of CoV-2-CoV-SARS. Animal vaccination data are also other encouraging, but safety in phase III trials remains to be observed in this and other events. Careful monitoring will need to be maintained afterwards, particularly given the highly innovative nature of some of the vaccines. It is essential to be able to reassure the public about the safety of these vaccines—put in perspective with the expected benefits—and to be able to provide the public with the information they need.
Efficiency is of course central. But behind this term there are several notions: protection against the benign form of the disease, severe forms (much rarer), duration of protection, effectiveness of protection for vulnerable people, particularly the elderly. Finally, are these vaccines capable of suppressing (or at least reducing the transmission of the virus) by preventing viral replication in the oropharynx? The answer to these questions and especially the last one will take time. The first so-called emergency approvals will depend on the rate of efficacy obtained, a trend towards the reduction of severe infections and a minimum delay in observation (2 months according to the FDA). Compaction of the development time for these vaccines should not lead to a reduction in the safety and efficacy criteria. It is only at this price that confidence in the vaccine can be established. Note that the predicted efficacy of Pfizer and Moderna vaccines is observed in the early post-vaccination phase, at the peak of the immune response—what will it be in a few months? The ability of the vaccines to interrupt (reduce) the chance of virus transmission will depend on the ability to break the pandemic via herd immunity. If the vaccine was perfectly effective [2], 70% of the population would need to be vaccinated! There is also the possible need for regular revaccination depending on the duration of protective immunity achieved.
5. Who to vaccinate?
Vaccination priorities will be defined according to vaccine performance. The French High Authority for Health is working in particular on this issue.
Professionally or socially exposed people (health, commerce, education, police, prison, people in precarious situations, etc.) appear to be a priority. If there are indications of effectiveness among the elderly and vulnerable, they should be vaccinated as a first-line priority. Only then can the vaccine(s) be offered to the rest of the population.
6. Producing and distributing vaccines
Vaccine needs will be very large, ideally 15 billion doses to vaccinate the entire world, taking into account that 2 doses will be needed for most vaccines. Although production capacity is increasing, it is estimated that by 2021 it will reach four billion doses… This raises the question of vaccine distribution in terms of both technical and ethical aspects. Technical because some vaccines require storage at −20 °C or −80 °C, which poses serious logistical problems. How vaccine distribution will be organized, each country must prepare for this.
Main vaccines in evaluation
| Principle | Adjuvant | Society | Development stage | Methods previously used for vaccines | |
|---|---|---|---|---|---|
| ∙ | Inactivated virus | Alu. salt | Sinovac | Phase III | Yes/multiple |
| Alu. salt | Sinopharm | Phase III | |||
| ∙ | Attenuated live virus | — | Codagenix Sérum Institute of India | Preclinical | Yes/multiple |
| ∙ | ARNm spike lipidic nanoparticles | Pfizer–BioNTech | Phase III–preliminary results | No | |
| — | Moderna | Phase III–preliminary results | |||
| Curevac | Phase III | ||||
| RNA auto replicative | Curevac | Preclinical | |||
| ∙ | DNA plasmid | — | Inovio/Genexine | Phase I/II | No |
| ∙ | Non replicative adenoviral vector | ||||
| Chimp Ad | Astra Zeneca/Oxford | Phase III | Yes Ebola | ||
| Ad 26 | Johnson and Johnson/Janssen | Phase III | No | ||
| Ad 5 | Cansino | Phase III | No | ||
| gorilla Ad | Reithera | Phase I | No | ||
| Ad 5+26 | Gamaleya | Phase III | |||
| ∙ | Recombinant spicule nanoparticules | Matrix-M | Novavax | Phase III (beginning) | Yes |
| AS03 | Sanofi | Phase I | |||
| Virus-like particle | Medicago | Phase I | Yes; hépatite B | ||
| ∙ | Replicative vector | ||||
| VSV-spike | MSD | Phase I | No | ||
| Rougeole-spike | — | MSD-Themis–Institut Pasteur | Phase I | ||
| Grippe-spike | — | Beijing Wantai | Phase I | ||
Alu: Aluminium; ad: adenovirus; vsv: vesicular stomatitis virus.
Rich countries have anticipated the acquisition of vaccines for their citizens through pre-purchases: 800 million doses for the United States, 5 doses per inhabitant for Great Britain, 400,000 million doses for the European community… Does this mean that we are moving towards a form of vaccine nationalism that is certainly understandable but problematic? [22, 23]. Indeed, effective control of the pandemic implies vaccinating at least 70–80% of all the inhabitants of the planet. In this case, efficiency and ethics combine to work towards this goal. How can we ensure that these vaccines become a public good? The WHO proposes to initially vaccinate 20% of the citizens of all countries, but we could go further and consider, for example, vaccinating first in the countries where the pandemic is strongest? [24]. At the initiative of the WHO, CEPI (coalition for epidemic preparedness innovation), GAVI (global vaccine alliance), Covax was created, of which France and the European community were partners from the outset. The aim of this structure is to raise the necessary funds to make access to vaccines available in all countries of the world, including 50% of low- and middle-income countries. The initial objective is to acquire 2 billion doses of vaccines. Will this initiative be sufficient to provide fair access to vaccines? It is too early to say, at this point in time the necessary funds have not been raised. However, complementary vaccine production initiatives, particularly in India, could help to ensure greater sharing. We would like to see a system of regulation and international governance capable of imposing such a policy as well as regulation of vaccine prices. A form of political reconstruction of the WHO would in this sense be necessary, taking advantage of the Covid-19 crisis [25, 26, 27].
7. Confidence in vaccination
A final key dimension of immunization success is confidence in immunization. It is known to what extent in France, but also in the United States, a reluctance to vaccinate has developed among a fraction of the population and health care personnel [28, 29]. Recent opinion surveys in the framework of Covid-19 have shown this again. It is therefore crucial that the implementation of a vaccination program includes a series of measures aimed at building the confidence of both health workers and citizens. This involves, on the one hand, practical facilitation of vaccination: simplified itinerary, vaccination by doctors, pharmacists and nurses, creation of mobile vaccination centers, full coverage of the cost by the National Health Insurance Fund, and on the other hand, targeted information campaigns with clear and transparent content [30]. Civil society through numerous associations involved in public health issues must be mobilized in the definition of this policy and as a media relay for explanation. Could be put forward if one or more vaccines prevent viral transmission the fact that vaccination is the object of an altruistic attitude: vaccination of some protects the most vulnerable. The human and social sciences must be mobilized to specify these modes of action and evaluate their impact [31]. Demonstrating efficacy will pose an ethical dilemma: the vaccine should be offered to the control group at the cost of preventing further evaluation, which would be unreasonable [32]. How can new therapeutic trials be considered in this situation?
Several strategies could be considered [33]. Finally, modeling tools should make it possible to evaluate the effect of the vaccine(s) on the pandemic according to their efficacy and acceptability [34, 35].
The introduction of vaccination against SARS-CoV-2 is a vital public health, societal and economic action. It cannot fail. Once it has been unequivocally demonstrated that one or more vaccines have a favorable risk/benefit balance, every effort should be made to progressively program the vaccination of populations on an international scale. Speed should not be confused with haste, and the ability to resist special interests, but it is a question of global mobilization to implement a common policy in the service of public health in order to achieve the progressive control of the pandemic. It will be essential to carry out longitudinal studies of vaccinated subjects (so-called phase 4 study) to assess the efficacy (and safety over time) according to groups (high risk, etc.). This evaluation will serve as a basis for forecasting the need for revaccination and the evolution of the pandemic [35].
French version
Le 9 novembre dernier, les sociétés Pfizer et BioNTech annoncent que leur vaccin anti SARS-CoV-2 constitué de l’ARN messager de la spicule du virus conférait une protection de 90% contre la survenue du Covid-19, à partir de résultats intermédiaires d’un essai clinique de phase III [1]. Cette annonce dont l’effet médiatique a un temps éclipsé l’élection présidentielle du nouveau président américain et l’état de la pandémie illustre le caractère exceptionnel de cette course au vaccin. Celle-ci a débuté il y a seulement 10 mois lorsque la séquence du virus fut publiée. Elle prend toute son importance, une fois correctement évaluée (voir ci-dessous) dans le contexte d’une pandémie non maîtrisée responsable à ce jour de plus de 1,3 million de décès dans le monde, pandémie provoquée par un virus contre lequel il n’existe pour l’instant pas de médicament réellement efficace malgré les recherches en cours. Le 16 novembre, la Société Moderna annonce à son tour que son vaccin à ARN a une efficacité à court terme de 94,5% confirmant ainsi avec une seconde préparation les premiers résultats apportés par les sociétés Pfizer et BioNtech. De plus, le vaccin Moderna paraît stable à +4 °C pendant 30 jours ce qui en facilitera la distribution et l’utilisation.
1. La course aux vaccins
On a observé une mobilisation exceptionnelle des mondes scientifique, industriel, politique, d’organisations gouvernementales, internationales et non gouvernementales pour essayer d’obtenir dans un délai record un ou plusieurs vaccins qui permettraient d’enrayer ou du moins de ralentir cette pandémie. Classiquement, le délai nécessaire à l’élaboration d’un vaccin est d’au moins 10 ans (Figure) [2, 3]. En raison des nombreuses étapes: du concept, aux essais pré-cliniques, des modèles animaux aux études toxicologiques, puis aux essais cliniques de phase I qui évaluent la tolérance et la dose à ceux de phase II et III qui évaluent efficacité et la sécurité d’emploi, aux étapes de production, d’autorisation et de distribution, on conçoit que les délais soient aussi longs. Dans le cadre du Covid-19, le pari fut d’aboutir à un vaccin en 12–18 mois. Comment cela est-il envisageable sans déroger aux règles strictes d’évaluation de ces produits ? Le développement de nouvelles technologies (voir ci-dessous) qui accélèrent considérablement la production de vaccins, associé aux chevauchements dans le temps des différentes étapes et une prise de risque par l’anticipation de la production des vaccins sont à l’origine de cette tentative de diminution des délais. Dans une certaine mesure, l’expérience de la mise au point de vaccins contre le virus Ebola a servi de modèle, tant sur un plan technique que logistique mais avec un changement d’échelle conséquent. Les phases cliniques ont été débutées très précocement et “emboitées”. L’éventuelle prise de risque industrielle a été très largement amortie par l’investissement massif de certains gouvernements pour financer le développement et la production de vaccins. C’est sans doute le cas de la Chine et surtout des États-Unis. Le gouvernement a mis en place l’opération “Warp Speed” qui a financé pour plus de 8 milliards le développement de 6 vaccins à ce jour avec comme objectif l’obtention de vaccins pour 300 millions de citoyens des États-Unis [4]. Par ailleurs, de nombreux états ainsi que la communauté européenne, ont passé des précommandes de vaccins afin de permettre à leurs concitoyens un accès rapide aux vaccins lorsque disponibles tout en apportant des garanties aux entreprises engagées dans cette course. Ainsi plus de 200 projets ont vu le jour. Leur stade de développement est très variable mais plus de 40 sont en essai clinique et 10 en essai de phase III, le premier ayant débuté fin juillet. Ce foisonnement de projets vaccinaux a bénéficié d’avancées technologiques et l’élaboration de nouvelles préparations vaccinales. Au total, des stratégies classiques aux stratégies nouvelles, on compte 7 formes de vaccins.
2. Les différents types de vaccins (Figure 1)
- Une approche classique consiste en l’utilisation de virus inactivés, à partir de virus produits en culture cellulaire, c’est une technologie bien connue, utilisée notamment pour le vaccin contre la grippe. Ils nécessitent l’emploi d’un adjuvant. Cette approche est particulièrement mise en œuvre par des industries chinoises avec des préparations en évaluation clinique de phase III [5].
- Une autre voie classique consiste en la préparation de vaccin vivant atténué en produisant des virus modifiés non pathogènes. C’est par exemple la technique retenue pour le vaccin dirigé contre le virus de la rougeole. La nécessité d’études d’optimisation préclinique — pour s’assurer notamment de la stabilité génomique du virus — allonge le temps de mise au point.
- Une technique innovante consiste en l’utilisation de l’ARN messager de la spicule du virus [6, 7, 8]. C’est l’information génétique codant pour les antigènes qui est apportée. Le choix de la spicule est lié au fait qu’il s’agit de la protéine virale qui se fixe au récepteur cellulaire (ACE-2) et permet l’entrée du virus. Les anticorps neutralisants détectés chez les patients infectés sont principalement dirigés contre la spicule. Cet ARN est placé dans des nanovésicules lipidiques qui permettent son incorporation cellulaire, sa traduction en protéines et in fine l’immunisation. C’est la technique utilisée par le laboratoire Pfizer associé à BioNTech ainsi que par la société Moderna. Cette technique permet une production complètement acellulaire et accélérée. Son caractère novateur impose par contre une attention particulière sur sa sécurité d’emploi. Enfin ces ARN sont fragiles et les vaccins doivent être conservés à −20 °C ou −70 °C en fonction des préparations. Toutefois Moderna vient d’annoncer une conservation possible à +4 °C pendant 30 jours. Une stratégie améliorée (nouvelle génération) consisterait en l’emploi d’un ARN auto réplicatif qui permettrait de réduire la quantité d’ARN à injecter; néanmoins de tels vaccins doivent être évalués avec précaution quand aux risques éventuels de non-contrôle de cette amplification in vivo [9].
- Le vaccin peut consister en de l’ADN codant pour la spicule, sous forme de plasmides. À nouveau la production massive est relativement aisée mais l’immunogénicité apparaît plus faible et les modalités d’injection plus complexes [10].
- Une autre solution consiste en l’emploi de vecteurs viraux au sein desquels l’information génétique — le gène de la spicule — a été ajoutée. Des vecteurs viraux incapables de réplication font l’objet d’importants efforts de recherche en vaccination. Il s’agit essentiellement d’adénovirus, soit infectant naturellement des primates soit l’homme mais faiblement prévalent pour éviter l’effet éventuel neutralisant d’une pré immunisation contre le vecteur. Plusieurs candidats vaccins de ce type sont en évaluation clinique (phase III) après l’obtention de résultats précliniques plutôt positifs [11, 12, 13].
- Une stratégie proche consiste en l’emploi de vecteurs réplicatifs fondés sur le virus de la stomatite vésiculaire [14] ou le virus atténué de la rougeole utilisé pour la vaccination contre ce virus, vecteurs au sein desquels est placé le gène de la spicule du SARS-CoV-2. Ces vaccins sont en début de test clinique.
- Enfin une stratégie attractive consiste en l’emploi de la protéine spicule recombinante produite en lignées cellulaires et associée à un adjuvant lipidique [15, 16]. Ce vaccin peut prendre la forme de pseudo particules virales, stratégie efficace dans le cadre de la vaccination contre le virus de l’hépatite B. Des modifications ont été apportées à la protéine S pour la stabiliser dans sa forme trimérique a priori la plus immunogène. Différentes préparations sont en cours d’évaluation clinique…. Le produit de Novavax induit un titre élevé d’anticorps neutralisants chez les sujets vaccinés lors des essais de phase I [2].
3. Questions en suspens
Il est bien difficile de prédire quel(s) sera(ont) in fine, la(es) stratégie(s) la(es) plus efficiente(s). On ne peut que se réjouir de la diversité d’approches qui augmente bien sûr d’autant les chances de succès. À ce stade, on sait que plusieurs de ces vaccins induisent chez l’homme la production d’anticorps neutralisants l’infection virale tels que mesurés in vitro, à des titres apparemment comparables à ceux des sérums de sujets convalescents du Covid-19 [2, 3, 17]. Ils induisent aussi une réponse T au moins CD4 de type Tfh (follicular helper) nécessaire à la production d’anticorps, et de type TH1 mais non TH2, ce qui pourrait contribuer à une meilleure protection dans le temps et éviter des effets délétères des réponses de type TH2 (anaphylaxie, inflammation) [18].
Il faut cependant remarquer que l’on ne peut pour l’instant établir de correspondance entre éventuelle efficacité clinique et titre d’anticorps neutralisants (ou fonction de la réponse T). On ne connaît pas non plus la cinétique de diminution des titres d’anticorps. Sera — t-elle similaire à celle des sujets infectés (plutôt lente chez les sujets malades, rapide chez les sujets infectés de façon asymptomatiques) ? [19].
Les stratégies développées pour l’instant reposent sur des injections intramusculaires des vaccins de ce fait peu susceptibles d’induire une immunité muqueuse dont pourtant on connaît l’importance dans l’immunité contre les virus respiratoires [20]. Certains types de préparation pourraient être utilisés en inhalation, cela fera sans doute l’objet d’études dans un second temps. Enfin la quasi-totalité des vaccins en préparation (en dehors des virus entiers) utilisent comme antigènes la spicule, la protéine du virus qui permet de se fixer sur son récepteur cellulaire ACE-2. Cette approche est logique car les anticorps neutralisants mis en évidence chez les patients infectés sont dirigés contre cette protéine et notamment (mais pas exclusivement) le domaine de fixation au récepteur. On ne peut écarter l’intérêt de l’utilisation d’antigènes complémentaires comme source d’une réponse immune protectrice. Cela pourra être examiné dans un second temps.
4. Critères de succès
Une utilisation large d’un vaccin anti SARS-2-CoV-2 impose qu’il réponde à une série de critères d’efficacité et de sécurité sur lesquels on ne peut envisager de déroger malgré les pressions éventuelles. L’Organisation mondiale de la santé, l’Académie des Sciences des États-Unis [21] et surtout les autorités réglementaires qui délivrent les autorisations d’utilisation: FDA (food and drug administration aux États-Unis), EMA en Europe ont émis des recommandations très précises. De nombreux points sont à considérer, outre bien sûr la qualité du produit vaccinal, en premier lieu les questions de sécurité: la réaction immédiate (“réactogénicité”) est-elle tolérable et quel est le risque d’événements indésirables graves ? Se pose la question d’une aggravation de la maladie par l’effet d’anticorps non neutralisants qui pourraient soit faciliter l’infection des macrophages, soit faciliter une réponse inflammatoire exacerbée. Les lymphocytes T de type TH2 pourraient aussi y contribuer. Ce risque n’est pas que théorique puisqu’il a été observé lors de seconde infection par le virus de la dengue (arbovirose) et lors de l’essai d’un vaccin contre la dengue [18] et expérimentalement avec des préparations vaccinales contre d’autres coronavirus. Un certain nombre d’éléments laisse néanmoins penser que ce risque est faible dans le cadre du SARS-CoV-2. Les données de vaccination chez l’animal sont aussi encourageantes. Reste à observer la sécurité lors des essais de phase III sur ce plan comme sur celui d’autres évènements. Une surveillance attentive devra être maintenue ensuite en particulier du fait du caractère très innovant de certains des vaccins. Il est essentiel de pouvoir rassurer le public sur la sécurité de ces vaccins — mise en perspective avec les bénéfices attendus.
L’efficacité est bien sûr centrale. Mais derrière ce terme se déclinent plusieurs notions: protection contre la forme bénigne de la maladie, les formes sévères (beaucoup plus rares), durée de la protection, efficacité de protection des personnes vulnérables notamment des personnes âgées. Enfin ces vaccins sont-ils capables de supprimer (ou au moins réduire la transmission du virus) en empêchant la réplication virale au niveau de l’oropharynx ? La réponse à ces questions et notamment la dernière prendra du temps. Les premières autorisations dites d’urgence dépendront du taux d’efficacité obtenue, d’une tendance à la réduction des infections sévères et d’un recul minimum d’observation (2 mois selon la FDA). La compaction du temps de développement de ces vaccins ne doit pas conduire à rogner les critères de jugement de sécurité et d’efficacité. Ce n’est qu’à ce prix que la confiance en cette vaccination pourra être établie. Remarquons que le taux d’efficacité annoncé des vaccins Pfizer et Moderna est observé dans la phase précoce post vaccination, lors du pic de la réponse immune : qu’en sera-t-il dans quelques mois ? De la capacité des vaccins à interrompre (réduire) la chance de transmission du virus dépendra la possibilité de casser la pandémie via l’immunité de groupe. Si le vaccin était parfaitement efficace [2] il faudrait que 70% de la population soit vaccinée ! Se pose également la nécessité éventuelle de revaccination régulière en fonction de la durée de l’immunité protectrice obtenue.
5. Qui vacciner ?
En fonction des performances des vaccins seront définies les priorités de vaccination. La Haute autorité de santé en France travaille en particulier sur cette question.
Les personnes professionnellement ou socialement exposées (santé, commerce, enseignement, police, prison, personnes en situation de précarité, …) apparaissent comme devant être prioritaires. S’il y a des indices d’efficacité chez les personnes âgées et vulnérables, celles-ci devront être vaccinées en première ligne. Ce n’est que dans un second temps que le(s) vaccin(s) pourra(ont) être proposé(s) au reste de la population.
6. Produire et distribuer les vaccins
Les besoins en vaccin seront très importants, idéalement 15 milliards de doses pour vacciner toute la planète en tenant compte du fait que 2 doses seront nécessaires pour la plupart des vaccins. Malgré le fait que les capacités de production augmentent, il est estimé qu’elles atteindront en 2021 quatre milliards de doses… Se pose donc la question de la distribution des vaccins tant dans ces aspects techniques que éthiques. Techniques, car certains vaccins nécessitent un stockage à −20 °C ou −80 °C ce qui n’est pas sans poser de sérieux problèmes de logistique. Comment sera organisé la distribution des vaccins, chaque pays doit s’y préparer.
Les pays riches ont anticipé l’acquisition de vaccins pour leurs citoyens par des préachats : 800 millions de doses pour les États-Unis, 5 doses par habitant pour la Grande Bretagne, 400, 000 millions de doses pour la communauté européenne … Est-ce à dire que l’on s’achemine vers une forme de nationalisme vaccinal certes compréhensible mais problématique ? [22, 23] En effet le contrôle effectif de la pandémie implique de vacciner au moins 70–80% de tous les habitants de la planète. En l’occurrence, efficacité et éthique se conjuguent pour œuvrer dans ce sens. Comment faire en sorte que ces vaccins deviennent un bien public ? L’OMS propose de vacciner initialement 20% des citoyens de tous les pays, mais on pourrait aller plus loin et considérer par exemple de vacciner en premier dans les pays où la pandémie est la plus forte ? [24] À l’initiative de l’OMS, du CEPI (coalition for epidemic preparedness innovation), du GAVI (global vaccine alliance), a été créé le Covax dont la France et la communauté européenne ont été d’emblée des partenaires. Cette structure a pour but de rassembler les fonds nécessaires pour rendre disponible l’accès aux vaccins dans tous les pays du monde en incluant 50% de pays à revenu faible ou moyen. L’objectif initial est d’acquérir 2 milliards de doses de vaccins. Cette initiative sera-t’elle suffisante pour permettre un accès juste aux vaccins ? Il est trop tôt pour le dire, pour l’instant les fonds nécessaires n’ont pas été recueillis. Cela dit des initiatives complémentaires de production de vaccins notamment en Inde sont susceptibles de contribuer à un meilleur partage. On souhaiterait un système de régulation et de gouvernance internationale capable d’imposer une telle politique ainsi qu’une régulation des prix des vaccins. Une forme de reconstruction politique de l’OMS serait en ce sens nécessaire en profitant de la crise du Covid-19 [25, 26, 27].
Principaux vaccins en évaluation
| Principe | Adjuvant | Compagnie | Stade de développement | Méthodologies déjà utilisées pour d’autres vaccins | |
|---|---|---|---|---|---|
| ∙ | Virus inactivé | Sel d’alu | Sinovac | Phase III | Oui/nombreux |
| Sel d’alu | Sinopharm | Phase III | |||
| ∙ | Virus vivant atténué | — | Codagenix Sérum Institute of India | Préclinique | Oui/nombreux |
| ∙ | ARNm spicule nano particules lipidiques | Pfizer–BioNTech | Phase III–résultats préliminaires | Non | |
| — | Moderna | Phase III–résultats préliminaires | |||
| Curevac | Phase III | ||||
| ARN auto réplicatif | Curevac | Préclinique | |||
| ∙ | ADN plasmidique | — | Inovio/Genexine | Phase I/II | Non |
| ∙ | Vecteur adénoviral non réplicatif | ||||
| Chimpanzé Ad | Astra Zeneca/Oxford | Phase III | Oui Ebola | ||
| Ad 26 | Johnson and Johnson/Janssen | Phase III | Non | ||
| Ad 5 | Cansino | Phase III | Non | ||
| Gorilla Ad | Reithera | Phase I | No | ||
| Ad 5+26 | Gamaleya | Phase III | |||
| ∙ | Spicule recombinante nano particules | Matrix-M | Novavax | Phase III (début) | oui |
| AS03 | Sanofi | Phase I | |||
| Virus-like particle | Medicago | Phase I | Oui; hépatite B | ||
| ∙ | Vecteur réplicatif | ||||
| VSV-spicule | MSD | Phase I | Non | ||
| Rougeole-spicule | — | MSD-Themis–Institut Pasteur | Phase I | ||
| Grippe-spicule | — | Beijing Wantai | Phase I | ||
Alu : Aluminium ; ad : adenovirus ; vsv : vesicular stomatitis virus.
7. Confiance en la vaccination
Une dernière dimension clé du succès de la vaccination concerne la confiance en la vaccination. On sait à quel point en France, mais aussi aux États-Unis s’est développée au sein d’une fraction de la population et du personnel soignant une réticence à la vaccination [28, 29]. Des enquêtes d’opinion récentes dans le cadre du Covid-19 l’ont encore montré. Il est donc crucial que la mise en œuvre d’un programme vaccinal comporte une série de mesures visant à établir la confiance tant du personnel de santé que des citoyens. Cela passe d’une part par une facilitation pratique de la vaccination: parcours simplifié, vaccination par médecins, pharmaciens et infirmiers, création de centres de vaccination mobiles, prise en charge intégrale du cout par la Caisse Nationale d’Assurance Maladie, d’autre part par des campagnes d’information ciblées, au contenu clair et transparent [30]. La société civile à travers de nombreuses associations impliquées dans les questions de santé publique doit être mobilisée dans la définition de cette politique et comme relai médiatique d’explication. Pourrait être mis en avant si un ou plusieurs vaccins empêchent la transmission virale le fait que la vaccination fasse l’objet d’une attitude altruiste: la vaccination des uns protège les plus vulnérables. Les sciences humaines et sociales doivent pouvoir être mobilisées pour préciser ces modalités d’action et en évaluer l’impact [31]. La démonstration de l’éventuelle efficacité ne sera pas sans poser un dilemme éthique : faut-il proposer le vaccin aux sujets du groupe contrôle, au prix d’empêcher toute évaluation ultérieure, ce qui ne serait pas raisonnable [32]. Comment envisager de nouveaux essais thérapeutiques dans cette situation ? Plusieurs stratégies pourront être envisagées [33]. Enfin les outils de la modélisation devraient permettre d’évaluer l’effet du(es) vaccin(s) sur la pandémie en fonction de leur efficacité et leur acceptabilité [34, 35].
La mise en place de la vaccination contre le SARS-CoV-2 est une action vitale tant en termes de santé publique que sociétale et économique. Elle ne saurait échouer. Lorsqu’il aura été démontré sans équivoque que un ou plusieurs vaccins comportent une balance bénéfice/risque favorable, tout doit pouvoir être mis en œuvre pour programmer de façon progressive la vaccination des populations et ce à l’échelle internationale. Il ne faut pas confondre vitesse et précipitation, savoir résister aux intérêts particuliers, mais il s’agit, par une mobilisation mondiale de mettre en œuvre une politique commune au service de la santé publique pour aboutir au contrôle progressif de la pandémie. Il sera essentiel d’effectuer des études longitudinales des sujets vaccinés (étude dite phase 4) pour apprécier l’efficacité (et la sécurité au cours du temps) et ce en fonction des groupes (risque élevé, …), cette évaluation servira de base des prévisions en termes de nécessité de revaccination et d’évolution de la pandémie [35].



 CC-BY 4.0
CC-BY 4.0