1. Introduction
Da Vinci’s famous drawing of the Vitruvian Man (1490) perfectly illustrates the proportions between the different parts of the body, but also the cosmogonic dimension of man at the center of all questions of the universe as it appeared at the end of the 15th century [1]. For biologists interested in the shape and the size of biological structures, it evokes a complex series of genetic controls, mechanical feedback controls and hormonal modulations that ensure the robustness and precision of these proportions. Indeed, the determination of the size of biological objects depends on so-called intrinsic mechanisms, autonomous to the organ, which at the same time determine its identity and shape, and on systemic or extrinsic mechanisms, orchestrated by hormones that transmit to the tissues information on their direct environment (from other tissues, metabolic state, stage of development) or on the outside world (temperature, nutrition etc.). In this review, I will discuss recent work on the Drosophila model that addresses some of these controls.
2. Drosophila as a model for the study of organ growth
Insects, and more specifically Drosophila, have been a very fertile field for studying organ formation and growth over the last fifty years. In insects with metamorphosis, known as “holometabolous”, the organs that make up the adult are born during the larval stages in the form of structures called “imaginal discs”. The identity, size and shape of these structures that will form the wings, eyes, antennae, thorax legs, abdomen and reproductive organs of the adult are based on the expression of a combination of genes coding for diffusible molecules called “morphogens”, whose function has been extensively studied in the Drosophila model [2, 3, 4, 5, 6]. The imaginal discs initially grow under the impulse of coupled cell growth and proliferation. This growth then ceases to form adult organs whose complex shape is the result of an elaborate morphogenesis that occurs during metamorphosis. Most of the molecular actors (morphogens, cell signaling pathways, hormones) involved in the establishment of these structures in the insect are conserved in vertebrates [7].
3. Autonomous growth
Several observations indicate that the size of adult structures in Drosophila is partly autonomously coded. The homeotic transformations that allow the identity of an organ to change during its development is accompanied by an equally modified growth: when a haltere is transformed into a wing, the resulting organ reaches the size of a wing and not that of a haltere that would have just taken the shape of a wing [8]. On the other hand, a wing disc transplanted into an adult abdomen continues to grow slowly and reaches a limit size comparable to that which it would have in its larval environment [9]. Finally, tissue ablation experiments show that discs have the capacity to regenerate missing parts during their development, demonstrating self-organizing properties [10].
Current work highlights the role of morphogens in the autonomous control of organ size. The molecule Decapentapledgic (Dpp), a member of the BMP family, plays a major role in tissue morphogenesis and has focused recent attention for its implication in growth control [11, 12, 13]. In the wing disc, Dpp is produced by a few rows of cells that define the boundary between the anterior and posterior regions. Dpp is secreted along the A/P axis and its activity forms a gradient that instructs the cells of their identity as a function of the level of signal they receive. Two initial observations indicate a role of Dpp in tissue growth: animals deficient for Dpp activity show a strong reduction in wing size. Conversely, localized overexpression of Dpp leads to ectopic wing formation [13]. These observations raise two fundamental questions concerning the role of morphogens in tissue growth: how can non-homogeneous activity lead to apparently homogeneous cell proliferation and growth? And what is the role of morphogens in stopping growth and determining final size? Several recent models make it possible to address these questions, although they do not reconcile all the experimental data accumulated over the last two decades. The “gradient scaling” model [14] proposes that the low point of the Dpp gradient adjusts to tissue size that increases with time, and that a cell in the gradient is maintained in active proliferation as long as it detects a difference in Dpp activity with its neighbors. As the disc expands, the gradient flattens and cell proliferation slow down until it stops [15]. This model thus explains both the homogeneous proliferation and its arrest. Observations made by other groups that the production of Dpp at the source increases with time has led to the “temporal dynamics” model, in which the proliferation of a cell is linked to the increase in the Dpp signal received per unit of time [16]. The decline of this increase over time leads to a progressive cessation of cell proliferation. These models have recently been called into question by the observation that the formation of the Dpp activity gradient, although necessary for the establishment of the disc pattern, is not required for its growth [17, 18].
How does organ growth stop? Disc transplantation experiments suggest that a molecular rule allows evaluating the size of the organ as a whole (neither the number nor the size of the cells seems to be counted). This rule varies according to the type of tissue and its function. Mammalian endocrine organs, for example, have a size that is fixed by hormonal or metabolic feedback controls [19, 20]. In the case of insect imaginal discs, physical constraints seem to play a role in slowing growth at the end of the larval period. Several observations indicate that at the tissue level, proliferation and cell growth increase pressure locally, inducing a mechanical feedback that slows growth in compressed areas and accelerates growth in stretched areas. These observations have led to two distinct models integrating the growth-promoting role of morphogens and mechanical feedbacks, which predict uniform growth and its cessation when a target size is reached [21, 22, 23, 24]. At the mechanistic level, the relay between the mechanical forces, via the acto-myosin network and the growth machinery, is provided by the Hippo module, conserved in Man and Drosophila [25, 26].
In summary, despite active research, the mechanisms of organ growth arrest are still largely misunderstood. These difficulties are partly due to technological limitations that restrict the observation of the action of morphogens in vivo. Overcoming these limitations will require the implementation of observation techniques through non-disruptive imaging of living organisms and fast-acting manipulations of genes via optogenetic technologies.
4. Systemic growth
Autonomous growth is in all circumstances modulated by extrinsic factors, the main one being nutrition. Organisms adapt their growth rate and final size to nutritional variations. This control is relatively well known at the cellular level since the discovery of the Target of Rapamycin (TOR) kinase pathway conserved from yeast to human [27]. The TORC1 kinase complex is a sensor for energy and nutrient whose activation leads to the synthesis of proteins, lipids and nucleic acids required for cell growth. The TORC1 complex is also molecularly linked to the insulin receptor pathway that coordinates the availability of nutrients throughout the body. But how is the integration between these two growth pathways achieved?
Studies in the Drosophila model have shown that specific endocrine organs such as the fat body (equivalent of liver and fat tissue in insects) act as sentinel organs that orchestrate the nutritional response [28]. Upon amino acid intake, the TOR kinase pathway is activated in fat cells. This leads to the production of insulinotropic molecules that reach the brain of the larvae (where the insulin/IGF-producing neurosecretory cells are located) and induce insulin secretion into the open circulation [29]. The release of insulin/IGF hormones in turns induces systemic growth of organs. In the absence of a nutritional signal from the fat, these hormones are not secreted and systemic growth is stopped. Thus, a functional separation appears between the TOR kinase pathway serving as a nutritional sensor in the fat, and the hormones produced in response to the fat signal, which act as a relay for systemic growth. Expectedly, muscles [30] and the intestine [31, 32, 33, 34] are also involved in the nutritional response. The signal molecules operating inter-organ communications have been the subject of intense research in Drosophila [35, 36, 37, 38, 39, 40], and many of them are molecules whose roles are conserved in vertebrates (Dilps/insulin/IGF, Impl2/IGF-BP, AKH/glucagon, Upd2/Leptin, Egr/TNF-α, Myo/GDF11, Daw/TGF-β, Hh/Shh, GBP/EGF) (Figure 1). Further research in this area requires the identification of the different sensor tissues and the mechanisms that operate for each of them. The use of genetic screens has already allowed the identification of a number of factor/receptor pairs. To go further, the use of in vivo molecular marking techniques in a emitting tissue, combined with the identification of the marked molecules by mass spectroscopy in the target tissues could be envisaged [41].
Communication between the fat and the brain orchestrates the nutritional response in Drosophila larvae. Several signals are emitted by the fat body in response to an amino acid (a.a.) or sugar/lipid signal. They lead to the production/secretion of Drosophila insulin-like peptides (DILPs) by the brain, which induce systemic larval growth. In pink: the Insulin-Producing neurons of the brain.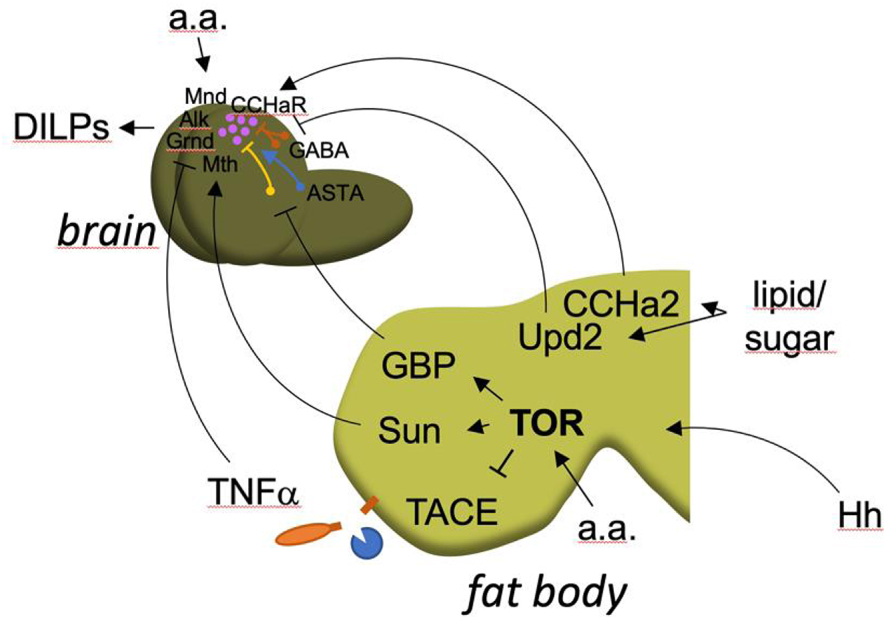
5. Growth coordination between body parts
In the 1980s, several laboratories observed that an alteration in the growth of imaginal discs leads to a delay in the larva-to-pupa transition in Drosophila [42]. In the particular case of the neoplastic growth of discs, i.e. tissues with unlimited growth, this developmental transition is even totally abolished and the larval stage is prolonged for more than 10 days, resulting in the formation of giant larvae [43]. This led Pat Simpson, then at the Molecular Genetics Center in Gif-sur-Yvette, to suggest that tissues whose growth is disturbed emit a signal that inhibits the developmental transition [42]. Thirty years after, using genetic screening approaches, our team confirmed this hypothesis and identified the signal that inhibits the developmental transition. It is a hormone of the insulin/relaxin family, called Drosophila insulin-like peptide 8 (Dilp8) [44, 45]. The dilp8 gene is strongly induced in imaginal discs whose growth is perturbed by inhibition of ribosomal function, or in neoplastic discs with uncontrolled growth. The work of several teams, including ours, has identified the circuit of action of the Dilp8 hormone. After its production by injured tissues, Dilp8 is secreted into the general circulation and reaches the brain of the larva, where it acts via its receptor Lgr3, expressed in a small number of neurons. The function of Lgr3 in these neurons interferes with the production of ecdysone, leading to a delay in the larval-pupal transition [46, 47, 48].
Remarkably, slowing growth in one tissue, for example the wing disc, induces a systemic effect throughout the body and other discs slow down as well [49]. This growth coordination also relies on the function of Dilp8, since blocking its expression in the damaged disc abolishes the non-autonomous growth inhibition and uncouples organ growth [50]. In line with this observation, addition of ecdysone to the food medium of the larvae is also sufficient to uncouple organ growth under these conditions [51]. This allows us to propose a coordination mechanism whereby the injured tissue produces Dilp8, the effect of which is to lower the circulating levels of ecdysone. Given the growth-promoting role of ecdysone (comparable to the anabolic effect of steroid hormones in vertebrates), this decrease leads to a general reduction of organ growth. Concomitantly, since ecdysone levels remain low, the larva-to-pupa transition is delayed, allowing tissues to catch up before moving to the next developmental stage.
In vertebrates, growth coordination between different parts of the body is also observed. When the number of chondrocytes is genetically reduced unilaterally in the mouse limb one week before birth, the limb on the manipulated side shows reduced growth. Remarkably, under these conditions, the size of the contralateral limb is also reduced [52]. In this case, the nature of the coordination is not known. It would of course be interesting to evaluate whether circulating relaxin-like molecules may be involved in these processes.
6. Adjusting organ size: the case of bilateral symetry
Organs reach their final size with remarkable precision. To realize this, just compare the size of two bilateral organs: our two arms and our two legs very rarely differ by more than 1% in size. Within the body, bilateral organs are subjected to similar developmental programs, and grow in an identical environment. They are therefore ideal objects for observing stochastic “errors” that may induce distortions in the developmental program. From an experimental point of view, these distortions are quantified by measuring the degree of fluctuating asymmetry (FA) of bilateral structures, a mark of developmental stability (or precision). Although the characterization of developmental stability has been achieved in many systems and environments, the molecular mechanisms responsible for maintaining developmental stability are unknown. The existence of specific mechanisms ensuring developmental precision has been proposed following the identification of mutations inducing strong developmental instability. In Drosophila, the chaperone Hsp90 corresponds to the definition of a robustness factor, the absence of which leads to the appearance of stochastic developmental defects [53]. Overexpression of the cyclin G gene in wing imaginal discs also leads to an increase in wing FA in the adult [54]. Cyclin G participates in the transcriptional regulation of a large number of genes via its interaction with the PRC1 and PR-DUB55 complexes, suggesting that the structure of gene networks is an intrinsic parameter in the control of the stability of developmental processes [55].
Mutations in the dilp8 gene, and that of its Lgr3 receptor, also induce an increase in fluctuating asymmetry in the wings [45, 46, 47, 56]. This led us to study the mechanisms controlling developmental stability by this hormone.
We first evaluated how wing disc fluctuating asymmetry evolves during larval and pupal development. FA is high during the larval period, revealing strong developmental instability. At the very beginning of metamorphosis, right after the larva-to-pupa transition, we observe a strong reduction of FA, which coincides with a peak of expression of dilp8. dilp8 mutant animals do not show the reduction in FA at this stage, involving this hormone in the developmental stabilization observed at the larva/pupal transition. Contrary to the response to localized growth impairment (see chapter on growth coordination), under physiological conditions, the dilp8 gene is highly expressed in the larval epidermis precisely at this transition, and its expression is controlled by ecdysone, which reaches maximum levels at the transition. Downstream of Dilp8 produced by the epidermis, a subpopulation of neurons expressing the Lgr3 hormone receptor modulates the production of ecdysone, constituting a feedback loop on ecdysone: ecdysone → Dilp8 ⊣ ecdysone, which is responsible for the adjustment of organ size at the beginning of metamorphosis [57] (Figure 2).
A hormonal Ecdysone/Dilp8/ Ecdysone feedback loop controls the adjustment of imaginal disc size after the larva-to-pupa transition in Drosophila.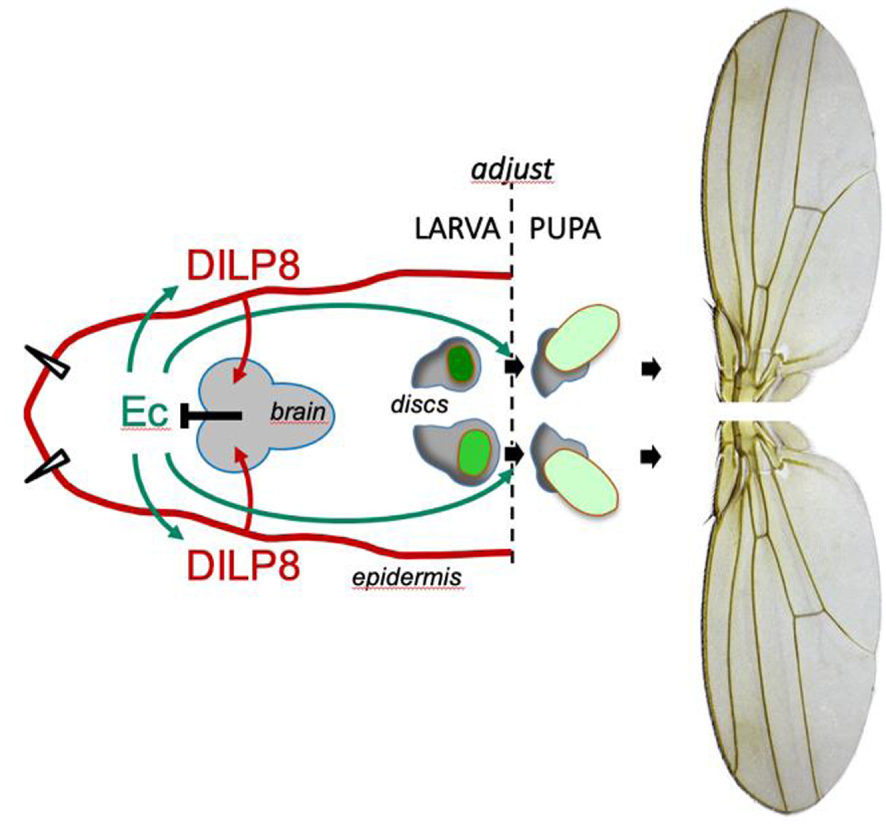
Several questions remain unanswered. Does the adjustment of wing size involve controlling the number or size of cells? Over what period of time is the adjustment made? Are there several successive phases of adjustment? How does ecdysone, a hormone with systemic function, ensure this adjustment of organ size locally? Ecdysone circulating at low levels during the larval period is a growth factor for the imaginal discs. But the progressive rise in ecdysone titers at the larval-pupal transition leads to a cessation of cell proliferation and growth. Size adjustment takes place when ecdysone levels decrease, a period when disc cells are arrested in their cell cycle. What about cell growth? A detailed description of all cellular and tissue parameters during the adjustment period will be necessary to better understand how developmental precision takes place during metamorphosis in Drosophila. Extension of these principles to other models is the next step. The conservation of specific functions of Dilp8 and its receptor Lgr3 in mammals has recently been proposed for tumor-induced anorexia [58]. However, the role of steroid hormones in developmental stability in mammals has not been explored.
French version
1. Introduction
Le célèbre dessin de l’homme de Vitruve par Da Vinci (1490) illustre à la perfection les proportions entre les différentes parties du corps, mais aussi la dimension cosmogonique de l’homme au centre de toutes les questions de l’univers tel qu’il apparaissait à la fin du XVe siècle [1]. Pour les biologistes qui s’intéressent à la genèse de la forme et la détermination de la taille des structures biologiques, il évoque une série complexe de contrôles génétiques, de rétrocontrôles mécaniques et de modulations hormonales assurant la robustesse et la précision de ces proportions. En effet, la détermination de la taille des objets biologiques dépend de mécanismes dits intrinsèques, autonomes à l’organe, qui déterminent en même temps son identité et sa forme, et de mécanismes systémiques ou extrinsèques, orchestrés par des hormones qui transmettent aux tissus des informations sur leur environnement direct (en provenance d’autres tissus, de l’état métabolique, du stade de développement) ou sur le monde extérieur (température, nutrition, etc.). Je discuterai dans cette revue les travaux récents sur le modèle drosophile qui ont permis d’aborder certains de ces contrôles.
2. La drosophile comme modèle d’étude de la croissance des organes
Les insectes, et plus spécifiquement la drosophile, ont constitué au cours des cinquante dernières années un terrain d’étude très fertile pour étudier la formation et la croissance des organes. Chez les insectes à métamorphose, dits « holométaboles », les organes qui constituent l’adulte prennent naissance durant les stades larvaires sous la forme de structures appelées « disques imaginaux ». L’identité la taille et la forme de ces structures qui formeront les ailes, yeux, antennes, pattes thorax, abdomen et organes reproducteurs de l’adulte reposent sur l’expression d’une combinaison de gènes codant pour des molécules diffusibles appelés « morphogènes », dont la fonction a été extensivement étudiée sur le modèle drosophile [2, 3, 4, 5, 6]. Les disques imaginaux grandissent dans un premier temps sous l’impulsion d’une croissance et d’une prolifération cellulaires couplées. Cette croissance cesse ensuite pour former les organes adultes dont la forme complexe est le fruit d’une morphogénèse élaborée qui survient durant la métamorphose. La plupart des acteurs moléculaires (morphogènes, voies de signalisation cellulaires, hormones) qui participent à la mise en place de ces structures chez l’insecte sont conservés chez les vertébrés [7].
3. La croissance autonome
Plusieurs observations indiquent que la taille des structures adultes chez la drosophile est codée en partie de manière autonome. Les transformations homéotiques qui permettent de changer l’identité d’un organe pendant son développement s’accompagne d’une croissance également modifiée : quand une haltère est transformée en aile, l’organe qui en résulte atteint la taille d’une aile et non celle d’une haltère qui aurait juste pris la forme d’une aile [8]. D’autre part, un disque d’aile transplanté dans un abdomen adulte continue de croitre lentement et atteint une taille limite comparable à celle qu’il aurait dans son environnement larvaire [9]. Enfin, des expériences d’ablation tissulaire montrent que les disques ont la capacité de régénérer les parties manquantes durant leur développement, démontrant des propriétés auto-organisatrices [10].
Les travaux actuels mettent en évidence le rôle clé des morphogènes dans le contrôle autonome de la taille des organes. La molécule Decapentapledgic (Dpp), un membre de la famille des BMPs, joue un rôle majeur dans la morphogénèse des tissus et a focalisé l’attention des recherches récentes sur la croissance [11, 12, 13]. Dans le disque d’aile, Dpp est produit par quelques rangées de cellules qui définissent la frontière entre les régions antérieure et postérieure du tissu. Dpp est sécrété le long de l’axe A/P et son activité forme un gradient qui instruit les cellules de leur identité en fonction du niveau de signal. Deux observations initiales indiquent un rôle de Dpp dans la croissance du tissu : les animaux avec un déficit d’activité Dpp montrent une forte réduction de la taille des ailes. Inversement, la surexpression localisée de Dpp conduit à la formation d’aile ectopique [13]. Ces observations posent elles-mêmes deux questions fondamentales concernant le rôle des morphogènes dans la croissance tissulaire : comment une activité non homogène peut-elle conduire à une prolifération cellulaire et une croissance en apparence homogènes ? Et quel est le rôle des morphogènes dans l’arrêt de la croissance et la détermination de la taille finale ? Plusieurs modèles récents permettent d’aborder ces questions, sans pour autant s’accorder avec toutes les données expérimentales accumulées au cours des deux dernières décennies. Le modèle de « gradient scaling » [14] propose que le point bas du gradient d’activité Dpp s’ajuste à la taille du tissu qui augmente avec le temps, et qu’une cellule dans le gradient est maintenue en prolifération active tant qu’elle détecte une différence d’activité Dpp avec ses voisines. Lors de l’expansion du disque, le gradient s’aplatit et la prolifération cellulaire ralentit, jusqu’à s’arrêter [15]. Ce modèle explique donc à la fois la prolifération homogène et son arrêt. L’observation faite par d’autres groupes que la production de Dpp à la source augmente avec le temps a conduit au modèle de « dynamique temporelle » dans lequel la prolifération d’une cellule est liée à l’augmentation du signal Dpp reçu par unité de temps [16]. Le déclin de cette augmentation dans le temps conduit à un arrêt progressif de la prolifération cellulaire. Ces modèles sont depuis peu remis en cause par l’observation que la formation du gradient d’activité Dpp, bien que nécessaire pour la mise en place du patron du disque, n’est pas requise pour sa croissance [17, 18].
Comment s’arrête la croissance des organes? Les expériences de transplantation de disques déjà citées suggèrent qu’une règle moléculaire permet l’évaluation de la taille de l’organe dans sa globalité (ni le nombre ni la taille des cellules ne semblent déterminants). Cette règle varie suivant le type de tissu et sa fonction. Les organes endocrines mammifères par exemple, ont une taille fixée par des rétrocontrôles hormonaux ou métaboliques [19, 20]. Dans le cas des disques imaginaux d’insectes, les contraintes physiques semblent jouer un rôle dans le ralentissement de la croissance en fin de période larvaire. Plusieurs observations indiquent qu’au niveau tissulaire, prolifération et croissance cellulaire augmentent la pression localement, induisant un rétrocontrôle mécanique qui ralentit la croissance des zones compressées, et accélère celle des zones étirées. Ces observations sont à l’origine de deux modèles distincts intégrant le rôle promoteur de croissance des morphogènes et le rétrocontrôle mécanique, qui prédisent une croissance uniforme puis son arrêt lorsqu’une taille cible est atteinte [21, 22, 23, 24]. Sur le plan mécanistique, le relais entre les forces mécaniques via le réseau d’acto-myosine et la machinerie de croissance est assuré par le module Hippo, conservé de l’homme à la drosophile [25, 26].
En résumé, en dépit d’une recherche active, les mécanismes d’arrêt de la croissance des organes sont encore largement incompris. Ces difficultés sont en partie dues à des limitations technologiques qui restreignent l’observation de l’action des morphogènes in vivo et qui nécessiteront la mise en place de techniques d’observation par de l’imagerie du vivant non perturbatrice et de manipulation des gènes à effet rapide via des technologies optogénétiques.
4. La croissance systémique
La croissance autonome est en toute circonstance modulée par des facteurs extrinsèques dont le principal est la nutrition. Les organismes adaptent leur rythme de croissance et leur taille finale aux variations nutritionnelles. Ce contrôle est relativement bien connu au niveau cellulaire depuis la découverte de la voie de la kinase Target of Rapamycin (TOR) conservée de la levure à l’homme [27]. Le complexe kinase TORC1 est un senseur de l’énergie et des nutriments dont l’activation conduit à la synthèse des protéines, lipides et acides nucléiques nécessaires à la croissance cellulaire. Le complexe TORC1 est également lié moléculairement à la voie du récepteur à l’insuline qui coordonne la disponibilité des nutriments à l’échelle de l’organisme. Mais comment se fait l’intégration entre ces deux voies de contrôle de la croissance ?
Les études menées sur le modèle drosophile ont démontré que certains organes endocrines tels que le corps gras (l’équivalent du foie et du tissus adipeux chez les insectes) jouent le rôle d’organes sentinelles qui orchestrent la réponse nutritionnelle [28]. En réponse à l’apport nutritionnel, la voie de la kinase TOR est activée dans les cellules du corps gras. Ceci conduit à la production de molécules insulinotropiques qui atteignent le cerveau de la larve où se situent les cellules neurosécrétrices productrices d’insuline/IGF, et induisent leur sécrétion dans le milieu intérieur [29]. Le relargage dans la circulation d’hormones de type insuline/IGF induit alors une croissance systémique de tous les organes. En l’absence de signal nutritionnel en provenance du corps gras, ces hormones ne sont pas sécrétées et la croissance systémique est réduite. Une séparation fonctionnelle apparaît donc entre la voie de la kinase TOR qui sert de senseur nutritionnel dans le corps gras, et les hormones produites en réponse au signal du corps gras, qui font le relais pour la croissance systémique. De manière attendue, les muscles [30] et l’intestin [31, 32, 33, 34] sont aussi impliqués dans la réponse nutritionnelle. Les signaux impliqués dans ces communications inter-organe ont fait l’objet d’une intense recherche chez la drosophile [35, 36, 37, 38, 39, 40], et nombre d’entre eux sont des molécules dont les rôles sont conservés chez les vertébrés (Dilps/insuline/IGF, Impl2/IGF-BP, AKH/glucagon, Upd2/Leptine, Egr/TNF-α, Myo/GDF11, Daw/TGF-β, Hh/Shh, GBP/EGF) (Figure 1). La poursuite de la recherche dans ce domaine nécessite d’identifier les différents tissus senseurs et les mécanismes qui opèrent pour chacun d’eux. L’utilisation de cribles génétiques a déjà permis l’identification d’un certain nombre de couples facteurs/récepteurs. Pour aller plus loin, l’utilisation de techniques de marquage moléculaire in vivo dans un tissu « émetteur », alliée à l’identification des molécules marquées par spectroscopie de masse dans les tissus cibles pourrait être envisagé [41].
La communication entre le corps gras et le cerveau orchestre la réponse nutritionnelle chez la larve de drosophile. Plusieurs signaux sont émis par le corps gras (fat body) en réponse à un signal acide aminé (a.a.), ou sucre/lipide. Ils conduisent à la production/sécrétion des Drosophila insulin-like peptides (DILPs) par le cerveau, qui induisent la croissance larvaire systémique.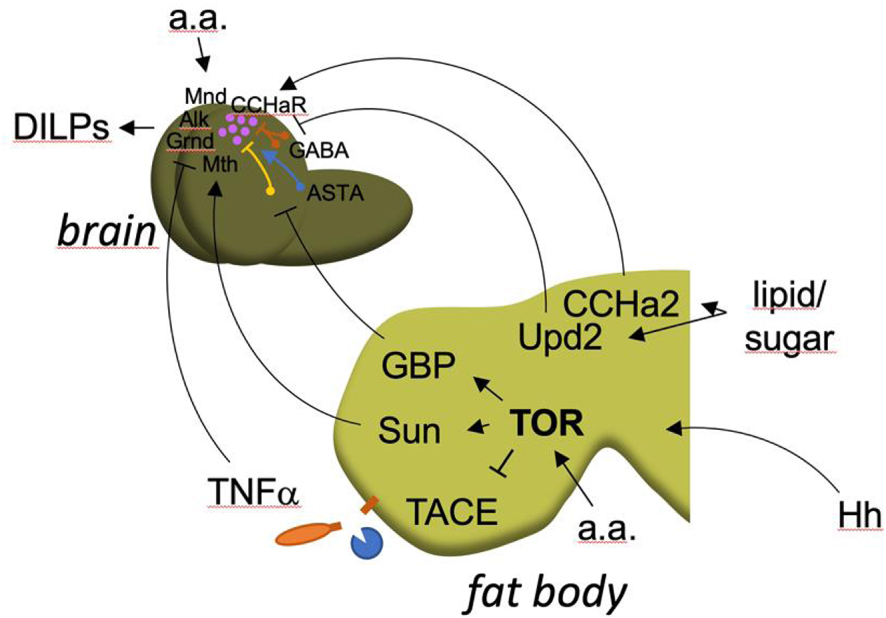
5. La coordination de croissance entre les parties du corps
Dans les années 80 du siècle dernier, plusieurs laboratoires ont fait l’observation qu’une altération de la croissance des disques imaginaux entraine un retard de la transition larve-pupe chez la drosophile [42]. Dans le cas particulier de la croissance néoplasique des disques, soit une croissance illimitée, cette transition développementale est même totalement abolie et le stade larvaire prolongé pendant plus de 10 jours, aboutissant à la formation de larves géantes [43]. Cela conduisit Pat Simpson, alors au Centre de Génétique Moléculaire de Gif-sur-Yvette, à suggérer que les tissus dont la croissance est perturbée, émettent un signal inhibiteur de la transition développementale [42]. Trente ans après ces premières observations, en utilisant des approches de crible génétique, notre équipe a confirmé cette hypothèse et identifié le signal inhibiteur de la transition développementale. Il s’agit d’une hormone de la famille des insuline/relaxine, appelée Drosophila insulin-like peptide 8 (Dilp8) [44, 45]. Le gène dilp8 est fortement induit dans les disques imaginaux dont la croissance est ralentie par inhibition de la fonction ribosomale, ou dans les disques néoplasiques à la croissance incontrôlée. Les travaux de plusieurs équipes dont la nôtre ont identifié le circuit d’action de l’hormone Dilp8. Après sa production par les tissus lésés, Dilp8 est sécrété dans la circulation générale et atteint le cerveau de la larve, où elle agit via son récepteur Lgr3 dans un petit nombre de neurones. La fonction de ces neurones interfère avec la production d’ecdysone, ce qui conduit à un retard de la transition larve-pupe [46, 47, 48].
De manière remarquable, le ralentissement de la croissance d’un type de tissu, par exemple le disque d’aile, induit un effet systémique dans tout l’organisme et les autres disques voient leur croissance également ralentie [49]. Cet effet de coordination de la croissance entre les différents organes repose également sur la fonction de Dilp8, puisque la suppression de l’expression de cette hormone par le disque lésé abolit l’inhibition de croissance non-autonome et découple la croissance des organes [50]. En lien avec cette observation, l’ajout d’ecdysone dans le milieu nutritif des larves suffit également à découpler la croissance dans ces conditions [51]. Ceci nous permet de proposer un mécanisme de coordination où le tissu lésé produit Dilp8 dont l’effet est d’abaisser les taux circulants d’ecdysone. Compte tenu du rôle promoteur de croissance de l’ecdysone (comparable à l’effet anabolique des hormones stéroïdiennes), cette baisse a pour conséquence de ralentir la croissance de manière systémique. Dans le même temps, les niveaux d’ecdysone restant bas, la transition larve/pupe est retardée, ce qui permet aux disques d’atteindre une taille suffisante avant de passer au stade développemental suivant.
Chez les vertébrés, une coordination de croissance entre les différentes parties du corps est également observée. Lorsque la croissance des chondrocytes est ralentie génétiquement de manière unilatérale chez le souriceau une semaine avant la naissance, les membres du côté lésé présentent une croissance réduite. De façon remarquable, dans ces conditions, la taille des membres contralatéraux est également réduite [52]. Dans ce cas, la nature de la coordination n’est pas connue. Il serait bien sûr intéressant d’évaluer si des molécules circulantes de type relaxine peuvent être impliquées dans ces processus.
6. L’ajustement de la taille : le cas des organes bilatéraux
Les organes atteignent leur taille finale avec une précision remarquable. Pour s’en rendre compte, il suffit de comparer la taille de deux organes bilatéraux : nos deux bras et nos deux jambes diffèrent très rarement de plus de 1% en taille. Au sein de l’organisme, les organes bilatéraux sont soumis à des programmes développementaux semblables et se développent dans des environnements identiques. Ils sont donc des objets idéaux pour observer les « erreurs » stochastiques susceptibles d’induire des distorsions dans le programme développemental. D’un point de vue expérimental, ces distorsions sont quantifiées en mesurant le degré d’asymétrie fluctuante (AF) des structures bilatérales, une marque de la stabilité (ou précision) développementale. Bien que la caractérisation de la stabilité développementale ait été faite dans de nombreux systèmes et de nombreux environnements, les mécanismes moléculaires responsables du maintien de la stabilité développementale sont inconnus. L’existence de mécanismes spécifiques assurant la précision développementale a été proposée à la suite de l’identification de mutations induisant une forte instabilité développementale. Chez la drosophile, la chaperone Hsp90 correspond ainsi à la définition d’un facteur de robustesse dont l’absence conduit à l’apparition de défauts développementaux stochastiques [53]. La surexpression de la cycline G dans le disque imaginal d’aile conduit également à une augmentation de l’AF dans l’aile adulte [54]. Cycline G participe à la régulation transcriptionnelle d’un grand nombre de gènes via son interaction avec les complexes PRC1 et PR-DUB [59], suggérant que l’organisation des réseaux de gènes est un paramètre intrinsèque du contrôle de la stabilité des processus développementaux [55].
Des mutations dans le gène dilp8 et celui de son récepteur Lgr3 induisent également une augmentation de l’asymétrie fluctuante dans les ailes [45, 46, 47, 56]. Ceci nous a poussés à étudier les mécanismes de contrôle de la stabilité développementale par cette nouvelle hormone.
Nous avons dans un premier temps évalué comment évolue l’asymétrie fluctuante des disques d’aile au cours de leur développement. Cette asymétrie est importante au cours de la période larvaire, révélant une forte instabilité développementale. Passé la transition larve-pupe, en tout début de métamorphose, nous observons une forte réduction de l’AF, qui coïncide avec un pic d’expression de Dilp8. Les animaux mutants pour dilp8 ne présentent pas de réduction de l’AF, impliquant cette hormone dans la stabilisation développementale observée à la transition larve/pupe. Contrairement au cas de la réponse à une altération de la croissance localisée (voir chapitre sur la coordination de la croissance), en conditions physiologiques, le gène dilp8 est fortement exprimé dans l’épiderme larvaire précisément lors de cette transition et son expression est contrôlée par l’ecdysone qui atteint une valeur maximum à la transition. En aval de Dilp8 produit par l’épiderme, une sous-population de neurones exprimant le récepteur de l’hormone Lgr3 module la production d’ecdysone, constituant une boucle de rétrocontrôle ecdysone → Dilp8 ⊣ ecdysone responsable de l’ajustement de la taille des organes en début de métamorphose [57] (Figure 2).
La boucle de rétrorégulation hormonale Ecdysone/Dilp8/Ecdysone contrôle l’ajustement de la taille des disques imaginaux après la transition larve/pupe chez la drosophile.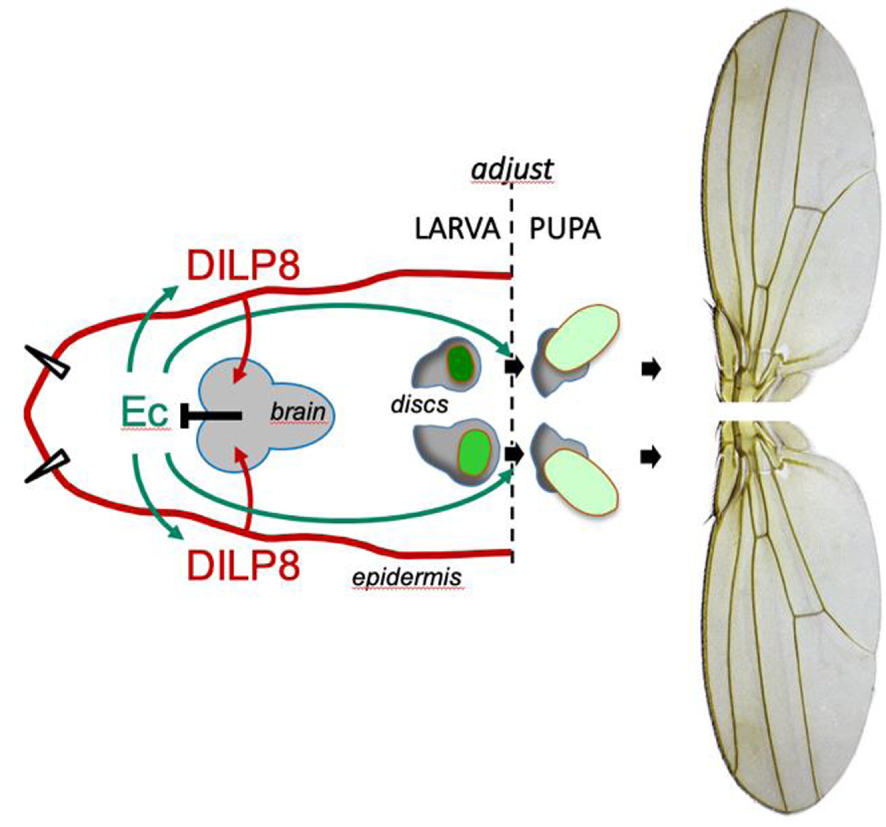
Plusieurs questions restent sans réponse. L’ajustement de la taille des ailes passe-t-il par un contrôle du nombre ou de la taille des cellules ? Sur quelle période de temps se fait l’ajustement ? Existe-t-il plusieurs phases successives d’ajustement? Comment l’ecdysone, une hormone à fonction systémique, assure-t-elle cet ajustement de la taille des organes localement? L’ecdysone qui circule à bas niveau au cours de la période larvaire est un facteur de croissance pour les disques imaginaux. Mais la montée progressive des titres d’ecdysone à la transition larve-pupe conduit à un arrêt de la prolifération cellulaire et de la croissance. L’ajustement de la taille a lieu lors de la baisse des taux d’ecdysone, une période où les cellules du disque sont arrêtées dans le cycle cellulaire. Mais qu’en est-il de la croissance ? Une description détaillée de tous les paramètres cellulaires et tissulaires au cours de la période d’ajustement sera nécessaire pour mieux comprendre comment la précision développementale se met en place au cours de la métamorphose chez la drosophile. L’extension à d’autres modèles constitue l’étape suivante. La conservation de fonctions spécifique de Dilp8 et de son récepteur Lgr3 chez les mammifères a récemment été proposée dans le cas de l’anorexie induite par les tumeurs [58]. En revanche, le rôle des hormones stéroïdes dans la stabilité développementale chez les mammifères n’a pas été exploré.




 CC-BY 4.0
CC-BY 4.0