1. Introduction
Molecular motors can alter microtubule growth and shrinkage [3]. They travel along the shaft and modulate microtubule dynamics as they reach microtubule ends, but have not been shown to have any impact on the microtubule shaft. Whether the mechanical work produced by moving motors impact the stability and dynamics of microtubule shaft has not yet been studied, notably because of technical limitations. Indeed, in most in vitro studies of the mechanical forces produced by molecular motors, microtubules were stabilised in order to block microtubule depolymerisation [4]. These conditions do not reflect the physiological conditions in which GTP-tubulin is rapidly hydrolysed to GDP-tubulin following tubulin dimer incorporation at the growing microtubule end. Because the GDP-tubulin lattice is less stable than that with GTP-tubulin, lattice dismantling may be more frequent than suggested by early experiments. Here we set out to study the impact of mechanical forces produced by kinesin and dynein motors on microtubules under conditions where the lattice would be made up of GDP-tubulin.
2. Results
2.1. Molecular motors can destroy non-stabilized microtubules
We first performed a “gliding assay”, where kinesin-1 motors are attached to the glass surface and the forces produced by motors result in microtubule translocation. We started with the classical conditions in which microtubules are stabilized with Taxol (Figure 1A). The total amount of microtubules did not change during the time-course of the assay. Next, to study the response of GDP-lattice microtubules, we capped microtubules on both ends with a short microtubule section consisting of GMPCPP-tubulin, which protects microtubules from depolymerising from their ends (Figure 1B). These capped-GDP microtubules started depolymerizing within minutes of initiating the gliding assay (Figure 1B, C) and were no longer detectable fifteen minutes later (Figure 1C).
Molecular motors destroy non-stabilized microtubules. (A) Schematic representation and images of the gliding assay of Taxol-treated microtubules. Scale bar: 50 μm. (B) Schematic representation and images of the gliding assay of capped-GDP microtubules. Scale bar: 50 μm. (C) Quantification of microtubule length variations in the experiments shown in A and B. The microtubule lengths were measured for all microtubules in the 600-μm-wide fields every minute during 15 min. Values were normalized with respect to the initial length (number of independent experiments N = 2, Taxol-treated microtubules n = 55; GMPCPP-microtubules n = 42; capped-GDP microtubules n = 42). Error bars represent standard deviation. (D) Schematic representation of the motility assay. The microtubule seed (magenta) is attached to the micropattern (blue), while the shaft (green) and the cap (magenta) are free. Motors (yellow) walk along the microtubules. (E) Sequence showing capped-GDP microtubule under RICM in the absence (left) or presence (right) of 1 nM Klp2. Images were taken every 2 min. Scale bar = 5 μm. (F) Survival curve of microtubules in the absence (black circle) or presence of 1 nM Klp2 (red triangles). Number of independent experiments: no Klp2, N = 9, n = 371; 1 nM Klp2, N = 5, n = 317. Error bars represent standard deviation. Adapted from [2].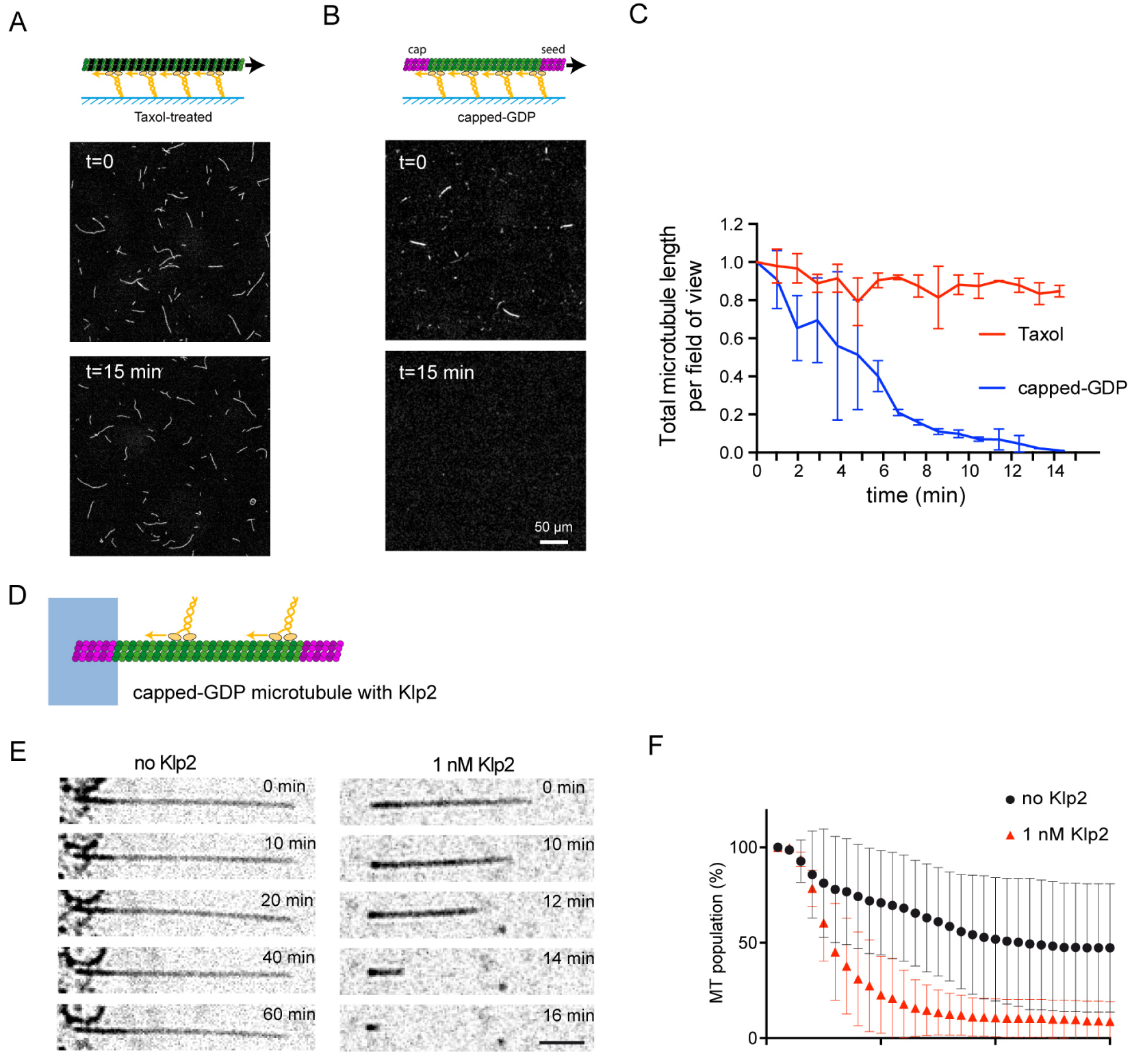
Incorporation of free tubulin into microtubules grown in Xenopus egg extract. (A) Schematic representation of the experimental setup to test the role of the microtubule growth medium on tubulin turnover in the microtubule lattice. Microtubules were grown in cell free Xenopus egg extract supplemented by 1 μM red-fluorescent free tubulin (step I) before washing and capping with GMPCPP (14 μM green tubulin, step II). Microtubules were then exposed to 14 μM green-fluorescent free tubulin for 15 min (step III) before a final washout and subsequent observation (step IV). (B) The images and line scans show an example of a microtubule grown in cell free Xenopus egg extract. Scale bar: 3 μm. Yellow stars point at incorporation sites. The graph shows the distribution of distances between incorporation sites after concatenating all microtubules in a random order. The red bars represents the geometric mean ∗/sd factor. (C) Schematic representation of the experimental setup to test the turnover of the microtubule lattice in fully reconstituted assay in the presence of purified tubulin. The images and line scans show an example of a microtubule grown in the presence of 26 μM of tubulin (red) and maintained capped in the presence of 14 μM of free tubulin (green). Yellow stars point at incorporation sites. Adapted from [1].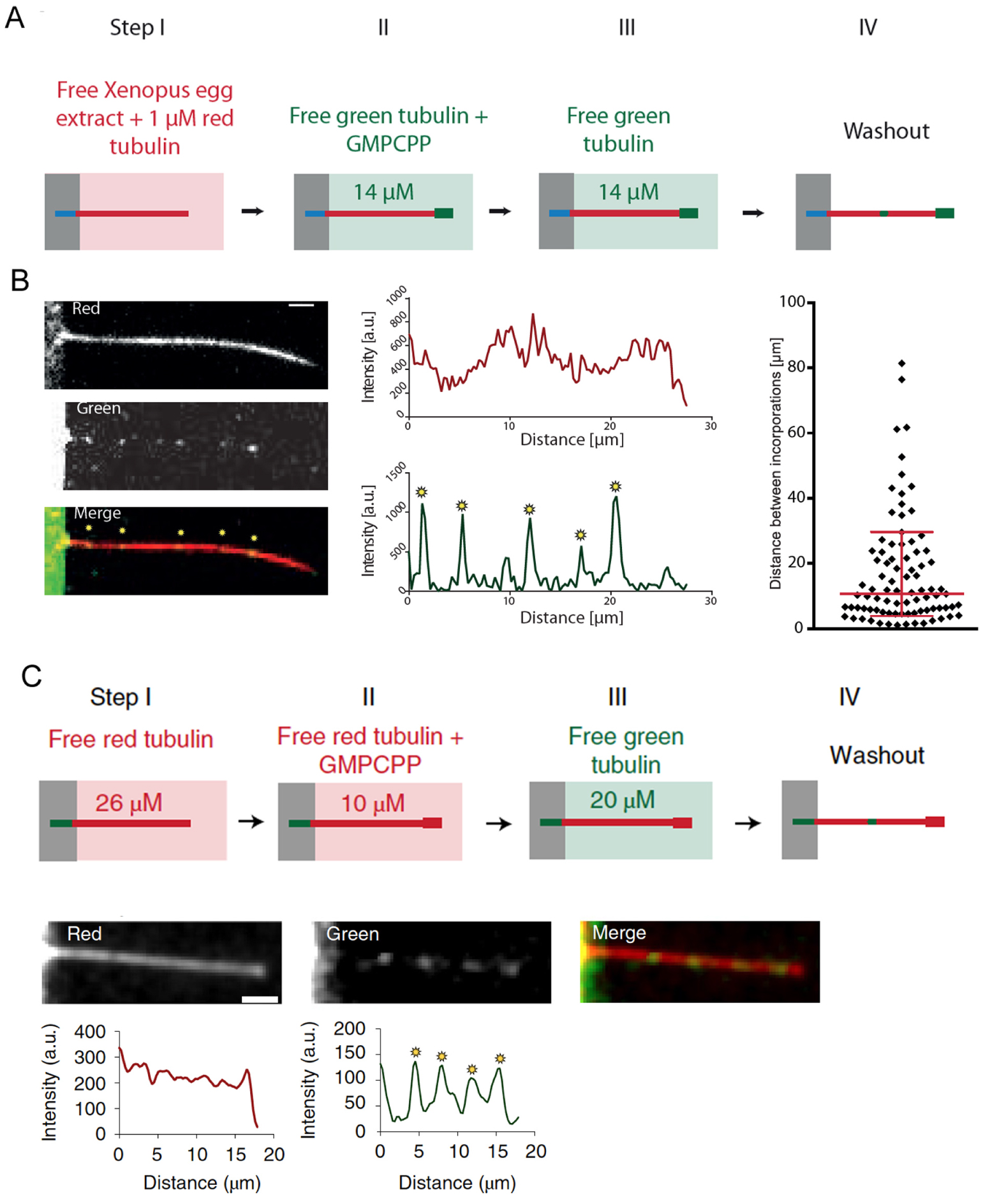
Free tubulin dimers prevent microtubule destruction by kinesin and dynein. (A) Schematic representation of the gliding assay of capped-GDP microtubules on kinesin-1 in the absence (left) or presence (right) of free non-labelled tubulin dimers. (B) Images of gliding microtubules when motors are activated by the addition of ATP (t = 0, top row) and 15 min later (t = 15 min, bottom row) in the two conditions described in A. Scale bar: 50 μm. (C) Quantification of microtubule length variations in the experiments shown in B. The microtubule lengths were measured for all microtubules in the 600-μm-wide fields every minute during 15 min. Values were normalized with respect to the initial length. Number of independent experiments N = 2, without free tubulin n = 42, with free tubulin n = 74. Error bars represent standard deviation. (D) Schematic representation of the motility assay in the absence (left) and presence (right) of free non-labelled tubulin dimers. (E) Image sequences show microtubules after the addition of Klp2 motors in the absence (left) or presence (right) of 14 μM of free tubulin dimers. Scale bar: 10 μm. (F) Survival curve of microtubules in the presence of molecular motors and absence of free tubulin (green) or in the presence of molecular motors and 14 μM of free tubulin dimers (blue). N = 1; no motor, n = 108; 10 nM Klp2 with free tubulin, n = 70. Adapted from [2].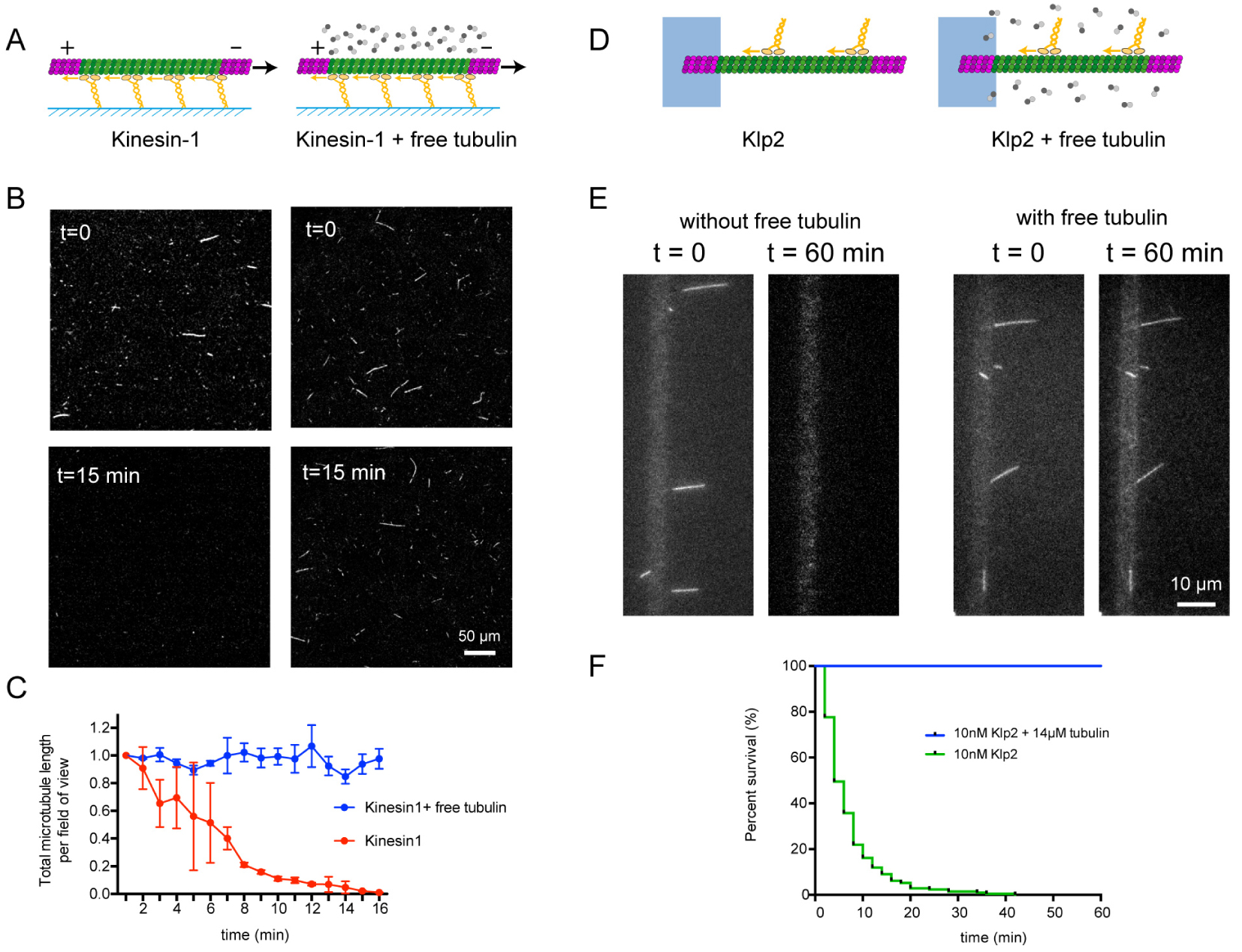
Molecular motors enhance tubulin exchange in the microtubule lattice. (A) Schematic representation of the three sequences during gliding assays of capped-GDP microtubules in the presence of 14 μM of free fluorescent tubulin. All experiments lasted 30 min. Only the duration of the gliding step was varied. Step 1 corresponds to the loading of capped-GDP microtubules and free green tubulin dimers on the layer of motors. Step 2 corresponds to the initiation of gliding by the addition of ATP. In the 0-min condition, i.e. without gliding, step 2 was skipped and ATP was not added. In the 15-min condition, step 2 was initiated 15 min after step 1. In the 30-min condition, step 2 immediately followed step 1. In all cases, fluorescent tubulin were removed after 30 min to measure the incorporation of free tubulin. (B) Images show the microtubule shaft (low intensity) with associated cap and seed (high intensity) (top row), the incorporation of free tubulin (middle row), and the overlay of the two signals (bottom row) at the end of the gliding assay (step 3). In these examples, microtubules glided on kinesin-1 for 30 min. Scale bar: 10 μm. (C) Schematic representation of the three sequences during motility assays on capped-GDP microtubules in the presence of 14 μM of fluorescent tubulin. Step 1 is the growth and capping of microtubules. Step 2 corresponds to the addition of motors and fluorescent tubulin. Step 3 corresponds to the removal of motors and replacement of fluorescent tubulin by non-labelled tubulin 40 min later. (D) Images show the microtubule shaft (top row), the incorporation of free dimers (middle row), and the overlay of the two signals (bottom row) at the end of the motility assay. Scale bar: 10 μm. Adapted from [2].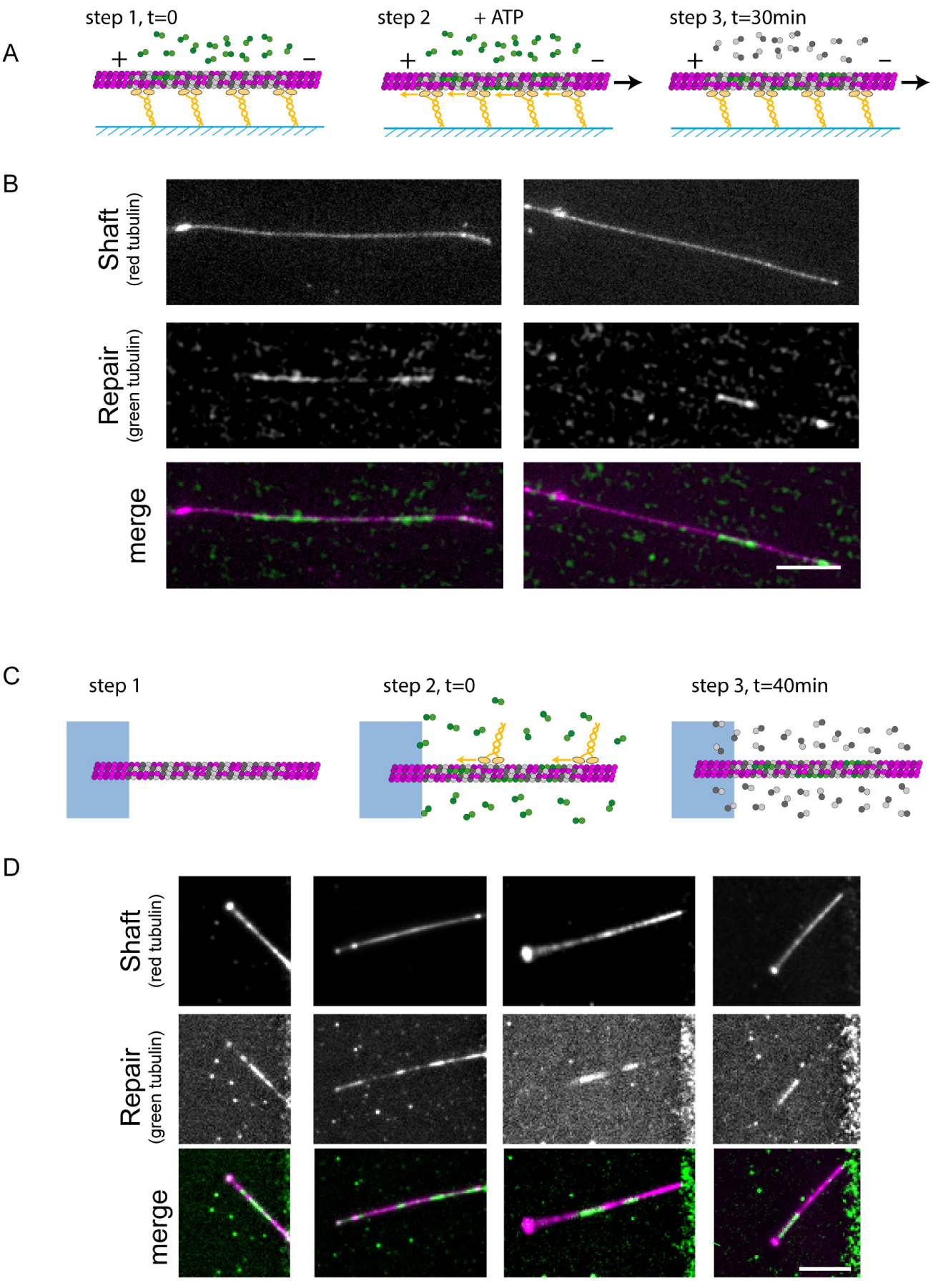
We then performed an alternative assay, “motility assay”, where microtubules are attached to the coverslip surface and motors walk on them [5]. To limit surface interactions, we used micropatterning to attach microtubule ends only to the surface, leaving the rest of the microtubule unattached to the non-adhesive surface coating [6] (Figure 1D). In the absence of motor about 70% of microtubules disappeared during the hour that lasted the experiment, and their lifetime was about 20 min. In the presence of 1 nM Klp2 (Figure 1E), 90% of microtubule disappeared and their lifetime was reduced to 8 min (Figure 1F), showing that kinesin motors break microtubules as they move along them.
2.2. Microtubules can spontaneously self-renew their components
In both motility and gliding assays, most breaking events were preceded by a local reduction of microtubule fluorescence, which we hypothesized was due to the loss of tubulin dimers. Noteworthy, in the conditions in which we performed these experiments, and which were used in other in vitro studies to study molecular motors, there was no free tubulin in the medium. However, our team previously found that free dimers could incorporate into the lattice microtubules in response to mechanical bending forces [7]. In addition, we recently found that this lattice turnover could occur spontaneously, i.e. in the absence of external forces [1]. This self-renewal is likely to happen in vivo as well since incorporation of free tubulin could be observed in a microtubule lattice that had been pre-assembled in a Xenopus egg extract (Figure 2A, B). It can also be observed in a reconstituted assay in which microtubules were assembled with purified tubulin, i.e. in the absence of the microtubule-associated proteins that accompany microtubule growth and renewal in vivo (Figure 2C). These observations raised the possibility that free tubulin dimers in solution could compensate for the loss of tubulin induced by walking motors by incorporating into the damaged region and protect the microtubule from breakage [7, 8].
2.3. Free tubulin protects microtubules from motor-induced destruction
To test the hypothesis that intrinsic microtubule self-renewing properties could protect them from motor-induced destruction, gliding assays were performed in the presence of free tubulin dimers (Figure 3A). Strikingly, capped-microtubules glided on kinesin-1 in the presence of tubulin dimers without any visible destruction (Figure 3B, C). Similarly, the addition of free dimers in motility assays (Figure 3D) fully protected microtubules from motor-induced breakage (Figure 3E, F).
2.4. Molecular motors catalyse the self-repair of microtubule lattice
To directly visualize microtubule repair in response to motor-induced destruction, we performed a two-color assay in which polymerized tubulin and free tubulin dimers were labelled with distinct fluorophores. Free fluorescent dimers were then washed away and replaced by non-labelled free tubulin in order to protect microtubules from spontaneous breakage and disassembly in the absence of free tubulin [1]. This allowed us to visualize tubulin incorporation at damaged sites. In a kinesin-1 gliding assay in the presence of free green-tubulin dimers (Figure 4A), red-fluorescent capped-GDP microtubules displayed micrometer-long green stretches along their shaft 30 min after the initiation of the gliding assay (Figure 4B). The incorporation of free tubulin dimers into the microtubule shaft could also be visualized in motility assays using a similar experimental strategy (Figure 4C). Clear stretches of green tubulin dimers along the shaft of red microtubules were present on the vast majority of microtubules after Klp2 moved along them (Figure 4D). Together these results show that walking motors can break the microtubule lattice, catalysing the incorporation of free tubulin dimers, which heal the lattice and protect it from disassembly. From this data, we infer that components of the microtubules that are supporting motor trafficking are continuously renewed.
3. Conclusion
An important issue remains whether motor-induced destruction and repair of microtubules can happens in living cells. The localisation of GTP-tubulin [9] or microtubule-associated proteins mediating microtubule repair such as CLIP-170 [10] and CLASP [11], can serve as a proxy for the identification of repair sites in living cells. These sites are numerous along microtubules submitted to high conformational stress [8], but also along straight microtubules in axons [12], where motor-based trafficking is particularly intense, supporting our hypothesis that motors are involved in this process. Importantly, the incorporation of new GTP-tubulin dimers generates rescue sites along microtubules, increasing their lifespan [13]. This raises the possibility that dynein and kinesin motors may trigger the selective stabilization of the microtubules they are walking on, which could be instrumental in the definition of preferential tracks in microtubule networks and the establishment of cell polarity [14].
Acknowledgments
This project has benefited from several funding sources: ERC Adv 741773 (AAA) to Laurent Blanchoin, ERC CoG 771599 (ICEBERG) to Manuel Théry, CEA IRTELIS PhD program to Sarah Triclin.
French version
1. Introduction
Les moteurs moléculaires peuvent modifier la croissance et le désassemblage des microtubules [3]. Ils se déplacent le long de l’axe et modulent la dynamique des microtubules lorsqu’ils atteignent les extrémités des microtubules, mais leur impact éventuel le long du microtubule n’a pas été envisagé. La question de savoir si le travail mécanique produit par les moteurs en mouvement a un impact sur la stabilité et la dynamique du réseau de microtubules n’a pas pu être étudiée pour des raisons techniques. En effet, dans la plupart des études in vitro des forces mécaniques produites par les moteurs moléculaires, les microtubules étaient stabilisés afin de bloquer la dépolymérisation des microtubules [4]. Ces conditions ne reflètent pas les conditions physiologiques dans lesquelles la GTP-tubuline est rapidement hydrolysée en GDP-tubuline suite à l’incorporation du dimère de tubuline à l’extrémité du microtubule en croissance. Comme le réseau de GDP-tubuline est moins stable que celui de GTP-tubuline, le démantèlement du réseau peut être plus fréquent que ne le suggèrent les premières expériences. Ici, nous avons entrepris d’étudier l’impact des forces mécaniques produites par les moteurs kinésine et dynéine sur les microtubules dans des conditions où le treillis serait constitué de GDP-tubuline.
2. Résultats
2.1. Les moteurs moléculaires peuvent détruire les microtubules non stabilisés
Nous avons d’abord réalisé un « test de transport des microtubules » où les moteurs kinesin-1 sont attachés à la surface du verre et les forces produites par les moteurs entraînent le déplacement des microtubules. Nous avons commencé avec les conditions classiques dans lesquelles les microtubules sont stabilisés avec du Taxol (Figure 1A). La quantité totale de microtubules n’a pas changé au cours de l’expérience. Ensuite, pour étudier la réponse des microtubules GDP, nous avons coiffé les microtubules à leurs deux extrémités avec une courte portion de microtubules constituée de tubuline GMPCPP, qui protège les microtubules de la dépolymérisation à partir de leurs extrémités (Figure 1B). Ces microtubules coiffés de GDP ont commencé à se dépolymériser quelques minutes après le début du test de transport (Figure 1B, C) et n’étaient plus détectables quinze minutes plus tard (Figure 1C).
Les moteurs moléculaires détruisent les microtubules non stabilisés. (A) Représentation schématique et images de l’essai de glissement des microtubules traités au Taxol. Barre d’échelle : 50 μm. (B) Représentation schématique et images de l’essai de glissement de microtubules coiffés de GDP. Barre d’échelle : 50 μm. (C) Quantification des variations de longueur des microtubules dans les expériences présentées en A et B. Les longueurs des microtubules ont été mesurées pour tous les microtubules dans les champs de 600 μm de large chaque minute pendant 15 min. Les valeurs ont été normalisées par rapport à la longueur initiale (nombre d’expériences indépendantes N = 2, microtubules traités au Taxol n = 55; microtubules GMPCPP n = 42; microtubules GDP capsulés n = 42). Les barres d’erreur représentent l’écart-type. (D) Représentation schématique de l’essai de motilité. La graine de microtubule (magenta) est attachée au micropattern (bleu), tandis que la tige (vert) et le chapeau (magenta) sont libres. Les moteurs (jaune) marchent le long des microtubules. (E) Séquence montrant le microtubule capsulé-GDP sous RICM en absence (gauche) ou en présence (droite) de 1 nM de Klp2. Les images ont été prises toutes les 2 min. Barre d’échelle = 5 μm. (F) Courbe de survie des microtubules en absence (cercle noir) ou en présence de 1 nM de Klp2 (triangles rouges). Nombre d’expériences indépendantes : sans Klp2, N = 9, n = 371; 1 nM Klp2, N = 5, n = 317. Les barres d’erreur représentent la déviation standard. Adapté de [2].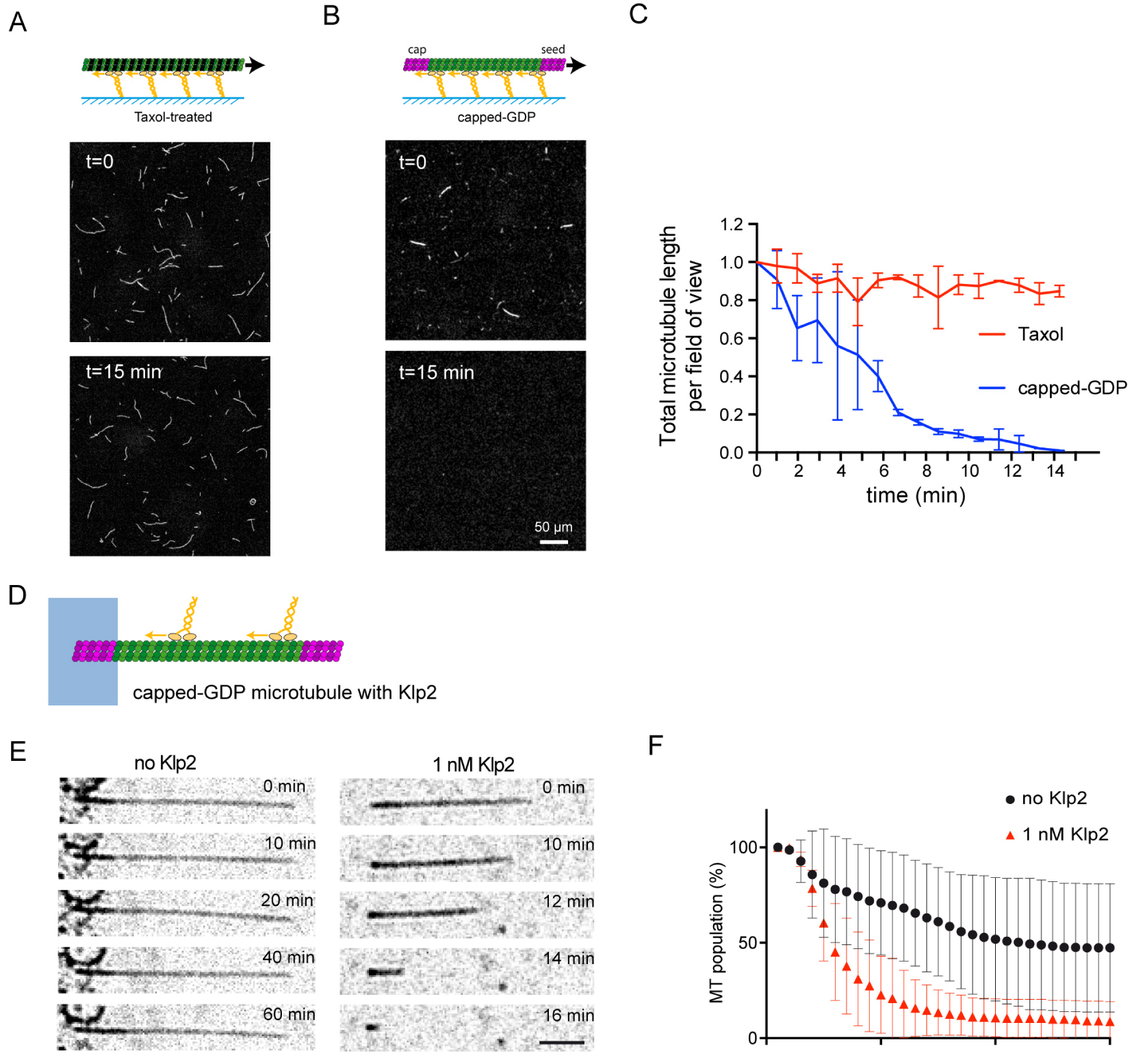
Nous avons ensuite réalisé un test alternatif, le « transport des moteurs », où les microtubules sont attachés à la surface de la lamelle de verre et où des moteurs marchent dessus [5]. Pour limiter les interactions de surface, nous avons utilisé le patterning de surface pour attacher les extrémités des microtubules uniquement à la surface, laissant le reste du microtubule non attaché au revêtement non adhésif de la surface [6] (Figure 1D). En l’absence de moteur, environ 70% des microtubules ont disparu pendant l’heure qu’a duré l’expérience, et leur durée de vie était d’environ 20 min. En présence de 1 nM de Klp2 (Figure 1E), 90% des microtubules ont disparu et leur durée de vie a été réduite à 8 min (Figure 1F), montrant que les moteurs de kinésine cassent les microtubules lorsqu’ils se déplacent le long de ceux-ci.
2.2. Les microtubules peuvent spontanément auto-renouveler leurs composants
Dans les essais de motilité et de glissement, la plupart des événements de rupture ont été précédés par une réduction locale de la fluorescence des microtubules, dont nous avons supposé qu’elle était due à la perte de dimères de tubuline. Il est à noter que dans les conditions dans lesquelles nous avons réalisé ces expériences, et qui ont été utilisées dans d’autres études in vitro pour étudier les moteurs moléculaires, il n’y avait pas de tubuline libre dans le milieu. Cependant, notre équipe a précédemment constaté que les dimères libres pouvaient s’incorporer aux microtubules du réseau en réponse à des forces mécaniques de flexion [7]. De plus, nous avons récemment découvert que ce renouvellement du réseau pouvait se produire spontanément, c’est-à-dire en l’absence de forces externes [1]. Cet auto-renouvellement est susceptible de se produire in vivo également puisque l’incorporation de tubuline libre a pu être observée dans un réseau de microtubules qui avait été pré-assemblé dans un extrait d’œuf de grenouille (Figure 2A, B). Elle peut également être observée dans un essai reconstitué dans lequel les microtubules ont été assemblés avec de la tubuline purifiée, c’est-à-dire en l’absence des protéines associées aux microtubules qui accompagnent la croissance et le renouvellement des microtubules in vivo (Figure 2C). Ces observations ont soulevé la possibilité que les dimères de tubuline libre en solution puissent compenser la perte de tubuline induite par les moteurs de marche en s’incorporant dans la région endommagée et protéger le microtubule de la rupture [7, 8].
Incorporation de tubuline libre dans des microtubules cultivés dans un extrait d’œuf de Xenopus. (A) Représentation schématique du dispositif expérimental permettant de tester le rôle du milieu de croissance des microtubules sur le renouvellement de la tubuline dans le réseau microtubulaire. Les microtubules ont été cultivés dans un extrait d’œuf de Xenopus exempt de cellules et complété par 1 μM de tubuline libre à fluorescence rouge (étape I) avant d’être lavés et coiffés avec du GMPCPP (14 μM de tubuline verte, étape II). Les microtubules ont ensuite été exposés à 14 μM de tubuline libre à fluorescence verte pendant 15 min (étape III) avant un lavage final et une observation ultérieure (étape IV). (B) Les images et les balayages linéaires montrent un exemple de microtubule cultivé dans un extrait d’œuf de Xenopus exempt de cellules. Barre d’échelle : 3 μm. Les étoiles jaunes pointent sur les sites d’incorporation. Le graphique montre la distribution des distances entre les sites d’incorporation après avoir concaténé tous les microtubules dans un ordre aléatoire. Les barres rouges représentent le facteur de moyenne géométrique ∗/sd. (C) Représentation schématique du montage expérimental pour tester le turnover du réseau de microtubules dans un essai entièrement reconstitué en présence de tubuline purifiée. Les images et les balayages linéaires montrent un exemple de microtubule cultivé en présence de 26 μM de tubuline (rouge) et maintenu coiffé en présence de 14 μM de tubuline libre (vert). Les étoiles jaunes indiquent les sites d’incorporation. Adapté de [1].
Les dimères de tubuline libre empêchent la destruction des microtubules par la kinésine et la dynéine. (A) Représentation schématique de l’essai de glissement des microtubules capsulés-GDP sur la kinésine-1 en l’absence (à gauche) ou en présence (à droite) de dimères de tubuline libres non marqués. (B) Images de microtubules glissants lorsque les moteurs sont activés par l’ajout d’ATP (t = 0, rangée supérieure) et 15 min plus tard (t = 15 min, rangée inférieure) dans les deux conditions décrites en A. Barre d’échelle : 50 μm. (C) Quantification des variations de longueur des microtubules dans les expériences présentées en B. Les longueurs des microtubules ont été mesurées pour tous les microtubules dans les champs de 600 μm de large chaque minute pendant 15 min. Les valeurs ont été normalisées par rapport à la longueur initiale. Nombre d’expériences indépendantes N = 2, sans tubuline libre n = 42, avec tubuline libre n = 74. Les barres d’erreur représentent l’écart-type. (D) Représentation schématique du test de motilité en l’absence (à gauche) et en présence (à droite) de dimères de tubuline libres non marqués. (E) Les séquences d’images montrent les microtubules après l’addition de moteurs Klp2 en absence (à gauche) ou en présence (à droite) de 14 μM de dimères de tubuline libres. Barre d’échelle : 10 μm. (F) Courbe de survie des microtubules en présence de moteurs moléculaires et absence de tubuline libre (vert) ou en présence de moteurs moléculaires et 14 μM de dimères de tubuline libre (bleu). N = 1; Sans moteur, n = 108; 10 nM Klp2 avec tubuline libre, n = 70. Adapté de [2].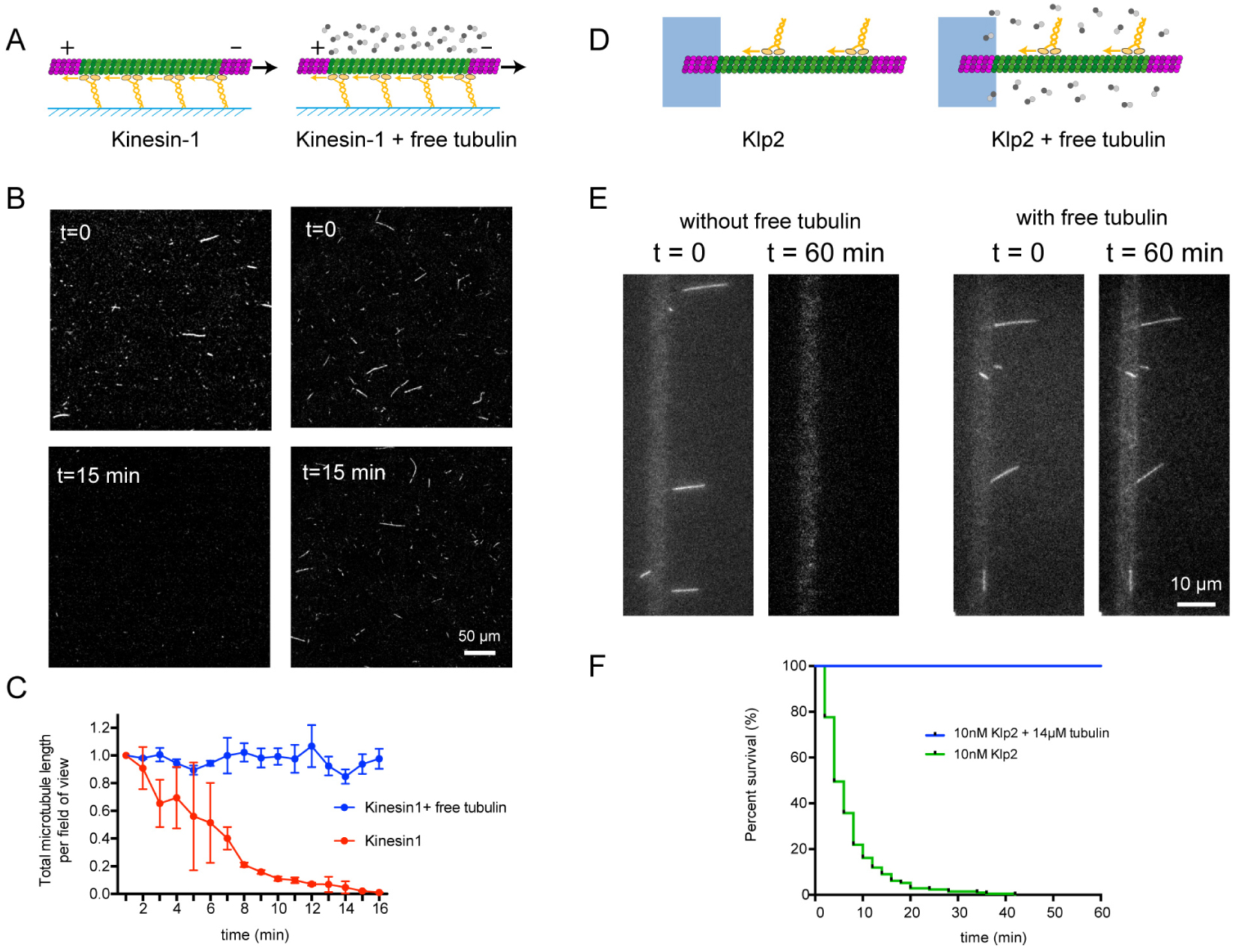
Les moteurs moléculaires améliorent l’échange de tubuline dans le réseau de microtubules. (A) Représentation schématique des trois séquences pendant les essais de glissement des microtubules capsulés-GDP en présence de 14 μM de tubuline libre fluorescente. Toutes les expériences ont duré 30 min. Seule la durée de l’étape de glissement a été modifiée. L’étape 1 correspond au chargement des microtubules GDP capsulés et des dimères de tubuline verte libre sur la couche de moteurs. L’étape 2 correspond à l’initiation du glissement par l’ajout d’ATP. Dans la condition 0 min, c’est-à-dire sans glissement, l’étape 2 a été sautée et l’ATP n’a pas été ajoutée. Dans la condition 15 min, l’étape 2 a été initiée 15 min après l’étape 1. Dans la condition de 30 min, l’étape 2 suivait immédiatement l’étape 1. Dans tous les cas, les tubulines fluorescentes ont été retirées après 30 min pour mesurer l’incorporation de tubuline libre. (B) Les images montrent l’axe des microtubules (faible intensité) avec la coiffe et la graine associées (forte intensité) (rangée du haut), l’incorporation de la tubuline libre (rangée du milieu), et la superposition des deux signaux (rangée du bas) à la fin de l’essai de glissement (étape 3). Dans ces exemples, les microtubules ont glissé sur la kinésine-1 pendant 30 min. Barre d’échelle : 10 μm. (C) Représentation schématique des trois séquences pendant les essais de motilité sur les microtubules capsulés-GDP en présence de 14 μM de tubuline fluorescente. L’étape 1 correspond à la croissance et au coiffage des microtubules. L’étape 2 correspond à l’ajout de moteurs et de tubuline fluorescente. L’étape 3 correspond au retrait des moteurs et au remplacement de la tubuline fluorescente par de la tubuline non marquée 40 min plus tard. (D) Les images montrent l’arbre des microtubules (rangée du haut), l’incorporation des dimères libres (rangée du milieu), et la superposition des deux signaux (rangée du bas) à la fin du test de motilité. Barre d’échelle : 10 μm. Adapté de [2].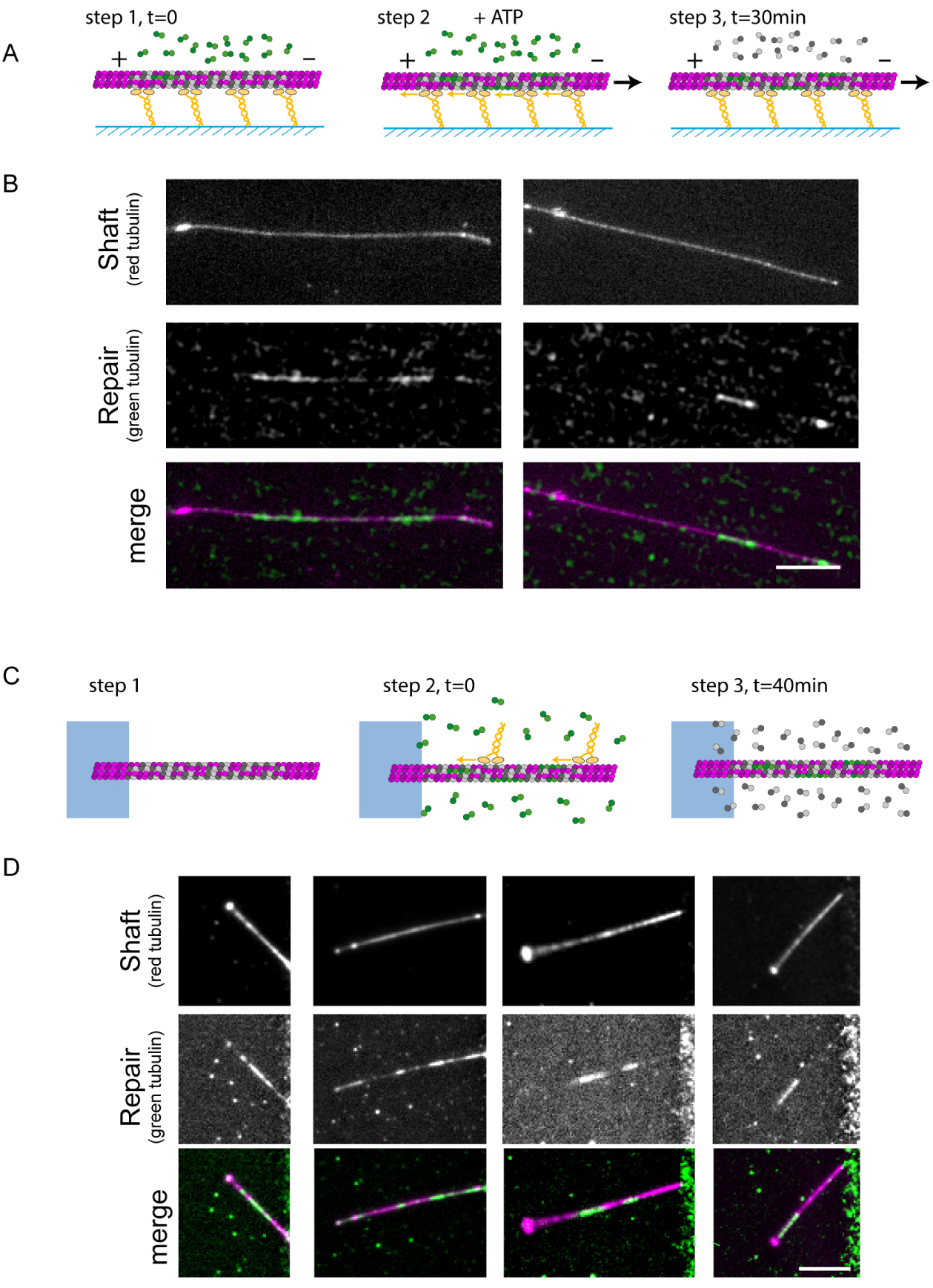
2.3. La tubuline libre protège les microtubules de la destruction induite par les moteurs
Pour tester l’hypothèse selon laquelle les propriétés intrinsèques d’auto-renouvellement des microtubules pourraient les protéger de la destruction induite par les moteurs, des essais de transport des microtubules ont été réalisés en présence de dimères de tubuline libre (Figure 3A). De manière frappante, les microtubules coiffés ont glissé sur la kinésine-1 en présence de dimères de tubuline sans destruction visible (Figure 3B, C). De même, l’ajout de dimères libres dans les essais de transport des moteurs (Figure 3D) a entièrement protégé les microtubules de la rupture induite par les moteurs (Figure 3E, F).
2.4. Les moteurs moléculaires catalysent l’autoréparation du réseau de microtubules
Pour visualiser directement la réparation des microtubules en réponse à la destruction induite par les moteurs, nous avons réalisé un test à deux couleurs dans lequel la tubuline polymérisée et les dimères de tubuline libres ont été marqués avec des fluorophores différents. Les dimères fluorescents libres ont ensuite été éliminés par lavage et remplacés par de la tubuline libre non marquée, afin de protéger les microtubules de la rupture et du désassemblage spontanés en l’absence de tubuline libre [1]. Ceci nous a permis de visualiser l’incorporation de la tubuline aux sites endommagés. Dans un essai de transport des microtubules par la kinésine-1 en présence de dimères libres de tubuline verte (Figure 4A), les microtubules coiffés de GDP et fluorescents en rouge présentaient des marques vertes de l’ordre du micromètre le long de leur axe 30 min après le début du transport (Figure 4B). L’incorporation de dimères de tubuline libres dans l’axe des microtubules a également pu être visualisée dans les essais de transport des moteurs en utilisant une stratégie expérimentale similaire (Figure 4C). Des marques contenant des dimères de tubuline verts étaient présentes sur la grande majorité des microtubules après que Klp2 se soit déplacé le long de ceux-ci (Figure 4D). Ensemble, ces résultats montrent que les moteurs moléculaires peuvent briser la structure des microtubules, et ainsi catalyser l’incorporation de dimères de tubuline libres, qui réparent le réseau et le protègent du désassemblage. Ces données montrent que les composants des microtubules qui soutiennent le trafic des moteurs sont continuellement renouvelés.
3. Conclusion
Une question importante reste de savoir si la destruction et la réparation des microtubules induites par les moteurs peuvent se produire dans les cellules vivantes. La localisation de la GTP-tubuline [9] ou des protéines associées aux microtubules qui médient la réparation des microtubules, telles que CLIP-170 [10] et CLASP [11], peut servir de proxy pour l’identification des sites de réparation dans les cellules vivantes. Ces sites sont nombreux le long des microtubules soumis à un stress conformationnel élevé [8], mais aussi le long des microtubules droits dans les axones [12], où la circulation des moteurs est particulièrement intense, soutenant notre hypothèse que les moteurs sont impliqués dans ce processus. Il est important de noter que l’incorporation de nouveaux dimères GTP-tubuline génère des sites de sauvetage le long des microtubules, ce qui augmente leur durée de vie [13]. Ceci soulève la possibilité que les moteurs dynéine et kinésine puissent déclencher la stabilisation sélective des microtubules sur lesquels ils marchent, ce qui pourrait être instrumental dans la définition de pistes préférentielles dans les réseaux de microtubules et l’établissement de la polarité cellulaire [14].
Remerciements
Ce projet a bénéficié de plusieurs sources de financement : ERC Adv 741773 (AAA) à Laurent Blanchoin, ERC CoG 771599 (ICEBERG) à Manuel Théry, programme doctoral IRTELIS du CEA à Sarah Triclin.




 CC-BY 4.0
CC-BY 4.0