1. Introduction
Biological systems develop mechanical forces to perform their functions at molecular, cellular and tissue levels [1, 2] and their mechanical behaviour is largely controlled by components that are out of thermodynamic equilibrium. They are fuelled by a continuous injection of energy at the microscopic level through molecular machines that transform chemical energy into mechanical work [3]. As such, they belong to the category of active materials that are out of equilibrium and are able to self-organize [4]. This concept of active materials can be applied to understand emergent biological properties at subcellular, cellular and pluricellular levels. Biological systems like cytoskeleton filaments; bacteria or eukaryotic cellular assemblies can be described using an important sub-class of active systems that relies on their rod-like shape called active nematics. At long time and large length scales, isotropic structures can be seen as fluids or gels and long range orientational orders of these particles results in a liquid crystal (LC) phase. Among the LC phases, one can distinguish nematic order where there is no head-to-tail asymmetry of the rod-like particles and polar order is composed of head–tail particles pointing in the same direction. Importantly, these LC phases can display singularities in their orientational field, through the formation of topological defects [5] (Box 1). For nematic LCs, two types of topological defects predominate as the lowest energy state: comet-like (+1∕2) or trefoil-like (−1∕2) (Box 1). The symmetries of polar liquid crystals do not allow defects of charge ±1/2 but instead host defects with integer charge. These properties, i.e. the absence of topological defects in an isotropic phase, along with the differences between polar and nematic systems, help in determining the active physical properties of living materials. Dynamic and continuous remodeling of cytoskeletal filaments present within the cell modulates these physical properties. Collective dynamics of in vitro reconstituted cytoskeletal structures have been described using the active nematic framework [6, 7, 8, 9]. In addition, cellular studies have demonstrated that actin cytoskeleton structures within cells undergo an isotropic–nematic transition to adapt to the external environment and generate contractile stresses [10, 11]. The collective dynamics of cells both in vitro and in vivo exhibit properties of polar and nematic structures where topological defects appear as organization centers during morphogenesis [12] and centers of mechanotransduction to regulate biological processes such as cell death driven extrusion [13], cell accumulation [14, 15, 16] and differentiation of cells [17]. The active nature of cellular behaviour arises from an interplay of cell–matrix and cell–cell interactions, which controls various phenomena including tissue morphogenesis [18], epithelial–mesenchymal transition [19], wound healing and tumour progression [20]. This active nature gives rise to single isolated cells that generate contractile force dipoles, i.e., the resulting forces due to actomyosin contraction, and pulling forces on focal adhesion sites located at the substrate, is typically a pair of approximately equal and opposite forces acting inwards along the cellular long axis. Thus, one would assume these individual contractile cells to generate contractile stresses in a monolayer. While this is true for a monolayer of fibroblasts [21], epithelial monolayers [13, 22] and a monolayer of neural progenitor cells [16] display extensile behaviour, that is the net force from the neighbours and substrate interaction acts to elongate the cell further along its long axis (Box 2). This poses a question on the emergence of extensile stresses within a collection of single contractile units and how this change in active behaviour of cells give rise to the tissue architecture observed in-vivo.
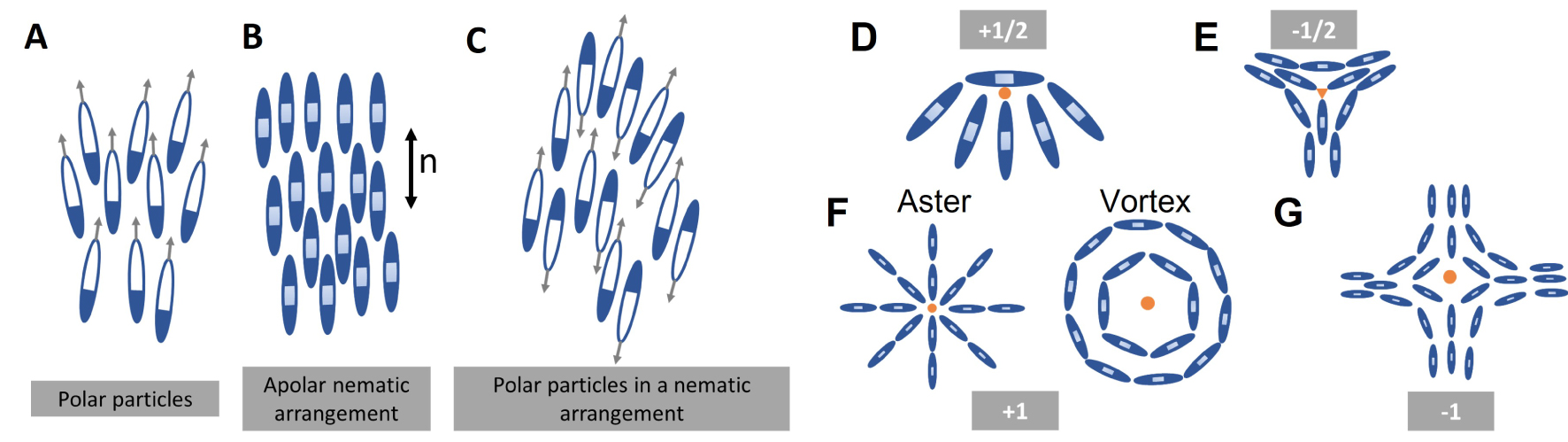
Box 1
Polar ordering: Alignment of constituent particles with a defined polarity (Figure A). Nematic ordering: Alignment of constituent particles with a head–tail symmetry in a parallel fashion (Figure B). Two polar particles arranged in an antiparallel fashion can give rise to a net nematic order (Figure C).
Liquid crystal ordering: Particles with a crystalline arrangement of elements with liquid like physical properties.
Topological defects: Regions of singularity in the orientational field and can be of different charges ( + 1∕2, − 1∕2, + 1 and − 1), Figure D–G. While half integer defects are stable in a nematic state, integer defects are stable in a polar state.
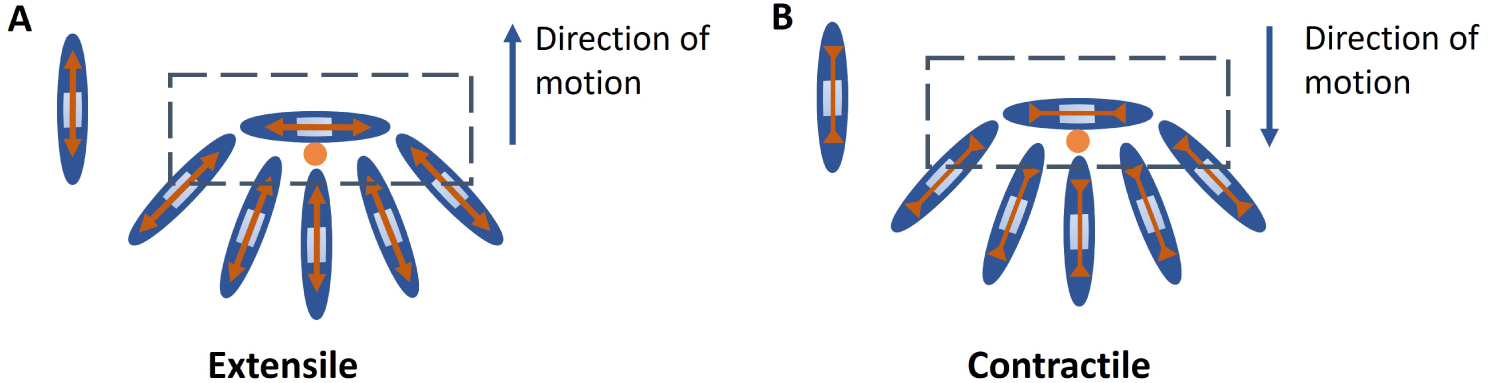
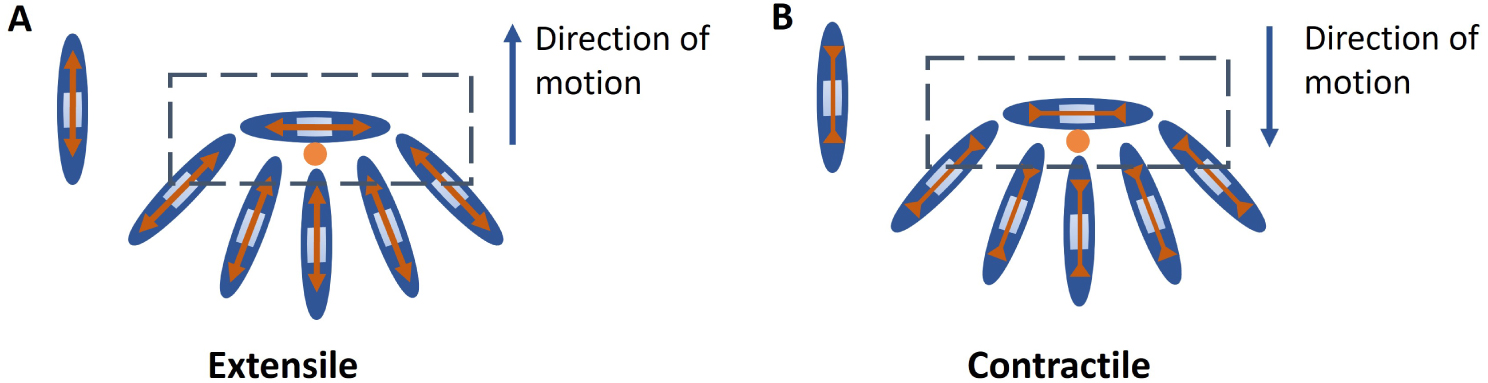
Box 2
Extensile nematics: A nematic particle with extension forces along the long axis which arises from internal activity of the cell, neighbour interaction or interaction with the substrate. Extensile stresses drive movement of + 1∕2 defect towards the head direction (Figure A).
Contractile nematics: A nematic particle with compressive forces along the long axis which arises from internal activity of the cell, neighbour interaction or interaction with the substrate. Contractile stresses drive movement of + 1∕2 defect towards the tail direction (Figure B).
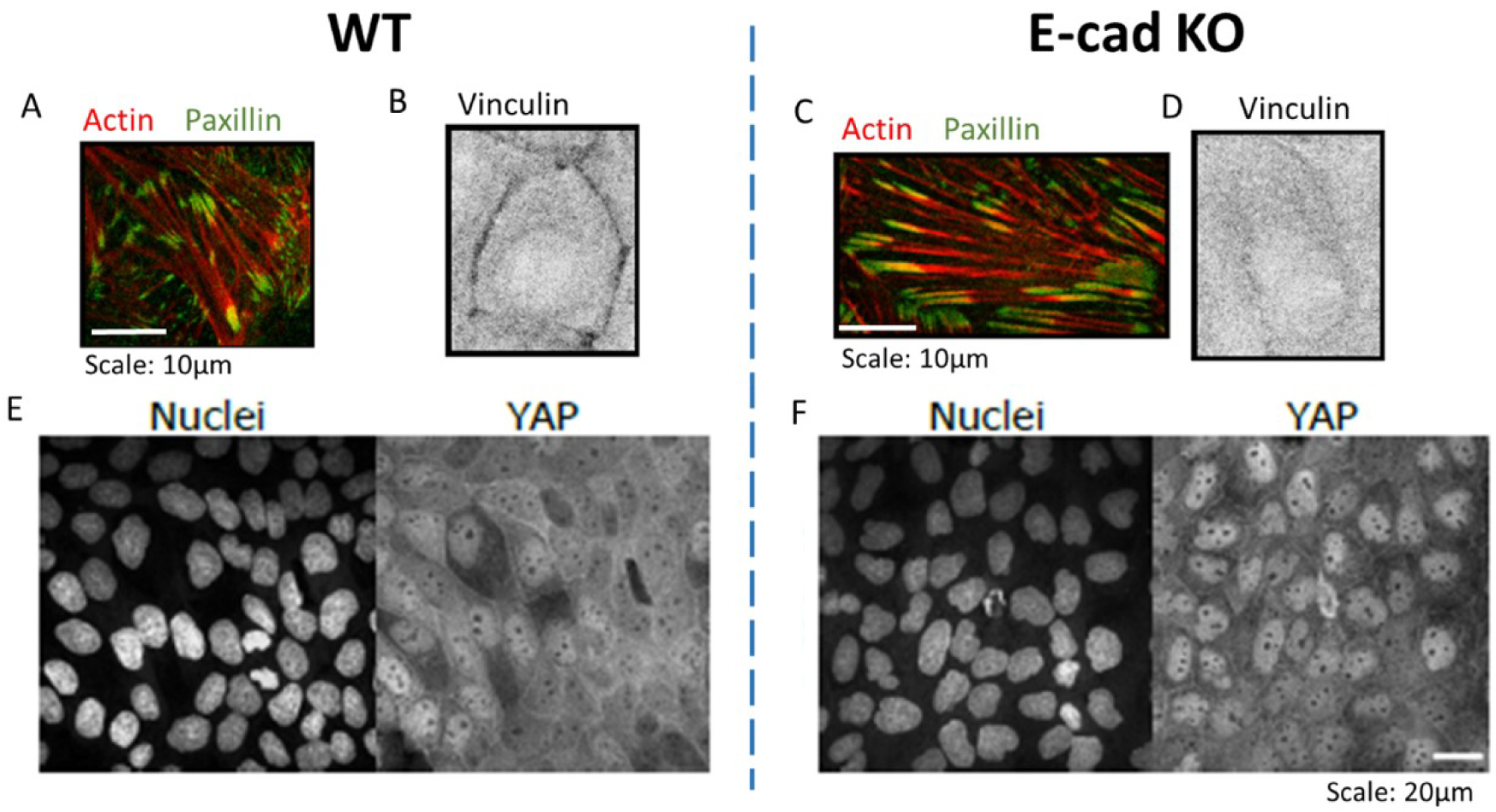
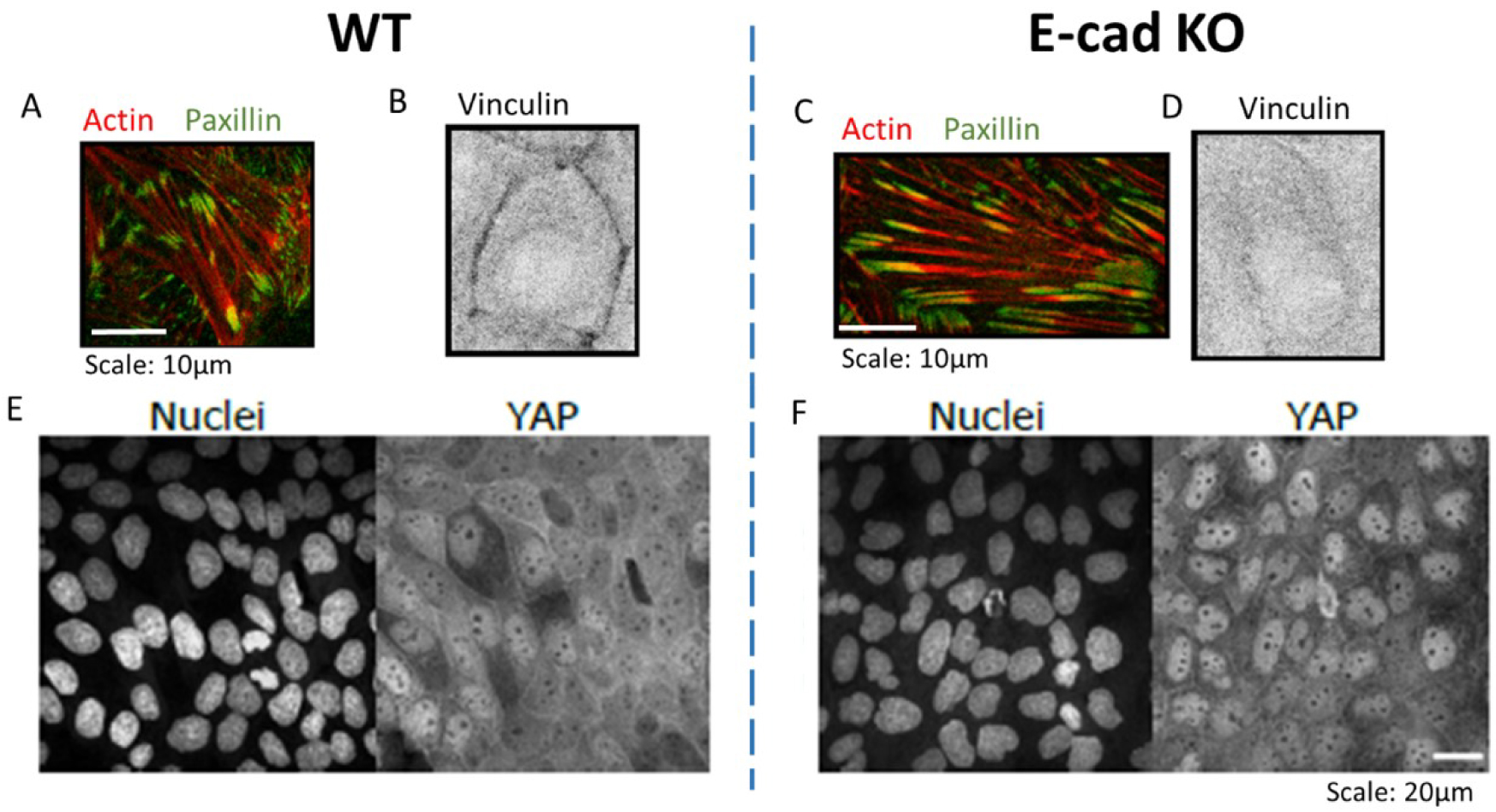
Immunostaining zoom of actin (red) and paxillin (green) within MDCK WT (A) and E-cad KO monolayer (C), vinculin (black) within WT (B) and E-cad KO (D) monolayers. Scale: 10 μm. Immunostaining of Nuclei (left) and YAP (right) on WT (E) and E-cad KO (F) monolayers. Adapted from [23]. Scale: 20 μm.
2. Results
In our recent work [23] we showed that contractile dipolar stresses observed at a single cell level, are not conserved within an epithelial monolayer (MDCK) which behaves as an extensile system. We define an extensile system by tracking the movement of + 1∕2 defects and its motion along the head of the defect defines an extensile system. On the other hand, in a contractile system + 1∕2 defects move towards the tail end of the defect (Box 2). In order to identify the origin of this extensile behaviour within an epithelial monolayer, we generated a Crispr Cas9 based knockout (KO) of E-cadherin, an adherens junction protein. This enabled us to study the changes in migratory and active nematic behaviour of epithelial monolayers in the presence and absence of E-cadherin hereby referred to as WT and E-cad KO. Removal of E-cadherin led to contractile behaviour of epithelial monolayers as observed by tracking the movement of + 1∕2 defects. This loss of E-cadherin led to a reduction in collective migratory properties of cells such as reduction in velocity correlation length, i.e., the distance up to which cells collectively move. This reduction in velocity correlation length points towards a decrease in neighbour cell interaction in the absence of E-cadherin. In addition, we also noticed a reduction in migratory speed of E-cad KO monolayers which was accompanied by an increase in traction forces exerted on the substrate in the absence of E-cadherin. These results in combination hinted at an increase in substrate interaction upon removal of E-cadherin. Previous studies have shown that epithelial cells exhibit a tight balance of cell–cell and cell–substrate adhesion forces whereby they exhibit a compensatory behaviour upon reduction in the level of either adhesions. Thus, in our system we looked at biological markers to verify if we observed such a compensatory effect. The increase in traction forces were accompanied by an increase in the size and area of focal adhesion molecule paxillin (Figure 1A, C) and a translocation of vinculin from cell–cell contacts to focal adhesion sites although the total amount of vinculin did not show a considerable change (Figure 1B, D). In addition, we observed an increase in nuclear localization of YAP in the absence of E-cadherin (Figure 1E, F). These results in combination highlight an increase in substrate adhesion within E-cad KO monolayers. Our experimental results were then validated using a phase field model where the strength of inter-cellular activity (mimicking cell–cell adhesions) and intra-cellular activity (mimicking cell–substrate adhesions and internal contractility) was modulated. Using this phase field model, we obtained a phase diagram showing that a change in the level of inter and intracellular interactions modulate extensile and contractile activity of cellular monolayers (Figure 2A). An increase in inter-cellular activity gave rise to extensile behaviour while increase in intra-cellular activity gave rise to contractile behaviour. This phase field diagram was replicated in our experimental setup by using various drugs to inhibit contractile activity within cells. For instance, treating E-cad KO monolayers with 5 μM blebbistatin did not alter the contractile activity of cells, while treating these monolayers with a higher dose of blebbistatin inhibited the contractile activity bringing back extensile behaviour observed in WT monolayers. In addition, treating E-cad KO monolayers with Y27632 (ROCK inhibitor) and plating cells on soft substrates (reduced substrate adhesion) resulted in extensile activity of E-cad KO monolayers. These experimental observations reiterate the phase diagram obtained showing that extensile and contractile behaviour indeed arises from a balance in inter and intracellular contractility.
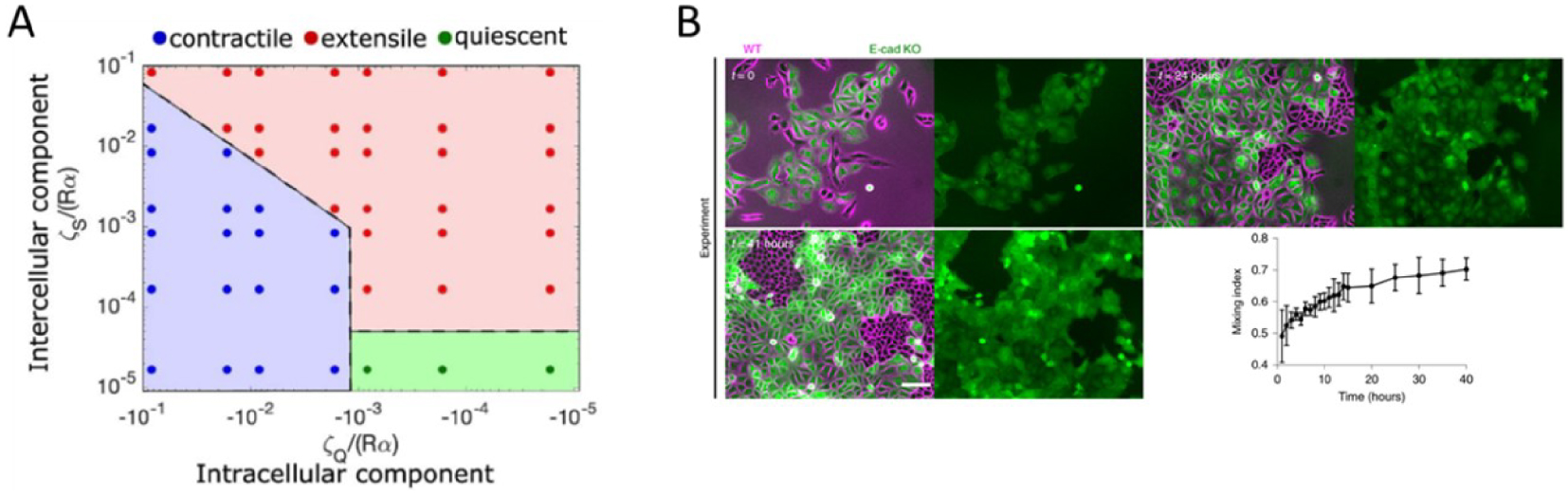
Phase diagram obtained from phase field modelling with varying values of intercellular and intracellular stresses. (B) Time-lapse sorting of extensile (WT) and contractile (E-cad KO) cells observed over time represented by mixing index obtained from experiments with MDCK WT (magenta) and E-cadherin KO cells tagged with LifeAct GFP (green). The mixing index from experiments was obtained from n = 5 different clusters from two independent samples. Error bars represent the standard deviation. Adapted from [23]. Scale bar: 100 μm.
Having observed different nematic activity of WT and E-cad KO monolayers, we wanted to understand the biological consequences of differences in nematic activity induced extensile and contractile behaviour. Thus, we mixed both MDCK WT and E-cadherin KO cells at 50/50 concentration and observed their ability to sort out into two distinct regimes whereby WT cells are surrounded by E-cadherin KO cells (Figure 2B). This sorting behaviour is in agreement with differential adhesion hypothesis (DAH) [24] and differential interfacial tension (DITH) [25] hypothesis whereby cells with higher adhesion/tension would be surrounded by cells with low adhesion/tension. However, DAH and DITH are explained using physics of passive systems under thermodynamic equilibrium without any matrix adhesion. However, cellular systems are active systems with sufficient matrix adhesion making the physical explanation of DAH and DITH lacking. Thus, to challenge these mechanisms, we changed the ratio of WT and E-cad KO cells where we observed a switch in sorting dynamics at different concentrations of WT and E-cad KO cells. For instance, mixing WT and E-cadherin KO at 30/70 replicated the 50/50 experiments where WT cells were surrounded by E-cad KO cells. While mixing WT and E-cadherin KO cells at 70/30 altered the mixing phenomenon with WT cells surrounding E-cadherin KO cells. This sorting behaviour was recapitulated by our phase field model as well and contradicts predictions by DAH and DITH. In the case of DAH or DITH regardless of the starting density cells would always surround cells with higher adhesion/tension with lower adhesion/tension in contrast to our experimental and numerical observations. Thus in this work, using active matter physics, we propose a new mechanism to explain cell sorting behaviour of migratory cells with strong substrate adhesion. This observation of cell sorting was recently reported in salivary gland epithelia where the stratified epithelia is composed of an epithelial layer with strong cell–cell adhesions surrounded by epithelial layer with strong cell–substrate adhesions and is essential to initiate branching in the salivary gland [26].
3. Conclusion
In this work, through a combination of experiments and in silico modelling we show that epithelial cells maintain their collective behaviour and nematic activity through a coordination of intercellular and intracellular stresses. Intercellular stresses are mediated through adherens junctions, while intracellular stresses are mediated by changes in substrate interaction and actomyosin organization. This gives rise to a phase diagram illustrating the emergence of extensile behaviour within cellular monolayers through a tight balance of inter- and intra-cellular activity. These differences in nematic activity is able to explain cell sorting observed in our system based on differences in their nematic activity. Comparing our observations of sorting with previously observed studies and hypothesis [24, 25] highlights fundamental distinctions that arise by taking into account the nature of active forces. Having understood the role of extensility and contractility in dictating demixing (sorting) of cells, this approach could be expanded to studying other biological processes such as tissue growth, development and tissue homeostasis. For instance, recent studies demonstrated the importance of nematic organization of actin cytoskeleton in Hydra during morphogenesis [12], while other studies have begun to explore the role of liquid-crystal ordering during morphogenesis [27] and in vivo epithelial tissue patterning [28]. These findings highlight the importance of active nematic behaviours at a collective level to understand tissue shape and organization, factors central to morphogenesis.
Conflicts of interest
Authors have no conflict of interest to declare.
French version
1. Introduction
Les systèmes biologiques développent des forces mécaniques pour remplir leurs fonctions aux niveaux moléculaire, cellulaire et tissulaire [1, 2]. Leur comportement mécanique est largement contrôlé par des composants qui sont hors d’équilibre. Ils reposent sur la consommation d’énergie au niveau microscopique par le biais de machines moléculaires qui transforment l’énergie chimique en travail mécanique en utilisant l’ATP comme source d’énergie [3]. En tant que tels, ils appartiennent à la catégorie des matériaux actifs, hors d’équilibre et capables de s’auto-organiser [4]. Ce concept de matériaux actifs peut être appliqué pour comprendre les propriétés biologiques émergentes aux niveaux subcellulaire, cellulaire et pluricellulaire. Les systèmes biologiques tels que les filaments du cytosquelette, les bactéries ou les assemblages cellulaires eucaryotes peuvent être décrits à l’aide d’une importante sous-classe de systèmes actifs qui repose sur leur forme en bâtonnet, appelée nématique active. Dans ce cas, une analogie peut donc être faite avec les cristaux liquides (CL) pour décrire ces systèmes biologiques. Dans ces phases nématiques, l’état de plus basse énergie correspond à l’alignement des particules dans une direction privilégiée soit alignées tête-queue (ordre polaire), soit alignées sans asymétrie des orientations des particules (ordre nématique). Cependant, il peut apparaître des singularités d’orientation, appelées défauts topologiques [5] (Encadré 1). Ces singularités existent dans les systèmes passifs mais peuvent être auto-générées par les forces actives au sein de systèmes biologiques. Pour les CL nématiques, deux types de défauts topologiques prédominent : les défauts de type comète (+1∕2) ou de type trèfle (−1∕2) (Encadré 1). Les symétries des cristaux liquides polaires n’autorisent pas les défauts de charge ±1/2 mais accueillent au contraire des défauts de charge entière. Au niveau subcellulaire, le remodelage dynamique et continu des filaments du cytosquelette présents dans la cellule module ces propriétés physiques. La dynamique collective de structures cytosquelettiques reconstituées in vitro a été décrite en utilisant le cadre nématique actif [6, 7, 8, 9]. De plus, des études cellulaires ont démontré que les structures du cytosquelette d’actine à l’intérieur des cellules subissent une transition isotrope–nématique pour s’adapter à l’environnement externe et générer des contraintes contractiles [10, 11]. La dynamique collective des cellules in vitro et in vivo présente également des propriétés de structures polaires et nématiques où les défauts topologiques apparaissent comme des centres d’organisation pendant la morphogenèse [12] et des centres de mécanotransduction pour réguler les processus biologiques tels que l’extrusion induite par la mort cellulaire [13], l’empilement [14, 15, 16] et la différenciation des cellules [17]. La nature active du comportement cellulaire résulte d’interactions cellule-matrice et cellule–cellule, qui contrôlent divers phénomènes tels que la morphogenèse tissulaire [18], la transition épithélio–mésenchymateuse [19], la cicatrisation et la progression tumorale [20]. La cartographie des forces au niveau des cellules isolées se résume souvent à l’émergence d’un dipôle de forces le long du grand axe cellulaire résultant de la contraction du cytosquelette d’actomyosine. Ces cellules, prises isolément, ont donc une nature « contractile » d’après la définition donnée précédemment. Ainsi, on pourrait supposer que ces cellules contractiles individuelles génèrent des contraintes contractiles dans une monocouche. Il s’avère que les monocouches épithéliales [13, 22] tout comme des cellules neurales progénitrices [16] présentent un comportement « extensible », c’est-à-dire que la force nette provenant de l’interaction entre les voisins et le substrat agit pour allonger davantage la cellule le long de son axe long. Cela pose la question de l’émergence de contraintes collectives au sein d’assemblées cellulaires.
Encadré 1
Ordre polaire : Alignement des particules constitutives avec une polarité définie (Figure A).
Ordre nématique : Alignement de particules constitutives avec une symétrie tête–queue de manière parallèle (Figure B). Deux particules polaires disposées de manière antiparallèle peuvent donner lieu à un ordre nématique net (Figure C).
Ordre des cristaux liquides : Particules présentant un arrangement cristallin des éléments avec des propriétés physiques semblables à celles d’un liquide.
Défauts topologiques : Régions de singularité dans le champ d’orientation et peuvent être de différentes charges ( + 1∕2, − 1∕2, + 1 et − 1), Figure D–G. Alors que les défauts demi-entiers sont caractéristiques d’un système nématique, les défauts entiers s’observent pour des systèmes nématiques ou polaires.
2. Résultats
Dans notre travail récent [23], nous avons montré que les contraintes dipolaires contractiles observées au niveau d’une seule cellule, ne sont pas conservées dans une monocouche épithéliale (MDCK) qui se comporte comme un système extensible. L’extensilité du système se définit par rapport au mouvement des défauts + 1∕2 qui se déplacent en sens opposé dans un système contractile (Encadré 2). Afin d’identifier l’origine de ce comportement extensible au sein d’une monocouche épithéliale, nous avons postulé que l’altération des jonctions adherens pouvait induire une modification des propriétés mécaniques des monocouches cellulaires. Pour cela, nous avons généré une lignée knockout (KO) pour la E-cadhérine, une protéine des jonctions adherens. Cela nous a permis d’étudier les changements dans le comportement migratoire et nématique actif des monocouches épithéliales en présence (WT) et en l’absence de E-cadhérine (E-cad KO). L’élimination de la E-cadhérine conduit à un comportement contractile des monocouches épithéliales. Ces cellules montrent également une diminution de leur comportement cohésif caractérisée par la longueur de corrélation spatiale des vitesses qui est réduite. Cette réduction s’explique par une diminution de l’interaction entre cellules voisines en l’absence de E-cadhérine. De plus, nous avons mis en évidence une réduction de la vitesse de migration des monocouches accompagnée par une augmentation des forces de traction exercées sur le substrat en l’absence de E-cadhérine. Ces résultats suggèrent une augmentation des interactions cellule–substrat lors de l’élimination de la E-cadhérine. Des études antérieures ont montré que l’équilibre étroit entre les forces d’adhésion cellule–cellule et cellule–substrat est crucial pour l’intégrité des tissus épithéliaux. Nous avons donc cherché à caractériser au niveau des complexes d’adhésion l’impact de la perte de E-cadhérine. L’augmentation des forces de traction s’accompagne d’une augmentation de la taille et de la surface des adhésions cellule–substrat, caractérisée par le marquage de la paxilline (Figure 1A, C) et d’une translocation de la vinculine, protéine connue pour être présente aux deux types de contacts, i.e. cellule–cellule et cellule-matrice, des contacts cellule–cellule aux sites d’adhésions focales (Figure 1B, D). En outre, nous avons observé une augmentation de la localisation nucléaire de YAP en l’absence de E-cadhérine (Figure 1E, F). L’ensemble de ces résultats met en évidence une augmentation de l’adhésion cellule–substrat au sein des monocouches de cellules E-cad KO.
Encadré 2
Au niveau cellulaire : Les nématiques « extensibles » peuvent être vus comme des particules avec des forces d’extension le long du grand axe. Dans le cas cellulaire, ces forces résultent de l’activité interne de la cellule, de l’interaction avec les voisins ou de l’interaction avec le substrat. Les contraintes d’extension entraînent le déplacement du défaut + 1∕2 vers la direction de la tête (Figure A).
Les nématiques « contractiles » peuvent être vus comme des particules nématiques avec des forces de compression le long du grand axe qui proviennent de l’activité interne de la cellule, de l’interaction entre voisins ou de l’interaction avec le substrat. Les contraintes contractiles entraînent le mouvement du défaut + 1∕2 vers la direction de la queue (Figure B).
Zoom d’immunomarquage de l’actine (rouge) et de la paxilline (vert) dans les monocouches MDCK WT (A) et E-cad KO (C), de la vinculine (noir) dans les monocouches WT (B) et E-cad KO (D). Echelle : 10 μm. Immunomarquage des noyaux (gauche) et de YAP (droite) sur des monocouches WT (E) et E-cad KO (F). Adapté de [23]. Echelle : 20 μm.
Ces résultats expérimentaux ont ensuite été confirmés par des approches basées sur un modèle de champ de phase. Ce type de modèle numérique permet de faire varier indépendamment l’activité intercellulaire (interactions cellule–cellule) et de l’activité intracellulaire (interactions cellule–substrat et la contractilité interne). A l’aide de ce modèle, nous avons pu proposer un diagramme de phase montrant qu’un changement du niveau des interactions inter et intracellulaires modulait l’activité nématique des monocouches cellulaires (Figure 2A). Une augmentation de l’activité intercellulaire donne lieu à un comportement extensible tandis qu’une augmentation de l’activité intracellulaire mène à un comportement contractile. Cette variabilité du comportement collectif a pu être testée expérimentalement en utilisant des drogues inhibitrices de contractilité. Par exemple, le traitement des monocouches E-cad KO avec 5 μM de blebbistatin ne modifie pas l’activité contractile des cellules, alors que le traitement de ces monocouches avec une dose plus élevée inhibe l’activité contractile, et induit un comportement « extensile ». Ces observations expérimentales reflètent le diagramme de phase obtenu montrant que le comportement extensible et contractile résulte bien d’un équilibre de la contractilité inter- et intra-cellulaires.
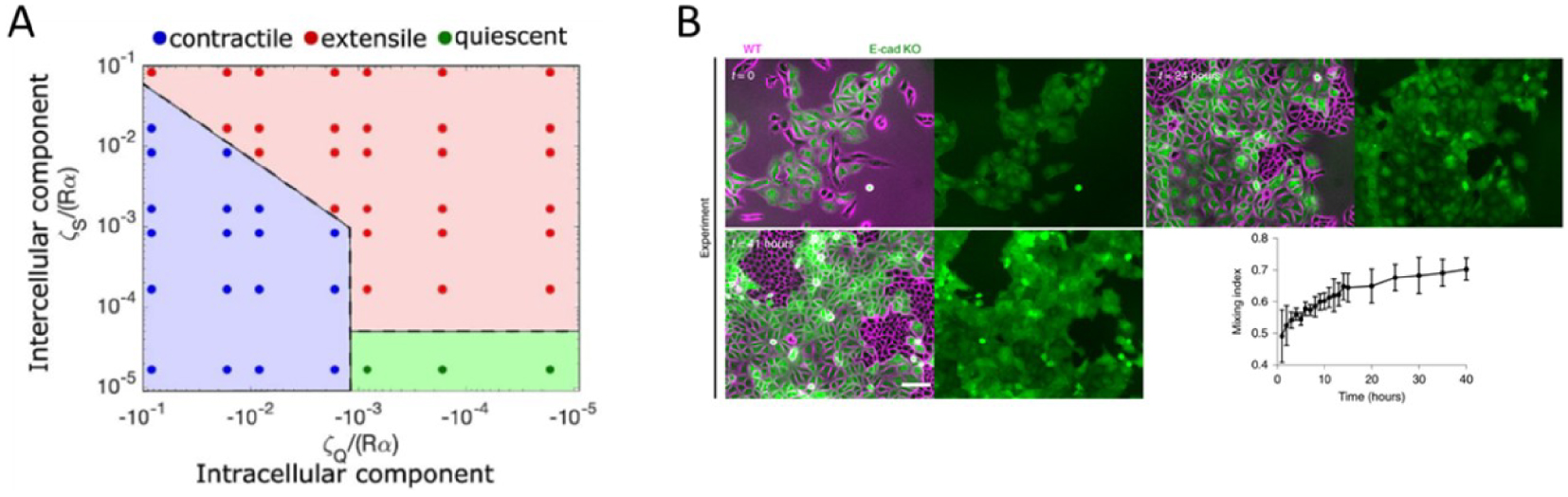
Diagramme de phase obtenu à partir de la modélisation du champ de phase avec des valeurs variables des contraintes intercellulaires et intracellulaires. (B) Triage chronologique des cellules extensibles (WT) et contractiles (E-cad KO) observées dans le temps, représenté par l’indice de mélange obtenu à partir d’expériences avec des cellules MDCK WT (magenta) et E-cadhérine KO marquées avec LifeAct GFP (vert). L’indice de mélange des expériences a été obtenu à partir de n = 5 groupes différents provenant de deux échantillons indépendants. Les barres d’erreur représentent l’écart-type. Adapté de [23]. Barre d’échelle : 100 μm. Masquer
Diagramme de phase obtenu à partir de la modélisation du champ de phase avec des valeurs variables des contraintes intercellulaires et intracellulaires. (B) Triage chronologique des cellules extensibles (WT) et contractiles (E-cad KO) observées dans le temps, représenté par l’indice de ... Lire la suite
Ayant observé une activité nématique différente des monocouches WT et E-cad KO, nous avons voulu comprendre les conséquences biologiques de ces différences mécaniques. Pour cela, nous avons étudié leur impact sur la ségrégation des populations cellulaires. Ainsi, nous avons mélangé les cellules MDCK WT et E-cadhérine KO à un ratio de 50/50 et observé leur capacité à se ségréger. Dans ce régime, les cellules WT sont entourées de cellules E-cadhérine KO (Figure 2B). Ce comportement est compatible avec des modèles antérieurs basés sur l’adhésion différentielle (DAH) [24] et des différences de tension interfaciale (DITH) [25], selon lesquelles les cellules ayant une adhérence/tension plus élevée seraient entourées de cellules ayant une adhérence/tension faible. Cependant, DAH et DITH se basent sur des hypothèses de systèmes à l’équilibre sans adhésion à la matrice extracellulaire. Pour tester la pertinence de notre modèle basé sur les forces actives générées par les cellules par rapport aux modèles précédents, nous avons changé le ratio de cellules WT et E-cad KO et nous avons observé un changement dans la dynamique de tri à différentes concentrations de cellules WT et E-cad KO. Par exemple, le mélange de cellules WT et E-cadhérine KO à 30/70 reproduit les expériences à 50/50 où les cellules WT étaient entourées de cellules E-cad KO. En revanche, le mélange de cellules WT et E-cadhérine KO à 70/30 modifie le résultat de ségrégation, les cellules WT entourant les cellules E-cadhérine KO. Ce comportement ne peut s’expliquer par les hypothèses de type DAH ou DITH. Ainsi, nous proposons un mécanisme alternatif basé sur les propriétés actives des cellules pour expliquer le comportement de tri cellulaire des cellules épithéliales avec adhésion au substrat. De plus, notre modèle prend en compte les différentes adhésions auxquelles sont soumises les cellules épithéliales. Cette observation de tri cellulaire a été récemment rapportée dans les épithéliums de la glande salivaire où l’épithélium stratifié est composé d’une couche épithéliale avec de fortes adhésions cellule–cellule entourée d’une couche épithéliale avec de fortes adhésions cellule–substrat, ce qui est essentiel pour initier la ramification dans la glande salivaire [26].
3. Conclusion
Dans ce travail, par une combinaison d’expériences et de modélisation in silico, nous montrons que les cellules épithéliales maintiennent leur comportement collectif et leur activité nématique par une coordination des contraintes intercellulaires et intracellulaires. Les contraintes intercellulaires sont médiées par les jonctions adherens, tandis que les contraintes intracellulaires sont médiées par des changements dans l’interaction avec le substrat et l’organisation de l’actomyosine. Ces différences d’activité nématique sont en mesure d’expliquer le tri des cellules et la ségrégation de populations cellulaires sur la base de différences dans leur activité nématique. La comparaison de nos observations de tri avec les études et hypothèses précédentes [24, 25] met en évidence des distinctions fondamentales qui apparaissent en prenant en compte la nature des forces actives. Ayant compris le rôle de l’extensivité et de la contractilité dans la ségrégation des cellules, cette approche pourrait être étendue à l’étude d’autres processus biologiques tels que la croissance, le développement et l’homéostasie des tissus. Par exemple, des études récentes ont démontré l’importance de l’organisation nématique du cytosquelette d’actine dans l’Hydre pendant la morphogenèse [12], tandis que d’autres études ont commencé à explorer le rôle de l’ordonnancement de type cristaux liquides pendant la morphogenèse [27] et la structuration des tissus épithéliaux in vivo [28]. Ces résultats soulignent l’importance des comportements nématiques actifs pour comprendre la forme et l’organisation des tissus, facteurs centraux de la morphogenèse.
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêt à déclarer.




 CC-BY 4.0
CC-BY 4.0