1. Introduction
The risks to public health associated with new and emerging viral infectious diseases are now well recognized. Zoonotic viruses with animal or/and arthropod reservoirs/vectors cause most of these diseases. Due to globalization, intercontinental travel, climate change and expansion of arthropod vectors the outbreaks of these diseases can happen anywhere. Furthermore, multiple biological agents have been classified by the Centers for Disease Control and Prevention (CDC), the national public health agency of the United States, as potential weapons of mass destruction or agents for biologic terrorism. Based on the ease of transmission, severity of morbidity, mortality, and likelihood of use, biological agents can be classified into three categories: category A, B and C. Category A are considered high-priority agents that pose the highest risk to national security because: (i) they can be easily disseminated or transmitted person-to-person; (ii) they result in high mortality rates and have the potential for major public health impact; (iii) they might cause public panic and social disruption; and (iv) they require special action for public health preparedness.
Biological agents classified as category A include smallpox, anthrax, plague, botulism, and tularemia, and viral hemorrhagic fevers (VHFs). VHFs comprise a group of diseases that are caused by several distinct viruses. These viruses, for the most part, are highly infectious and pathogenic, and relatively easy to produce. Agents of VHFs include arenaviruses (Lassa fever and other South American hemorrhagic fever viruses), nairoviruses (Crimean-Congo hemorrhagic fever virus (CCHFV)) and filoviruses (Ebola and Marburg viruses).
Regardless of their origin, these viruses share several common characteristics, i.e., they are all lipid-enveloped RNA viruses that naturally exist in animal or arthropod host populations. Humans are not the natural reservoir for any of them, outbreaks of hemorrhagic fevers occur irregularly and sporadically, and with few exceptions there is no specific treatment or vaccines available. These viruses are distributed according to where their host species lives, and thus, VHFs are usually geographically restricted to specific regions of the world where they are maintained in enzootic cycles, but under certain circumstances, they can emerge in different regions of the globe, as was recently demonstrated with the Ebola epidemic in West Africa in 2013. Additionally, when such viruses are imported, it is very unlikely that the concerned area can be considered safe even after the control of the initial outbreak, as they are likely to become endemic and to generate new cases, sometimes years after the apparent eradication [1, 2].
2. Eco-epidemiological aspects of tick-borne CCHFV- and nairovirus-induced diseases
Viruses causing these hemorrhagic fevers can be transmitted to humans through direct contact with animals or animal-infected fluids such as fecal matter, saliva and urine. However, some of the viruses (e.g. Ebola, Marburg, Lassa and CCHFV) may be transmited by close person-to-person contact, or through their body fluids or by contact with contaminated objects, which further complicates outbreak management. Finally, the viruses associated with arthropod vectors are more pernicious, as they can also be transmitted to humans via an arthropod bite.
Ticks transmit the most diverse array of infectious agents of any arthropod vectors. Abiotic and biotic factors can shape the ecology of ticks (population dynamics and geographic range) and have implications on the distribution patterns and incidences of tick-borne infections [3].
Orthonairovirus, a genus in the family Nairoviridae of the order Bunyavirales, includes over 41 viruses assigned to 15 groups/species and that are transmitted by ticks [4]. This genus has well-characterized virus members that are highly pathogenic to humans and animals, such as CCHFV, causing severe hemorrhagic fevers and frequently fatal disease in humans [5]. The disease was first characterized in Crimea in 1944 and given the name Crimean hemorrhagic fever. It was then recognized in 1969 as the cause of the disease in Congo that appeared in 1956, hence the current name of the disease. Other members of the Orthonairovirus genus include the Nairobi sheep disease virus (NSDV), which is responsible for lethal hemorrhagic gastroenteritis in small ruminants [6], as well as several viruses about which little is known, including the hosts in which they naturally circulate. Although clinically less significant, nairoviruses of different species including NSDV, Dugbe (DUGV), Erve (ERVEV), Kasokero (KASV), Tamdy (TAMV) have been associated with non-lethal diseases in humans [7]. New nairoviruses are continuously being reported [8, 9, 10, 11] and some have been associated with human disease, like as the Yezo virus isolated from patients with thrombocytopenia and leukopenia in Japan and China [11, 10].
The WHO R&D Blueprint recently ranked CCHFV as a high-priority pathogen as it can lead to epidemics, with a high case fatality rate (CRF) (10–40%) [12]. CCHFV is maintained in nature in a silent vertical and horizontal transmission cycle involving ticks as vectors and reservoirs, and a variety of hosts for the ticks [13]. CCHFV infection is usually asymptomatic in non-human hosts, implying that CCHFV can be present in areas without being noticed.
CCHFV worldwide distribution. Countries with one or more CCHFV strains are colored. Countries with serological evidence for CCHFV are colored in grey. Imported CCHF cases to non-endemic countries in Europe are indicated. Adapted from [14].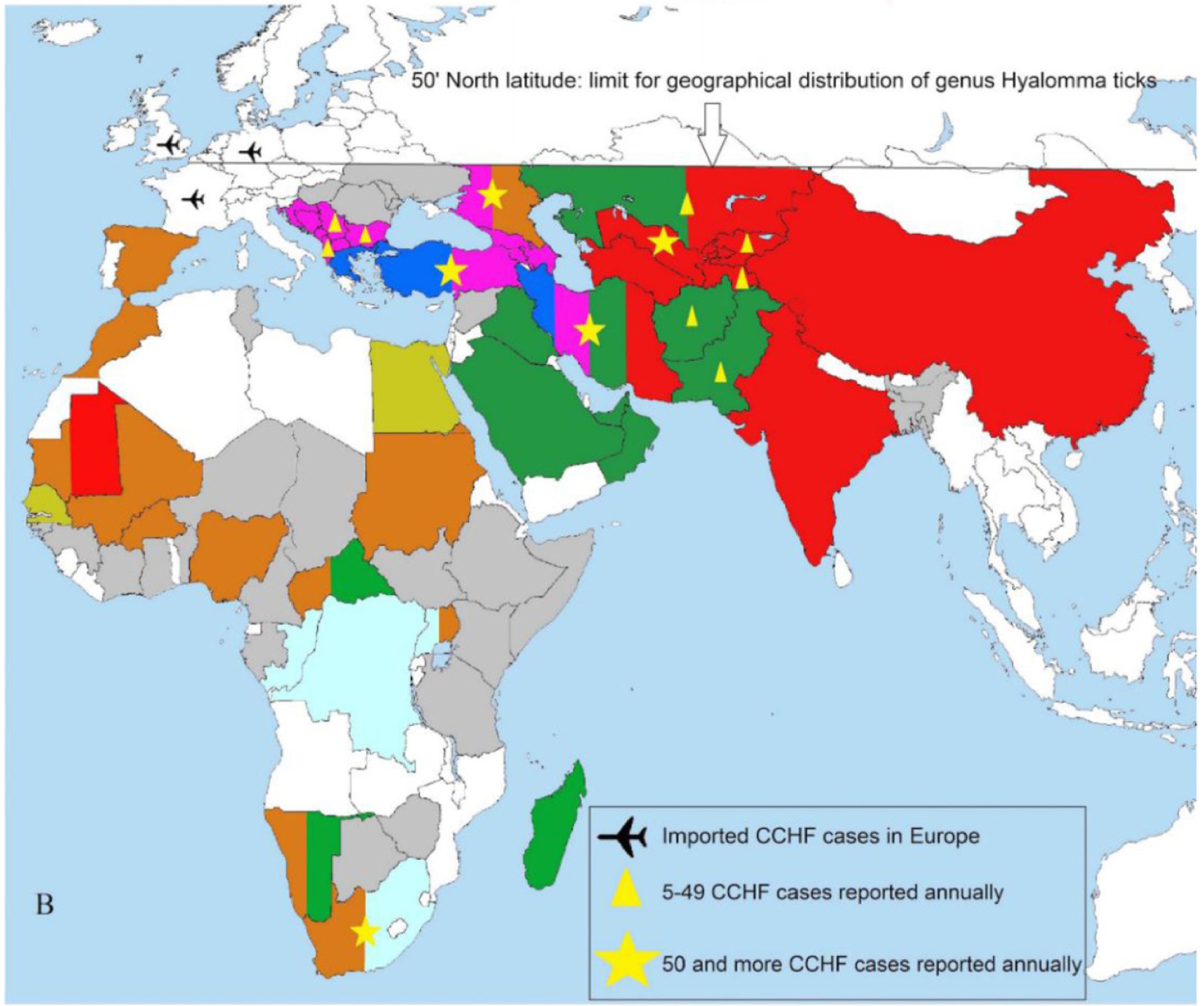
CCHFV is the most widespread tick-borne virus of medical importance with several thousands of human cases (Figure 1). CCHFV is widely spread around the world: Asia (Iran, Afghanistan, Pakistan, Iraq,United Arab Emirates, Kuwait, Oman, Saudi Arabia, China, Tajikistan, Uzbekistan, Kazakhstan, India) [15], Africa (South Africa, Egypt, Mauritania, Kenya, Sudan, Democratic Republic of Congo, Chad, Niger, Nigeria, Senegal, Uganda, Tanzania) [16], and Europe (Albania, Bulgaria, Turkey, Greece, Georgia, Russia, Kosovo, Spain) [17]. Until now, CCHF has never been reported in northern Europe, Australia or in the Americas. Its distribution mirrors the geographic distribution of its tick vectors and since 2000, the incidence and range of confirmed CCHF cases have markedly increased, probably due to the geographical expansion of Hyalomma spp. ticks. The main vector of CCHFV seems to be H. anatolicum in Near East and Middle East, H. asiaticum from Central Asia to China, H. rufipes in southern Russia and Africa and H. marginatum in the Balkans. Some other tick species from the genera Dermacentor, Boophilus, Amblyomma, Rhipicephalus, and Haemaphysalis have been found positive for CCHFV in the field, or experimentally infected, but there is little evidence for their involvement in the natural cycle of the virus. Contrary to other tick-borne virus, CCHFV is most likely maintained in the field by Hyalomma spp. and not in a vertebrate species. Indeed, transovarian, transstadial and sexual transmission has been described, together with cofeeding transmission, while no actual vertebrate reservoir has been identified so far. While many ticks choose to access their host by waiting for a long time on vegetation and hook on to their host’s hair when it gets in close contact, Hyalomma spp. prefers to actively hunt their host by moving towards it, sometimes for a distance of up to 100 m. They are found in a different habitat (generally in arid or semiarid lowland and middle altitude biotopes but also in more humid regions). Such vectors are absent from the American continent and Australia, which may explain the absence of detection of CCHFV in those locations so far. However, the presence of a competent vector cannot be completely ruled out. Hyalomma ticks (H. marginatum, lusitanicum, rufipes) are now present in western Europe including southern continental France [18], and in southwestern countries like Italy [19], Spain [20] and Portugal [21]. Infected ticks in Spain were first detected in 2010, and since 2013 eight autochthonous cases of CCHF have been reported and confirmed by molecular methods [22, 23], three of them with a fatal outcome.
3. Socio-economic impact of CCHF outbreaks and epidemic
Introduction of CCHFV in non-endemic areas can have negative effects on the national and international economy, which depends heavily on the control measures that may be applied following detection.
Due to the risk of human contamination from close contact with animal fluids, severe restrictive measures would have to be implemented. While CCHFV infection in ruminants is asymptomatic, physical contact with infected bodily fluids or blood can transmit the virus to humans. To minimize the risk of exposure would require extensive virological and serological monitoring to ensure the safety of people in contact with those animals. Breeders, slaughterhouse employees and veterinarians would be particularly exposed. Particularly, biological farming may put livestock at risk as such farming practice is often required to keep natural barriers and more green spaces which are suitable for small wildlife, which in turn is essential for the nymph stages of ticks. Thus, persistence of infections and human cases are more likely to occur around extensive and biological farming sites. CCHF is on the diseases list of OIE. Imports into the EU of live animals are prohibited from endemic areas if the animal tests positive for CCHFV (EU-regulation 206/2010). Before confirmation of CCHFV circulation, infections among Western European livestock or wildlife would certainly go unnoticed without consequences for animal welfare. However, when detected in livestock, (import) restrictions should be taken by other countries, resulting in economic losses. Other costs include eradication and surveillance costs including extra precautions on slaughterhouses. In the case of CCHF, human health is under threat, and more control measures that potentially seriously affect animal welfare would be taken.
4. CCHF impact on public health and absence of treatment
CCHF outbreaks constitute a threat to public health services. Not only would they have to manage an influx of patients, but also the risk of nosocomial infections of health care personnel and other patients, for a disease associated with a high CFR (10–40%) and for which there is no means of treatment or prevention. Those most at risk of contracting CCHFV infection are those with frequent contact with livestock, wildlife or those who are active in areas where ticks are present such as hunters and hikers [24]. CCHFV can also be transmitted to those who encounter infected animal products, such as slaughterhouse personnel, veterinarians and hunters.
The fact that the symptoms in humans are very unspecific and range from a mild flu-like illness to severe hemorrhagic fever, can contribute to delayed diagnosis and awareness of CCHF and result in ineffective development of contingency and emergency plans. The disease burden—defined as loss of QALY’s (quality adjusted life years)—is obviously very high for infected people. Though, the effect on society as a whole will depend on whether or not the infection was imported, or if the infection was contracted locally and on the severity of disease; more severe disease expression will likely result in more consequences. In addition, the people’s risk perception can be an important driver influencing their behavior and this in turn can negatively affect the economy. For example, people may avoid certain animal products, and restrict travelling to minimize the risk of contracting CCHFV, resulting in loss of tourist revenue.
There is currently no approved specific antiviral treatment and prophylaxis for CCHF. Treatment for CCHF is primarily supportive. The virus is sensitive in vitro to the antiviral drug ribavirin [25]. It has been used in the treatment of CCHF patients reportedly with some benefit [26], but the real effectiveness of this treatment remains widely debated today. Likewise, there is lack of approved vaccines against CCHFV. Investigated CCHF vaccine approaches included subunit antigen preparations, genetically modified plants, as well as DNA and viral vectors expressing CCHFV antigens, transcriptionally competent virus-like particles (VLPs), messenger RNA (mRNA) vaccine, and inactivated whole CCHFV particles [27]. CCHFV is genetically diverse and the concern is whether a single vaccine can protect against global CCHFV strains. Whilst studies on the immunogenicity of CCHFV vaccine candidates yielded interesting findings, results were often difficult to interpret as no well-defined immune correlate of protection is available.
5. Threats associated with CCHFV circulation
Although it is known that Iraq studied CCHFV as a potential biological weapon [28], there is no overt evidence that CCHFV and other agents of VHFs have been weaponized. Nevertheless, CCHFV can be potentially disseminated via aerosolization [29], it is therefore likely to be used for military or terrorist purposes.
The establishment of permanent natural focus of CCHFV in new areas depends on many complex variables including the presence and densities of both Hyalomma ticks and vertebrate hosts [13]. However, the continued spread of the tick vector and reservoir (Hyalomma species), has resulted in the virus becoming established in territories where it was not previously endemic; like its introduction to Turkey, Greece and, more recently, Spain. Thus, at least for these countries, the potential use of CCHFV as a biological agent would be difficult to distinguish from natural outbreaks. It also should be taken into account that Hyalomma ticks are also now present in southern continental France [18] and Italy [19]. Although, France and Italy have not yet reported human cases of CCHFV, high CCHFV seroprevalence has been reported in livestock in Corsica [30] and CCHFV RNA has been detected in a tick from a migratory bird in Italy [31]. Importantly, both countries were estimated to be at medium risk for introduction and exposure to CCHFV [32].
It is also conceivable that CCHFV could have already been introduced and is silently circulating in ticks and vertebrate hosts in countries that are currently considered CCHF free, as the tick-animal-tick cycle usually goes unnoticed and the infection in domestic animals is usually not apparent, underscoring the strong need to implement large-scale epidemiologic studies and continuous monitoring of CCHFV infection in these countries. Indeed, in accordance with an European Centre for Disease Prevention and Control (ECDC)-initiated assessment on the importance of vector-borne diseases in 2008, CCHF has been identified as a priority disease for the EU [33].
Independently of the level of CCHFV endemicity, airborne transmission of CCHF should be considered as a real risk, particularly during aerosol-generating medical procedures when treating patients with autochthonous or travel-acquired CCHFV [34]. CCHF spread from person to person may cause nosocomial outbreaks with a high CFR. From 1953 to 2016, 158 published cases of CCHFV nosocomial infection were found in 20 countries in Africa, Asia and Europe. Almost all cases were symptomatic (92.4%), with an overall CFR of 32.4% [35]. Nosocomial CCHFV infections usually occur in hospital settings, and healthcare workers (HCWs) are mainly affected with percutaneous contact being identified as the primary transmission route [35]. Thus, during the care and treatment of patients with CCHF, standard contact precautions, barrier precautions and airborne preventive measures should be applied. The risk is magnified by the fact that large populations are susceptible to CCHFV and only limited treatment and vaccination strategies exist.
Disease surveillance systems should be implemented in France to detect potential threat of CCHFV infection to human health. Likewise, public health programs and health care providers should be prepared for this potentially devastating impact on public health.
Finally, CCHFV can be encountered in multiple theaters of operation where French militaries are deployed (Figure 1). In 2009, a lethal case of CCHFV was acquired by a US soldier in Afghanistan, resulting in the nosocomial transmission to two health care providers [36]. The week before the onset, the patient was exposed to frequent outdoors activities, tick bites and undercooked goat meat and blood. This fatal case illustrates the risks associated with CCHFV infections.
6. General aspects of CCHFV life cycle
CCHFV is enveloped and roughly spherical, and the viral genome consists of three single-stranded RNA segments (L, M, and S) of negative or ambisense polarity (Figure 2). The RNA segments exclusively replicate in the cytosol and encode up to five non-structural proteins and four structural proteins, namely the RNA-dependent RNA polymerase, the nucleoprotein NP, and two envelope glycoproteins (GPs), Gc and Gn. The viral GPs are generated by proteolytic cleavage of a precursor polyprotein by host SPases and proprotein convertases (Figure 2). Besides their roles in virion assembly, the virus GPs are also responsible for the attachment of viral particles to the surface of host cells and their subsequent penetration into the cytosol. CCHFV relies on clathrin-mediated endocytosis pathway for entry and penetrates the cytosol from the multivesicular body [37, 38]. Gc is suspected to be responsible for binding to the cellular receptors, because monoclonal antibodies targeting Gc can neutralize infection of mammalian cells [39], and also is responsible for acid-activated membrane fusion.
Structure of the CCHFV virion. The virion is spherical and between 80 and 100 nm in diameter. Its lipid envelope is composed of spicules corresponding to the glycoproteins Gn and Gc. The virion contains three single-stranded RNA segments (S, L and M), encapsidated by NP and L protein.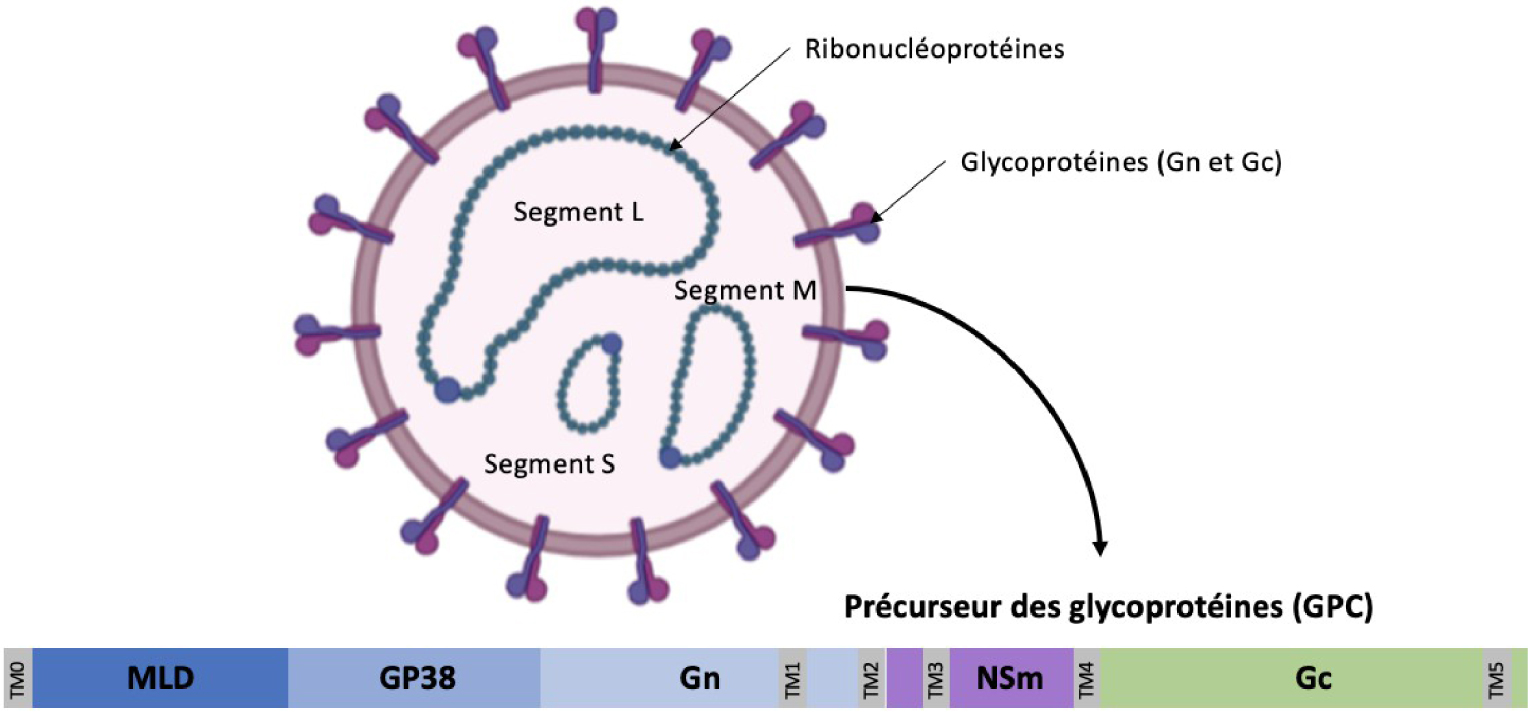
Currently, cellular receptors, co-factors, and pathways used by CCHFV to enter host cells remain largely unidentified and uncharacterized. The human C-type lectin DC-SIGN, HSPGs and the nuclear factor Nucleolin have been proposed to allow CCHFV entry [40, 41]. It is however apparent that HSPG and DC-SIGN lectin do not seem to act as bona fide receptors as the cells lacking either of the two remain sensitive to infection, underlining the fact that CCHFV can use other receptors—not to mention that the virus can infect a wide spectrum of tissues, most of which do not express DC-SIGN.
Furthermore, it is currently unknown whether CCHFV exploits one conserved receptor versus alternative entry pathways between humans and other mammalian and tick hosts. There are clear differences in the spreading mechanisms between human and bovine cells infected with CCHFV with a direct impact on cell pathology [42], though it remains to be investigated if these differences are linked to cell biology of virus–receptor mediated interactions.
7. Reverse genetics systems for CCHFV
Fundamental research on CCHFV has been limited, in part due to the need for high security laboratories and extensive security measures. The recently developed reverse genetics systems that mimic CCHFV life cycle and produce VLPs that resemble authentic virions in protein composition and morphology have allowed the study of many aspects of the viral replication cycle, cell tropism and neutralizing activity of antibodies without the requirement of special laboratories [43, 44, 39, 45]. CCHF VLPs are generated by transfection with a reporter minigenome (GFP, Renilla or NanoLuc luciferase) devoid of any viral gene that replaces the virus tripartite genome and three helper plasmids expressing CCHFV structural proteins. The minigenome is flanked by the 5′ and 3′ non-coding regions that are sufficient to initiate viral transcription, replication and encapsidation by the virus nucleocapsid protein (NP) and RNA polymerase (L). Interactions between NP- and L-associated minigenome RNA molecules and virus GPs drive incorporation of these RNPs into nascent VLPs and budding.
More recently, another reverse genetics system has been developed to generate single-cycle infectious CCHF virus-like replicon particles (VRP) [46]. The method for producing VRPs is based on the reverse genetics system previously described for CCHFV strain IbAr10200 [47] that allows recovery of infectious wild type or recombinant viruses from cloned complementary cDNA of the complete S, M and L segments cloned between a T7 promoter and HDV ribozyme (HDR). The striking difference consists in replacing the plasmid containing the full-length M genome segment (pT7-M) with a plasmid that encodes only the M segment ORF and expresses CCHFV GPs. The absence of the M segment in VRP particles limits their replication to a single cycle. CCHF VRPs has been tested successfully as a vaccine candidate in mice lacking type I interferon receptor (IFNAR−∕−) [46].
8. Animal models for CCHF
While capable of infecting a large number of animal species, CCHFV infections, are generally asymptomatic, regardless of often inducing a detectable viremia that can last for more than five days. Signs of disease and lethality are only observed in humans and in newborn mice and rats following intracranial or intraperitoneal inoculation of the virus, and therefore, newborn rodents were the first animal models used for the study of CCHF disease [48, 49]. Though, newborn animal models are typically not representative of disease progression in adult animals or in humans and more importantly, they do not predict immunotherapeutic protection behavior in adult rodents.
STAT-1 and IFNAR−∕− knockout mice have both been used as lethal models of CCHF disease [50, 51, 52] and proven to be useful models for the study of CCHFV pathogenesis and pre-clinical testing of CCHFV vaccines and therapeutics. STAT-1 deficiency prevents the upregulation of genes due to a signal by either type I or type II interferons, whereas the genetic defect of IFNAR−∕− mice specifically affects the interferon type I signaling. Both models show characteristics of human disease such as early spikes in viremia in the blood, elevated liver enzymes, histopathological lesions in the liver and lymphocyte depletion in the spleen. As IFN-I signaling is important for the generation of mature antigen-presenting cells, driving T cell and subsequent B cell responses, as well as promoting the generation of memory T and B cell pools, these immunocompromised mice may not represent ideal models for testing vaccines and completely understand the immunological basis of protection against CCHFV.
To overcome some of these limitations a new murine model that allows dynamic control of IFN-I signaling has been developed. It relies on utilization of an antibody against IFN-I receptor A (MAR1-5A3) to transiently block IFN-I resulting in consistent lethal/severe CCHF disease upon infection. This system allows vaccination in an immune intact animal before exposure to virus and lessens the impact that IFN-I disruption may have on secondary immune responses following challenge [53, 54].
In addition to conventional mouse models, humanized NOD/SCID mice depleted of mouse hematopoietic stem cells, with human CD34 + hematopoietic stem cells and engineered to express human stem cell factor (SCF), human granulocyte/ macrophage-colony-stimulating factor 2 (GM-CSF) and human interleukin-3 (IL-3) have been developed [55]. These humanized mice, termed Hu-NSG™-SGM3, developed most severe histopathological changes in the brain and are considered a model for addressing cellular and molecular factors involved in CCHF neurological disease.
Recently, a cynomolgus macaque severe disease model was described that establishes the first immunocompetent animal model for CCHF [56], to study pathogenic disease mechanisms and evaluate candidate medical countermeasures. Two CCHFV strains have been tested and compared in this model [57]. CCHFV-infected animals demonstrated signs of clinical illness, viremia, significant changes in clinical chemistry and hematology values, and serum cytokine profiles consistent with CCHF disease in humans though, mortality was not a constant.
9. Targeting viral entry as a strategy for antivirals
Virus–host receptor interactions are key regulators of viral transmission and crucial determinants of virus host range, tissue tropism and pathogenesis. Delivery of the viral genome inside the host cell is the earliest stage for any viral infection, and involves several successive steps, each one being amenable to therapeutic intervention. At this stage, enveloped viruses such as CCHFV first bind to specific surface receptors of the target cell membrane, followed by internalization and fusion of the viral envelope with an endosomal membrane. Thus, these two steps (receptor engagement and membrane fusion) are primary targets. The viral proteins involved in membrane fusion belong to three structural classes: I, II and III. The Gc protein of the Nairoviridae is considered a class II protein, with Gn as the companion protein. This class of proteins, which probably derive from a common ancestor, present strong structural analogies (presence of three domains: DI, DII and DIII) and share the same fusion mechanism. Thus, the Gn and Gc GPs form a heterodimer at the surface of the virion membrane, in a metastable state called the prefusion conformation. In this model, the fusion loops are buried prior to activation, presumably at the interface between Gn and Gc. After binding to the receptor via one or more regions of the heterodimer not yet identified, dissociation of this heterodimer is observed followed by activation of the fusion protein induced by the decrease of pH in the endosome in which the virus has been internalized. The Gc protein then adopts a transient conformation characterized by its extension, the exposure of the fusion loop and its insertion into the host cell membrane. Trimerization of the protein is observed and then the Gc trimers undergo a further conformational change resulting in a hairpin conformation. During this process, domain III of the homotrimer folds onto a central axis consisting of domains I and II with the three fusion loops at their ends, forcing the base of Gc closer to the fusion loops. Several homotrimers, formed in a ring, are involved in this phenomenon and ultimately allow the approach and fusion of the host and virus membranes (Figure 3).
Fusion model for a class II protein. The three domains of the fusion protein are shown in the following colors: domain I in red, domain II in yellow, and domain III in blue. The fusion loop is represented by the green stars (A). Following receptor recognition (B), the companion protein separates from the fusion protein, which undergoes several important conformational changes. First, it extends towards the cell membrane, exposing the fusion loop and allowing its insertion into the membrane (C). Then trimerization of the fusion proteins occurs and domain III folds onto the central axis formed by domains I and II (D). The complete folding allows the apposition of the membranes of the target cell and the virus, leading to their fusion (E).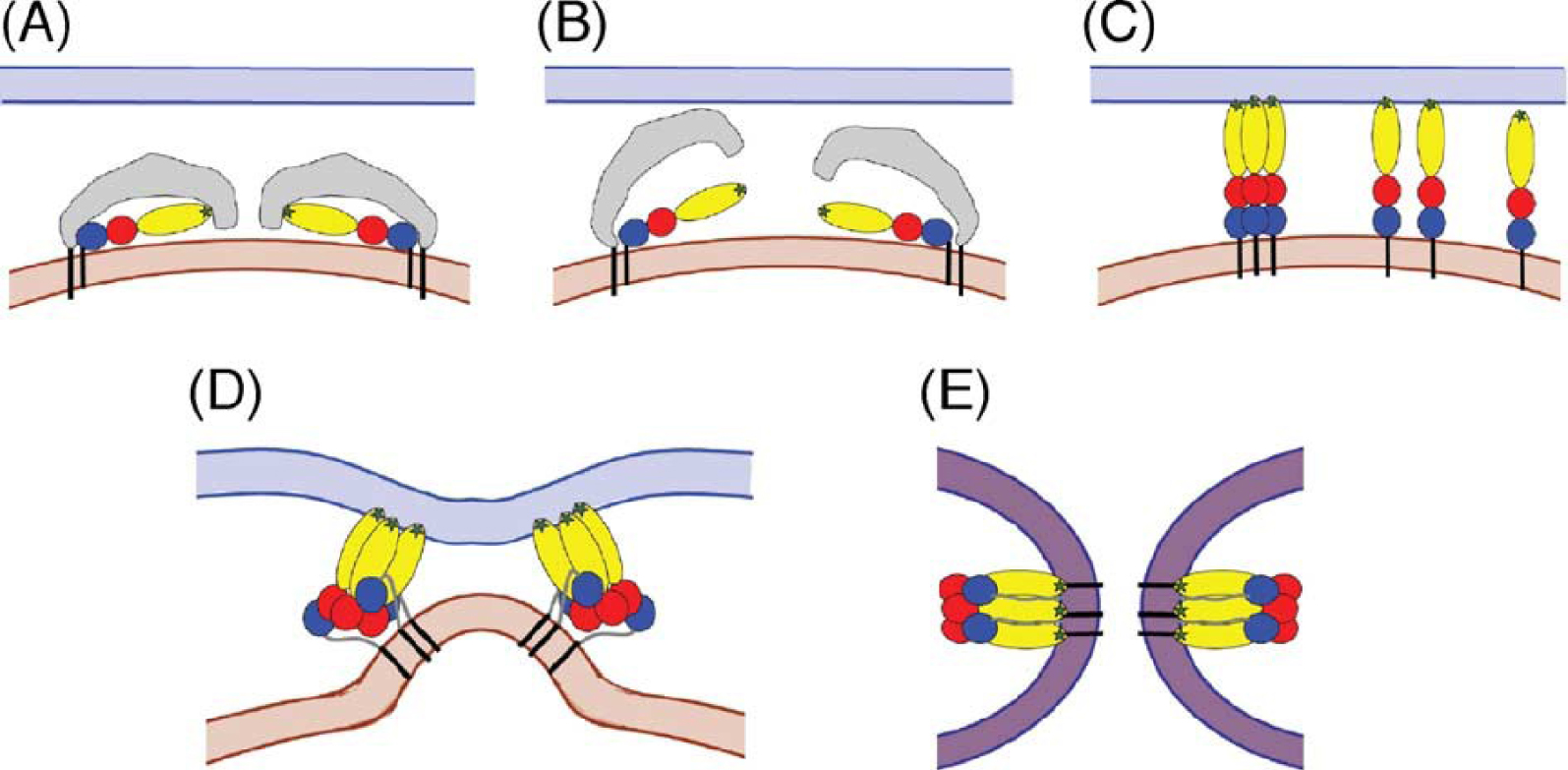
It has recently been shown that potently neutralizing antibodies isolated from convalescent patients [58] indeed act by blocking membrane fusion for entry. These antibodies act by both blocking the insertion of fusion loops into the membrane, but also by preventing homotrimer formation [59]. These antibodies point to sites of vulnerability on CCHFV glycoprotein Gc that can be targeted.
Finally, a virus-specific receptor for CCHFV has not been identified so far. The fact that CCHFV successfully spreads through various cell types suggests that the GPs may engage different cellular receptors depending on the cell type and/or host or, alternatively, may use an ubiquitously-expressed receptor. At the molecular level, CCHFV-receptor interactions likely determine the virus entry pathway, which could occur through distinct routes in different cells. The lack of identification of this receptor is a major obstacle to the study of this virus and to the development of specific therapeutics to inhibit viral entry. Indeed, the identification of the receptor would allow to target, in addition to the fusion mechanism, the receptor–viral glycoprotein interaction. Given that viral entry is a critical step for viral infection, inhibition of viral entry by targeting host- or virus-related components is considered as an attractive strategy to prevent and treat CCHFV infections.
10. Conclusions and perspectives
CCHF is a perfect example of emerging/re-emerging infectious diseases, which represent a major threat to public health, biodiversity, and global economy. Despite increasingly frequent outbreaks of the CCHFV occurring every year, little fundamental knowledge exists about the biology of this dangerous zoonotic virus. Although the enzootic tick-vertebrate-tick cycle of orthonairoviruses is documented, the manner by which they propagate across continents and the factors governing their marked zoonotic behaviour are not understood. The molecular and cell biological aspects of their life cycle have also been poorly studied.
It is mandatory to attempt breaching these knowledge gaps by (i) identifying known and novel pathogenic orthonairoviruses in bats or other mammals and ticks from different habitats, including areas where these viruses circulate, (ii) characterizing orthonairovirus diversity, incidence and prevalence in mammalian reservoirs and in vector tick species, (iii) identifying ecological and evolutionary factors facilitating viral circulation in species populations and assemblages to assess their potential for breaking the species barriers and spill over into humans and (iv) dissecting cell entry determinants by a comprehensive molecular, structural and cell biological approach to understand in detail the interactions with cell entry receptors and subsequent membrane fusion step in endosomes. Such a comprehensive approach will raise the level of knowledge on these pathogens and will provide targets for anti-nairoviral treatments as well as identify vulnerable sites on nairoviral particles that can be targeted by protecting antibodies.
Conflicts of interest
Authors have no conflict of interest to declare.
French version
1. Introduction
Les risques pour la santé publique associés aux maladies infectieuses virales nouvelles et émergentes sont désormais bien reconnus. La plupart de ces maladies sont causées par des virus zoonotiques dont les réservoirs/vecteurs sont des animaux et/ou des arthropodes. En raison de la mondialisation, des voyages intercontinentaux, du changement climatique, de l’expansion des arthropodes vecteurs, des épidémies liées à ces maladies sont susceptibles de survenir plus fréquemment et dans des régions où on ne les avait jamais vues. Par ailleurs, de multiples agents biologiques ont été classés par les Centers for Disease Control and Prevention (CDC), l’agence nationale de santé publique des États-Unis, comme armes potentielles de destruction massive ou agents de terrorisme biologique. Sur la base de la facilité de transmission, de la gravité de la morbidité, de la mortalité et de la probabilité d’utilisation, les agents biologiques peuvent être classés en 3 catégories : A, B et C. Les agents de la catégorie A sont considérés comme des agents hautement prioritaires qui présentent le risque le plus élevé pour la sécurité nationale car (1) ils peuvent être facilement disséminés ou transmis de personne à personne ; (2) ils entraînent des taux de mortalité élevés et peuvent avoir un impact majeur sur la santé publique ; (3) ils peuvent provoquer une panique publique et des perturbations sociales importantes ; et (4) ils exigent une action spéciale pour la préparation des mesures de la santé publique.
Les agents biologiques classés dans la catégorie A comprennent la variole, l’anthrax, la peste, le botulisme, la tularémie et les fièvres hémorragiques virales (FHV). Les FHV comprennent un groupe de maladies causées par plusieurs virus distincts. Ces virus, pour la plupart, sont hautement infectieux et pathogènes, et relativement faciles à cultiver. Les agents des FHV comprennent des arénavirus (fièvre de Lassa et autres virus de fièvre hémorragique sud-américaine (FHS)), des nairovirus (virus de la fièvre hémorragique de Crimée-Congo (CCHFV)) et les filovirus (virus Ebola et Marburg).
Quelle que soit leur origine, ces virus ont plusieurs caractéristiques communes, à savoir qu’ils sont tous des virus à ARN enveloppés qui existent naturellement dans les populations hôtes animales ou arthropodes. L’homme n’est en effet le réservoir naturel d’aucun d’entre eux ; aussi, les épidémies de fièvres hémorragiques surviennent de manière irrégulière et sporadique et, à quelques exceptions près, il n’existe aucun traitement ou vaccin spécifique. Ces virus sont distribués en fonction du lieu où vit leur espèce hôte. Ainsi, les FHV sont généralement limitées géographiquement à des régions spécifiques du monde où elles sont maintenues dans des cycles enzootiques. Dans certaines circonstances, elles peuvent émerger dans différentes régions du globe, comme cela a été récemment démontré avec les épidémies d’Ebola en Afrique de l’Ouest en 2013. En outre, lorsque ces virus sont importés, il est très peu probable que la zone concernée puisse être considérée comme sûre, même après le contrôle de l’épidémie initiale, car ils sont susceptibles de devenir endémiques et de générer de nouveaux cas, parfois des années après leur éradication apparente [1, 2].
2. Eco-épidémiologie des maladies causées par le CCHFV et les nairovirus, transmises par les tiques
Les virus à l’origine de ces fièvres hémorragiques peuvent être transmis à l’homme par contact direct avec des animaux ou des fluides infectés par des animaux, tels que les matières fécales, la salive et l’urine. Cependant, certains des virus (par exemple, les virus Ebola, Marburg, Lassa et de la fièvre hémorragique de Crimée-Congo) peuvent se transmettre par un contact étroit de personne à personne, ou par l’intermédiaire de leurs fluides corporels ou d’un contact avec des objets contaminés, ce qui complique encore la gestion des épidémies. Enfin, les virus associés aux arthropodes vecteurs sont plus pernicieux, car ils peuvent également être transmis à l’homme par une piqûre d’arthropode.
Parmi tous les arthropodes vecteurs, ce sont les tiques qui transmettent la gamme d’agents infectieux la plus diversifiée. Des facteurs abiotiques et biotiques peuvent façonner l’écologie des tiques (dynamique des populations et aire de répartition géographique) et avoir des répercussions sur les schémas de distribution ainsi que sur l’incidence des infections transmises par les tiques [3].
Le genre Orthonairovirus appartient à la famille des Nairoviridae de l’ordre des Bunyavirales et comprend plus de 41 virus affectés à 15 groupes/espèces, tous transmis par les tiques [4]. Ce genre compte certains membres bien caractérisés, hautement pathogènes pour l’homme et les animaux, tels que le virus de la fièvre hémorragique de Crimée-Congo (CCHFV). Ce virus provoque en effet une grave fièvre hémorragique, la fièvre hémorragique de Crimée-Congo (FHCC) associée à un taux de mortalité élevé [5]. La maladie a été caractérisée pour la première fois en Crimée en 1944 et a reçu le nom de fièvre hémorragique de Crimée. Elle a ensuite été reconnue en 1969 comme la cause de la maladie au Congo apparue en 1956, d’où le nom actuel de la maladie. Un autre nairovirus, le virus de la maladie du mouton de Nairobi (NSDV), est responsable d’une gastro-entérite hémorragique mortelle chez les petits ruminants [6]. Bien que cliniquement moins importants, des nairovirus de différentes espèces, dont les virus NSDV, Dugbe (DUGV), Erve (ERVEV), Kasokero (KASV), Tamdy (TAMV), ont été associés à des maladies chez l’homme, bien que les signes cliniques associés soient moins sévères que ceux retrouvés suite à une infection par le CCHFV [7]. Par ailleurs, de nouveaux nairovirus sont continuellement signalés [8, 9, 10, 11], certains étant associés à des maladies humaines, comme le virus Yezo isolé chez des patients atteints de thrombocytopénie et de leucopénie au Japon et en Chine [11, 10].
Le plan directeur de l’OMS pour la recherche et le développement a récemment classé le CCHFV comme un agent pathogène hautement prioritaire, car il peut entraîner des épidémies, avec un taux de létalité élevé (10 à 40%) [12]. Le CCHFV se maintient dans la nature dans un cycle de transmission vertical et horizontal silencieux impliquant les tiques comme vecteurs et réservoirs, avec une grande variété d’hôtes pour les tiques [13]. L’infection par le CCHFV est généralement asymptomatique chez les hôtes non humains, ce qui implique que le CCHFV peut être présent dans des régions sans être remarqué.
Distribution mondiale du CCHFV. Les pays ayant déclaré une ou plusieurs souches du CCHFV sont colorés. Les pays présentant des preuves sérologiques de la présence du CCHFV sont indiqués en gris. Les cas de FHCC importés dans des pays européens non endémiques sont indiqués. Adapté de [14].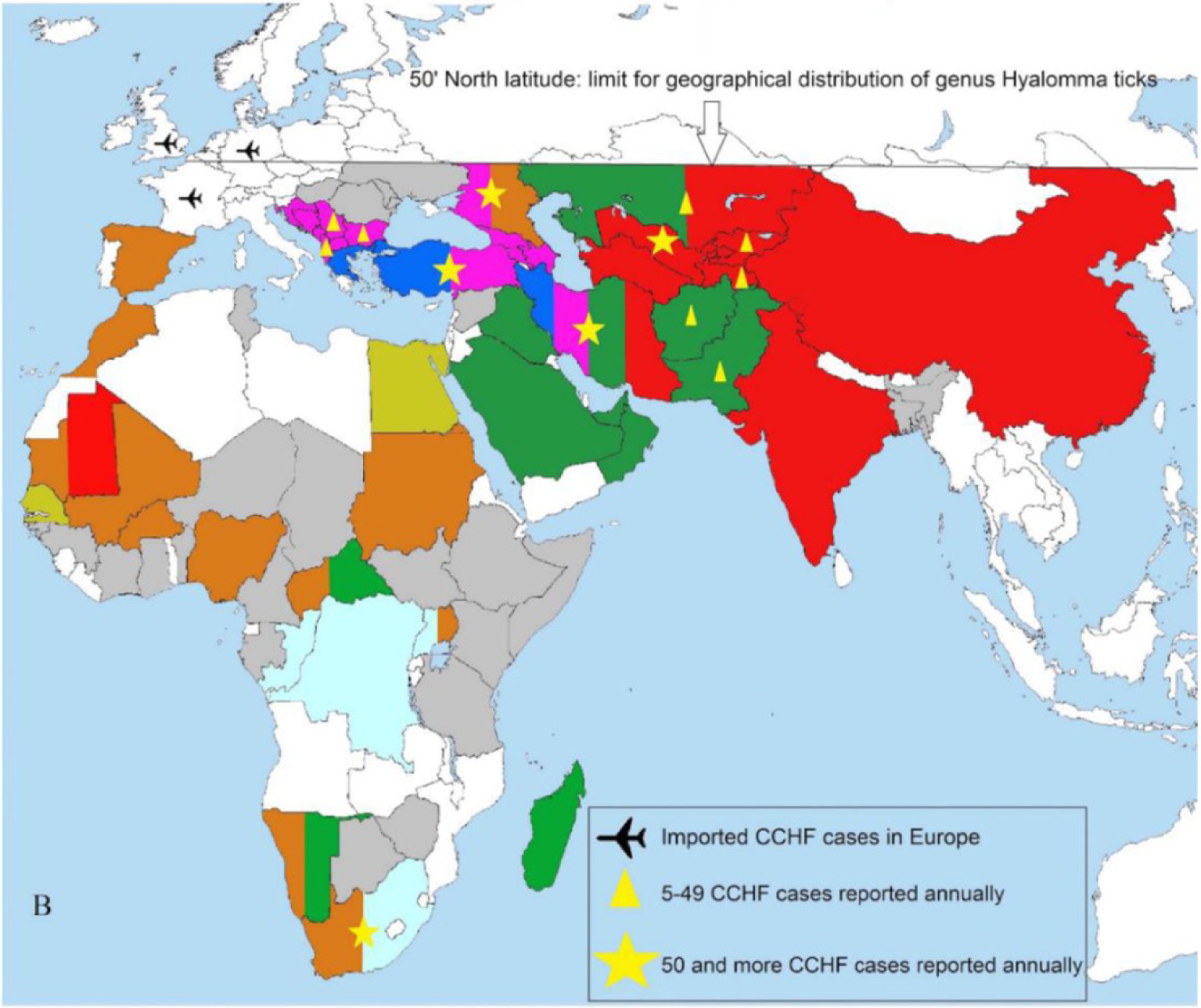
Le CCHFV est le virus transmis par les tiques qui combine à la fois la plus grande aire de répartition et l’importance médicale la plus élevée, avec plusieurs milliers de cas humains (Figure 1). En effet, le CCHFV est largement répandu dans le monde : Asie (Iran, Afghanistan, Pakistan, Iraq, Émirats arabes unis, Koweït, Oman, Arabie saoudite, Chine, Tadjikistan, Ouzbékistan, Kazakhstan, Inde) [15], en Afrique (Afrique du Sud, Égypte, Mauritanie, Kenya, Soudan, République démocratique du Congo, Tchad, Niger, Nigeria, Sénégal, Ouganda, Tanzanie) [16], et en Europe (Albanie, Bulgarie, Turquie, Grèce, Géorgie, Russie, Kosovo, Espagne). Jusqu’à présent, la FHCC n’a jamais été signalée en Europe du Nord, en Australie ou sur le continent américain. Sa distribution se superpose à la distribution géographique de ses tiques vectrices. Depuis 2000, on observe une augmentation de l’incidence et de l’extension géographique des cas confirmés de FHCC, probablement en raison de l’expansion géographique des tiques Hyalomma spp. Les principaux vecteurs du virus semblent être H. anatolicum au Proche-Orient et au Moyen-Orient, H. asiaticum de l’Asie centrale à la Chine, H. rufipes dans le sud de la Russie et en Afrique et H. marginatum dans les Balkans. D’autres espèces de tiques des genres Dermacentor, Boophilus, Amblyomma, Rhipicephalus et Haemaphysalis ont été trouvées positives pour le CCHFV sur le terrain ou après infection expérimentale, mais il y a peu de preuves de leur implication dans le cycle naturel du virus. Contrairement à d’autres virus transmis par les tiques, le CCHFV est très probablement maintenu sur le terrain par Hyalomma spp. et non par une espèce vertébrée. En effet, la transmission transovarienne, trans-stadienne et sexuelle a été décrite, ainsi que la transmission par coalimentation, alors qu’aucun réservoir vertébré réel n’a été identifié jusqu’à présent. Alors que de nombreuses tiques choisissent d’accéder à leur hôte en attendant longtemps sur la végétation et en s’accrochant aux poils de leur hôte lorsqu’elles entrent en contact étroit, Hyalomma spp. préfère chasser activement son hôte en se déplaçant activement vers lui, parfois sur une distance allant jusqu’à 100 m. On les trouve dans un habitat différent (généralement dans des biotopes arides ou semi-arides de basse et moyenne altitude mais aussi dans des régions plus humides). De tels vecteurs sont absents du continent américain et de l’Australie, ce qui peut expliquer l’absence de détection du CCHFV dans ces endroits jusqu’à présent. Cependant, la présence d’un vecteur compétent ne peut être totalement exclue. Les tiques Hyalomma (H. marginatum, lusitanicum, rufipes) sont maintenant présentes en Europe occidentale, y compris dans le sud de la France continentale [18], et dans les pays du sud-ouest comme l’Italie [19], l’Espagne [20] et le Portugal [21]. En Espagne, les tiques infectées ont été détectées pour la première fois en 2010 et, depuis 2013, ce sont huit cas autochtones de FHCC qui ont été signalés et confirmés par des méthodes moléculaires [22, 23], parmi lesquels trois ont connu une issue fatale.
3. Impact socio-économique des foyers et des épidémies de FHCC
L’introduction du CCHFV dans des zones non endémiques peut avoir des effets négatifs sur l’économie nationale et internationale, en raison principalement des mesures de contrôle qui peuvent être appliquées après la détection.
En raison du risque de contamination humaine par contact étroit avec des fluides animaux infectés, des mesures de restriction sévères devraient être mises en œuvre. Bien que l’infection par le CCHFV chez les ruminants soit asymptomatique, le contact physique avec des fluides corporels ou du sang infectés représente un risque avéré de transmission du virus à l’homme. Pour minimiser le risque d’exposition, il faudrait mettre en place une surveillance virologique et sérologique approfondie afin de garantir la sécurité des personnes en contact avec ces animaux. Les éleveurs, les employés des abattoirs et les vétérinaires seraient particulièrement exposés. En particulier, l’élevage en plein air se verrait confronté à des difficultés de gestion importante car les animaux élevés dans ce mode d’élevage sont les plus susceptibles d’être en contact avec des tiques infectées. Ainsi, l’un des premiers secteurs qui seraient touchés serait sans doute l’élevage. En effet, la FHCC figure sur la liste des maladies répertoriées par l’OIE. Les importations dans l’UE d’animaux vivants sont interdites à partir des zones endémiques si l’animal est testé positif pour le CCHFV (règlement de l’UE 206/2010). La reconnaissance de la maladie sur notre territoire entraînerait immédiatement la mise en place de restrictions (barrières à l’export notamment) par les pays partenaires, ce qui entraînerait des pertes économiques très importantes. Les autres coûts comprennent les mesures d’éradication et de surveillance, y compris la mise en place de procédures visant à renforcer la sécurité des personnels dans les abattoirs. Dans le cas de la FHCC, la santé humaine étant menacée, des mesures de contrôle supplémentaires, susceptibles d’affecter gravement le bien-être des animaux, seraient prises.
4. Impact de la FHCC et de l’absence de traitement sur la santé publique
Les épidémies de FHCC constituent une menace importante pour les services de santé publique. Non seulement ceux-ci devraient gérer à la fois un afflux de malades mais également les risques d’infections nosocomiales du personnel de santé et des autres patients, pour une maladie associée à un taux de létalité élevé (10–40%) et pour laquelle il n’existe pas de moyens de traitement ou de prévention. Les personnes les plus à risque de contracter une infection par le CCHFV sont celles qui ont des contacts fréquents avec le bétail, les animaux sauvages ou celles qui sont actives dans des zones où les tiques sont présentes, comme les chasseurs et les randonneurs [24]. Le CCHFV peut également être transmis aux personnes qui travaillent en contact avec des tissus animaux, comme le personnel des abattoirs, les éleveurs, les vétérinaires et les chasseurs.
Le fait que les symptômes chez l’homme soient très peu spécifiques, allant d’un léger syndrome grippal à une fièvre hémorragique sévère, peut contribuer à retarder le diagnostic de la FHCC et entraîner un développement inefficace des plans d’urgence et de secours. L’impact médical de la maladie — défini comme la perte de QALY (années de vie en bonne santé) — est évidemment très élevé pour les personnes infectées. Cependant, l’effet sur la société dans son ensemble dépendra essentiellement de l’origine de l’infection. Si les seules formes déclarées en France sont des cas importés, l’impact sera limité. En revanche, s’il est démontré que l’infection a été contractée sur le territoire national, l’impact sera beaucoup plus important, à plus forte raison si la maladie entraîne un nombre important de cas graves. En outre, la perception du risque par les gens peut être un facteur important influençant leur comportement et, à son tour, avoir un effet négatif sur l’économie. Les consommateurs pourront ainsi choisir d’éviter certains produits d’origine animale et limiter les voyages afin de minimiser le risque de contracter le CCHFV, ce qui entraînera une perte de revenus touristiques supplémentaire.
Il n’existe actuellement aucun traitement antiviral ou prophylactique spécifique approuvé pour la FHCC. Le traitement de la FHCC est principalement un traitement de support. Le virus est sensible in vitro à la ribavirine, un médicament antiviral [25]. Ce médicament a été utilisé dans le traitement de patients atteints de FHCC, parfois avec un certain bénéfice [26], mais l’efficacité réelle de ce traitement reste aujourd’hui largement débattue. De même, il n’existe pas de vaccins approuvés contre le CCHFV. Les approches vaccinales étudiées contre la FHCC comprennent des préparations d’antigènes sous-unitaires, des virus génétiquement modifiés, ainsi que des vecteurs ADN et viraux exprimant les antigènes du CCHFV, des particules pseudovirales (VLP) transcriptionnellement compétentes, des vaccins à ARN messager (ARNm) et des particules entières inactivées du CCHFV [27]. Le CCHFV étant génétiquement diversifié, une question importante est de savoir si un seul vaccin pourra protéger contre toutes les souches du CCHFV retrouvées dans le monde. Bien que les études sur l’immunogénicité des candidats vaccins contre le CCHFV aient donné des résultats intéressants, ceux-ci sont souvent difficiles à interpréter car il n’existe encore pas de corrélat de protection immunitaire bien défini pour cette maladie.
5. Menaces associées à la circulation du CCHFV
Bien que l’on sache que l’Irak a étudié le virus de la FHCC comme une arme biologique potentielle [28], il n’existe aucune preuve manifeste que le CCHFV a été ou puisse être utilisé comme arme. Néanmoins, le CCHFV peut potentiellement être disséminé par aérosolisation [29], il est donc susceptible d’être utilisé à des fins militaires ou terroristes.
L’établissement d’un foyer naturel permanent du CCHFV dans de nouvelles zones dépend de nombreuses variables complexes, notamment la présence et les densités de tiques Hyalomma et d’hôtes vertébrés [13]. Cependant, la propagation continue de la tique vecteur et réservoir (espèce Hyalomma) a permis au virus de s’établir dans des territoires où il n’était pas endémique auparavant, comme nous le montre son introduction en Turquie, en Grèce et, plus récemment, en Espagne. Ainsi, au moins pour ces pays, l’utilisation potentielle du CCHFV comme agent biologique serait difficile à distinguer des foyers naturels. Il faut également tenir compte du fait que les tiques Hyalomma sont désormais également présentes dans le sud de la France continentale [18] et en Italie [19]. Bien que la France et l’Italie n’aient pas encore signalé de cas humains de CCHFV, une séroprévalence élevée du CCHFV a été signalée chez le bétail en Corse [30] et l’ARN du CCHFV a été détecté dans une tique provenant d’un oiseau migrateur en Italie [31]. Il est important de noter que les deux pays ont été estimés à un risque moyen d’introduction et d’exposition au CCHFV [32].
Il est par ailleurs concevable que le CCHFV ait déjà été introduit et circule silencieusement dans les tiques et les hôtes vertébrés dans des pays qui sont actuellement considérés comme exempts de CCHFV, car le cycle tique-animal-tique passe généralement inaperçu et l’infection des animaux domestiques n’est pas apparente, ce qui souligne la forte nécessité de mettre en œuvre des études épidémiologiques à grande échelle et une surveillance continue de l’infection par le CCHFV dans ces pays. En effet, conformément à une évaluation initiée par l’ECDC sur l’importance des maladies à transmission vectorielle en 2008, la FHCC a été identifiée comme une maladie prioritaire pour l’UE [33].
Indépendamment du niveau d’endémicité du CCHFV, la transmission aérienne du CCHFV doit être considérée comme un risque réel, en particulier lors de procédures médicales générant des aérosols lors du traitement de patients atteints du CCHFV autochtone ou acquis lors de voyages. La propagation du CCHFV d’une personne à l’autre peut provoquer des épidémies nosocomiales avec un taux de létalité élevé. De 1953 à 2016, 158 cas publiés d’infection nosocomiale par le CCHFV dans 20 pays d’Afrique, d’Asie et d’Europe ont été décrits. Presque tous les cas étaient symptomatiques (92,4%), avec un taux de létalité global de 32,4%. Les infections nosocomiales à CCHFV surviennent généralement en milieu hospitalier, et les travailleurs de la santé sont les premiers touchés, le contact percutané étant identifié comme la principale voie de transmission. Ainsi, pendant les soins et le traitement des patients atteints de FHCC, il convient d’appliquer des procédures drastiques permettant de limiter les risques de transmission par voie aérienne. Le risque est amplifié par le fait que la quasi-totalité de la population est sensible au CCHFV et que seules des stratégies limitées de traitement et de vaccination sont disponibles.
Des systèmes de surveillance de la maladie devront être mis en place en France pour détecter la menace potentielle de l’infection par le CCHFVC pour la santé humaine. De même, les programmes de santé publique et les prestataires de soins de santé doivent être préparés à cet impact potentiellement dévastateur sur la santé publique.
Enfin, le CCHFV peut être rencontré sur les multiples théâtres d’opérations où sont déployés les militaires français (Figure 1). Par exemple, en 2009, un cas mortel de CCHFV a été acquis par un soldat américain en Afghanistan, entraînant la transmission nosocomiale à 2 soignants. La semaine précédant l’apparition du virus, le patient avait été exposé à des activités fréquentes en plein air, à des morsures de tiques et à de la viande et du sang de chèvre insuffisamment cuits. Ce cas mortel illustre les risques associés aux infections par le CCHFV dans le contexte d’opérations militaires.
6. Aspects généraux du cycle viral du CCHFV
Le CCHFV est enveloppé et grossièrement sphérique, son génome viral consiste en trois segments d’ARN monocaténaires (L, M et S) de polarité négative ou ambisens (Figure 2). Les segments d’ARN se répliquent exclusivement dans le cytosol et codent jusqu’à cinq protéines non structurales et quatre protéines structurales, à savoir l’ARN polymérase ARN-dépendante, la nucléoprotéine NP et deux glycoprotéines (GP) d’enveloppe, Gc et Gn. Les GP virales sont générées par le clivage protéolytique d’une polyprotéine précurseur par des signalases (SPases) et des proprotéines convertases de l’hôte (Figure 2). Outre leur rôle dans l’assemblage des virions, les GP virales sont également responsables de l’attachement des virions à la surface des cellules hôtes et de leur pénétration ultérieure dans le cytosol. Le CCHFV utilise la voie de l’endocytose médiée par la clathrine pour entrer dans la cellule et pénètre dans le cytosol à partir du corps multivésiculaire [37, 38]. La protéine Gc est soupçonnée d’être responsable de la liaison aux récepteurs cellulaires, car les anticorps monoclonaux ciblant Gc peuvent neutraliser l’infection des cellules de mammifères [39], et elle est également responsable de la fusion membranaire, qui est déclenchée par une baisse de pH.
Structure du virion du CCHFV. Le virion est sphérique et fait entre 80 et 100 nm de diamètre. Son enveloppe lipidique est composée de spicules correspondant aux glycoprotéines Gn et Gc. Le virion contient trois segments d’ARN monocaténaires (S, L et M), encapsidés par la NP et la protéine L.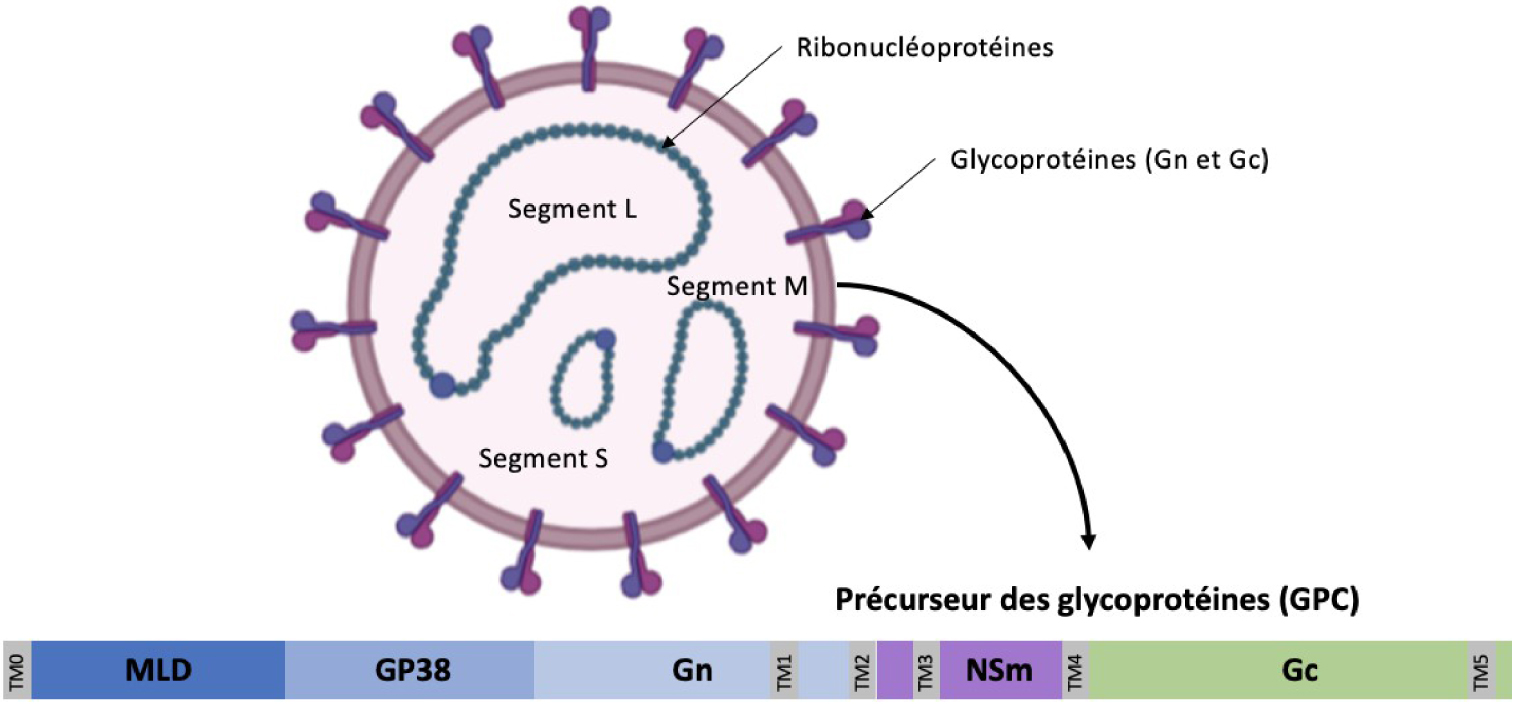
À l’heure actuelle, les récepteurs cellulaires, les cofacteurs et les voies utilisées par le CCHFV pour pénétrer dans les cellules hôtes restent largement non identifiés et non caractérisés. La lectine humaine de type C (DC-SIGN), les protéoglycanes à héparane sulfates (HSPG) et le facteur nucléaire Nucléoline ont été proposés pour permettre l’entrée du CCHFV [40, 41]. Il est cependant évident que les lectines HSPG et DC-SIGN ne semblent pas agir comme de véritables récepteurs, car les cellules qui en sont dépourvues restent sensibles à l’infection (voir les données préliminaires), ce qui indique que le CCHFV peut utiliser d’autres récepteurs, sans compter que le virus peut infecter un large éventail de tissus, dont la plupart n’expriment pas DC-SIGN. En outre, on ignore actuellement si le CCHFV exploite un récepteur unique (conservé) ou des voies d’entrée alternatives entre l’homme, les autres mammifères et les tiques. Il existe de nettes différences dans les mécanismes de propagation entre les cellules humaines et bovines infectées par le CCHFV, avec un impact direct sur la pathologie cellulaire [42], mais il reste à déterminer si ces différences sont liées à la biologie cellulaire des interactions virus–récepteur.
7. Systèmes de génétique inverse pour le CCHFV
La recherche fondamentale sur le CCHFV a été limitée, notamment en raison de la nécessité de disposer de laboratoires de haute sécurité et de mesures de sécurité étendues. Les systèmes de génétique inverse récemment mis au point, qui imitent le cycle de vie du virus et produisent des particules virales de type « virus-like particle » (VLP) ressemblant aux virions authentiques par leur composition protéique et leur morphologie, ont permis d’étudier de nombreux aspects du cycle de réplication virale, du tropisme cellulaire et de l’activité neutralisante des anticorps sans nécessiter de laboratoires spéciaux [43, 44, 39, 45]. Les VLPs du CCHF sont générées par transfection avec un minigénome rapporteur (GFP, Renilla ou NanoLuc luciférase) dépourvu de tout gène viral et remplaçant le génome tripartite du virus, et avec trois plasmides auxiliaires exprimant les protéines structurales du CCHFV. Le minigénome est flanqué des régions non codantes 5′ et 3′ qui sont suffisantes pour initier la transcription, la réplication et l’encapsidation virales par la protéine de nucléocapside (NP) et l’ARN polymérase (L) du virus. Les interactions entre les molécules d’ARN du minigénome associées à NP et L, et les glycoprotéines du virus entraînent l’incorporation de ces RNPs dans les VLPs naissantes et leur bourgeonnement.
Plus récemment, un autre système de génétique inverse a été mis au point pour générer des particules CCHFV de type « réplicon » (VRP), capables de se répliquer en un cycle unique [46]. La méthode de production des VRPs est basée sur le système de génétique inverse précédemment décrit pour la souche IbAr10200 du CCHFV [47], qui permet de récupérer des virus infectieux de type sauvage ou recombinant à partir de l’ADNc complémentaire cloné des segments S, M et L entiers, clonés entre un promoteur T7 et un ribozyme du virus de l’hépatite Delta (HDV). La différence avec le système infectieux est que la production de VRPs consiste à remplacer le plasmide contenant le segment M complet du génome (pT7-M) par un plasmide auxiliaire qui ne code que pour l’ORF du segment M et ainsi exprime les GPs du CCHFV. L’absence du segment M dans les particules VRP limite ainsi leur réplication à un seul cycle. Les VRPs du CCHFV ont été testés avec succès comme candidat vaccin chez des souris dépourvues de récepteur d’interféron de type I (IFNAR−∕−) [46].
8. Modèles animaux pour la FHCC
Bien qu’elles soient capables d’infecter un grand nombre d’espèces animales, les infections par le CCHFV sont généralement asymptomatiques, même si elles induisent souvent une virémie détectable qui peut durer plus de 5 jours. Les signes de maladie et de létalité ne sont observés que chez l’homme ainsi que chez les souris et rats nouveau-nés après inoculation intracrânienne ou intrapéritonéale du virus. Aussi, les rongeurs nouveau-nés ont donc été les premiers modèles animaux utilisés pour l’étude de la maladie de la FHCC [48, 49]. Cependant, ces modèles animaux nouveau-nés ne sont généralement pas représentatifs de l’évolution de la maladie chez des animaux adultes ou chez l’homme et, surtout, ils ne permettent pas d’évaluer des méthodes de protection par immunothérapie comme dans le cas de rongeurs adultes.
Les souris STAT-1 et IFNAR−∕− knockout ont toutes deux été utilisées comme modèles de la maladie [50, 51, 52] et se sont révélées être des modèles utiles pour l’étude de la pathogenèse de la FHCC, de tests précliniques de candidats vaccins ou de traitements contre la FHCC. La déficience de STAT-1 empêche l’effet des interférons de type I ou II, tandis que le défaut génétique des souris IFNAR−∕− affecte spécifiquement la signalisation de l’interféron de type I. Les deux modèles présentent certaines caractéristiques de la maladie humaine telles que des pics précoces de virémie dans le sang, des enzymes hépatiques élevées, des lésions histopathologiques dans le foie et une déplétion lymphocytaire dans la rate. Comme la signalisation de l’IFN-I est importante pour la génération de cellules présentatrices d’antigènes, la régulation des réponses des lymphocytes T et des lymphocytes B, ainsi que la génération de pools de lymphocytes T et B mémoires, ces souris immunodéprimées ne représentent pas des modèles idéaux pour tester les vaccins et comprendre les bases immunologiques de la protection contre le CCHFV.
Pour surmonter certaines de ces limitations, un nouveau modèle murin permettant un contrôle de la signalisation de l’IFN-I a été développé. Il repose sur l’utilisation d’un anticorps contre le récepteur A de l’IFN-I (MAR1-5A3) capable de bloquer transitoirement l’IFN-I, ce qui entraîne une maladie létale/sévère de la FHCC lors de l’infection. Ce système permet, par exemple, l’étude de la vaccination d’un animal immuno-compétent avant son exposition au virus et réduit l’impact que la perturbation de l’IFN-I peut avoir sur les réponses immunitaires secondaires après l’infection [53, 54].
Outre les modèles de souris classiques, des souris NOD/SCID, dépourvues de cellules souches hématopoïétiques, humanisées avec des cellules souches hématopoïétiques humaines et modifiées pour exprimer le facteur des cellules souches (SCF) humain, le facteur 2 de stimulation des colonies de granulocytes/macrophages (GM-CSF) humain et l’interleukine-3 (IL-3) humaine ont été développées [55]. Ces souris humanisées, appelées Hu-NSG™-SGM3, développent des altérations histopathologiques sévères dans le cerveau et sont considérées comme un modèle de choix pour étudier les facteurs cellulaires et moléculaires impliqués dans la maladie neurologique de la FHCC.
Récemment, un modèle de macaque cynomolgus a été décrit, établissant ainsi le premier véritable modèle animal immunocompétent pour la FHCC [56], permettant d’étudier les mécanismes de pathogenèse de la FHCC et d’évaluer des contre-mesures médicales. Deux souches de CCHFV ont été testées et comparées dans ce modèle [57]. Les animaux infectés par le CCHFV ont montré des signes cliniques de la maladie, une virémie, des changements significatifs dans les paramètres biochimiques et hématologiques, et des profils de cytokines sériques cohérents avec la maladie chez l’homme, bien que la mortalité n’ait pas été une constante.
9. Cibler l’entrée virale comme stratégie pour les antiviraux contre la FHCC
Les interactions entre le virus et les récepteurs de l’hôte sont des régulateurs clés de la transmission virale et des déterminants cruciaux du spectre d’hôtes du virus, du tropisme tissulaire et de la pathogenèse. L’entrée du génome viral à l’intérieur de la cellule hôte est l’étape la plus précoce de toute infection virale. Elle comprend plusieurs étapes successives, chacune d’entre elles pouvant faire l’objet d’une stratégie thérapeutique. Les virus enveloppés tels que le CCHFV se lient d’abord à des récepteurs de surface spécifiques de la membrane de la cellule cible, puis l’enveloppe virale fusionne avec une membrane de la cellule hôte. Ainsi, ces deux étapes (engagement du récepteur et fusion des membranes) constituent des cibles de choix. Les protéines virales à l’origine de la fusion des membranes appartiennent à 3 classes structurales : I, II et III. La protéine Gc des Nairoviridae est considérée comme une protéine de classe II, Gn étant la protéine accompagnatrice. Cette classe de protéines, qui dérivent vraisemblablement d’un ancêtre commun, présentent de fortes homologies structurales (présence de 3 domaines : DI, DII et DIII) et partagent le même mécanisme de fusion. Ainsi, les glycoprotéines Gn et Gc forment un hétérodimère à la surface de la membrane du virion, en état métastable appelé conformation de préfusion. Dans ce modèle, les boucles de fusion sont enfouies avant leur activation, vraisemblablement à l’interface entre Gn et Gc. Après fixation au récepteur via une ou plusieurs régions de l’hétérodimère non identifiées à ce jour, on observe une dissociation de cet hétérodimère puis une activation de la protéine de fusion induite par la diminution du pH dans l’endosome dans lequel le virus a été internalisé. La protéine Gc adopte alors une conformation transitoire caractérisée par son extension, l’exposition de la boucle de fusion puis son insertion dans la membrane de la cellule hôte. On observe une trimérisation de la protéine puis les trimères de Gc subissent un nouveau changement de conformation aboutissant à une conformation en épingle à cheveux. Pendant ce processus, le domaine III de l’homotrimère se replie sur un axe central constitué par les domaines I et II avec les trois boucles de fusion à leur extrémité, ce qui force le rapprochement de la base de Gc avec les boucles de fusion. Plusieurs homotrimères, formés en anneau, sont impliqués dans ce phénomène et permettent in fine le rapprochement et la fusion des membranes de l’hôte et du virus (Figure 3).
Modèle de fusion pour une protéine de classe II. Les trois domaines de la protéine de fusion sont présentés selon les couleurs suivantes : Domaine I en rouge, domaine II en jaune et domaine III en bleu. La boucle de fusion est représentée par les étoiles vertes (A). Suite à la reconnaissance du récepteur (B), la protéine accompagnatrice se sépare de la protéine de fusion, qui subit plusieurs changements de conformation importants. Dans un premier temps, elle présente une extension en direction de la membrane cellulaire, ce qui expose la boucle de fusion et permet son insertion dans la membrane (C). Puis il y a trimérisation des protéines de fusion et le domaine III se replie sur l’axe central formé par les domaines I et II (D). Le repliement complet permet l’apposition des membranes de la cellule cible et du virus, aboutissant à leur fusion (E).
Il a été récemment montré que de puissants anticorps neutralisants isolés chez des patients convalescents [58] agissent en bloquant la fusion membranaire lors de l’entrée. Ces anticorps agissent en bloquant à la fois l’insertion des boucles de fusion dans la membrane, mais aussi en empêchant la formation de l’homotrimère [59]. Ces anticorps désignent ainsi des sites de vulnérabilité sur la glycoprotéine Gc du CCHFV qui peuvent dès lors être ciblés.
Enfin, jusqu’à ce jour, aucun récepteur spécifique du virus n’a été identifié pour le CCHFV. Le fait que le CCHFV se propage avec succès sur différents types de cellules suggère que les glycoprotéines virales (GPs) peuvent engager différents récepteurs cellulaires selon le type de cellule et/ou l’hôte ou, alternativement, utiliser un récepteur exprimé de manière ubiquitaire. Au niveau moléculaire, les interactions entre le CCHFV et les récepteurs déterminent la voie d’entrée du virus, qui pourrait ainsi utiliser des voies distinctes selon les types cellulaires. L’absence d’identification de ce récepteur est un frein majeur à l’étude de ce virus et à la mise au point de thérapeutiques spécifiques permettant d’inhiber l’entrée virale. En effet, l’identification du récepteur permettrait de cibler, en plus du mécanisme de fusion, l’interaction récepteur–glycoprotéines virales. Étant donné que l’entrée virale est une étape critique de l’infection virale, l’inhibition de l’entrée virale en ciblant des composants liés à l’hôte ou au virus est considérée comme une stratégie intéressante pour prévenir et traiter les infections par le CCHFV.
10. Conclusions et perspectives
La FHCC est un parfait exemple de maladies infectieuses émergentes/ré-émergentes qui représentent une menace majeure pour la santé publique, la biodiversité et l’économie mondiale. Malgré l’apparition chaque année de foyers de plus en plus fréquents de la FHCC, il existe peu de connaissances fondamentales sur la biologie de ce dangereux virus zoonotique. Bien que le cycle enzootique tique-vertébré-tique des orthonairovirus soit documenté, la manière dont ils se propagent à travers les continents et les facteurs régissant leur comportement zoonotique marqué ne sont pas compris. Les aspects de biologie moléculaire et cellulaire de leur cycle de vie ont également été peu étudiés.
Il est impératif de tenter de combler ces lacunes dans les connaissances en (i) identifiant les orthonairovirus pathogènes connus et nouveaux chez les chauves-souris ou d’autres mammifères et chez les tiques de différents habitats, y compris dans les zones où ces virus circulent, (ii) caractérisant la diversité, l’incidence et la prévalence des orthonairovirus dans les réservoirs mammaliens et chez les espèces de tiques vectrices, (iii) identifiant les facteurs écologiques et évolutifs qui facilitent la circulation virale dans les populations et les assemblages d’espèces afin d’évaluer leur potentiel à franchir les barrières d’espèces et à se propager chez l’homme et (iv) disséquant les déterminants de l’entrée dans la cellule par une approche globale de biologie moléculaire, structurelle et cellulaire afin de comprendre en détail les interactions avec les récepteurs d’entrée dans la cellule et l’étape ultérieure de fusion membranaire dans les endosomes. Une telle approche globale permettra d’élever le niveau de connaissance sur ces agents pathogènes et fournira des cibles pour des traitements anti-nairoviraux. Elle permettra également d’identifier les sites vulnérables sur les particules nairovirales qui peuvent être ciblés par des anticorps protecteurs.
Conflit d’intérêt
Les auteurs n’ont aucun conflit d’intérêt à déclarer.




 CC-BY 4.0
CC-BY 4.0