La version française de l’article est disponible à la suite de la version anglaise
1. Introduction
Endocytosis allows eukaryotic cells to internalize substances from their environment. The different known pathways of endocytosis are based on the initial formation of an invagination of the plasma membrane. This invagination progressively evolves into a vesicle or tubule that buds into the cytosol, transporting internalized cargoes to intracellular compartments, in particular endosomes. Invaginations vary in size, shape and dynamics depending on the molecular machinery involved in their formation. This diversity also reflects the considerable variation in nature, composition and size of the endocytic substances. However, under certain conditions, the process leading to the formation and stabilization of invaginations can be halted and even reversed, thus aborting the internalization process. The formation and maturation of invaginations are tightly regulated processes that require energy to overcome the resistance of the plasma membrane to deformation. Many parameters such as membrane tension, internal hydrostatic pressure or properties of the cargo to be internalized can make the plasma membrane more difficult to bend. Thus, successful endocytosis depends on a balance of forces, some promoting membrane deformation and others opposing it.
Clathrin-dependent endocytosis (CDE) is probably the most studied and best understood pathway of endocytosis. The small invaginations of the plasma membrane associated with EDC were first identified in 1964 and are commonly referred to as clathrin-coated pits (CCPs) [1]. Clathrin is the major component of the protein coat that assembles on the cytosolic side of the plasma membrane [2]. This coat is thus composed of clathrin, but also of numerous adapters and regulators, and generates forces that bend the plasma membrane to form an invagination and then a vesicle (Figure 1). Concomitantly with its action on membrane bending, the clathrin coat recruits surface receptors and their ligands, packing them into the forming endocytosis vesicles. Cargoes internalized into these vesicles are then transported to the endosomal system from where they can be recycled to the cell surface or addressed to lysosomes for degradation.
Schematic representation of normal and frustrated clathrin-coated structures dynamics.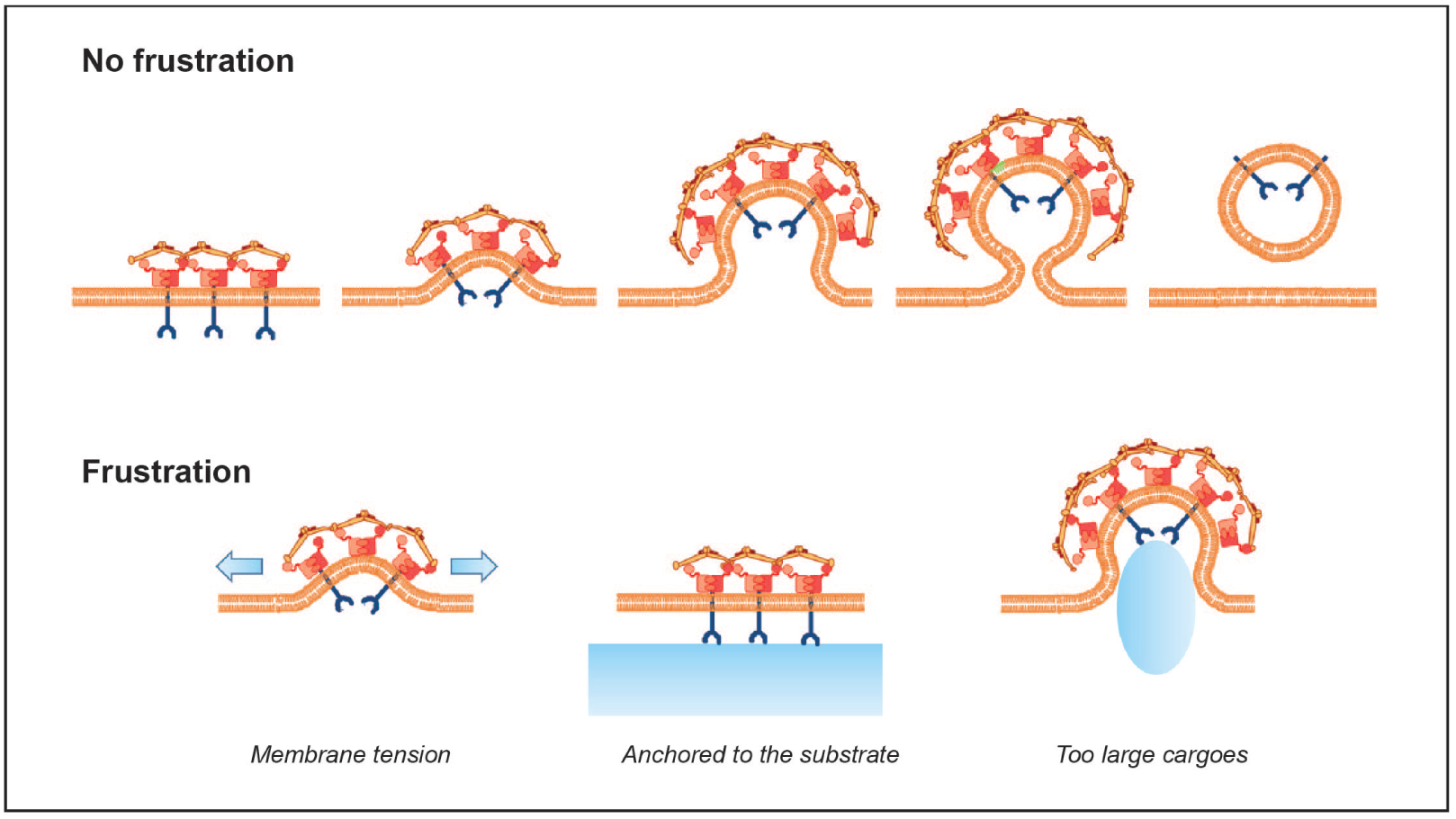
The canonical role of PRCs in the regulation of endocytosis is central to cell homeostasis as it controls nutrient acquisition, plasma membrane composition but also the signaling activity of surface receptors. However, many observations show that the ability of CRPs to bend the membrane and bud can be disrupted. Indeed, several environmental factors have been described as preventing or slowing down membrane invagination in CRPs. This state of frustrated endocytosis is not necessarily deleterious for the cell because it allows it to acquire information about its environment and to perform specific functions. We propose that frustrated EDC is an integral part of the homeostatic response and can help the cell adapt to changing environmental conditions. Here, we first provide a historical perspective and definition of frustrated endocytosis. We then describe the different causes as well as the functional consequences of frustrated endocytosis in physiological and pathological conditions.
2. Definition of frustrated endocytosis
We consider frustrated endocytosis as the consequence of a mechanical constraint that prevents internalization by an otherwise perfectly adapted endocytosis structure. This definition excludes any type of perturbation affecting a priori the molecular or chemical composition, and thus the functions, of the endocytosis machinery considered. Frustrated endocytosis thus results from a mechanical obstruction preventing membrane invagination and/or scission of this invagination. The endocytic structures can be temporarily or permanently frustrated. Frustration can also be local or global.
The first reported example of frustrated endocytosis is the result of experimental perturbations to unravel the mechanisms of phagocytosis. Phagocytosis is dedicated to the internalization of large solid particles, such as bacteria, which are coated with factors that trigger the formation of a phagocytic cup, the phagocytosis-specific invagination. In pioneering work, the authors coated glass coverslips with these phagocytosis triggers [3, 4]. Because the glass coverslip is far too large to be phagocytized by a cell, the result is the formation of a stable phagocytic cup that spreads over the glass in an attempt to internalize it. This experimental condition actually reflects pathological situations in which phagocytes cannot internalize extracellular particles that are too large, such as long structures composed of carbon nanotubes [5] or amyloid fibers [6]. The resulting incomplete phagocytosis leads to the secretion of toxic compounds that damage neighboring healthy tissues and trigger a detrimental inflammatory response [7, 8]. In contrast, frustration of other endocytosis pathways may play a role in homeostasis. Caveolae are small invaginations of the plasma membrane that regulate the endocytosis of various cargoes [9, 10]. Yet, at equilibrium, caveolae maintain themselves in a stable invaginated state, without vesicle generation [10]. Caveolae are also known to regulate plasma membrane tension by flattening into the membrane to buffer a sudden increase in tension [11]. Conversely, reduction in plasma membrane tension causes them to assemble and may promote their budding [10]. Thus, caveolae are potentially constitutively frustrated structures at equilibrium, whose dynamics are modulated by perturbations in membrane tension. Finally, CRPs are also subject to frustration. It is very likely that frustration accounts for much of the wide range of dynamic behavior encountered among populations of clathrin-coated structures. Indeed, the average lifespan of PRCs, i.e. the time required to form a vesicle from the initial recruitment of the clathrin coat, is highly variable from one cell type to another. This lifetime can also vary within the same cell depending on subcellular location, substrate composition, or cell cycle progression. In addition to CRPs, many cell types have large clathrin assemblies that remain flat and have very long lifetimes. These particular structures have been called clathrin-coated plaques (hereafter referred to as plaques). They actually represent an extreme example of frustrated EDC.
3. Mechanisms of frustrated endocytosis in the clathrin pathway
The dynamics of CRPs and the sequence of events leading to vesicle formation have been extensively studied. The clathrin and adaptor coat exerts forces that bend the membrane inward into the cell to form an invagination (Figure 1). The stiffness and bending tension of the plasma membrane, as well as the cell turgor pressure, in turn oppose membrane deformation. Membrane stiffness depends on its chemical composition, which is known to vary during the life of the cell [12]. However, to date, no link has been established between changes in membrane lipid composition and potential frustration of CRPs. Resistance to plasma membrane deformation can also be increased by adhesion of the actin cortex to the lipid bilayer [13]. A rigid actin cortex has been linked to blockage of endocytosis in Drosophila [14]. In mammalian cells, the factors contributing to frustrating EDC are primarily membrane tension as well as the nature of the cargos to be internalized (Figure 1).
3.1. Plasma membrane tension
EDC is known to be particularly sensitive to membrane tension. Experimentally increasing membrane tension by hypotonic shock completely blocks the dynamics of CRPs [15]. This reflects the difficulty that the clathrin coat has in deforming the membrane when the voltage is elevated [16, 17, 18]. Membrane tension can be perturbed by many physiological or pathological factors. During mitosis, increased osmotic pressure causes rounding of the cell [19] leading to an increase in membrane tension that negatively impacts the EDC [20, 21]. Membrane tension is also likely to be increased systemically in cells subjected to compressive forces as in cancers [22] or in asthmatic patients [23]. Such compressive forces have been shown to block the dynamics of CRPs in vitro [15, 24], most likely due to the elevation of membrane tension.
Local variations in membrane tension can also modulate the dynamics of PRCs. Indeed, membrane tension is not homogeneous across the plasma membrane [25] and in migrating mesenchymal cells, tension is higher at the front than at the back of the cells [26, 27, 28]. Thus, it has been shown that CRPs have a longer lifespan at the front than at the back of the cell [29]. These observations may explain why clathrin-coated structures tend to accumulate at the front of migrating cells [30, 31]. Polarized epithelial cells also exhibit membrane tension asymmetry, and the lifespan of CRPs is longer on the apical side, where tension is greatest, than on the basolateral side [32].
3.2. Cargo properties
The second major cause of EDC frustration lies in the properties of cargoes intended to be internalized by PRCs. Cargo refers to receptors or other proteins on the cell surface that are capable of binding clathrin and its adapters for recruitment and internalization by PRCs. It is most often the mechanical properties, shape or size of the object to which these cargoes bind that represent a limitation for the endocytosis process. Cargoes play an active role in the maturation and life span of PRCs. For example, overexpression of the transferrin receptor reduces the occurrence of abortive PRCs (PRCs disassembling without forming vesicles), and helps them progress through the sequential steps of EDC [33]. Thus, different cargos recruit different sets of adapters and this impacts the lifespan of the PRCs [34, 35]. Cargoes may also modulate the composition and/or activity of the clathrin machinery, but this will not be discussed here because it is outside our definition of frustrated endocytosis.
PRCs also control the internalization of viruses, bacteria and nanoparticles. These objects often reach a large size that makes EDC more difficult. Indeed, there is a relationship between the size of the cargo and the time required to complete its endocytosis [36, 37]. Thus, the larger a cargo, the longer it takes for a CRP to internalize it. Bacteria are much larger than the average 100 nm diameters of CRPs [38]. Nevertheless, Listeria monocytogenes, Escherichia coli, and other bacteria have been shown to recruit a clathrin coat to their cell entry sites [39, 40, 41]. Some bacteria use clathrin structures as a pedestal to organize the actin cytoskeleton into a structure for their internalization [39, 41]. The shape of the object also plays a role. For example, it takes twice as long for a PRCs to internalize vesicular stomatitis virus due to its asymmetric bullet-shaped morphology (180 nm by 70 nm) [42, 43]. Similarly, the endocytosis efficiency of opsonized nanoparticles also depends on their shape [44].
One of the most common causes of frustration is when the clathrin machinery is anchored to the substrate via adhesion receptors. The substrate can then be viewed as cargo that cannot be internalized. For example, nonspecific attachment of the plasma membrane to a glass slide opsonized with concanavalin A completely blocks CRPs [45]. It is likely that strong adhesion to a large, inflexible substrate prevents the clathrin coat from bending the membrane. Many adhesion receptors such as certain integrins accumulate at the CRPs. A population of CRPs localized near focal adhesions and rich in β1 integrin has an increased lifespan compared with CRPs located in other areas of the plasma membrane [45]. When cells are placed on extracellular matrix (ECM)-coated glass that engages integrin β1, the dynamics of CRPs slow down and EDC is inhibited [45]. These data suggest that anchoring of the clathrin coat to the substrate via integrins prevents PRCs from budding efficiently. Similarly, we have shown that clathrin-coated structures accumulate along collagen fibers [46]. This is also dependent on β1 integrin and leads to the formation of tubular clathrin structures that wrap around the collagen fiber and have an increased life span. The collagen fibers are far too long to be internalized by the CRPs, which therefore become frustrated. Clathrin-coated plaques are large, flat mantle assemblies that are highly stable to the plasma membrane [24, 47]. Plaques can produce vesicles at their edges but not at their centers. Plaque formation is dependent on the integrin αvβ5, which accumulates strongly in the plaques [16, 24, 48, 49]. Plaques can have a lifetime of several hours, much longer than the lifetime of conventional PRCs (30 to 60 s) or even PRCs frustrated by integrin β1 commitment to the substrate (a few minutes). The reasons for this disparity are not clear but probably depend on the affinity of the different integrins for the substrate and/or for the clathrin coat.
4. Functions of EDC frustration
Overall, many situations can lead to a frustrated EDC. Frustration is often restricted to a subset of clathrin-coated structures and could be mitigated by compensatory mechanisms. For example, CRPs located on the apical side of polarized epithelial cells require acin polymerization to bud [32]. Similarly, plaques are often associated with an actin network-promoting vesicle budding at their edges [50]. Data suggest that frustration is felt locally by CRPs experiencing difficulty in deforming the membrane and that this triggers local actin polymerization to overcome mechanical resistance [42]. Even in extreme cases where frustration cannot be circumvented by palliative mechanisms, the frustrated EDC is not necessarily deleterious and can instead be used by the cell to gather information about its environment and perform specific functions.
4.1. Implications for signaling
A commonly accepted model is that endocytosis of surface receptors either quenches or modulates their signaling activity [51, 52]. However, clathrin and the adaptor coat may themselves modulate signaling at the plasma membrane, presumably by providing a platform for the recruitment of specific adaptors involved in signaling [35, 53]. In addition, the lifetime of CRPs on the cell surface has been linked to signal intensity [35]. We have recently shown that systemic frustration of CRPs in compressed cells increases signaling in the mitogen-activated protein kinase (MAPK) pathway [54]. Thus, clathrin structures now appear not only as endocytosis structures but also as signaling platforms. It is therefore not surprising that plaques modulate receptor-mediated signaling. These extremely frustrated structures recruit many signaling receptors and stimulate their signaling activity [24, 47, 50]. Plaques are mechanosensitive structures because they assemble according to the stiffness of the substrate. The stiffer the substrate, the more the plaques assemble [24]. Thus, the plates instruct the cell about the elasticity of the substrate by transforming mechanical information into biochemical information [24]. Because the causes of frustration are most often mechanical in nature, and frustrated clathrin structures modulate signaling pathways, a major function of the frustrated EDC could be to perform mechanotransduction. Thus, the frustrated EDC could play an important role in physiological and pathological contexts involving mechanical forces, such as during fibrosis and cancers.
4.2. Implications for cell adhesion
As mentioned previously, strong adhesion to the substrate, particularly via integrins, is a common cause of frustration of CRPs [24, 45, 46]. Conversely, it is possible that integrin clustering at clathrin structures confers a role for CRPs in cell adhesion to the substrate. Indeed, the clustering of integrins or other adhesion receptors at adhesion structures is essential for cell anchorage to the substrate [55]. Thus, we proposed that PRCs serve as adhesion structures in 3D environments by clamping collagen fibers [46]. These CRPs are enriched in β1 integrin which causes them to become frustrated on the fibers but in turn confers new adhesion capabilities to the cell that allow it to migrate into 3D collagen networks. Similarly, it is now clearly demonstrated that clathrin plaques serve as substrate adhesion structures [56, 57, 58, 59]. Thus, the clustering of integrins at clathrin-coated structures not only causes the frustration of these structures but at the same time provides a new means for the cell to adhere to the substrate.
4.3. Plates as a scaffold for the actin cytoskeleton
Clathrin plaques can also serve as a platform for cytoskeleton organization. Plaques are abundant in skeletal muscle and are required for the organization of sarcomeric actin [48] as well as for the arrangement of intermediate filaments [60]. In the absence of plates, muscles can no longer exert forces. Plaques assemble in an actin-independent manner and do not possess any of the molecular modules connecting integrins to the actin cytoskeleton as is the case in focal adhesions [59]. However, other components of the clathrin coat such as dynamin or HIP1R can bind actin and modulate its organization [61]. It is likely that the highly stable nature of the plaques is advantageous in providing a scaffold for cytoskeletal organization.
5. Perspectives
Frustrated EDC thus appears to be an important regulator of many cellular processes, from signaling to adhesion, from cell migration to mitosis. Yet, the ins and outs of frustrated endocytosis are still difficult to understand. For example, the clustering of receptors or ligands into rigid microdomains erected by clathrin and adaptors may promote the development of forces on receptor-ligand complexes [62]. Therefore, EDC frustration could be both a consequence of local mechanical resistance and a means to achieve the local force generation required for specific regulatory purposes. This could be true at the level of clathrin plaques where potential tensile forces exerted by the clathrin coat could participate in local αvβ5 activation or stabilization of integrin-ECM bonds [59]. Intriguingly, although actin is very often dispensable for EDC, clathrin-coated structures frequently exploit the actin network in frustration. The identification of a molecular module for frustration detection within the clathrin coat itself [42] would provide an excellent opportunity to study the cellular functions of EDC frustration.
Conflicts of interest
Authors have no conflict of interest to declare.
Acknowledgments
The laboratory is funded by Gustave Roussy, Inserm and the University of Paris-Saclay, with additional from the Fondation pour la Recherche Médicale, the Institut National du Cancer National Cancer Institute (2018-1-PL BIO-02-IGR-1) and the French National Research Agency (ANR-15-CE15-0005-03).
Version française
1. Introduction
L’endocytose permet aux cellules eucaryotes d’internaliser des substances provenant de leur environnement. Les différentes voies d’endocytose connues reposent sur la formation initiale d’une invagination de la membrane plasmique. Cette invagination évolue progressivement en une vésicule ou un tubule qui bourgeonne dans le cytosol, transportant ainsi les cargos internalisés vers des compartiments intracellulaires, en particulier les endosomes. Les invaginations varient en termes de taille, de forme et de dynamique en fonction de la machinerie moléculaire impliquée dans leur formation. Cette diversité reflète également les variations considérables en nature, composition et taille des substances endocytées. Cependant, dans certaines conditions, le processus conduisant à la formation et à la stabilisation des invaginations peut être stoppé et même s’inverser, faisant ainsi avorter l’internalisation en cours. La formation et la maturation des invaginations sont des processus étroitement régulés qui nécessitent de l’énergie afin de surmonter la résistance de la membrane plasmique à la déformation. De nombreux paramètres tels que la tension de membrane, la pression hydrostatique interne ou les propriétés de la cargaison à internaliser peuvent rendre la membrane plasmique plus difficile à courber. Ainsi, la réussite de l’endocytose dépend d’un équilibre de forces, certaines favorisant la déformation de la membrane et d’autres s’y opposant.
L’endocytose dépendante de la clathrine (EDC) est probablement la voie d’endocytose la plus étudiée et la mieux comprise. Les petites invaginations de la membrane plasmique associées à l’EDC ont été identifiées pour la première fois en 1964 et sont généralement nommées « puits recouverts de clathrine » (PRCs) [1]. La clathrine est le principal composant du manteau protéique qui s’assemble sur la face cytosolique de la membrane plasmique [2]. Ce manteau est donc constitué de clathrine, mais aussi de nombreux adaptateurs et régulateurs, et génère des forces qui courbent la membrane plasmique pour former une invagination puis une vésicule (Figure 1). Concomitamment à son action sur la courbure de la membrane, le manteau de clathrine recrute des récepteurs de surface et leurs ligands, les empaquetant ainsi dans les vésicules d’endocytose en formation. Les cargos internalisés dans ces vésicules sont ensuite acheminés vers le système endosomal d’où ils peuvent être recyclés vers la surface cellulaire ou être adressés aux lysosomes pour y être dégradés.
Représentation schématique de la dynamique normale ou frustrée des structures recouvertes de clathrine.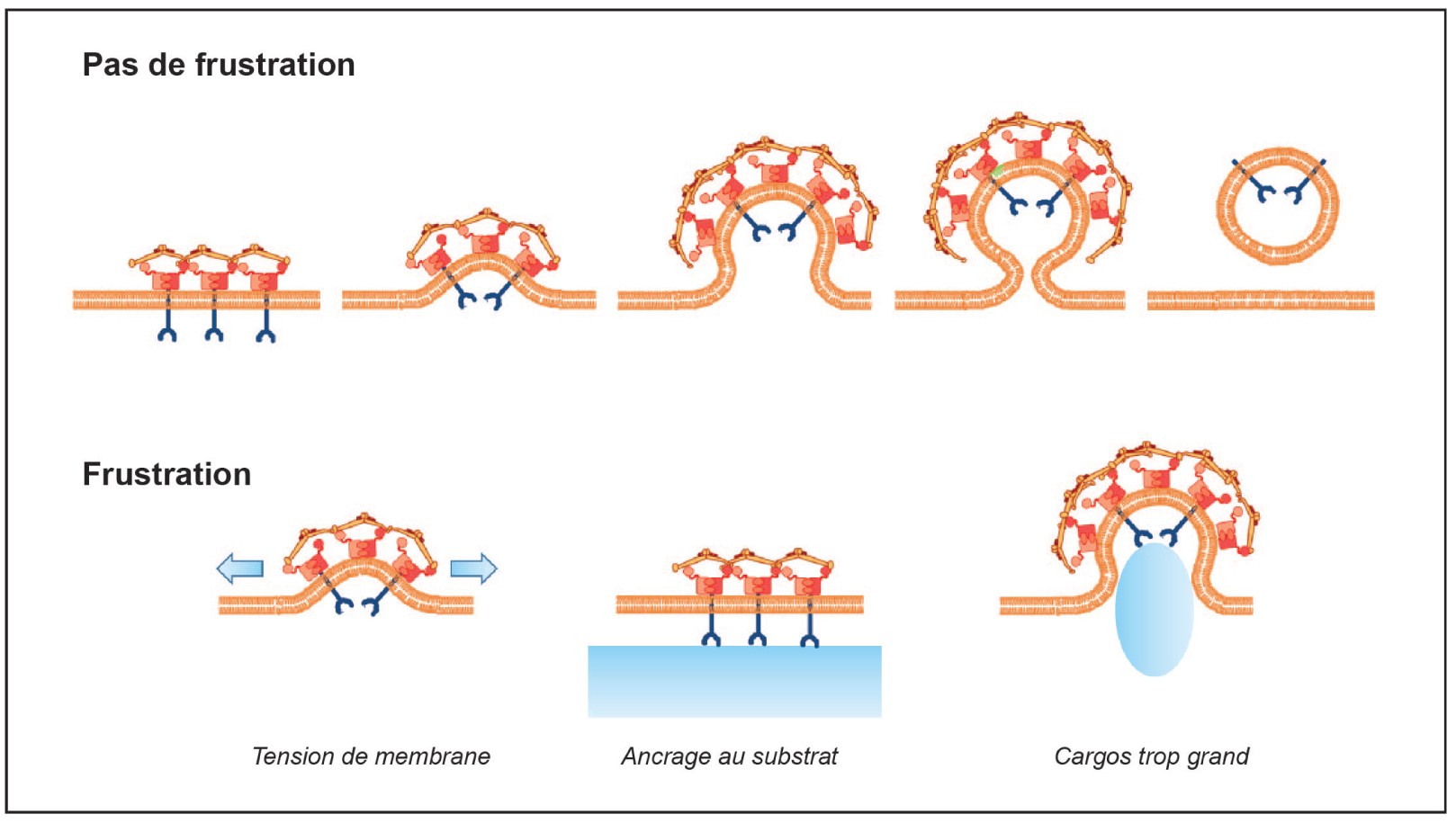
Le rôle canonique des PRCs dans la régulation de l’endocytose est central pour l’homéostasie cellulaire car il contrôle l’acquisition de nutriments, la composition de la membrane plasmique mais aussi l’activité de signalisation des récepteurs de surface. Cependant, de nombreuses observations montrent que la capacité des PRCs à courber la membrane et à bourgeonner peut être perturbée. En effet, plusieurs facteurs environnementaux ont été décrits comme empêchant ou ralentissant l’invagination membranaire au niveau des PRCs. Cet état d’endocytose frustrée n’est pas nécessairement délétère pour la cellule car il lui permet d’acquérir des informations à propos de son environnement et d’accomplir des fonctions spécifiques. Nous proposons que l’EDC frustrée soit une partie intégrante de la réponse homéostatique et puisse aider la cellule à s’adapter à des conditions environnementales changeantes. Ici, nous fournissons d’abord une perspective historique et une définition de l’endocytose frustrée. Nous décrivons ensuite les différentes causes ainsi que les conséquences fonctionnelles de l’endocytose frustrée en condition physiologique et pathologique.
2. Définition de l’endocytose frustrée
Nous envisageons l’endocytose frustrée comme la conséquence d’une contrainte mécanique qui empêche l’internalisation par une structure d’endocytose par ailleurs parfaitement adaptée. Cette définition exclut tout type de perturbations affectant a priori la composition moléculaire ou chimique, et donc les fonctions, de la machinerie d’endocytose considérée. L’endocytose frustrée résulte donc d’une obstruction mécanique empêchant l’invagination de la membrane et/ou la scission de cette invagination. Les structures d’endocytose peuvent être frustrées de façon temporaire ou permanente. La frustration peut également être locale ou globale.
Le premier exemple rapporté d’endocytose frustrée est le fruit de perturbations expérimentales visant à décortiquer les mécanismes de la phagocytose. La phagocytose est dédiée à l’internalisation de particules solides de grandes tailles, telles que des bactéries, et qui sont recouvertes de facteurs déclenchant la formation d’une coupe phagocytaire, l’invagination spécifique de la phagocytose. Dans des travaux pionniers, les auteurs ont recouvert des lamelles de verre par ces facteurs déclenchant la phagocytose [3, 4]. La lamelle de verre étant bien trop grande pour être phagocytée par une cellule, il en résulte la formation d’une coupe phagocytaire stable qui s’étale sur le verre en tentant de l’internaliser. Cette condition expérimentale reflète en réalité des situations pathologiques dans lesquelles les phagocytes ne peuvent pas internaliser des particules extracellulaires trop grandes comme par exemple de longues structures composées de nanotubes de carbone [5] ou des fibres amyloïdes [6]. La phagocytose incomplète qui en résulte conduit à la sécrétion de composés toxiques qui endommagent les tissus sains voisins et déclenchent une réaction inflammatoire néfaste [7, 8]. En revanche, la frustration d’autres voies d’endocytose peut jouer un rôle dans l’homéostasie. Les cavéoles sont de petites invaginations de la membrane plasmique qui régulent l’endocytose de divers cargos [9, 10]. Pourtant, à l’équilibre, les cavéoles se maintiennent dans un état invaginé stable, sans génération de vésicules [10]. Les cavéoles sont également connues pour réguler la tension de la membrane plasmique en s’aplatissant dans la membrane pour tamponner une augmentation soudaine de la tension [11]. À l’inverse, la réduction de la tension de la membrane plasmique entraîne leur assemblage et peut favoriser leur bourgeonnement [10]. Ainsi, les cavéoles sont potentiellement des structures constitutivement frustrées à l’équilibre, et dont la dynamique est modulée par des perturbations de la tension de membrane. Enfin, les PRCs sont également sujets à la frustration. Il est très probable que la frustration explique en grande partie les comportements dynamiques très variés rencontrés parmi les populations de structures recouvertes de clathrine. En effet, la durée de vie moyenne des PRCs, c’est-à-dire le temps nécessaire à la formation d’une vésicule à partir du recrutement initial du manteau de clathrine, est très variable d’un type cellulaire à l’autre. Cette durée de vie peut également varier au sein d’une même cellule en fonction de la localisation subcellulaire, de la composition du substrat, ou de la progression du cycle cellulaire. Outre les PRCs, de nombreux types cellulaires présentent de grands assemblages de clathrine qui restent plats et dont la durée de vie est très longue. Ces structures particulières ont été appelées plaques recouvertes de clathrine (ci-après appelées plaques). Elles représentent en réalité un exemple extrême d’EDC frustrée.
3. Mécanismes de la frustration de l’endocytose dans la voie de la clathrine
La dynamique des PRCs et la séquence des événements menant à la formation d’une vésicule ont été largement étudiées. Le manteau de clathrine et d’adaptateurs exerce des forces qui courbent la membrane vers l’intérieur de la cellule, afin de former une invagination (Figure 1). La rigidité et la tension de flexion de la membrane plasmique, ainsi que la pression de turgescence cellulaire, s’opposent quant à eux à la déformation de la membrane. La rigidité de la membrane dépend de sa composition chimique qui est connue pour varier durant la vie de la cellule [12]. Cependant, à ce jour, aucun lien n’a été établi entre la modification de la composition lipidique des membranes et une potentielle frustration des PRCs. La résistance à la déformation de la membrane plasmique peut également être augmentée par l’adhésion du cortex d’actine à la bicouche lipidique [13]. Un cortex d’actine rigide a été lié à un blocage de l’endocytose chez la drosophile [14]. Dans les cellules de mammifères, les facteurs contribuant à frustrer l’EDC sont essentiellement la tension de membrane ainsi que la nature des cargos à internaliser (Figure 1).
3.1. Tension de la membrane plasmique
L’EDC est connue pour être particulièrement sensible à la tension membranaire. L’augmentation expérimentale de la tension membranaire par choc hypotonique bloque complètement la dynamique des PRCs [15]. Ceci reflète la difficulté qu’a le manteau de clathrine à déformer la membrane lorsque la tension est élevée [16, 17, 18]. La tension membranaire peut être perturbée par de nombreux facteurs physiologiques ou pathologiques. Lors de la mitose, une pression osmotique accrue provoque l’arrondissement de la cellule [19] conduisant à une augmentation de la tension de membrane qui impacte négativement l’EDC [20, 21]. La tension membranaire est aussi probablement augmentée de manière systémique dans les cellules soumises à des forces de compression comme c’est le cas dans les cancers [22] ou chez les patients asthmatiques [23]. Il a été démontré que de telles forces de compression bloquent la dynamique des PRCs in vitro [15, 24], très probablement en raison de l’élévation de la tension de membrane.
Des variations locales de la tension de membrane peuvent également moduler la dynamique des PRCs. En effet, la tension de membrane n’est pas homogène sur l’ensemble de la membrane plasmique [25] et dans des cellules mésenchymateuses en migration, la tension est plus élevée à l’avant qu’à l’arrière des cellules [26, 27, 28]. Ainsi, il a été démontré que les PRCs ont une durée de vie plus longue à l’avant qu’à l’arrière de la cellule [29]. Ces observations pourraient expliquer pourquoi les structures recouvertes de clathrine ont tendance à s’accumuler à l’avant des cellules en migration [30, 31]. Les cellules épithéliales polarisées présentent également une asymétrie de tension membranaire et la durée de vie des PRCs est plus longue du côté apical, là où la tension est la plus forte, que du côté basolatéral [32].
3.2. Propriétés des cargos
La deuxième cause principale de frustration de l’EDC réside dans les propriétés des cargos destinés à être internalisés par les PRCs. Le cargo désigne les récepteurs ou autres protéines présents à la surface des cellules capables de lier la clathrine et ses adaptateurs afin d’être recrutés et internalisés par les PRCs. Ce sont le plus souvent les propriétés mécaniques, la forme ou la taille de l’objet auquel ces cargos se lient qui représentent une limitation pour le processus d’endocytose. Les cargos jouent un rôle actif dans la maturation et la durée de vie des PRCs. Par exemple, la surexpression du récepteur de la transferrine réduit l’occurrence des PRCs abortifs (PRCs se désassemblant sans former de vésicules), et les aide à progresser dans les étapes séquentielles de l’EDC [33]. Ainsi, différents cargos recrutent différents ensembles d’adaptateurs et cela a un impact sur la durée de vie des PRCs [34, 35]. Les cargos peuvent aussi moduler la composition et/ou l’activité de la machinerie de clathrine mais cette question ne sera pas discutée ici car elle s’éloigne de notre définition de l’endocytose frustrée.
Les PRCs contrôlent également l’internalisation de virus, de bactéries et de nanoparticules. Ces objets atteignent souvent une taille importante qui rend l’EDC plus difficile. En effet, il existe une relation entre la taille de la cargaison et le temps nécessaire pour compléter son endocytose [36, 37]. Ainsi, plus une cargaison est grande, plus il faut de temps à un PRC pour l’internaliser. Les bactéries sont beaucoup plus grandes que le diamètre moyen de 100 nm des PRCs [38]. Néanmoins, il a été démontré que Listeria monocytogenes, Escherichia coli et d’autres bactéries recrutent un manteau de clathrine à leurs sites d’entrée dans la cellule [39, 40, 41]. Certaines bactéries utilisent les structures de clathrine comme piédestal pour organiser le cytosquelette d’actine en une structure permettant leur internalisation [39, 41]. La forme de l’objet joue également un rôle. Ainsi, il faut deux fois plus de temps à un PRCs pour internaliser le virus de la stomatite vésiculaire en raison de sa morphologie asymétrique en forme de balle de fusil (180 nm sur 70 nm) [42, 43]. De même, l’efficacité d’endocytose de nanoparticules opsonisées dépend également de leur forme [44].
L’une des causes les plus courantes de frustration est lorsque la machinerie de clathrine est ancrée au substrat par l’intermédiaire de récepteurs d’adhérence. Le substrat peut alors être considéré comme une cargaison qui ne peut être internalisée. Par exemple, l’attachement non spécifique de la membrane plasmique à une lamelle de verre opsonisée par de la concanavaline A bloque complètement les PRCs [45]. Il est probable qu’une forte adhérence à un substrat de grande taille et non flexible empêche le manteau de clathrine de courber la membrane. De nombreux récepteurs d’adhérence telles que certaines intégrines s’accumulent au niveau des PRCs. Une population de PRCs localisé près des adhérences focales et riche en intégrine β1 présente une durée de vie accrue par rapport aux PRCs situés dans d’autres zones de la membrane plasmique [45]. Lorsque les cellules sont placées sur du verre recouvert d’une matrice extracellulaire (MEC) qui engage l’intégrine β1, la dynamique des PRCs ralentit et l’EDC est inhibée [45]. Ces données suggèrent que l’ancrage du manteau de clathrine au substrat via les intégrines empêche les PRCs de bourgeonner efficacement. Similairement, nous avons montré que les structures recouvertes de clathrine s’accumulent le long des fibres de collagène [46]. Ceci dépend également de l’intégrine β1 et conduit à la formation de structures de clathrine tubulaires qui s’enroulent autour de la fibre de collagène et dont la durée de vie est augmentée. Les fibres de collagène sont bien trop longues pour être internalisées par les PRCs qui s’en retrouvent donc frustré. Les plaques recouvertes de clathrine sont de grands assemblages de manteau plats et très stables à la membrane plasmique [24, 47]. Les plaques peuvent produire des vésicules sur leur bord mais pas en leur centre. La formation des plaques dépend de l’intégrine αvβ5 qui s’y accumule fortement [16, 24, 48, 49]. Les plaques peuvent avoir une durée de vie de plusieurs heures, bien plus longue que la durée de vie des PRCs classiques (30 à 60 s) ou même que des PRCs frustrés par l’engagement de l’intégrine β1 au substrat (quelques minutes). Les raisons de cette disparité ne sont pas claires mais dépendent probablement de l’affinité des différentes intégrines pour le substrat et/ou pour le manteau de clathrine.
4. Fonctions de la frustration de l’EDC
Globalement, de nombreuses situations peuvent conduire à une EDC frustrée. La frustration est souvent limitée à un sous-ensemble de structures recouvertes de clathrine et pourrait être atténuée par des mécanismes compensatoires. Par exemple, les PRCs situés du côté apical des cellules épithéliales polarisées nécessitent la polymérisation d’acine pour bourgeonner [32]. Similairement, les plaques sont souvent associées à un réseau d’actine favorisant le bourgeonnement de vésicules sur leurs bords [50]. Des données suggèrent que la frustration est ressentie localement par les PRCs éprouvant des difficultés à déformer la membrane et que ceci déclenche une polymérisation locale de l’actine pour surmonter la résistance mécanique [42]. Même dans les cas extrêmes où la frustration ne peut être contournée par des mécanismes palliatifs, l’EDC frustrée n’est pas nécessairement délétère et peut au contraire être utilisée par la cellule pour recueillir des informations sur son environnement et exécuter des fonctions spécifiques.
4.1. Conséquences pour la signalisation
Selon un modèle communément admis, l’endocytose de récepteurs de surface permet soit d’éteindre soit de moduler leur activité de signalisation [51, 52]. Toutefois, la clathrine et le manteau d’adaptateur peuvent eux-mêmes moduler le signal à la membrane plasmique, probablement en fournissant une plateforme pour le recrutement d’adaptateurs spécifiques participant à la signalisation [35, 53]. De plus, la durée de vie des PRCs à la surface des cellules a été liée à l’intensité du signal [35]. Nous avons récemment montré que la frustration systémique des PRCs dans des cellules compressées augmente la signalisation dans la voie de la protéine kinase activée par les mitogènes (MAPK) [54]. Ainsi, les structures de clathrine apparaissent désormais non seulement comme des structures d’endocytose mais aussi comme des plateformes de signalisation. Il n’est donc pas surprenant que les plaques modulent la signalisation médiée par les récepteurs. Ces structures frustrées à l’extrême recrutent de nombreux récepteurs de signalisation et stimulent leur activité de signalisation [24, 47, 50]. Les plaques sont des structures mécanosensibles car elles s’assemblent en fonction de la rigidité du substrat. Plus le substrat est rigide, plus les plaques s’assemblent [24]. Ainsi, les plaques instruisent la cellule quant à l’élasticité du substrat en transformant une information mécanique en une information biochimique [24]. Les causes de frustration étant le plus souvent de nature mécanique, et les structures de clathrine frustrées modulant les voies de signalisation, une fonction majeure de l’EDC frustrée pourrait être de réaliser la mécanotransduction. Ainsi, l’EDC frustré pourrait jouer un rôle important dans des contextes physiologiques et pathologiques mettant en jeu des forces mécaniques, comme au cours de la fibrose et des cancers.
4.2. Conséquences pour l’adhésion des cellules
Comme mentionné précédemment, une forte adhérence au substrat, notamment via des intégrines, est une cause courante de frustration des PRCs [24, 45, 46]. Inversement, il est possible que le regroupement des intégrines au niveau des structures de clathrine confère aux PRCs un rôle dans l’adhérence cellulaire au substrat. En effet, le regroupement des intégrines ou d’autres récepteurs d’adhésion au niveau des structures d’adhérence est essentiel pour assurer l’ancrage de la cellule au substrat [55]. Ainsi, nous avons proposé que les PRCs servent de structures d’adhérence dans des environnements 3D en pinçant les fibres de collagène [46]. Ces PRCs sont enrichies en intégrine β1 ce qui provoque leur frustration sur les fibres mais confère en retour de nouvelles capacités d’adhérence à la cellule qui lui permettent de migrer dans des réseaux 3D de collagène. De même, il est maintenant clairement démontré que les plaques de clathrine servent de structures d’adhérence au substrat [56, 57, 58, 59]. Ainsi, le regroupement des intégrines au niveau des structures recouvertes de clathrine provoque non seulement la frustration de ces structures mais fournit en même temps un nouveau moyen pour la cellule d’adhérer au substrat.
4.3. Les plaques, un échafaudage pour le cytosquelette d’actine
Les plaques de clathrine peuvent également servir de plateforme pour l’organisation du cytosquelette. Les plaques sont abondantes dans les muscles squelettiques et sont nécessaires à l’organisation de l’actine sarcomérique [48] ainsi qu’à l’arrangement des filaments intermédiaires [60]. En l’absence de plaques, les muscles ne peuvent plus exercer de forces. Les plaques s’assemblent de manière indépendante de l’actine et ne possèdent aucun des modules moléculaires reliant les intégrines au cytosquelette d’actine comme c’est le cas au niveau des adhérences focales [59]. Cependant, d’autres composants du manteau de clathrine comme la dynamine ou HIP1R peuvent lier l’actine et moduler son organisation [61]. Il est probable que la nature extrêmement stable des plaques soit avantageuse pour fournir un échafaudage pour l’organisation du cytosquelette.
5. Perspectives
L’EDC frustrée apparaît donc comme un régulateur important de nombreux processus cellulaires, de la signalisation à l’adhérence, de la migration cellulaire à la mitose. Pourtant, les tenants et aboutissants de l’endocytose frustrée sont encore difficiles à cerner. Par exemple, le regroupement des récepteurs ou des ligands dans des microdomaines rigides érigés par la clathrine et les adaptateurs peut favoriser le développement de forces sur les complexes récepteur-ligand [62]. Par conséquent, la frustration de l’EDC pourrait être à la fois une conséquence de la résistance mécanique locale et un moyen d’atteindre la production de force locale requise à des fins de régulation spécifiques. Cela pourrait être vrai au niveau des plaques de clathrine où les potentielles forces de traction exercées par le manteau de clathrine pourraient participer à l’activation locale d’αvβ5 ou à la stabilisation des liaisons intégrine-MEC [59]. De façon intrigante, bien que l’actine soit très souvent dispensable pour l’EDC, les structures recouvertes de clathrine exploitent fréquemment le réseau d’actine en cas de frustration. L’identification d’un module moléculaire de détection de la frustration au sein même du manteau de clathrine [42] offrirait une excellente opportunité d’étudier les fonctions cellulaires de la frustration de l’EDC.
Conflit d’intérêt
Les auteurs déclarent ne pas avoir de conflit d’intérêt.
Remerciements
Le laboratoire est financé par Gustave Roussy, l’Inserm et l’université Paris-Saclay et des financements complémentaires de la fondation pour la recherche médicale, L’Institut National du Cancer (2018-1-PL BIO-02-IGR-1) et l’Agence Nationale de la Recherche (ANR-15-CE15-0005-03).



 CC-BY 4.0
CC-BY 4.0