Abridged English version
The effects of chronic dehydration by deprivation of water for three days out of four during four repeated cycles were investigated in adult male wistar rats; rat chow was always available ad libitum. In this work, some blood variables: hematocrit, plasma osmolality, natremia, kaliemia, proteinemia and plasma rennin concentration, were determined. In addition, corticotropic and vasopressinergic activities and plasma nitric oxide (NO) synthesis have been evaluated.
Radioimmunoassay realized the determination of the plasma and pituitary rates of ACTH as well as those of AVP, while the rates of corticosterone in plasma and adrenal gland were determined by fluorimetry. The plasma rate of NO, valued indirectly by the measurement of the concentrations of the nitrate/nitrite (NOx) which represents the final metabolites of the reaction of oxidation of NO, was measured by colorimetric method with Roche's kit.
All results were reported as means ± SEM. Data were tested by analysis of variance (ANOVA) for comparison between control and water deprived groups.
Our results reveal that chronic water deprivation produces a significant loss in body mass (17±1%) and a decrease of about 32% in the plasma volume demonstrated by the increase in hematocrit and plasma osmolality, as well as by increased natremia and proteinemia.
The increase in plasma renin concentration (PRC) that occurs during water deprivation is mediated by the renal sympathetic nerves or adrenomedullary cathecolamine release. In addition, some mechanism plays a major role in mediating increased PRC. It would be attributed, on the one hand, to an increase of renin liberation and, on the other hand, to a decrease in the rate of the enzyme metabolic clearance; then, the liberation of renin via the macula densa would be stimulated by the changes of the electrolytes movements in kidney.
Furthermore, the increase of plasma AVP concentration and the depletion of AVP from pituitary were caused by hyperosmolality and hypovolemia induced by water deprivation.
The decrease of AVP in the hypothalamus, in spite of the induction of its biosynthesis, would imply the fact that the rate of disappearance of the hormone from this region is quicker than the rate of synthesis.
According to our results, the activity of corticotropic axis was not statistically affected by chronic dehydration; this would be in favour of a possible adaptation of the animal to water stress. Several hypotheses could be given out in order to explain this adaptation.
The activity of synthesis of NO by chronic dehydration could be due to the rise of systemic rates of AVP and to the activation of sympathetic nervous system. But, NO is known to maintain a powerful vasodilator tone on the whole circulatory tree, so it could have a buffer effect on the vasoconstriction and therefore on the hypertension caused by water deprivation. Otherwise, the NO participates in the regulation of water reabsorption by the collector tubes of the kidney and in the regulation of water intake by its dipsogenic action. However, the exact physiological role played by NO during water deprivation remains widely unknown.
1 Introduction
Le stress est considéré comme une situation non physiologique capable de perturber l'équilibre homéostatique de l'être vivant. Les réponses de l'organisme au stress sont très variables et dépendent du type, de l'intensité et de la durée de l'agent stressant [1]. En général, le stress est associé à une activation de plusieurs systèmes endocriniens, incluant le système nerveux sympathique et l'axe hypothalamo-hypophyso-surrénalien [2].
Par ailleurs, l'implication du monoxyde d'azote (NO) dans la réponse aux agents stressants est bien établie [3]. Le NO, considéré comme la plus petite bio-molécule inorganique, est un gaz instable, qui joue un rôle important dans le cerveau en général, et dans les fonctions neuroendocrines en particulier. Il est synthétisé à partir de la l-arginine par l'enzyme NO synthase (NOS) et diffuse rapidement de son lieu de production selon un gradient de concentration. Le NO peut agir comme neurotransmetteur/neuromodulateur de la plupart des fonctions biologiques du système nerveux central [4]. L'expression sélective des NOS dans certaines structures centrales telles que l'organe subfornical (SFO), l'organe vasculaire de la lame terminale (OVLT), l'aire préoptique (POA), les noyaux hypothalamiques paraventriculaire (PVN) et supraoptique (SON) et les parties caudale (CVLM) et rostrale (RVLM) du bulbe ventrolatéral [5,6] démontre son rôle dans plusieurs aspects du fonctionnement cérébral en général, et plus particulièrement dans la régulation de la balance hydrique et de la pression artérielle. Il participe alors à la plupart des grandes fonctions physiologiques. De plus, Tsuchiya et al. [7] et Calza et al. [8] ont montré l'implication du NO dans la réponse à différents types de stress. La privation hydrique est considérée parmi les agressions susceptibles de stimuler l'activité de plusieurs axes de régulation de l'homéostasie corporelle.
Le but de ce travail est d'étudier l'effet d'une déshydratation chronique sur quelques paramètres sanguins dont la concentration rénine plasmatique (CRP), l'activité de l'axe hypophyso-corticosurrénalien (HCS) et de l'axe vasopressinergique, ainsi que le taux circulant des nitrates/nitrites, métabolites finaux du NO.
2 Matériel et méthodes
2.1 Animaux
Les animaux utilisés pour réaliser cette étude sont des rats de sexe mâle, de souche « wistar », dont le poids varie entre 250 et 300 g. Les rats sont acquis auprès de la Société des industries pharmaceutiques de Tunisie (SIPHAT). Avant toute expérimentation, les animaux sont gardés deux à trois semaines dans l'animalerie où la température (22±1 °C), le degré d'hygrométrie (70±10 %) et le cycle lumière/obscurité (12 h/12 h, avec la période de lumière commençant à 7 h du matin) sont contrôlés.
Tous les animaux reçoivent un régime alimentaire standard équilibré sous forme de bouchons provenant de la Société industrielle de concentré de Sfax, Tunisie (SICO). L'alimentation et l'eau de distribution sont fournies ad-libitum.
2.2 Conditions expérimentales
Deux groupes de rats ont été étudiés : un groupe de rats témoins recevant de l'eau et de la nourriture ad libitum tous les jours et un groupe de rats soumis à une déshydratation chronique qui consiste à priver les animaux d'eau trois jours sur quatre et ceci pendant quatre cycles successifs. Dans le cas de déshydratation, la nourriture est fournie à volonté.
La privation d'eau à raison de trois jours sur quatre a été choisie pour réaliser un état de déshydratation chronique vraie, car un jour de réhydratation ne permet pas à l'animal de retrouver toutes ses fonctions initiales [9,10].
Les animaux sont sacrifiés à la fin du quatrième cycle, c'est-à-dire le matin du 17e jour.
Le poids corporel des rats a été déterminé le premier et le dernier jour de l'expérimentation.
2.3 Prélèvement des échantillons
Le sacrifice des animaux est réalisé par décapitation rapide le matin entre 9 h et 11 h. Il ne faut pas dépasser les 30 s entre la prise de l'animal et la récolte de sang afin d'éviter qu'une décharge d'ACTH n'atteigne et n'active le cortex surrénalien. Le sang artério-veineux est recueilli, soit sur héparine, soit sur EDTA, puis centrifugé pendant 15 min à 3000 g. Dans les deux minutes qui suivent la décapitation, l'hypothalamus, l'hypophyse et les surrénales sont prélevées. Les aliquotes de sang et les organes sont stockés à −80 °C jusqu'aux différentes déterminations.
2.4 Détermination de quelques paramètres sanguins
- – L'hématocrite est déterminé sur du sang prélevé dans des microtubes héparinés et centrifugés pendant 10 min à 3000 g.
- –
Le volume plasmatique a été calculé selon la formule de Van Beaumont et al. [11] :
- avec :
- % PV=pourcentage de variations du volume plasmatique,
- Htavant=hématocrite des rats contrôles,
- Htaprès=hématocrite des rats déshydratés.
- – L'osmolarité plasmatique (Fisk OR osmomètre), la natrémie et la kaliémie (par des électrodes spécifiques) ont été mesurées.
- – La concentration rénine plasmatique (CRP) a été déterminée par dosage radio-immunologique, sans extraction préalable. La rénine est dosée de façon indirecte en mesurant son activité enzymatique. Le dosage de l'activité rénine comporte deux phases : une phase d'incubation, pendant laquelle l'enzyme génère de l'angiotensine I (ANG I), dont la dégradation est prévenue par l'addition d'inhibiteurs des angiotensinases et de l'enzyme de conversion, et une seconde phase de dosage de l'ANG I formée, par radio-immunologie. L'incubation est réalisée en présence d'un excès de substrat exogène (angiotensinogène de rat) afin que la cinétique de production d'ANG I soit linéaire (l'enzyme est saturée par son substrat). Dans ces conditions, l'activité enzymatique est proportionnelle à la quantité d'enzyme. On parle alors de concentration plasmatique en rénine (CRP). La technique de mesure de la CRP est adaptée de la méthode développée par Ménard et Catt [12] pour être applicable à de petits volumes de plasma (25 μl). La sensibilité du dosage est de 4,2 pg d'ANG I par tube. Les reproductibilités intra et inter-essais sont respectivement de 4,8 % et 8,1 %.
2.5 Détermination de l'activité de l'axe hypophyso-surrénalien
2.5.1 Taux hypophysaire et plasmatique de la corticotrophine (ACTH)
100 μl de plasma (prélevé sur EDTA) ont servi au dosage de l'ACTH plasmatique. L'hypophyse est broyée à l'aide d'un polytron dans 500 μl d'eau acétique. Le broyat a été centrifugé 15 min à 3000 g. 15 μl du surnageant ont servi au dosage des protéines selon la méthode de Spector [13] et 100 μl au dosage de l'ACTH hypophysaire. Le dosage de l'ACTH plasmatique et hypophysaire est effectué par un dosage radioimmunologique à l'aide du kit CIS, réf : ACTHK-PR. D'après le kit utilisé, l'antisérum est un antisérum de lapin anti-ACTH bovin. La sensibilité du dosage est de 5 à 10 pg/tube. Les coefficients de variation intra et inter-essais sont respectivement de 5 et 6 %.
2.5.2 Taux surrénalien et plasmatique de la corticostérone
0,5 ml de plasma a servi au dosage de la cortistérone circulante. Les surrénales ont été pesées, puis broyées à l'aide d'un polytron dans 4 ml de sérum physiologique et 1 ml d'éthanol. Après 15 min de centrifugation à 3000 g, 2 ml d'extrait ont été utilisés pour le dosage de la corticostérone. Ce dosage a été effectué par la méthode fluorimétrique, méthode basée sur la fluorescence émise par la corticostérone en milieu sulfurique concentré, mise au point par Silber et al. [14] et modifiée par Guillemin et al. [15]. La sensibilité du dosage est de 0,02 μg de corticostérone par tube.
2.5.3 Détermination de l'activité de l'axe vasopressinergique
- • Taux hypothalamique et hypophysaire de l'AVP. L'hypothalamus et l'hypophyse ont été broyés au polytron dans 1 ml d'eau bidistillée. Un aliquote de l'homogénat a servi au dosage des protéines selon la méthode de Spector [13]. Le reste du broyat a été centrifugé pendant 15 min à 3000 g. Le taux de l'AVP dans les tissus a été déterminé par une méthode radio-immunologique. L'antisérum utilisé est l'immunsérum (IS421) obtenu à partir d'un protocole d'immunisation de lapins [16]. Le coefficient de variation intra-essai est de 4,2 % et le coefficient de variation inter-essai est de 5,2 %.
- • Taux plasmatique de l'AVP. Le taux plasmatique de l'AVP a été déterminé par dosage radio-immunologique après extraction de l'hormone par la bentonite [17]. L'immunsérum utilisé (K9-IV) est obtenu par immunisation chez le lapin [18]. Les coefficients de variation intra et inter-essais du dosage sont respectivement de 4,1 et 7 %.
La sensibilité du dosage radio-immunologique de l'AVP est de 2 à 2,5 pg d'hormone par tube.
2.5.4 Détermination des taux circulants du NO
Le taux de NO produit est estimé indirectement par la mesure de la somme des concentrations des nitrites et des nitrates (NOx), ces derniers représentant les métabolites finaux de la réaction d'oxydation du NO. Le dosage des NOx est effectué, sur du plasma prélevé sur EDTA, sans traitement préalable, par une microméthode colorimétrique à deux étapes. La première étape consiste en une réduction des nitrates en nitrites par une nitrate réductase, la seconde est l'addition des réactifs de Griess, qui vont convertir les nitrites en un composé coloré ayant un maximum d'absorption à 540 nm [19].
Ce dosage est réalisé selon le protocole décrit dans le kit commercialisé par Roche®.
2.5.5 Analyse statistique
Les résultats sont présentés sous forme de moyennes ± SEM ; une analyse de variance puis un test t de Student ont été effectués pour la comparaison des rats témoins et des rats déshydratés. Les différences sont jugées significatives quand p<0,05. Nous représenterons :
- – pour p<0,05,
- – pour p<0,01,
- – pour p<0,001.
3 Résultats
3.1 Masse corporelle et quelques paramètres sanguins
La déshydratation chronique entraı̂ne une réduction hautement significative de la masse corporelle (306±7,5 vs 230±8,5 pour les rats déshydratés ; p<0,01).
Le calcul du pourcentage de la variation du volume plasmatique montre une baisse d'environ 32 % après la privation hydrique.
Après la déshydratation chronique, une augmentation significative de l'hématocrite, de l'osmolalité plasmatique, de la natrémie et de la protéinémie est enregistrée, tandis que la kaliémie baisse. Une importante élévation de la CRP est également notée (Tableau 1).
Effet de la déshydratation chronique sur les différents paramètres sanguins
| Paramètres sanguins | Témoins (n=10) | Déshydratés (n=10) |
| Hématocrites (%) | 40,31 ± 0,35 | 49,88 ± 0,73∗∗ |
| Osmolalité plasmatique (mOsmoles kg−1H2O) | 293,40 ± 1,41 | 301 ± 1,85∗∗ |
| Na+ plasmatique (mequiv l−1) | 133,05 ± 0,50 | 139 ± 0,54∗ |
| K+ plasmatique (mequiv l−1) | 6,97 ± 0,09 | 6,53 ± 0,16∗ |
| Protéines plasmatiques (g l−1) | 69,51 ± 0,94 | 78,76 ± 1,47∗∗∗ |
| CRP (ng Al−1 ml−1 h−1) | 20,40 ± 0,50 | 64,90 ± 9,70∗∗∗ |
∗ p<0,05.
∗∗ p<0,01.
∗∗∗ p<0,001. Déshydratés vs témoins. n=nombre de cas.
3.2 Axe vasopressinergique
Après quatre cycles de privation d'eau, l'hypovolémie et l'hyperosmolalité entraı̂nent une libération accrue d'AVP dans le plasma, concomitant à une baisse hautement significative de la concentration de l'AVP hypophysaire. Au niveau hypothalamique, une légère baisse du taux de l'AVP est notée (Tableau 2).
Effet de la déshydratation chronique sur l'activité vasopressinergique
| Activité vasopressinergique | Témoins (n=10) | Déshydratés (n=10) |
| AVP hypothalamique (ng par mg de protéines) | 6,35 ± 1,40 | 4,10 ± 1,15∗ |
| AVP hypophysaire (ng par mg de protéines) | 297,66 ± 43,23 | 4,25 ± 0,25∗∗∗ |
| AVP plasmatique (pg ml−1) | 1,08 ± 0,15 | 10,80 ± 1,20∗∗∗ |
∗ p<0,05.
∗∗∗ p<0,001. Déshydratés vs témoins. n=nombre de cas.
3.3 Axe hypophyso-corticosurrénalien (HCS)
Au vu des résultats résumés dans le Tableau 3, la déshydratation chronique n'entraı̂ne aucune différence significative pour les paramètres étudiés concernant l'axe corticotrope.
Effet de la déshydratation chronique sur l'activité hypophyso-corticosurrénalienne
| Activité corticotrope | Témoins (n=10) | Déshydratés (n=10) |
| ACTH hypophysaire (μg par mg de protéines) | 1,11 ± 0,13 | 0,94 ± 0,06 |
| ACTH plasmatique (pg mg−1) | 106,68 ± 29,19 | 200,96 ± 38,04 |
| Poids surrénalien | 18,80 ± 0,50 | 19,50 ± 0,50 |
| Corticostérone surrénalienne (μg par mg de surrénale) | 11,80 ± 0,22 | 13,33 ± 1,10 |
| Corticostérone plasmatique (μg par 100 ml de plasma) | 13,93 ± 1,37 | 17,34 ± 1,70 |
3.4 Taux des nitrates/nitrites (NOx)
La privation hydrique chronique entraı̂ne une élévation hautement significative des taux circulants des NOx (1,315±0,208 contre 0,721±0,076 mg l−1 de plasma pour les rats déshydratés, p<0,01 ; Fig. 1).
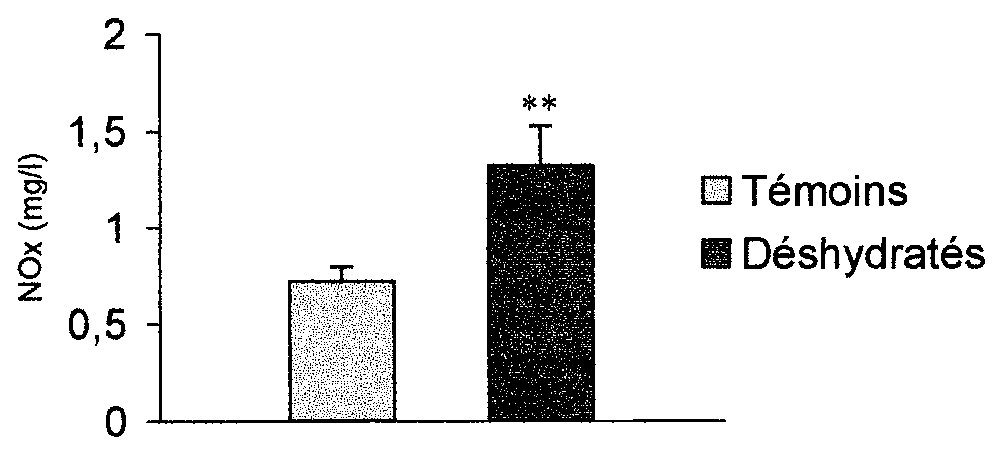
Effet de la déshydratation chronique sur les NOx plasmatiques (n=10 par groupe). .
4 Discussion
Nos résultats montrent que la déshydratation chronique entraı̂ne une perte significative de la masse corporelle et une baisse d'environ 32 % du volume plasmatique chez le rat. La baisse de la masse corporelle, supposée due à la réduction des fluides corporels des différents compartiments de l'organisme, peut aussi, en partie, être causée par une réduction de la prise alimentaire qui accompagne toujours la privation hydrique [20].
L'augmentation de l'hématocrite, de l'osmolalité plasmatique, de la natrémie et de la protéinémie sont en faveur d'une hémoconcentration et d'une hypovolémie [21].
D'après notre étude, la privation hydrique provoque une élévation de la CRP. Une élévation de l'activité de la rénine plasmatique ainsi qu'une élévation des concentrations de l'angiotensine I et II ont été décrites après une privation hydrique, une charge sodée ou une hémorragie chez le rat [22]. Il est bien établi que le facteur majeur de la régulation de la sécrétion de rénine est l'activité du système nerveux sympathique. En effet, l'innervation sympathique rénale est abondante au niveau des cellules myo-épithéliales juxtaglomérulaires de l'artériole afférente, sécrétrices de rénine. Cependant, l'étude de Blair et al. [23] montre que la CRP augmente après 48 heures de privation hydrique chez le rat, même après dénervation rénale et ablation médullo-surrénalienne. Ceci indique que d'autres mécanismes contribuent fortement à l'augmentation des taux de rénine plasmatique en réponse à la déshydratation. Un mécanisme serait basé sur le fait que la libération de rénine est stimulée par les changements des mouvements des électrolytes au niveau rénal, associés à une réduction de la kaliémie, une natriurèse et/ou une balance sodique, potassique et chlorique négative qui surviennent au cours de la privation hydrique [24]. Un autre mécanisme, induisant une partie de l'augmentation des taux plasmatiques de rénine, serait dû à la baisse du taux du métabolisme hépatique de cette enzyme. Le taux de dégradation de la rénine est proportionnel au flux sanguin hépatique [25], et il est bien connu que ce dernier diminue en réponse à la déshydratation [26]. Ainsi, l'augmentation des taux de rénine plasmatique, au cours d'une privation hydrique, serait attribuée, d'une part, à une augmentation de libération de rénine et, d'autre part, à une baisse du taux de clairance métabolique de l'enzyme.
Par ailleurs, nous avons remarqué que la privation hydrique chronique constitue un puissant stimulus physiologique de la sécrétion d'AVP. L'augmentation des taux circulants de l'AVP concomitante à sa déplétion neurohypophysaire est induite par l'hyperosmolalité et l'hypovolémie consécutives à la déshydratation [27]. La libération de l'hormone neurohypophysaire a pour but la rétention de l'eau libre au niveau des tubes collecteurs du rein, afin de minimiser les pertes hydriques. Au niveau hypothalamique, nous avons enregistré une baisse des taux d'AVP après la déshydratation chronique. Cependant, plusieurs auteurs ont montré l'activation des neurones vasopressinergiques au cours de la privation hydrique [28,29]. D'autres travaux ont signalé que l'augmentation de l'osmolalité plasmatique stimule l'expression des ARNm de l'AVP hypothalamique [30]. Ainsi, la baisse de l'AVP hypothalamique que nous avons enregistrée, malgré l'induction de sa biosynthèse par la déshydratation, impliquerait le fait que le taux de disparition de l'hormone de cette région, c'est-à-dire son transport axoplasmique, ait lieu plus rapidement que le taux de synthèse lorsque la déshydratation se prolonge.
Nos résultats indiquent que la déshydratation chronique n'affecte pas l'activité de l'axe corticotrope, alors que nos travaux précédents ont montré une activation de cet axe après une déshydratation aiguë de trois jours, reflétant un état de stress [31]. Or, les travaux de Dohanics et al. [32] et ceux de Chowdrey et al. [33] montrent que la sécrétion de la corticostérone n'est pas altérée chez des rats recevant une charge sodique à 2 % pendant 7 et 12 jours respectivement. Il semble donc que la normalisation de l'activité corticotrope au bout de 17 jours de déshydratation intermittente est en faveur d'une possible adaptation de l'animal au stress hydrique. Cependant, l'affirmation de l'adaptation de l'animal nécessite des travaux complémentaires, qui consistent en la détermination de l'évolution de la sécrétion hormonale au cours du temps ; les mesures réalisées au 17e jour ne représentent qu'un seul point de cette évolution. Par ailleurs, il est bien établi que l'AVP circulante peut stimuler les cellules corticotropes hypophysaires induisant la sécrétion d'ACTH [34]. Or, d'après notre étude, la concentration de l'ACTH reste stable, malgré les taux élevés de l'AVP enregistrés au cours de la déshydratation chronique. Des réponses similaires ont été décrites durant une privation hydrique prolongée [35] et durant une stimulation osmotique chronique chez le rat [33]. Ainsi, nous pouvons suggérer qu'il y aurait des mécanismes additionnels capables de vaincre l'effet stimulateur de l'AVP, tels que des influences neuronales et humorales secondaires aux variations du volume et d'autres facteurs non encore identifiés, comme par exemple la substance-P, pouvant être considérés comme des médiateurs potentiels de l'inhibition corticotrope [33]. L'élévation soutenue d'AVP plasmatique après une stimulation osmotique chronique pourrait aussi conduire à une désensibilisation de l'hypophyse à cette hormone et, par conséquent, à une réduction de la réponse sécrétoire de l'ACTH. De plus, une étude récente a montré que l'activité CRH-like de l'AVP n'est pas nécessaire à l'activation du système hypothalamo-hypophyso-surrénalien induite par une privation hydrique chez le rat [36].
D'après notre étude, la privation hydrique chronique est associée à une activation de la synthèse du NO reflétée par l'augmentation des teneurs des NOx plasmatiques. O'Shea et Gundlach [37] ont observé un accroissement de l'expression des ARNm et de l'activité des NOS au niveau des NPV et NSO hypothalamiques, suggérant une activation de la synthèse de NO, après une privation hydrique. Cette activation pourrait être due, d'une part, à la hausse des taux d'AVP systémique [38] et, d'autre part, à l'activation du système nerveux sympathique [39]. En effet, il a été démontré par Gharbi et al. [40] que la privation hydrique chronique provoque l'activation du système vasopressinergique et du système nerveux sympathique central et périphérique. Les mêmes auteurs ont également enregistré une élévation de la pression artérielle dans ces conditions. Or, le NO, diffusant des cellules endothéliales, est connu pour entretenir un tonus vasodilatateur puissant sur l'ensemble de l'arbre circulatoire [41]. Ainsi, il pourrait avoir un effet tampon sur la vasoconstriction et, par conséquent, sur l'hypertension induites par la déshydratation [42,43]. Ce mécanisme est probablement important dans le maintien d'un flux sanguin continu aux organes vitaux au cours du stress hydrique.
Le NO libéré joue un rôle important dans le maintien de l'équilibre de la balance hydrique. En effet, il participe à la régulation de la réabsorption de l'eau au niveau des tubes collecteurs des reins [38] et à la régulation du comportement de la prise hydrique par son action dipsogénique [44]. Par ces effets, le NO favorise une balance hydrique positive.
L'axe corticotrope n'échappe pas à l'action du NO. Certains auteurs ont montré que le NO stimule la libération de la CRH [45], tandis que d'autres ont montré l'inhibition de celle-ci [46,47]. Des études réalisées in vitro suggèrent que le NO peut jouer un double rôle dans le contrôle de l'axe corticotrope, l'un inhibiteur et l'autre stimulateur selon la nature du stress [48] et la zone du système nerveux central mise en jeu [49]. Notre étude semble indiquer qu'au cours du stress hydrique le NO jouerait plutôt un rôle inhibiteur et serait en faveur d'une normalisation de l'activité de l'axe corticotrope. L'affirmation d'une véritable relation de cause à effet est cependant prématurée et nécessite des études complémentaires.
Nous pouvons conclure que la déshydratation chronique entraı̂ne une normalisation de l'axe HCS et induit une multitude de modifications physiologiques telles que la baisse de la volémie et l'augmentation de l'osmolalité plasmatique, concomitantes à des variations de certains systèmes hormonaux impliqués dans le maintien de l'homéostasie hydrique. En particulier, l'axe de synthèse de NO, qui est activé par la déshydratation chronique, jouerait un rôle clé dans l'équilibre de la balance hydrique. Toutefois, le rôle physiologique exact joué par le NO dans ces processus reste largement inconnu.


