Abridged English version
Cancer is a complex process caused by a cellular dysfunction leading to a whole organ or even organism vital perturbation. To better understand this process we need to understand each of the levels involved and what allows the change of scales.
A matricellular protein, called PAI-1 (Plasminogen Activator Inhibitor type I) has been identified as able to induce cell adhesion, reorganization of actin cytoskeleton and morphological changes, and to promote cell migration. PAI-1 participates in a regulation network linking the extracellular matrix and the cell. The molecular bridge formed by this protein and others is able to transduce biochemical and biomechanical signals to the cell. The cell response can be evaluated in terms of mRNA rate constants. It can further be assessed by the evaluation of migration mode or speed. We are using the game theory and the game network theory to model this dynamic at the cell scale.
PAI-1, found closely around the most invasive tumours, represents an independent factor of bad prognosis. Cancer cells, having undergone the epithelial-mesenchymal transition (EMT), can use PAI-1 for their migration. However, if the environment is very rich in PAI-1, the cells undergo a second transition, the so-called mesenchymal–amoeboid transition (MAT). Their migration becomes then ‘amoeboid’ and is very different from the mesenchymal migration, at least by the independence towards integrins and protease activity. This amoeboid state is characterized by a complete reorganisation of actin (with actin rings) and by the activation of the Rho GTPases transduction pathways. Furthermore, in the presence of this particular (i.e. PAI-1-enriched) environment, the cells down-regulate their PAI-I mRNAs rate constants.
From the cellular level to the tissue level
The regulation network occurs at the cellular/microenvironmental level and includes a PAI-I concentration threshold. However, the consequences of a unique cell MAT can be its escape from the initial tumour, i.e. metastatic migration. If this occurs, the moving cancer cell will meet a microenvironment in which PAI-1 progressively decreases, and the cell could return to the mesenchymal condition through an inverse transition (form amoeboid to mesenchymal behaviour). As it is a cancer cell, it will proliferate, produce more PAI-I (a characteristic of the most invasive cells) and perhaps again undergo MAT. The PAI-I negative feedback in terms of RNAs, described earlier, could help this regulation to occur. We have perhaps identified one of the conditions for a cell to undergo MAT and return. This might be of importance in the understanding of the metastatic escape. To complete our experimental approach, we used the Game theory to model the molecular network involved in this process (see Manceny et al. [37]).
A nonlinear system
The regulation of a given cancer cell behaviour by its PAI-1 microenvironment could then be considered as a cause leading to consequences at the organ or the organism level. And its critical transition point is that one single molecule of PAI-1 could do the job! In avalanches, it is known that at the critical state, the output is not proportional to the input, that is, the system is highly nonlinear and gives rise to ‘non-obvious’ effects. Could the PAI-1 swing (i.e. effect of one more or one less molecule of PAI-1) control the ‘biological avalanche’ of cancer? This hypothesis is illustrated in Fig. 1.
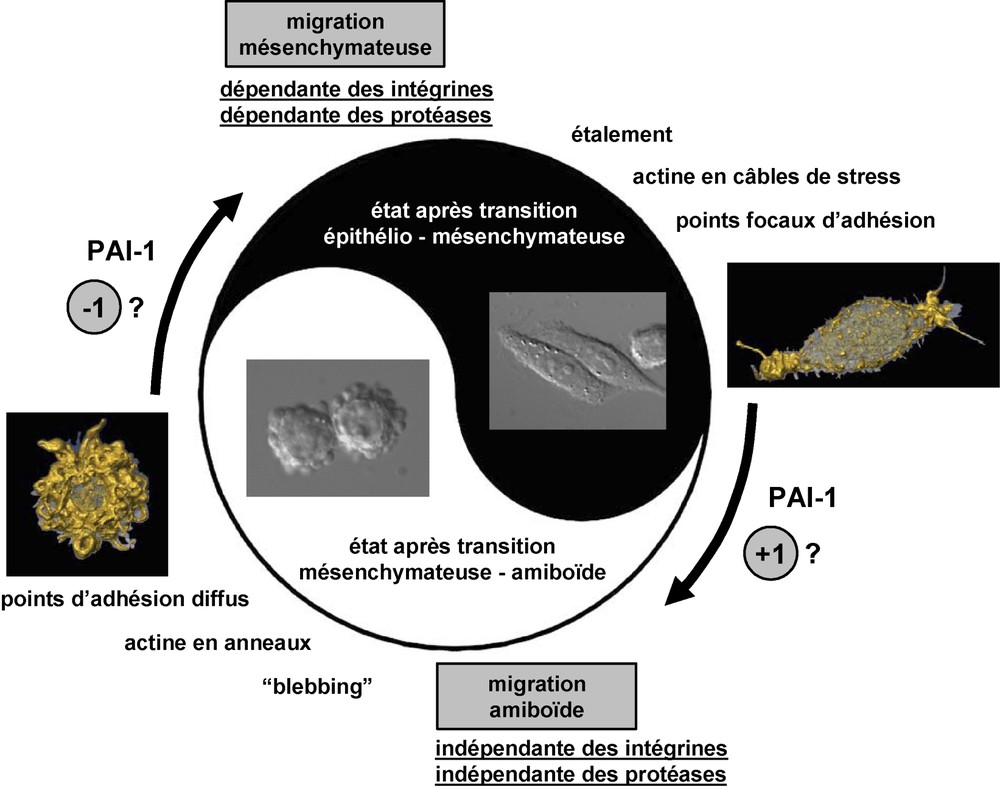
Le yin et le yang de la migration d'une cellule cancéreuse (hypothèse inspirée de [10]). Les cellules cancéreuses ayant subi une transition épithélio-mésenchymateuse sont des cellules qui adhèrent fortement à la matrice extracellulaire : elles présentent des points focaux d'adhésion et une structure profonde et stable du cytosquelette d'actine en câbles de tension, responsables de leur aspect fusiforme (photographie et image de droite). Cet état conditionne soit la prolifération cellulaire, soit une migration cellulaire de type mésenchymateuse mettant en jeu les intégrines et les protéases dans une dynamique d'interactions adhérence/protéolyse avec la matrice extracellulaire. Dans l'état de transition mésenchymateuse–amiboïde, les cellules cancéreuses maintiennent une migration de type amiboïde, qui est indépendante des intégrines et qui n'implique pas de protéolyse. Les cellules sont peu adhérentes à la matrice extracellulaire, leur cytosquelette d'actine s'organise en anneaux corticaux et instables responsable du blebbing (photographie et image de gauche). La migration amiboïde est favorisée par une concentration élevée de PAI-1 matriciel dans le microenvironnement, à l'inverse de la migration mésenchymateuse. Nous avançons l'hypothèse que l' « aiguillage » réversible du type de migration et la conversion de l'état mésenchymateux vers l'état amiboïde dépend de la concentration matricielle en PAI-1. La variation d'une seule molécule de PAI-1 pourrait faire basculer la cellule d'un état à un autre. (NB : les photographies sont réalisées en contraste de phase, les images sont des reconstructions en trois dimensions du cytosquelette d'actine permettant d'en distinguer les structures).
The yin and yang of a cancer-cell migration that underwent the epithelio-mesenchymal transition (inspired from P. Friedl, 2004). These cells adhere strongly at the extracellular matrix: they show focal contacts and a dense and profound organization of the actin cytoskeleton (stress fibres) responsible for their spindle-shape aspect (photograph and picture on the right). Two cell behaviour are dependent on that state. Cell proliferation or cell migration (mesenchymal type) that involves integrins and proteases in a dynamic interaction of adhesion and proteolysis. In the state of mesenchymal-amoeboid transition, cancer cells maintain an amoeboid type migration that is independent of integrins and proteolysis. Cells are loosely adherent to the extracellular matrix, their actin cytoskeleton is organized in instable cortical rings responsible for the ‘blebbing’ phenomenon (photograph and picture on the left). The amoeboid migration is favoured by a high concentration of matrix PAI-1 in the microenvironment, conversely to mesenchymal migration. We hypothesize that the reversible ‘switching’ of the migration type and the conversion from the mesenchymal state to the amoeboid state could depend on the concentration of matrix PAI-1. The variation of one single molecule of PAI-1 could make the cell swing from one state to another. (NB: Photographs are shown in phase contrast, pictures are three-dimensional reconstructions of the actin cytoskeleton allowing the observation of organized structures.)
1 Cancer, migration cellulaire : un changement d'échelle ?
Le processus cancéreux est une dynamique complexe : pour mieux comprendre les événements observés à différentes échelles (moléculaire, cellulaire, tissulaire et de l'organisme) il faut intégrer l'ensemble des paramètres qui nous semblent contrôler la dynamique du système dans un modèle mécanistique global.
À l'échelle de l'organisme, il s'agit d'une pathologie. Celle-ci est issue d'un dysfonctionnement moléculaire qui s'exprime à l'échelle de la cellule (dysfonctionnement d'origine génétique). Cette cellule est elle-même sous l'influence de son environnement immédiat. On retrouve en effet des liens étroits entre le processus cancéreux et le milieu extracellulaire, qui peut induire, permettre, favoriser ou au contraire freiner l'échappement métastatique. Ces liens multiples liant la cellule à son environnement se retrouvent à tous les niveaux : à l'échelle cellulaire, ils sont restreints à l'environnement immédiat de la cellule cancéreuse (c'est le microenvironnement cellulaire), à l'échelle du tissu, la nature des liens est la résultante des différents apports, sécrétions ou présence de cellules tumorales et non tumorales ; à l'échelle de l'organe, ces liens dépendent essentiellement des conséquences systémiques de la pathologie.
Ainsi, à chacune des ces échelles, l'environnement influence les processus biologiques ; mais c'est à l'échelle cellulaire que se déclenche un des processus-clés : l'échappement métastatique, qui caractérise l'invasion cancéreuse. Cet échappement nécessite une séquence de phases de migration, puis de prolifération cellulaire. Ce sont, sans doute, les modifications des assemblages moléculaires liant cellules et matrice, ou assemblages matricellulaires, qui vont créer les conditions favorables au déclenchement du processus. Ces conditions incluent l'adoption par les cellules tumorales d'un profil migratoire associé aux conditions de départ du processus. Ce profil peut être caractérisé par des variations moléculaires, morphologiques, « comportementales ».
Un assemblage moléculaire matricellulaire implique l'inhibiteur de l'activateur du plasminogène (PAI-1) sous sa forme matricielle [1]. Lorsque cette molécule est abondante dans le microenvironnement, le comportement migratoire de plusieurs types cellulaires s'en trouve modifié [1,2] en particulier celui de cellules cancéreuses invasives [3]. Il apparaît donc essentiel de déterminer le rôle de PAI-1 matriciel dans le processus cancéreux, d'autant plus que des études cliniques ont montré qu'il représente un facteur indépendant de mauvais pronostic [4] et qu'in vivo, PAI-1 est retrouvé en fortes concentrations dans la matrice, en périphérie des tumeurs [5].
2 PAI-1 : une molécule-pivot dans le processus de migration cellulaire ?
2.1 Migration cellulaire et processus métastatique
Le caractère métastatique des cancers dépend de la capacité des cellules cancéreuses à quitter le tissu d'origine (la tumeur primaire) et ensuite à s'implanter et proliférer ailleurs. La migration cellulaire accompagne l'invasion tumorale et constitue le point de départ du processus métastatique. Les cellules cancéreuses acquièrent de nouvelles propriétés biochimiques et caractéristiques morphologiques leur permettant de s'échapper de la tumeur principale. Une partie de ces transformations est communément appelé EMT (transition épithélio-mésenchymateuse) ; elle se traduit par la disparition des phénotypes épithéliaux au profit de marqueurs mésenchymateux [6]. Les cellules n'expriment plus alors le gène de la E-cadhérine, perdent l'expression de la cytokératine 8 et ré-expriment la vimentine [7].
Les cellules cancéreuses ayant subi l'EMT utilisent spontanément une migration de type mésenchymateux. Ce type de migration est caractérisé par une protéolyse péricellulaire active, l'établissement de points d'ancrages très résistants et un cytosquelette d'actine structuré. Les points focaux d'adhérence à la matrice extracellulaire, par l'intermédiaire des intégrines, participent à l'organisation des filaments d'actine et la formation de protrusions membranaires de types lamellipodes [8].
Mais dans certaines conditions environnementales, les cellules cancéreuses (cellules ayant donc déjà « passé » ou « subi » la transition epithélio-mésenchymateuse) peuvent subir une seconde transition, appelée transition mésenchymateuse-amiboïde (MAT). Dans ce cas, le cytosquelette d'actine se réorganise, abandonnant la formation de fibres de stress, au profit d'une architecture plus légère, avec redistribution diffuse et corticale de l'actine. Cette réorganisation, conduit à la formation d'anneaux d'actine (actin rings) et se trouve sous le contrôle de l'activation de la protéine ROCK-1, un effecteur de la petite GTPase RhoA [9]. La morphologie générale s'arrondit : les cellules présentent de nombreux bourgeonnements ou blebs ; on parle d'une morphologie amiboïde.
Le type de migration de ces cellules cancéreuses devient alors très différent d'une migration mésenchymateuse. Il s'agit d'une migration de type amiboïde dans laquelle les cellules se déforment, leur membrane est animée de mouvements dynamiques liés à la formation/déformation des blebs (on parle de blebbing). Les cellules se faufilent au travers des mailles de la matrice extracellulaire en n'ayant recours, ni à une activité protéasique, ni aux intégrines [10,11] ; en revanche, elles utilisent de nombreux points d'ancrage de faible intensité et des séquences d'adhésion/dé-adhésion très rapides [12,13].
Nous avançons l'hypothèse que PAI-1 joue un rôle clé dans l'ensemble de ces processus. Pour comprendre ce rôle, il faut se placer à l'échelle cellulaire et considérer PAI-1 en modulateur des fonctions cellulaires.
2.2 PAI-1 est un modulateur des fonctions d'adhésion et de dé-adhésion cellulaires
PAI-1 est le principal inhibiteur de l'uPA ou activateur du plasminogène de type urokinase, une sérine protéase qui convertit le plasminogène en plasmine. PAI-1 existe, soit à l'état soluble, soit associé à la matrice.
Sous sa forme soluble, PAI-1 se lie à l'uPA, elle-même fixée à son récepteur membranaire, l'uPAR. Cette interaction aboutit à l'arrêt de la protéolyse péricellulaire dépendante de l'uPA. La fixation de PAI-1 conduit à l'endocytose du complexe uPAR–uPA–PAI-1 par le biais d'un récepteur spécifique de l'internalisation, le α2MLRP. Le complexe uPA-PAI-1 est dégradé tandis que le récepteur uPAR est recyclé à la membrane [14,15].
Sous sa forme associée à la matrice, on parle alors de PAI-1 matriciel (ou PAI-1m), PAI-1 est lié principalement à la vitronectine [16]. Lorsque le complexe uPAR–uPA–PAI-1 se forme avec le PAI-1matriciel, il constitue alors, un pont moléculaire liant la cellule à la matrice extracellulaire. In vitro, le PAI-1 matriciel module les interactions entre la cellule et la matrice [2,17–19] et plus particulièrement lors des processus d'adhésion et de mobilité [3,20].
2.3 PAI-1, un modulateur de la réorganisation du cytosquelette d'actine ?
Dans certaines conditions, l'assemblage moléculaire (uPAR–uPA–PAI-1) relie la cellule à la matrice extracellulaire et est à l'origine de contraintes mécaniques générées par la matrice ou par la cellule. Ces contraintes ont pu être mesurées en terme de forces par magnétocytométrie [21], elles sont directement transmises au cytosquelette et induisent sa réorganisation. Ainsi, la formation du complexe tripartite uPAR–uPA–PAI-1 serait capable de transduire des signaux biomécaniques à la cellule en augmentant la rigidité du cytosquelette [21].
L'assemblage moléculaire (uPAR–uPA–PAI-1) est également capable de transduire des signaux biochimiques et morphologiques à la cellule. En effet, nous avons montré que des cellules placées dans un environnement enrichi en PAI-1 présentent une forte activation de la petite GTPase RhoA ainsi qu'une morphologie arrondie avec de nombreux bourgeonnements membranaires ou blebs, témoins de l'activation de ROCK-1, un effecteur de RhoA. De plus les matrices enrichies en PAI-1 pourraient déclencher des signaux intracellulaires activant la cascade des Rho GTPases [22]. Cette famille regroupant entre autres les kinases Cdc42, Rac1 et RhoA contribue au remodelage du cytosquelette d'actine. En effet Rac1 est impliquée dans la formation des lamellipodes tandis que RhoA stimule l'organisation des filaments d'actine soit en anneaux contractiles soit en fibres de stress [9].
Les différentes morphologies induites par la réorganisation du cytosquelette d'actine sont utilisées lors de la migration cellulaire [23].
2.4 PAI-1 serait un modulateur de la migration cellulaire
In vitro, selon le type cellulaire utilisé (cellules mésenchymateuses, épithéliales, normales ou cancéreuses, invasives ou non invasives) et selon les conditions de culture (en deux ou trois dimensions, avec ou sans sérum, en présence de l'une ou l'autre protéine matricielle) PAI-1 agit soit en favorisant la migration soit en la défavorisant... [3,24–27]. Dans nos expériences, où nous utilisons de très fortes concentrations de PAI-1 (molécule recombinante dont l'activité se maintient 500 h), avec des cellules myogéniques [2], des cellules issues de lignées de cancer du sein [3] ou de cancer colorectal [22], PAI-1 réunit les prérequis pour être considéré comme une molécule « pro-migratoire ». Nous avons pu montrer que son action est d'autant plus efficace qu'on s'adresse à des cellules plus invasives [3], tous les types cellulaires étudiés ayant déjà « passé » ou « subi » la transition épithélio-mesenchymateuse (EMT).
Nous avons observé in vitro qu'un environnement très enrichi en PAI-1 entraîne une modification du comportement des cellules cancéreuses. On observe une activation des GTPases de la famille Rho dans des cellules qui adoptent le mode de migration amiboïde et présentent toutes les caractéristiques morphologiques de l'état post-MAT.
Jusque là, seules des conditions de culture en trois dimensions ont permis d'observer à la fois la morphologie et la migration amiboïdes [11]. En proposant à des cellules cancéreuses colorectales, un environnement très enrichi en PAI-1, nous avons obtenu les mêmes résultats.
PAI-1 à haute concentration apparaît donc comme une protéine capable d'entraîner une transition mésenchymateuse-amiboïde et ses conséquences.
2.5 PAI-1 à l'interface matrice/cellule
Pour ses capacités, in vitro, d'induire l'adhésion cellulaire, la réorganisation du cytosquelette d'actine, des changements morphologiques importants et sa participation au processus de migration cellulaire, PAI-1, sous sa forme matricielle, pourrait être considéré comme une protéine matricellulaire [28]. La famille des protéines dites matricellullaires englobe plusieurs membres, tels que la thrombospondine 1 et 2, l'ostéonectine et l'ostéopontine, par exemple. Ces protéines sont des constituants de la matrice extra cellulaire, mais elles ne participent pas à l'établissement des propriétés structurales de la matrice comme le font les collagènes, les laminines ou la fibronectine. Les protéines matricellulaires permettent de moduler des fonctions cellulaires comme l'adhésion ou la migration [29,30].
L'assemblage moléculaire, formé entre PAI-1 lié à la matrice extracellulaire, d'une part, et l'uPA lié à son récepteur membranaire, d'autre part, semble être capable de transmettre des signaux biochimiques et biomécaniques à la cellule.
3 PAI-1, une molécule pour un changement d'échelle ?
De par sa localisation dans le tissu péritumoral et son rôle de marqueur indépendant de mauvais pronostic, PAI-1 joue évidemment un rôle qui dépasse l'échelle cellulaire…
3.1 À l'échelle moléculaire : une machinerie auto-régulée
Une boucle de régulation négative transforme un environnement très riche en PAI-1 en environnement moins riche en PAI-1. La formation et la déformation du pont moléculaire uPAR–uPA–PAI-1 induit une réponse cellulaire moléculaire et fonctionnelle. La cellule augmente ou diminue sa migration [3] ; elle pourrait également moduler l'expression de certains messagers du système PAs [22,31]. Ainsi le processus migratoire utilisé par les cellules dépendrait à la fois de la biodisponibilité de PAI-1 et de la régulation des éléments du système PAs.
Nous avons observé également, in vitro, que cet environnement très enrichi en PAI-1 entraîne, dans les cellules cancéreuses, une régulation négative des ARNm de PAI-1 [31]. Si l'on suppose que le taux protéique de PAI-1 suit l'évolution des ARNm, la présence de PAI-1, entretenue in vivo par les cellules elles-mêmes, devrait diminuer rapidement. Les cellules se retrouveraient alors dans l'équivalent d'un microenvironnement pauvre en PAI-1.
3.2 À l'échelle cellulaire : des états réversibles
À l'échelle d'une cellule, une boucle d'interactions implique, d'une part la cellule et son microenvironnement, avec les changements morphologiques observés et d'autre part, la membrane et le noyau, avec les régulations des messagers et, sans doute, des protéines.
Ici le réseau de régulation qui régit le comportement cellulaire pourrait être dépendant de la concentration relative de PAI-1 avec deux points critiques : la concentration de PAI-1 qui engage la cellule dans la transition MAT et celle qui permettrait la transition inverse.
Une faible variation de cette concentration microenvironnementale de PAI-1 pourrait entraîner des conséquences catastrophiques. Les conséquences envisageables d'une seule transition MAT sont disproportionnées par rapport à la cause. En effet, la transition MAT offre à la cellule qui s'y engage la possibilité de s'échapper de la tumeur initiale, d'entreprendre une migration métastasique et, grâce à la dynamique du microenvironnement, à la faveur d'une transition inverse, de s'arrêter. Ceci implique, pour la cellule cancéreuse, un retour possible au « comportement » prolifératif initial et éventuellement l'établissement d'une tumeur secondaire. La régulation négative du taux d'ARN messagers de PAI-1 pourrait y contribuer.
Si tel est le cas, la cellule cancéreuse qui a repris sa condition de cellule cancéreuse initiale, non migrante, va proliférer, produire du PAI-1 (une caractéristique de la plupart des cellules cancéreuses invasives) et à nouveau se trouver dans les conditions de la transition MAT. Les points critiques de cette situation seraient des seuils de concentration en PAI-1 matriciel. Ils pourraient être franchis, symétriquement, par la variation (c'est-à-dire l'augmentation ou la diminution relative) de la concentration de PAI-1 dans le microenvironnement de la cellule en question.
Cette dynamique des liens cellule/microenvironnement induit un changement qualitatif du comportement cellulaire pouvant influencer la migration ou la prolifération. À chaque changement des conditions environnementales, la cellule peut se retrouver entraînée dans une nouvelle dynamique.
L'émergence d'un comportement migratoire, le retour vers un comportement non migratoire – possiblement prolifératif – ou la transition vers un autre type de migration est un changement qualitatif, à l'échelle cellulaire. Il peut conduire à des conséquences d'une toute autre échelle : la création d'une métastase. Celle-ci est en effet le résultat d'une séquence de phases de prolifération, d'une phase de migration suivie au moins d'une nouvelle phase de prolifération. Comprendre le processus métastatique implique donc de comprendre comment une même cellule issue d'une même tumeur initiale peut se comporter, soit en cellule proliférative, soit en cellule migrante – que cette migration soit de type adhésion–extension–dé-adhésion, soit de type amiboïde.
PAI-1 est capable d'induire la migration amiboïde, et initie une boucle de rétroaction négative conduisant à une diminution de sa biodisponibilité : il pourrait donc représenter un carrefour de transition. D'ailleurs, des souris dont le gène de PAI-1 a été annulé (KO pour PAI-1), réagissent à l'injection de cellules tumorales en développant des tumeurs moins volumineuses avec un nombre de métastases très diminué, en comparaison avec les souris non mutantes [32].
La Fig. 1 tente de résumer l'hypothèse de la dynamique pour une cellule, des liens cellule/microenvironnement relatif à PAI-1.
3.3 À l'échelle du tissu, puis de l'organisme : une situation d'échappement
En utilisant cet environnement particulier (c'est-à-dire très enrichi en PAI-1) nous cherchions en fait, à mimer les conditions dans lesquelles les cellules tumorales se trouvent in vivo. En effet on décrit la présence d'un « bouclier » de PAI-1 à la périphérie des tumeurs très invasives [33]. Cet environnement de PAI-1 est créé, d'une part, par les cellules tumorales elle mêmes [3] ; il est en effet connu que, plus les cellules sont « invasives », plus elles sécrètent de PAI-1. D'autre part, les cellules stromales produisent également du PAI-1 [34]. Nous abordons ainsi une échelle supérieure, celle de l'environnement de la tumeur, ou échelle tissulaire.
On admet généralement que la probabilité d'échappement métastatique concerne moins d'une cellule tumorale sur 10 000, et que c'est une moindre proportion qui sera à l'origine d'une tumeur secondaire. Il s'agit d'un événement rare, et pourtant essentiel. Dans les avalanches, il est connu que la résultante n'est pas proportionnelle à la cause, c'est-à-dire que le système est non linéaire. C'est d'ailleurs cette non-linéarité des effets par rapport aux causes qui rend nécessaire une modélisation adéquate pour mieux comprendre le processus en cause.
Dans notre exemple, une seule molécule de PAI-1 pourrait-elle jouer le rôle d'amorce de cette avalanche biologique – catastrophique – conduisant à la métastase ? Et inversement ?
4 Conclusion : la dialectique de la migration d'une cellule cancéreuse
Nos observations, réalisées à l'échelle cellulaire et moléculaire, pourraient rendre compte d'un micro-état (ou état local) du système. Mais c'est à une toute autre échelle de complexité que s'évalue le résultat de l'évolution du processus de migration d'une cellule cancéreuse vers un retour à la phase proliférative. Ce nouvel état, que l'on pourrait qualifier d'émergeant, réunirait les pré-requis du développement d'une métastase. L'ensemble des dynamiques cellulaires et leurs résultantes représenteraient l'état global, ou macro-état.
Pour comprendre le processus métastatique, il ne s'agit pas seulement d'identifier une cascade d'interactions moléculaires, aussi essentielle soit-elle, mais il faut la réinscrire dans la dynamique du microenvironnement et des relations cellules-matrice, puis (ré)intégrer les changements et leurs conséquences à différentes échelles. La conscience des limites de « l'exercice biologique expérimental » pour expliquer des mécanismes aussi complexes que celui de l'échappement métastatique nous incite à utiliser la modélisation mathématique, d'une part, pour tester des lois de comportement qu'on ne peut atteindre qu'après d'innombrables expériences et, d'autre part, pour limiter ces expériences à la validation ou à la réfutation d'un modèle [35].
Il apparaît évident que la généralisation des effets possibles de PAI-1 n'est pas raisonnable en biologie cellulaire classique.
Pour notre part, nous avons évalué les effets de nombreuses concentrations de PAI-1 sur différents types cellulaires, sur le plan biochimique comme sur le plan morpho-dynamique. Mais si nous nous bornons à l'approche expérimentale pour mieux comprendre les lois de « comportement » cellulaire propices à l'échappement métastasique, il nous faudrait utiliser des gammes considérables de concentrations de PAI-1, de temps d'exposition, de densités cellulaires, de types cellulaires d'invasivité croissante ; ensuite il nous faudrait produire puis intégrer une quantité gigantesque de données.
La modélisation peut nous faire approcher ces lois de comportement cellulaire en évitant cette inflation expérimentale ; dans un esprit de dialogue interdisciplinaire, nous pourrions ensuite en vérifier « à la paillasse » la pertinence, et progressivement aboutir à la simulation.
Une première modélisation, par la théorie des jeux et plus précisément celle des réseaux de jeux, développée par Franck Delaplace, nous a permis de décrire une partie de la dynamique de l'assemblage moléculaire uPAR–uPA–PAI-1 et de calculer deux états stables [36]. Sur le plan du comportement cellulaire, ces états stables correspondent, l'un à l'état après MAT observé dans un microenvironnement riche en PAI-1, l'autre à l'état après EMT observé dans un microenvironnement pauvre en PAI-1. Ainsi, nous faisons l'hypothèse que la concentration de PAI-1 matriciel oriente le devenir d'une cellule cancéreuse ayant subi l'EMT, soit en la maintenant dans un état « post-EMT » (faible concentration en PAI-1 matriciel), favorable à une migration conventionnelle et possiblement à un retour à l'état prolifératif, soit en lui faisant subir la MAT (forte concentration en PAI-1 matriciel), favorable à la migration amiboïde et à l'échappement métastatique.
Sans prétendre utiliser « la meilleure » ou la seule modélisation adéquate, nous poursuivons, dans une approche interdisciplinaire, une modélisation, par la théorie des réseaux de jeux, des interactions cellule–microenvironnement spécifique des cancers solides. Ce type de modélisation est présenté dans ce numéro, dans l'article intitulé Modéliser les interactions moléculaires par la théorie des réseaux de jeux, par M. Manceny, C. Chettaoui, M. Malo, G. Barlovatz-Meimon et F. Delaplace (ce numéro, [37]).


