Abridged English version
The post-harvest quality of the cut flower proves to be a first-choice selection criterion for a rose breeder. This is due to the fact that, because of the increasing complexity of the production–commercialisation networks, the transports and the retaining time of flowers last more and more. In the mean time, the breeders' methods of selection are based on the observation of the evolution in vase, which is difficult to analyse. We did evidence that the evolution of the senescence in vase can be appreciated by measurements of pH, conductivity, and osmolarity of the petals' cell sap of a rose variety [1]. The values of these three observation criteria increase during senescence. We have tried, to check whether physiological tests could be used for selection, with the purpose of foreseeing the post-harvest quality of varieties in process of evaluation. In each of the four seasons of the years 2004 and 2005, we realised the measurements of vase life, pH, conductivity, and osmolarity of cell saps taken on three flowers per variety, out of 27 varieties grown in the same greenhouse of Meilland Incorporated at the Cannet-des-Maures (France). The studied petals were directly removed from the plant after the corresponding flowers had achieved a well-defined flower bud-opening stage: ‘the cracked bud stage’ [5].
For this group of varieties, we have been able to establish regression lines between the average values of the three parameters and the average notes gathered during the holding in vase. The measurements of pH and of osmolarity did not happen to be correlated to the behaviour in vase life tubes. Conductivity happens to be correlated (). When the correlation is tested on varieties grouped by colours (white, yellow and ochre; pink and red; multicolour), and no longer on the overall mixed varieties, then, the pH is valuable, r varying from −0.78 and −0.91.
The comparative study of the r coefficients characterizing the correlations between the pH and the notes in vase life shows that the former parameter (pH of the cell sap measured in the colour group) is more stable and therefore less dependent upon fluctuations of the cultural neighbouring.
Markings in vase necessitate more flowers, in order to be more reliable. Systematic seasonal replications require a heavy protocol. Therefore, the concerned measurement can be effected on varieties of petals, and it corresponds to a device that enables simultaneous tests in a large number of varieties. Thus, in the past, markings in vase were made on a small number of varieties (about 100 per year) represented by a sufficient quantity of plants (at least 20 per variety). Nowadays, we can use the measure of pH on about 1000 varieties per year, represented by the only seed plant and a first flowering. Consequently, the study of the post-harvest quality can now be started two years in advance compared to the former process (which was exclusively applied to vase life's marking).
The study of the pH only gives information on the potential longevity of the flower, but not on its opening characteristics. Therefore, the measure must be completed with the observation of the opening speed of the plant. We know that they are closely related to the opening speed in the vase life tubes. Thus, the respect of this criterion does not slacken the precocity of intervention during the selection.
1 Introduction
La qualité de post-récolte de la fleur coupée est devenue pour l'obtenteur rosiériste un critère de sélection de tout premier ordre, ceci essentiellement parce qu'en raison de la complexité croissante des réseaux de production–commercialisation, les transports et durée de rétention des fleurs sont de plus en plus longs [2]. Or, les méthodes de sélection utilisées par les obtenteurs reposent sur des observations d'évolution en vase difficiles à standardiser [3–5]. Il semble que les variations de durée de vie en vase puissent être attribuées à des stomates foliaires [6,7] ou à des températures [5] et intensités lumineuses [8,9] différentes. Nous avons pu montrer que l'évolution de la sénescence en vase d'une variété de rose pouvait être appréciée de façon objective et fiable par la mesure du pH, de la conductance, ou de l'osmolarité du suc cellulaire des pétales [1]. Les valeurs de ces trois critères d'observation augmentent au cours de la sénescence. De plus, elles évoluent de façon corrélative avec la sénescence, selon que celle-ci est accélérée ou retardée par différents traitements tels que des apports hormonaux [1,10] ou l'utilisation dans le vase de solutions conservatrices [11].
Nous avons voulu vérifier si les tests physiologiques précités pouvaient être utilisés à des fins de sélection, de façon à prévoir la qualité post-récolte de variétés en cours d'évaluation.
2 Matériel et méthodes
Nous avons pour cela, pour chacune des quatre saisons des années 2004 et 2005, réalisé des mesures de pH, conductance et osmolarité, selon [1], du suc cellulaire, pris sur trois fleurs par variété, de 27 variétés cultivées dans la même serre des établissements Meilland, au Cannet-des-Maures. Les pétales ont été prélevés directement sur la plante après que les fleurs eurent atteint le cracked bud stage [5].
2.1 Cracked bud stage
Le stade était caractérisé par un ou deux pétales, légèrement détachés du reste du bouton, et trois sépales, faisant un angle de 30 ou 45° avec l'axe du bouton, tandis que les deux autres sépales formaient un angle de 90° avec ce dernier.
2.2 Extraction du suc cellulaire et mesure du pH
Le suc était soutiré par une technique de congélation–décongélation [12]. Des pétales étaient récoltés et immédiatement conservés dans de petits tubes et conservés à . Les tubes ont été plongés pendant une minute dans une bassine d'eau à . Le suc cellulaire était rapidement récolté au travers d'un gaz et centrifugé pour 15 minutes à 3000 g. Le surnageant était retiré et son pH mesuré avec une électrode pH.
2.3 Conductivité
La conductivité d'électrolyse du suc dilué (1/50e) était mesurée avec un conductimètre Consort K 320 (précision : 0,001 μs).
2.4 Pression osmotique
La pression osmotique du suc cellulaire était mesurée avec un micro-osmomètre Roebling (précision : 1 milli-osmole).
2.5 Vie en vase
Aux mêmes moments étaient récoltées, au même stade, trois fleurs par variété des mêmes variétés. Ces fleurs étaient disposées dans des éprouvettes de 250 ml, remplies d'eau distillée, dans une pièce climatisée [5]. Elles ont été observées quotidiennement jusqu'à ce que leur fanaison ait été atteinte et notée (sous forme d'une note moyenne par variété) [5,13].
Les trois fleurs par variété étaient coupées à 40 cm. Elles étaient placées dans des éprouvettes de 250 ml, remplies d'eau distillée, et laissées dans une salle de culture maintenue à 23 °C et 70% d'humidité relative, sous une intensité de lumière de 23 W m−2 (Madzafluor B6 TF « P »/CFT tubes), avec une photopériode de 16 h. Leur développement était suivi individuellement jusqu'à ce que deux stades d'ouverture reconnaissables soient éventuellement atteints : « à moitié ouvert », quand au moins trois des pétales du verticille extérieur faisaient un angle de 30° avec l'axe du bouton, et « complètement ouvert », quand cet angle était de 90°. De cette façon, chaque fleur observée pouvait être considérée comme une répétition pour l'analyse statistique.
3 Résultats
Nous avons pu établir, pour ce groupe de variétés, des droites de régression entre les valeurs moyennes des trois paramètres mesurés et les notes moyennes obtenues lors des tenues à l'eau observées lors de l'année 2004. Alors que les mesures du pH (Fig. 1) et de la pression osmotique (Fig. 2) ne semblent pas être corrélées au comportement en éprouvette (les coefficients de corrélation r caractérisant les droites de régression sont respectivement de et ), celles de la conductance (Fig. 3) paraissent, en revanche, bien corrélées (). En ce qui concerne le pH, si la corrélation est testée non plus sur l'ensemble des variétés, mais sur des variétés regroupées par couleurs (blanches, jaunes et ocre ; roses et rouges ; multicolores), elle apparaît alors comme valable (Figs. 4–6), étant caractérisée par des coefficients r variant de à .
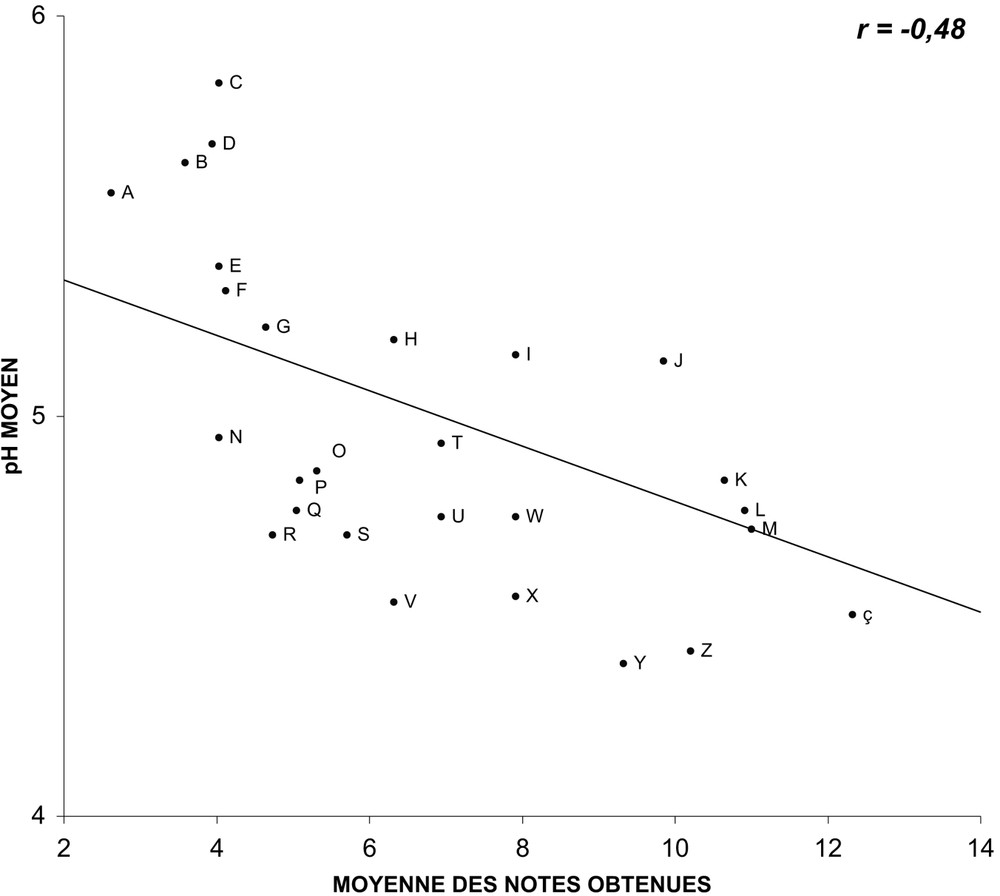
Relation entre le pH moyen du suc cellulaire de pétales et les notes moyennes obtenues en éprouvette pour 27 variétés, mesuré et obtenues lors de quatre répétitions saisonnières en 2004 (les lettres identifient les variétés observées).
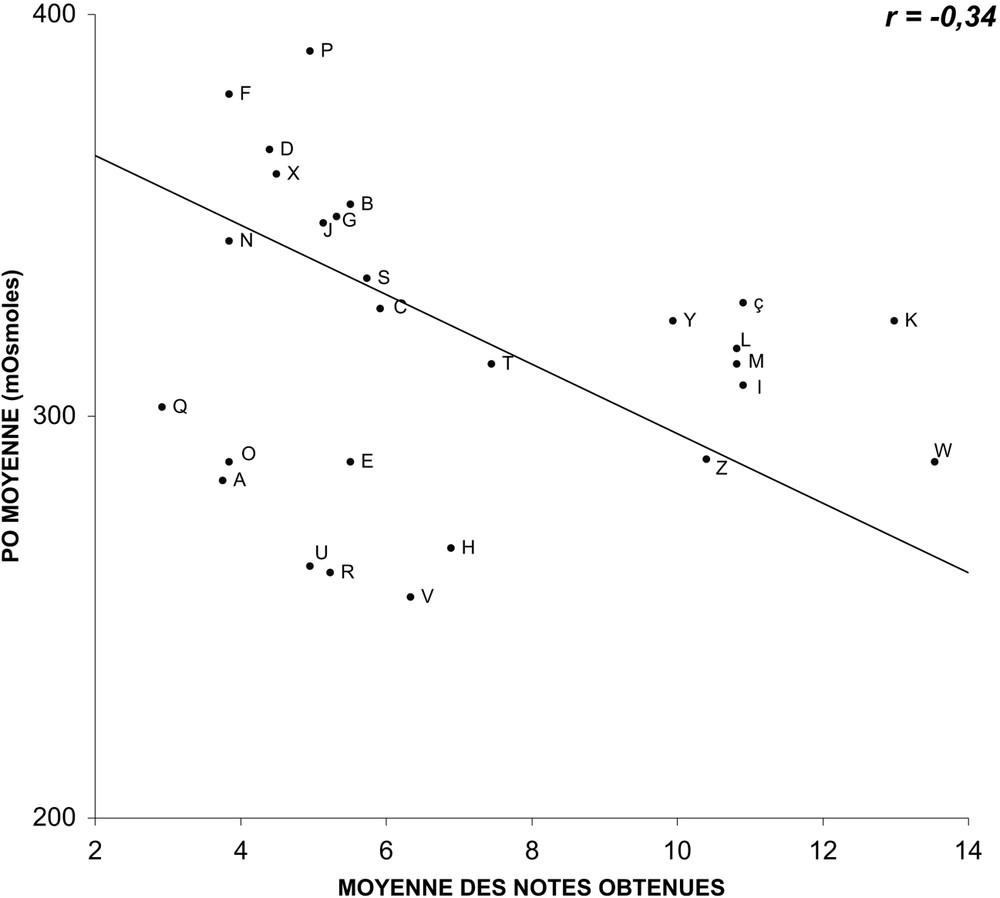
Relation entre la pression osmotique moyenne du suc cellulaire de pétales et les notes moyennes obtenues en éprouvette pour 27 variétés, mesurée et obtenues lors de quatre répétitions saisonnières en 2004 (les lettres identifient les variétés observées).
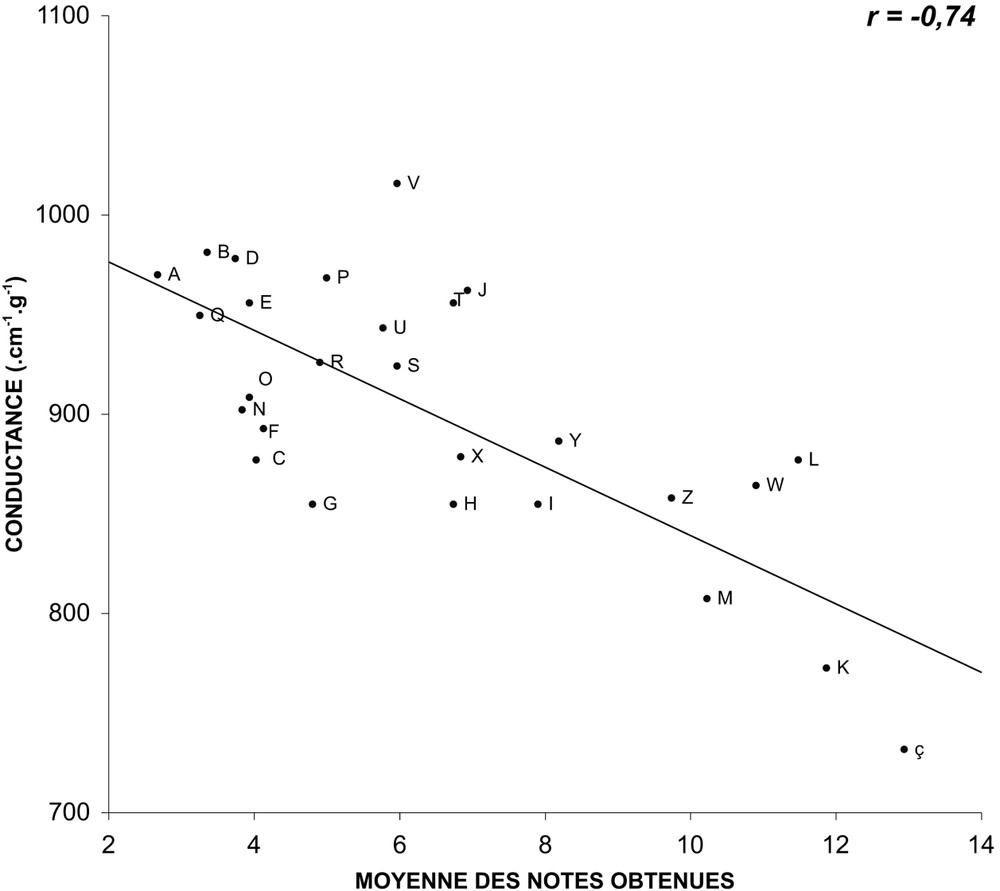
Relation entre la conductance moyenne du suc cellulaire des pétales et les notes moyennes obtenues en éprouvette pour 27 variétés, mesurée et obtenues lors de quatre répétitions saisonnières en 2004 (les lettres identifient les variétés observées).
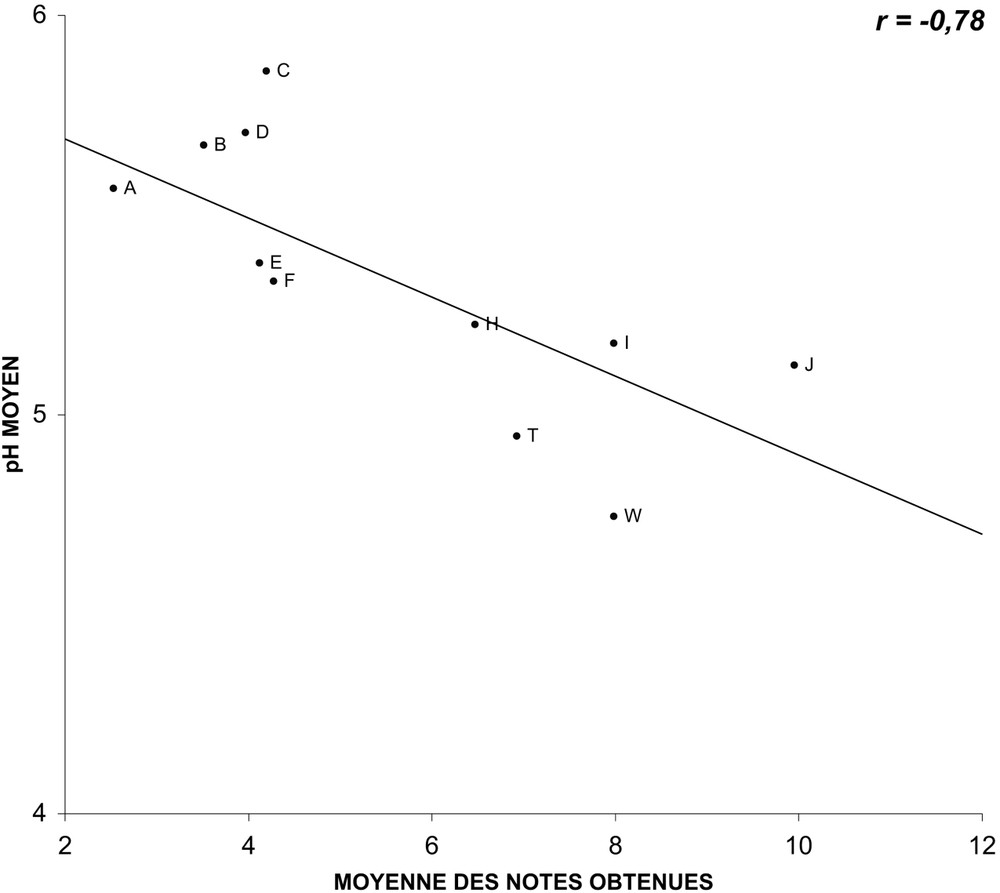
Relation entre le pH moyen du suc cellulaire des pétales et les notes moyennes obtenues en éprouvette pour les variétés blanches, jaunes et ocre, mesuré et obtenues lors de quatre répétition saisonnières en 2004 (les lettres identifient les variétés observées).
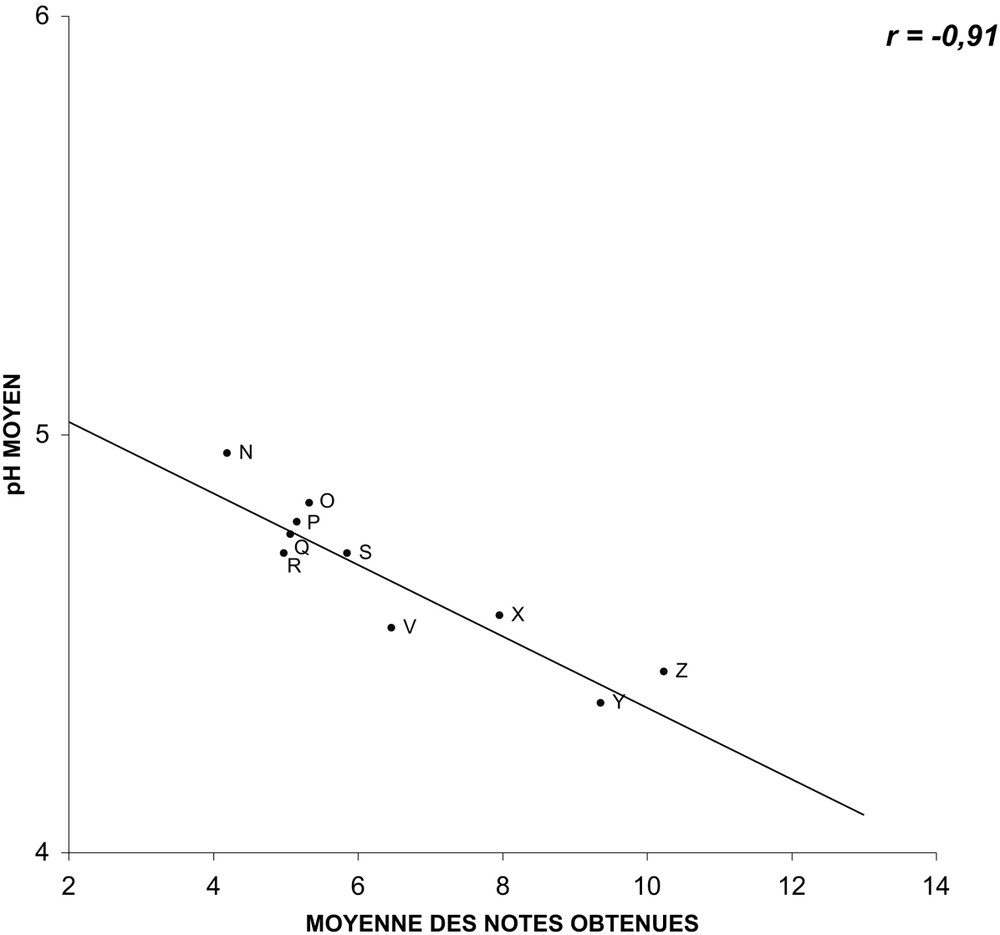
Relation entre le pH moyen du suc cellulaire de pétales et les notes moyennes obtenues en éprouvette pour les variétés roses et rouges, mesuré et obtenues lors de quatre répétitions saisonnières en 2004 (les lettres identifient les variétés observées.)
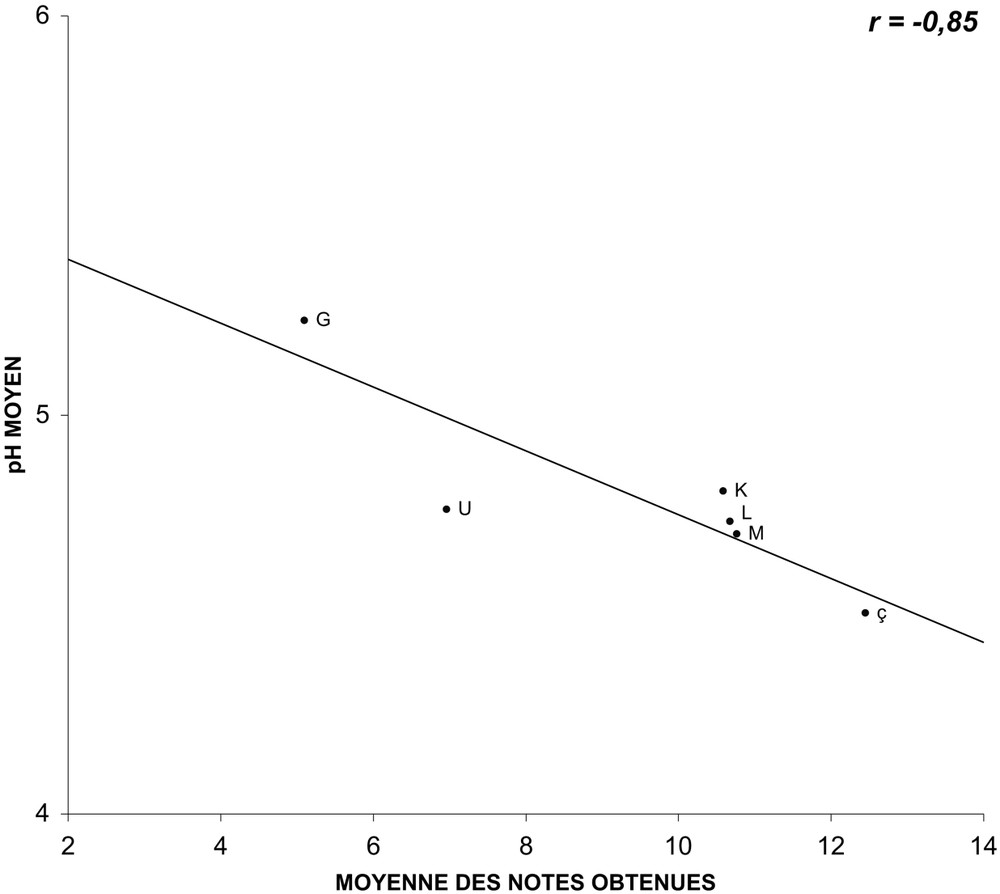
Relation entre le pH moyen du suc cellulaire des pétales et les notes moyennes obtenues en éprouvette pour les variétés multicolores, mesuré et obtenues lors de quatre répétitions saisonnières en 2004 (les lettres identifient les variétés observées).
Ces résultats ont été confirmés par la répétition des mêmes types de mesures et observations lors de floraisons au cours des quatre saisons de l'année 2005 (par exemple, mesure du pH pour les variétés blanches, jaunes et ocre : , ; les roses et rouges : , ; les multicolores : , ). Les coefficients r caractérisant les différentes corrélations testées sont restés du même ordre, confirmant la hiérarchie de valeur des paramètres mesurés, dans un but d'évaluation de la qualité post-récolte variétale.
De plus, l'étude comparative des coefficients r caractérisant les corrélations entre les pH mesurés, d'une part, et les notes obtenues en éprouvette, d'autre part, lors des répétitions saisonnières réalisées en 2004 et 2005, a montré que le premier paramètre (pH du suc cellulaire mesuré au sein d'un groupe « couleur ») était le plus stable, et donc le moins soumis aux fluctuations de l'environnement cultural (Tableaux 1a–c et 2).
Coefficient r caractérisant les corrélations entre les pH du suc cellulaire de pétales de 11 variétés blanches, jaunes et ocre (a), 10 variétés roses et rouges (b), 6 variétés multicolores (c), mesurés ou obtenus lors de répétitions saisonnières effectuées en 2004 et 2005
| Coefficient r | pH mesuré en 2004 | ||||
| (a) | hiver | printemps | été | automne | |
| pH mesuré en 2005 | hiver | 0,94 | 0,91 | 0,88 | 0,89 |
| printemps | 0,92 | 0,83 | 0,90 | 0,89 | |
| été | 0,87 | 0,92 | 0,95 | 0,92 | |
| automne | 0,89 | 0,91 | 0,90 | 0,92 | |
| (b) | hiver | printemps | été | automne | |
| pH mesuré en 2005 | hiver | 0,93 | 0,90 | 0,92 | 0,89 |
| printemps | 0,93 | 0,89 | 0,92 | 0,90 | |
| été | 0,92 | 0,91 | 0,94 | 0,89 | |
| automne | 0,91 | 0,90 | 0,89 | 0,91 | |
| (c) | hiver | printemps | été | automne | |
| pH mesuré en 2005 | hiver | 0,94 | 0,92 | 0,91 | 0,92 |
| printemps | 0,92 | 0,93 | 0,91 | 0,92 | |
| été | 0,89 | 0,89 | 0,92 | 0,93 | |
| automne | 0,89 | 0,94 | 0,89 | 0,90 |
Coefficient r caractérisant les corrélations entre les notations obtenues en éprouvette pour les 27 variétés étudiées, mesurées ou obtenues lors de répétitions saisonnières effectuées en 2004 et 2005
| Coefficient r | Notations de tenue à l'eau en 2004 | ||||
| hiver | printemps | été | automne | ||
| Notations de tenue à l'eau en 2005 | hiver | 0,79 | 0,77 | 0,74 | 0,80 |
| printemps | 0,76 | 0,78 | 0,74 | 0,78 | |
| été | 0,76 | 0,77 | 0,75 | 0,74 | |
| automne | 0,79 | 0,77 | 0,74 | 0,84 |
4 Conclusion
L'amélioration de la conductance et surtout celle du pH du suc cellulaire de pétales de variétés appartenant à un même groupe « couleur » (bien meilleure) nous a permis d'apprécier la qualité post-récolte nettement plus précocement au cours du processus de sélection. La conductance est moins stressée que la pression osmotique par la forme cellulaire [14] ou les solutions salées, la température [15]. Le pH du suc cellulaire avec différents pigments a été mesuré [16–19]. En effet, alors que les notations en vase nécessitent pour être suffisamment fiables une quantité importante de fleurs, des répétitions saisonnières systématiques représentant un protocole lourd, la mesure concernée peut être effectuée sur des pétales variétaux et correspond à un dispositif permettant de tester un grand nombre de variétés simultanément.
Ainsi, alors que les notations en éprouvette ne pouvaient auparavant être réalisées que sur un nombre restreint de variétés (environ 100 par an) représentées par une quantité suffisante de plantes (au moins 20 par variété), nous pouvons aujourd'hui utiliser la mesure du pH sur environ 1000 variétés par an, représentées par le seul plant issu de semis, et ce dès sa première floraison. De cette façon, l'étude de la qualité post-récolte peut maintenant être entreprise avec deux ans d'avance sur l'ancien processus (qui s'appuyait exclusivement sur les notations en vase).
L'étude du pH ne renseignant que sur la longévité potentielle de la fleur et non sur sa cinétique d'ouverture, la mesure doit être accompagnée d'observations de vitesses d'ouverture sur la plante. Nous savons en effet que celles-ci sont étroitement corrélées à la vitesse d'ouverture observable en éprouvette [2]. Ainsi, la prise en compte de ce critère ne ralentit pas la précocité des interventions au cours de la sélection.
Remerciements
Nous remercions M. Alain Meilland pour son aimable autorisation de publication de ces résultats.


