1 Introduction
Les mécanismes exacts qui permettent au stress de réguler la réponse inflammatoire de l’organisme restent flous, malgré nos connaissances quant à l’influence de ce dernier sur l’équilibre Th1/Th2. Ces contradictions peuvent parfois venir du fait que la notion de stress est beaucoup trop large et couvre des situations extrêmement diverses. Le caractère potentiellement stressant d’un stimulus résulte de plusieurs facteurs ; il dépend de la nature de ce stress, mais aussi de la capacité de l’organisme à répondre de façon appropriée à celui-ci, et même du facteur épigénétique. Des études plus récentes tendent à associer les récepteurs nucléaires LXR à d’autres fonctions physiologiques, dont le contrôle des mécanismes gérant le stress. Le développement de ligands pour LXR synthétiques ainsi que la compréhension de l’implication directe de ces récepteurs dans la régulation de l’expression génique de la pro-opiomélanocortine, et indirecte en produisant une variété de cytokines en réponse au stress, vont ouvrir, dans un proche avenir, de nouvelles méthodes thérapeutiques contre les effets indésirables du stress sur le comportement du système immunitaire [1–3].
2 Un aperçu général sur l’univers du stress
Le stress est une réponse réflexe, aussi bien psychologique que physiologique, de l’organisme à une situation délicate qui requiert une adaptation. Il est à la confluence de l’événement objectif et de l’événement subjectif [4,5]. Les mécanismes physiologiques impliqués dans le stress chronique sont nombreux et peuvent contribuer à une grande variété de troubles, dans tous les systèmes, y compris le système immunitaire [6]. Le stress modifie l’équilibre Th1/Th2 via l’axe HPA et un ensemble de médiateurs immunitaires. Cela rendra le corps plus vulnérable aux infections externes d’une manière scientifique, alors que d’autres prétendent le contraire, à savoir que le stress pourrait être considéré comme un stimulant immunitaire [5,7].
3 Les récepteurs hépatiques X, structure et activation
Les récepteurs hépatiques LXRα et β (aussi connu sous les noms de NR1H3 et NR1H2, respectivement) ont été clonés il y a plus d’une décennie sur la base de l’homologie de séquence avec d’autres récepteurs. Les LXR étaient à l’origine considérés comme des récepteurs nucléaires « orphelins », car leurs ligands naturels étaient inconnus [8] ; cependant, ces récepteurs ont été « adoptés » après la découverte de ce que les métabolites du cholestérol – les oxystérols – se lient à ces récepteurs et les activent à des concentrations physiologiques [9]. LXRα est fortement exprimé dans le foie et à des niveaux inférieurs dans les glandes surrénales, l’intestin, l’adipeux, les macrophages, les poumons et les reins, alors que LXRβ est ubiquitairement exprimé [9,10]. Ils sont des facteurs de transcription dépendant du ligand, qui forment des hétérodimères permissifs avec le récepteur rétinoïde X (RXR), c’est-à-dire que le complexe peut être activé par les ligands de l’un ou l’autre des partenaires. Les hétérodimères LXR/RXR se lient aux éléments sensibles aux LXR (LXREs) dans l’ADN constitué de répétitions directes (DRs) de la séquence principale AGGTCA séparées par quatre nucléotides (DR-4) [11,12]. Comme la plupart des autres récepteurs nucléaires qui forment des hétérodimères avec RXR, les LXRs résident à l’intérieur du noyau, où ils sont liés à des LXREs apparentés et en complexe avec des corépresseurs tels que le médiateur silencieux de l’acide rétinoïque et du récepteur hormonal thyroïde (SMRT) ou encore le récepteur nucléaire corépresseur (N-CoR) [13] (Fig. 1).

Les LRX constituent des signaux de transcription qui décèlent le cholestérol. Au sein du noyau, les hétérodimères LXR/RXR sont reliés au niveau des promoteurs des gènes cibles, en complexe avec les corépresseurs. La liaison des ligands d’oxystérol entraîne l’échange du complexe corépresseur en un complexe coactivateur et induit l’expression du gène cible.
En l’absence de ligand, ces actions de type inter-corépresseurs sont maintenues et l’activité transcriptionnelle des gènes cibles est réprimée. La liaison du ligand au LXR entraîne un changement de conformation qui facilite l’échange du complexe coactivateur pour le complexe corépresseur et la transcription des gènes cibles [12,14].
4 L’axe LXR-corticotrope
La compréhension des mécanismes et du rôle précis des LXR dans la physiologie générale de l’organisme aidera en fin de compte à développer des molécules modulatrices qui pourront être utilisées dans le traitement de nombreuses pathologies, inclusivement la prévention des effets indésirables du stress chronique, en particulier l’immunosuppression [1,15]. LXRα et β pourraient remplir un rôle fondamental dans l’activation de l’axe corticotropique, en agissant sur la régulation du polypeptide précurseur de l’expression du gène de la pro-opiomélanocortine (POMC) de l’ACTH dans la glande pituitaire (Giraldi et al., 2011). Avec des ligands synthétiques destinés aux LXR tels que le TO901317 (TO) chez la souris, les chercheurs ont constaté une augmentation significative des expressions ARNm POMC, ACTH et de la corticostérone in vivo. Ceci pourrait être résolu par une supposition, à savoir que le stress chronique agira donc comme activateur de ces récepteurs, conduisant l’organisme à produire des ligands naturels LXRs [16,17] (Fig. 2). Il a été suggéré, par exemple, que le d-glucose et le d-glucose-6-phosphate détectés à des concentrations élevées pendant un syndrome d’adaptation sont des ligands physiologiques pour les deux isoformes des LXRs, qui peuvent fonctionner semblablement au cholestérol [17].
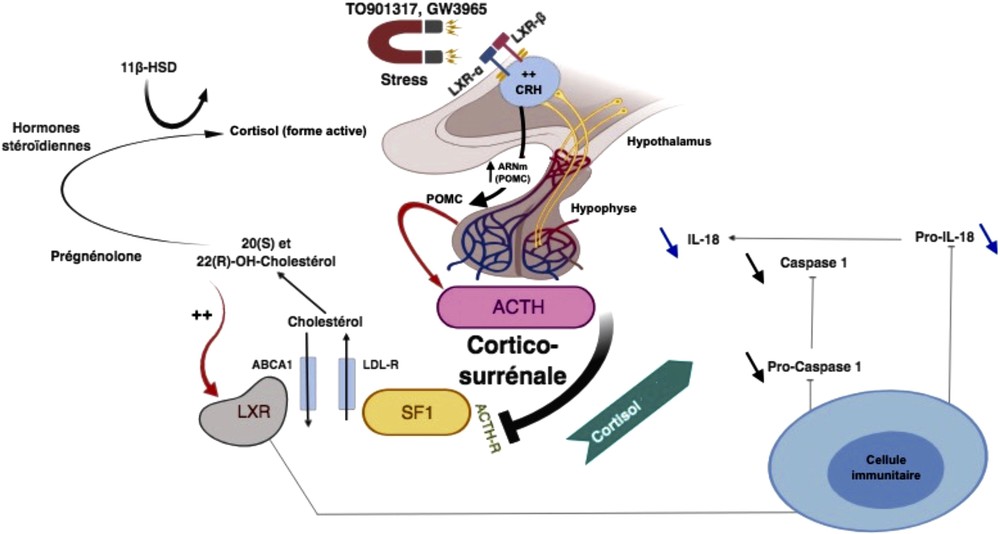
Proposition d’un modèle de signalisation des récepteurs X du foie au niveau de l’axe HPA et du système immunitaire dans une période de stress. L’activation de l’axe HPA par le stress entraîne une accumulation des ligands LXR consécutivement à la stéroïdogenèse. Dans la pituitaire, la stimulation des récepteurs LXR favorisera l’expression de l’ARNm POMC, un précurseur de l’ACTH. En outre, les ligands LXR dans le système immunitaire agiront avec les niveaux des cortisols (formes actives) sur la suppression des cytokines pro-inflammatoires, notamment l’IL-18.
5 Les LXR, un control total du métabolisme face au stress
Le rôle de LXR dans le contrôle du métabolisme des lipides et des glucides a été le plus investigué depuis leur découverte. Toujours est-il que les chercheurs tendent à associer ces récepteurs nucléaires à d’autres fonctions physiologiques [18]. D’une part, après une longue période d’exposition à un facteur physique ou psychique de stress, l’organisme en manque d’énergie commence à appauvrir de ces réserves, notamment le cholestérol [19,20]. La conséquence en est une accumulation de dérivés comme le desmostérol (24-déshydrocholestérol) et l’oxystérol, qui sont de puissants activateurs pour les LXRs. L’inhibition de la desmostérol réductase par le triparanol entraîne une expression accrue des gènes cibles LXR en raison de la formation endogène de desmostérol [21]. L’activité de l’axe corticotropique HPA au cours du stress induit la sécrétion d’hormones stéroïdes, comme le 22R-hydroxycholestérol, considéré comme métabolite intermédiaire pour la biosynthèse de ces hormones à partir du cholestérol ; il agit même comme agoniste endogène des LXRs [22]. D’autre part, de grandes quantités d’oxystérols ainsi qu’un ensemble de dérivés métaboliques activeront le LXR au moment de la réponse au stress, avec pour objectif l’augmentation du flux de cholestérol et la protection contre une éventuelle surcharge phagocytaire par ce dernier [23] – un mécanisme indésirable, lorsque les cellules apoptotiques sont celles phagocytées. En outre, lorsque les macrophages phagocytent des bactéries ou d’autres agents pathogènes qui renferment une quantité importante de cholestérol, les LXR seront stimulés davantage [24]. De même, le stress favorisera probablement les expressions de ABCA1, ABCG1, StAR, CYP11A1 et 3b-HSD1 dans les glandes surrénales en activant les LXRs. Les données suggèrent que T0901317 augmente la corticostérone plasmatique chez les souris de type sauvage et limite l’action immunitaire contre un agent infectieux en conséquence. Les chercheurs expliquent qu’il s’agit d’un mécanisme qui permet aux LXRs de protéger les surrénales de la surcharge en stimulant à la fois le flux de cholestérol et les stéroïdes [15].
Il ressort que la réponse au stress favorisera l’activation du LXR par un ensemble de ligands internes dérivés de produits métaboliques générés par le stress lui-même. Indirectement, ils moduleront l’expression du gène POMC, une production élevée d’hormones du stress et une immunosuppression (Fig. 2).
D’autres recherches impliqueront directement les deux isoformes LXRα et β dans le contrôle de la réponse inflammatoire, la phagocytose et l’apoptose, ceci en régulant la transcription de ABCA1, ABCG1 et en induisant le transport du cholestérol par ces ABC transporteurs [25,26]. Les LXR exercent également une action inhibitrice sur les gènes pro-inflammatoires IL-1β et iNOS, spécifiquement au niveau de leurs promoteurs. Il a été démontré qu’ils peuvent jouer le rôle de facteurs de transcription, notamment pour NF-κB ou AP1, ce qui signifie une action agoniste qui ne passe pas nécessairement par l’ADN [27,28] (Fig. 3). Le même mécanisme permet aux LXR d’inhiber la production d’IL-1β et d’IL-18. Ces récepteurs limiteront la réponse inflammatoire par un contrôle des cytokines pro-inflammatoires. L’IL-18 fait partie de cette catégorie de protéines dont l’activation du LXR empêche la production. En effet, les LXR agissent plus spécifiquement sur la caspase-1 en réduisant les ARNm et l’expression des précurseurs de la caspase-1 [29,30] (Fig. 2).
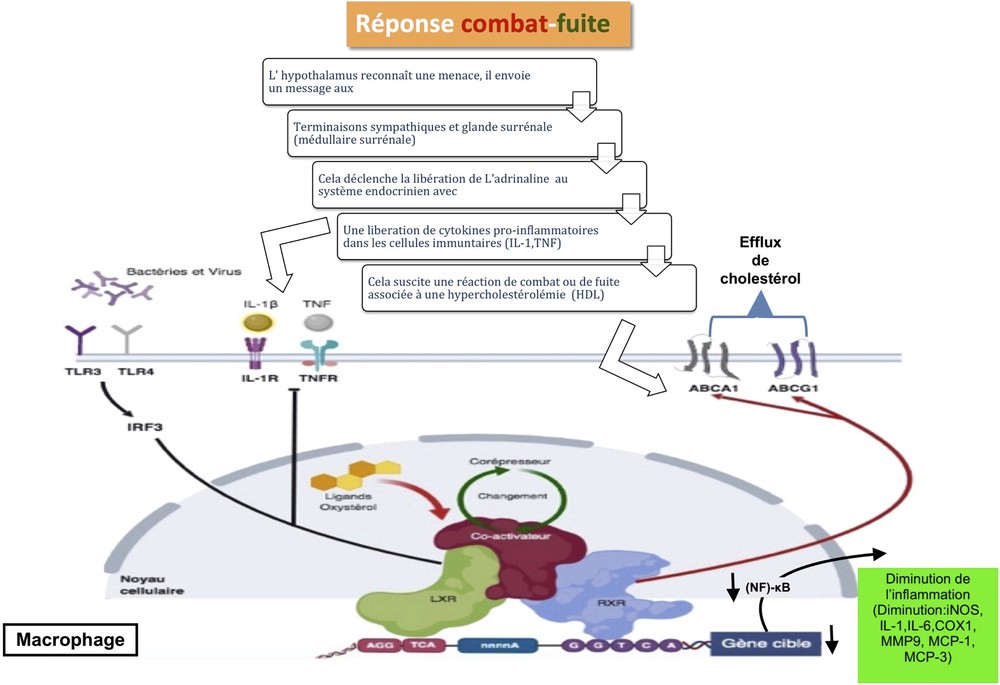
Intégration de la signalisation métabolique et inflammatoire des lipides dans les macrophages lors d’une réponse combat/fuite, réflexe visant à aider une personne à gérer physiquement une menace (le corps perçoit le stress comme une menace). La reconnaissance des cytokines générées en présence du « stresseur » (les cellules de l’immunité Th1) par les récepteurs correspondants déclenche l’expression d’autres gènes pro-inflammatoires (par exemple, INOS). L’activation des récepteurs TLR3/4 par ces signaux bloque la transcription des gènes TLR-dépendants. Par ailleurs, la réaction de l’axe HPA (catécholamine, néoglucogenèse) produit un ensemble de ligands LXRs (efflux de cholestérol) qui vont inhiber l’induction NF-κB-dépendante et l’expression des gènes inflammatoires.
Indépendamment, les facteurs de transcription hématopoïétiques PU.1 et IRF8 sont des facteurs critiques dans l’inflammation et la protection contre les infections. Ils stimulent la maturation des cellules souches en macrophages plutôt qu’en granulocytes, ainsi qu’en lymphocytes CD8 [31]. L’implication du stress en tant qu’activateur de LXRα affecte l’expression des gènes par IRF8 en induisant directement les niveaux d’IRF8 et en favorisant la dimérisation de l’IRF8. Cette amplification de la régulation de l’IRF8, le puissant inhibiteur endogène de l’IL-18, est clairement liée à la réduction de l’expression de l’IL-18 par LXR, démontrant un rôle régulateur négatif sans précédent pour cette cytokine pro-inflammatoire [32,33]. D’autres études ajoutent que l’utilisation d’agonistes LXR a réduit la sécrétion d’interféron gamma (IFN-γ), TNF-α et IL-2 par les lymphocytes Th1, sans avoir d’effet sur la production d’IL-10 et sur les cellules Th2 [33].
Libérée des agressions virales et bactériennes, la protéine C-réactive (CRP) est une protéine prototype en phase aiguë, synthétisée par les hépatocytes en réponse aux signaux pro-inflammatoires, en particulier IL-1b et IL-6. Les CRP jouent un rôle important dans la réponse immunitaire. Ils permettent la mobilisation et l’activation des leucocytes, ainsi que la stimulation de la phagocytose [34]. L’activation renforcée de ces récepteurs en cas de stress comme pour les ligands T0901317, GW3965 est en mesure de diminuer la survenue des CRP induites par les cytokines. Les IL-1b et IL-6 activent la transcription du gène CRP en incitant la dissociation du corépresseur nucléique de son promoteur. Le LXR prévient cet effet, maintenant ainsi le gène CRP dans un état réprimé [35]. In vivo, l’administration de T0901317 pendant trois jours a abaissé les taux de synthèse hépatique, CRP plasmatique et la composant sérique amyloïde-P [36].
6 Un rôle immunostimulateur exercé par les LXR
Et si l’activation des récepteurs LXR était, au contraire, un moyen développé par l’organisme pour lutter contre le stress de manière à rendre ces barrières immunitaires plus efficaces ? Un second groupe de scientifiques tente de prouver cette hypothèse, en rapportant que ces derniers participent à l’amélioration de l’immunité innée ; comme preuve, l’expression LXRα (mais pas LXR β) est fortement stimulée chez les macrophages infectés par des pathogènes intracellulaires tels que Listeria et Shigella flexneri, mais faiblement stimulée par des pathogènes extracellulaires tels que Escherichia coli ou Staphylococcus aureus. En effet, leur activation par les ligands est liée à une augmentation de l’expression du gène anti-apoptotique (Api6) et donc des macrophages. Ceci suggère que les modèles LXR–/–sont plus sensibles aux pathogènes, donc aux différents « stresseurs », parce qu’ils interfèrent avec la régulation à la hausse de l’Api6 induite par l’infection, ce qui mène à l’apoptose prématurée des macrophages [37,38]. Il a été en avantage démontré que la stimulation LXRα réduit le taux d’apoptose des macrophages dérivés de la moelle osseuse (BMM) en réponse à diverses infections par différents pathogènes tels que Salmonella typhimurium, Bacillus anthracis et E. coli [39]. En ce qui concerne les propriétés anti-inflammatoires de ces ligands LXRs, leur profil d’activité est distinct de celui des autres anti-inflammatoires classiques. Les glucocorticoïdes et les antagonistes des cytokines affectent généralement tous les types d’immunité, contrairement aux ligands LXR, qui stimulent simultanément une réponse immunitaire non spécifique tout en supprimant la réaction inflammatoire auto-immune [38,40].
Conclusion
Depuis qu’ils ont perdu leur statut d’orphelin, les récepteurs hépatiques X (LXR) ont rapidement adopté de nouveaux rôles physiologiques. Nous savons maintenant que ces récepteurs sont impliqués dans le métabolisme du cholestérol ou des lipides, mais plus encore dans le syndrome général d’adaptation. Conformément à cela, les LXR sont devenus des intégrateurs du métabolisme et de la modélisation neuro-immunologique face au stress sous forme d’un axe dédié LXR-corticotrope. Les ligands de la LXR sont donc prometteurs en tant que thérapeutiques potentielles, étant donné leurs propriétés anti-inflammatoires. Les travaux futurs se poursuivront afin de définir leurs rôles dans l’immunité et le métabolisme ainsi que d’explorer davantage les voies de signalisations des LXR comme cible dans les maladies cardiovasculaires et inflammatoires humaines à la suite d’une exposition chronique au stress. Une induction particulièrement attrayante consisterait à démontrer in vivo que le « stresseur », en tant que menace externe, peut agir comme un vrai substituant aux agonistes LXR (synthétiques ou naturels), favorisant ainsi le flux de cholestérol et inhibant l’inflammation.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.


