1. Amélioration du riz et apomixie
Avec 500 millions de tonnes de riz blanchi produites sur plus de 160 millions d’hectares, le riz est la première céréale destinée à la consommation humaine et l’aliment de base pour plus de la moitié de l’humanité. C’est une culture vivrière principalement d’autoconsommation puisque seuls 10 % de la production entrent dans des échanges internationaux, contre 20 % pour le blé tendre. Les variétés de riz (Oryza sativa L.) cultivées dans le monde sont issues d’évènements de domestication en Asie, dont le nombre est encore débattu, et qui ont abouti à deux sous-espèces partiellement interfertiles – japonica et indica. Les variétés présentent une large gamme d’adaptations à une diversité de climats, de systèmes de culture, de pratiques et de préférences de consommation. Une domestication indépendante a eu lieu en Afrique pour donner l’espèce Oryza glaberrima Steud., cultivée principalement en Afrique de l’Ouest. Les défis de nourrir la population mondiale (10 milliards d’habitants prévus en 2050) dans un climat changeant tout en réduisant l’impact environnemental de la riziculture (économie d’eau et d’engrais et réduction des émissions de gaz à effet de serre, comme le méthane, dans les rizières), rendent nécessaire la co-conception de nouvelles variétés diversifiées pour répondre à la fois à des demandes locales spécifiques et à cet effort global d’adaptation [1].
La création de nouvelles variétés mobilise les accessions présentes dans la diversité des espèces cultivées et leurs apparentées sauvages (plus de 100 000 chez le riz) en les croisant entre elles pour obtenir des descendances génétiquement variables, notamment pour les caractères agronomiques, au sein desquelles le sélectionneur va choisir les plantes puis les lignées les plus intéressantes au travers de cycles de sélection opérés sur les générations suivantes. Le retour à l’homogénéité variétale est facilité chez le riz, comme chez le blé, par son mode de reproduction sexuée par autofécondation (la plante est dite autogame) : les gamètes présents dans les gamétophytes mâles (le pollen) et femelle (le sac embryonnaire) portés respectivement par l’étamine et l’ovaire, le plus fréquemment appartenant à la même fleur, vont s’unir pour former l’embryon et l’albumen (les réserves) du grain au cours d’un processus appelé double fécondation (Figure 1A). Les gamètes sont le produit final d’une première division cellulaire spécialisée – la méiose – d’une cellule initiale diploïde (deux lots chromosomiques parentaux) au cours de laquelle les chromosomes parentaux vont recombiner et voir leur nombre réduit de moitié pour devenir haploïde. Les cellules résultant de la méiose – la mégaspore fonctionnelle et les microspores, côté femelle et mâle – vont subir des divisions (mitoses) pour former les gamétophytes.
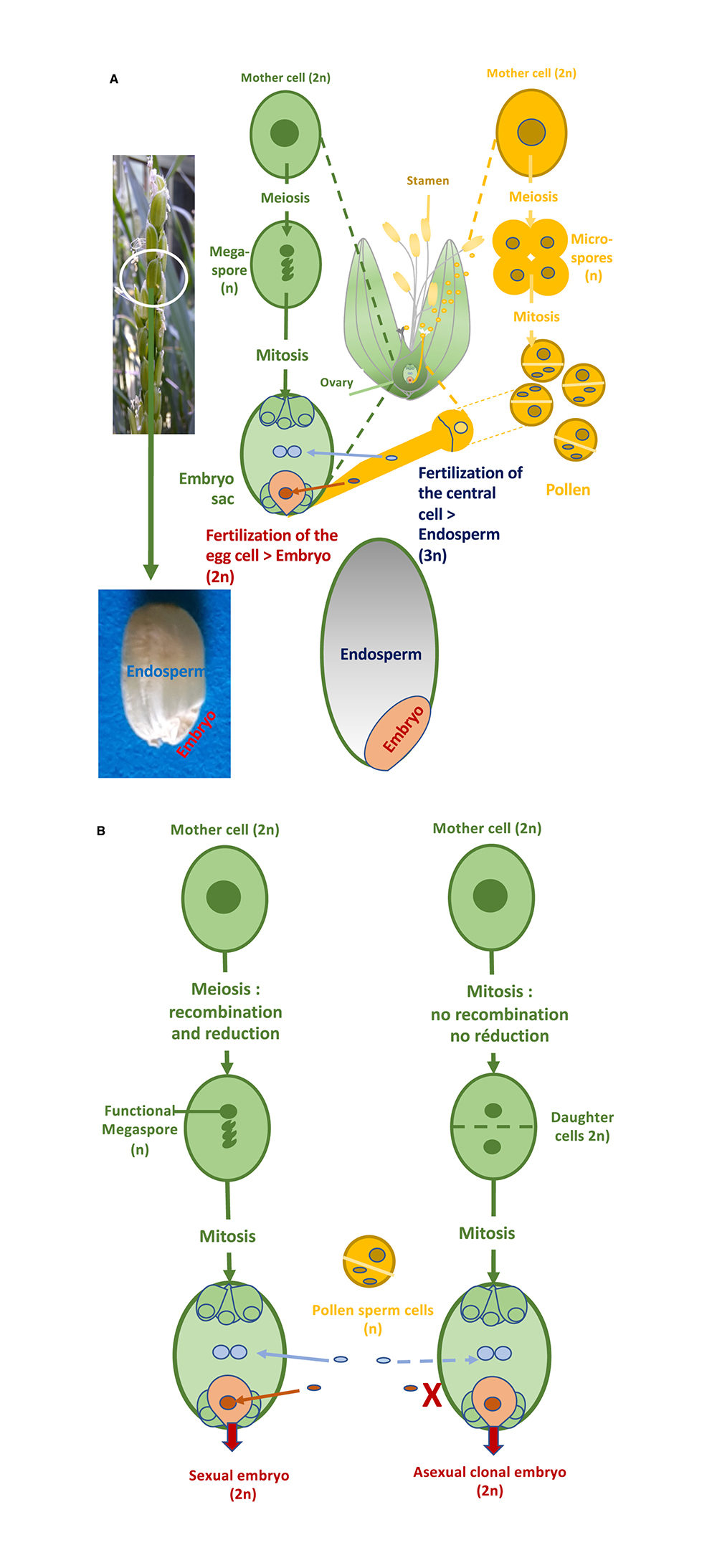
(A) La double fécondation chez le riz : comme chez plus de 70% des espèces d'angiospermes, le gamétophyte femelle (sac embryonnaire) du riz est de type Polygonum, composé de 7 cellules résultant de la cellulisation d'un coénocyte à 8 noyaux produit par 3 divisions d'une seule mégaspore fonctionnelle (à gauche). La mégaspore fonctionnelle est l'une des quatre spores produites par la méiose femelle, les trois autres spores dégénérant. Au cours de la méiose, les chromosomes parentaux homologues de la cellule mère diploïde, après avoir répliqué leur ADN en deux chromatides sœurs, se sont appariés pour réaliser des échanges réciproques ou non d’ADN constituant la recombinaison génétique, puis migrent vers des pôles opposés lors de la première division de la méiose. Au cours de la seconde division de méiose les chromatides sœurs recombinées ou non se séparent pour être distribuées dans quatre spores. Le nombre de chromosomes est ainsi divisé par deux dans les spores recombinées, qui sont haploïdes. Le gamétophyte mâle, le pollen, est trinucléé, et se forme après deux divisions d'un produit de la méiose, la microspore (à droite). Les deux cellules spermatiques du grain de pollen sont les gamètes mâles qui vont fusionner avec le noyau de la cellule œuf du sac embryonnaire, le gamète femelle, et les deux noyaux de la cellule centrale pour former respectivement l’embryon et l’albumen du grain. Comme indiqué sur la figure centrale le riz s’autoféconde c’est à dire que les gamètes de la même plante vont s’unir pour former la descendance. Ce processus d’autofécondation conduit à rendre ou maintenir les deux lots parentaux identiques au cours des cycles de la plante (homozygotes). (B) Lors de l’apomixie gamétophytique diplosporique, (à droite) la cellule mère diploïde va réaliser une simple mitose pour former les spores puis les gamétophytes portant les gamètes : de ce fait les gamètes ont la même constitution génétique que la plante mère et sont diploïdes et non recombinés. La parthénogenèse de la cellule œuf permet un développement d’un embryon diploïde sans fécondation (parthénogénétique) tandis que la fécondation de la cellule centrale peut ou non avoir lieu pour former l’albumen.
Les variétés de riz diffusées sont généralement des lignées pures, présentant deux lots chromosomiques en grande partie identiques, assurant l’homogénéité variétale. Cependant, il existe un intérêt à utiliser directement les descendances, elles aussi homogènes, formées à partir de grains hybrides résultant du croisement de deux lignées pures. Elles présentent en effet une vigueur hybride, déjà mise en évidence par Darwin [2] et redécouverte par Shull chez le maïs [3]et concernant tout un ensemble de caractères, dont le plus connu est une production en grain plus stable et accrue de 20 à 30 %. Les bases génétiques et moléculaires de ce phénomène de vigueur aussi appelé « hétérosis » résultant de la présence et des interactions des deux génomes parentaux dans un génome hybride ont été très étudiées [4]. À l’instar du maïs, des variétés hybrides F1 de riz sont utilisées, mais les plantes de riz ne se croisant pas de façon spontanée à une haute fréquence entre elles, le recours à des systèmes complexes géniques ou génocytoplasmiques de stérilité mâle est nécessaire [5]. La fécondation du parent femelle par le pollen du parent mâle doit souvent être assistée mécaniquement. La production de semences F1 a donc un coût élevé : celui-ci limite donc le nombre de combinaisons testées et diffusées et surtout empêche les petits riziculteurs du Sud d’avoir accès à ces semences , et ce d’autant plus qu’elles doivent être renouvelées à chaque plantation. En effet, les grains F2 récoltés sur les plantes hybrides F1, s’ils sont semés, vont former des descendances hétérogènes, notamment pour des caractères agronomiques essentiels (hauteur de plante, cycle de culture, qualité de grain etc..), et donc difficilement exploitables en riziculture. Cette divergence est liée au brassage génétique réalisé lors de la méiose qui va recombiner les chromosomes homologues des génomes différents des deux parents. Pour reproduire par grain à l’identique un hybride au cours des générations successives, il faudrait mettre en place chez le riz une reproduction asexuée clonale. Ce mode de reproduction pourrait être obtenu si la cellule initiale du gamète femelle se divisait par une simple mitose, sans recombinaison ni réduction des chromosomes parentaux, formant deux cellules filles identiques, suivi de la formation d’un embryon à partir de la cellule œuf du sac embryonnaire, sans fécondation par le gamète mâle.
Un mode de reproduction asexuée par grain appelé « apomixie » existe dans la nature chez plus de 400 espèces de plantes à fleur, principalement sauvages mais aussi cultivées, comme les fourrages et les Citrus, où il se réalise suivant différentes voies selon l’origine de la cellule donnant naissance à l’embryon clonal (sporophytique ou gamétophytique) [6]. Dans sa forme la plus aboutie (dite gamétophytique diplosporique), l’apomixie contourne le brassage génétique et la réduction du nombre de chromosomes opérés lors de la reproduction sexuée par la transformation de la méiose en mitose (apoméiose), suivie du développement de la cellule œuf par parthénogenèse, sans fécondation par le gamète mâle porté par le pollen (Figure 1B). La fusion des noyaux polaires centraux avec le gamète mâle peut s’avérer ou non nécessaire pour la formation des réserves du grain (si non, on parle alors de développement autonome de l’albumen).
Du fait de son intérêt pour la production de formules hybrides « immortalisées », la recherche d’une source d’apomixie chez les espèces cultivées et leurs apparentées sauvages a été conduite pendant de nombreuses années. Des loci génétiques intervenant dans le déterminisme de l’apoméiose et de la parthénogenèse ont été identifiés chez les espèces sauvages mais leur transfert aux espèces cultivées a jusqu’à présent échoué à les convertir à l’apomixie [7]. Aucune source d’apomixie n’a pu être trouvée chez le riz [8]. Une alternative est donc de procéder à l’ingénierie d’une apomixie synthétique chez les plantes cultivées, ce qui a mobilisé la recherche pendant ces 20 dernières années.
2. Mise au point de l’apomixie synthétique chez le riz
Comme décrit précédemment, trois éléments sont nécessaires pour parvenir à mimer l’apomixie gamétophytique diplosporique : i) la conversion de la méiose en mitose ; ii) le développement de la cellule œuf en embryon sans fécondation par le gamète mâle ; et iii) la formation de l’albumen avec (ou sans) fécondation des noyaux polaires par le gamète mâle.
Concernant la première composante, trois mécanismes majeurs différencient la méiose de la mitose : i) l’appariement des chromosomes homologues parentaux et leur recombinaison ; ii) la migration monopolaire des chromatides sœurs issues de la réplication de l’ADN en première division de méiose ; et iii) l’existence de la seconde division de méiose qui distribue les chromatides recombinées dans quatre spores haploïdes (Figure 2A). La triple mutation MiMe (Mitosis instead of Meiosis) permet chez Arabidopsis d’abolir ces différences [9] : premièrement, la recombinaison et l’appariement sont supprimés par l’inactivation d’un membre du complexe d’initiation de la recombinaison (par exemple SPO11-1 ou PAIR1). Ensuite, la migration conjointe des chromatides sœurs lors de la méiose est remplacée par leur séparation grâce à l’inactivation de la cohésine REC8. Enfin, la deuxième division méiotique est supprimée par l’inactivation du régulateur du cycle cellulaire OSD1 (Figure 2A). En collaboration avec l’INRAE de Versailles, nous avons introduit ces trois mutations avec succès chez le riz [10], et le riz MiMe produit des gamètes mâles et femelles diploïdes (2 x 12 chromosomes) non recombinés, c’est à dire ayant le génotype de la plante mère. La cellule œuf diploïde est fécondée par un gamète mâle diploïde et forme un embryon sexué clonal tétraploïde tandis que l’albumen formé après fusion des noyaux polaires diploïdes et d’un gamète mâle diploïde est supposé être hexaploïde (Figure 2B). Les plantes tétraploïdes apoméiotiques de riz peuvent se développer mais sont stériles.
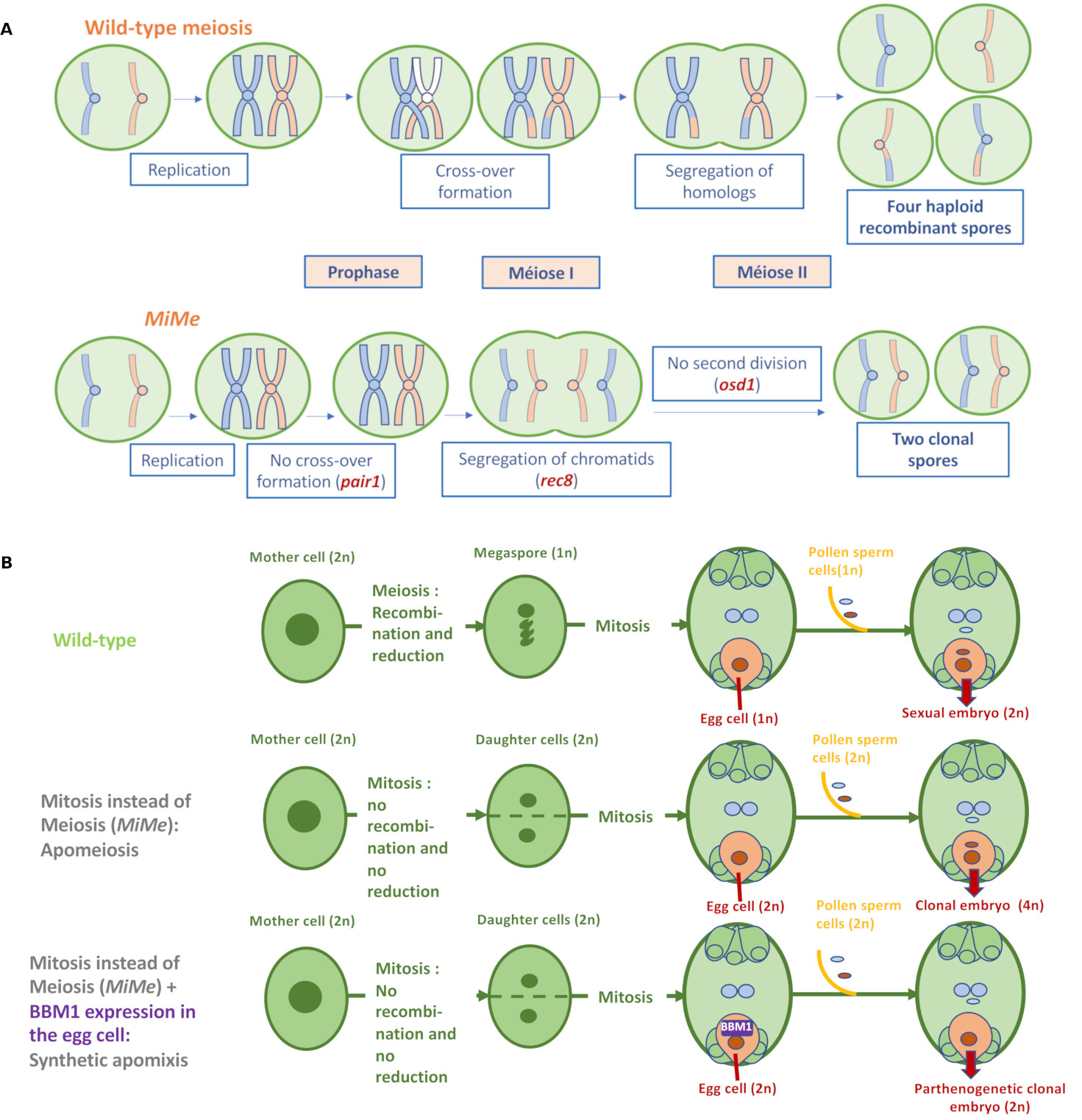
Apomixie synthétique chez le riz. (A) La triple mutation MiMe (Mitose au lieu de Méiose) transforme la méiose en mitose chez Arabidopsis [9] et le riz [10]. MiMe va abolir les trois différences essentielles distinguant la méiose de la mitose à savoir (i) l'appariement des chromosomes homologues et la recombinaison, (ii) la migration vers un même pôle des chromatides sœurs lors de la première division de méiose, et (iii) l'existence d'une deuxième division séparant les chromatides sœurs. (B) L'association de MiMe et d’un déclenchement parthénogénétique de l’embryogenèse de la cellule œuf sans fécondation, par expression dans cette cellule du facteur de transcription BABYBOOM permet le développement d’un embryon clonal [13]. La formation du grain est complétée par la fécondation des noyaux de la cellule centrale pour former l’albumen.
La seconde composante est le développement parthénogénétique de la cellule œuf sans fécondation : l’étude des gènes transcrits dans des gamètes isolés de riz a permis d’identifier un facteur de transcription candidat de la famille APETALATA 2, BABYBOOM (OsBBM1) [11]. L’allèle mâle de OsBBM1 est exprimé dans les cellules spermatiques, mais l’allèle femelle reste réprimé dans la cellule œuf jusqu’à la fécondation. Un orthologue de ce gène découvert chez le colza (Brassica napus) s’est avéré induire l’embryogenèse somatique lorsqu’il est exprimé de manière constitutive dans les cellules d'Arabidopsis [12]. De même, l’accumulation constitutive d’OsBBM1 chez le riz déclenche la formation d’embryons somatiques sur différents organes [13]. Ces données s’ajoutant au fait qu’un orthologue putatif d’OsBBM1 est également présent dans le locus responsable de l’apomixie facultative chez la graminée sauvage Pennisetum [14], ont identifié OsBBM1 comme un bon candidat pour déclencher avec succès la parthénogenèse via son expression ectopique spécifiquement dans la cellule œuf du sac embryonnaire, qui conduit à la formation d’embryons haploïdes chez le riz témoin diploïde [13]. Associée dans un second temps à la triple mutation MiMe, cette expression spécifique de OsBBM1 permet d’obtenir une apomixie synthétique permettant la production de plantes apomictiques diploïdes clonales avec une fréquence allant jusqu’à 30 %, le reste des descendants étant des plantes tétraploïdes issues de fécondation sexuée (Figure 2B) [13].
Enfin, la troisième composante est la formation avec ou sans fécondation des réserves du grain. Dans l’étude précédente, l’albumen accompagnant l’embryon parthénogénétique se formait de façon apparemment normale, sans que sa ploïdie ni sa qualité n’aient été analysées [13].
3. Une apomixie synthétique à haute fréquence chez un riz hybride
Dans le cadre d’une collaboration avec UC Davis et le Max Planck Institut de Cologne, nous avons transféré dans un hybride commercial de riz (BRS-CIRAD 302) un construction unique porteur des éléments permettant de réaliser l’apoméiose par la triple mutation MiMe (via mutagenèse CRISPR/Cas9) associés ou non avec les éléments déclencheurs de la parthénogenèse (promoteur spécifique de la cellule œuf d’Arabidopsis ou de riz contrôlant le gène OsBBM1) (Figure 3A) [15]. Les constructions et les méthodes ont été publiées et détaillées [15]. L’hybride indica/indica de riz BRS-CIRAD 302, diffusé au Brésil en 2010 a été choisi du fait de ses bonnes performances et de sa qualité de grain remarquable. Les plantes régénérées fertiles étaient bien porteuses de la triple mutation MiMe [15]. Les descendances des plantes transformées avec le construit sans déclencheur parthénogénétique sont toutes tétraploïdes comme attendu et possèdent les marqueurs microsatellites diagnostic de l’hybride, et donc sont bien apoméiotiques. Lorsque le déclencheur parthénogénétique est présent en contexte MiMe une certaine fréquence de plantes diploïdes est attendue dans les descendances : dans notre cas, 80 % des 28 triples mutants observés avaient une fréquence de descendances diploïdes supérieure à 80 %. Une fréquence de 95 à 100 % a été observée dans quatre évènements sélectionnés sur les deux générations suivantes indiquant que OsBBM1 induit de façon stable et avec une fréquence élevée la parthénogenèse (Figure 3B). La reproduction clonale est censée maintenir le génome de l’hybride F1 à l’identique sur les générations successives : nous avons donc séquencé à faible profondeur les plantes régénérées sur deux générations et observé une séquence rigoureusement identique à celle de l’hybride [15]. Cela montre que l’apomixie synthétique, induite par la combinaison des mutations MiMe et de l’expression de OsBBM permet une propagation clonale très efficace des hybrides F1 à travers les grains. L’apomixie doit également permettre une transmission du phénotype de l’hybride F1 au cours des générations : les phénotypes ont été examinés de manière plus approfondie dans les descendances de seconde génération de quatre hybrides apomictiques cultivées avec des plantes témoin F1 BRS-CIRAD 302 (Figure 3C). Aucune différence significative dans les caractéristiques des plantes n’a été observée entre les descendances apomictiques et le témoin hybride, qui se retrouve donc récapitulé de façon fidèle et homogène via l’apomixie synthétique [15].
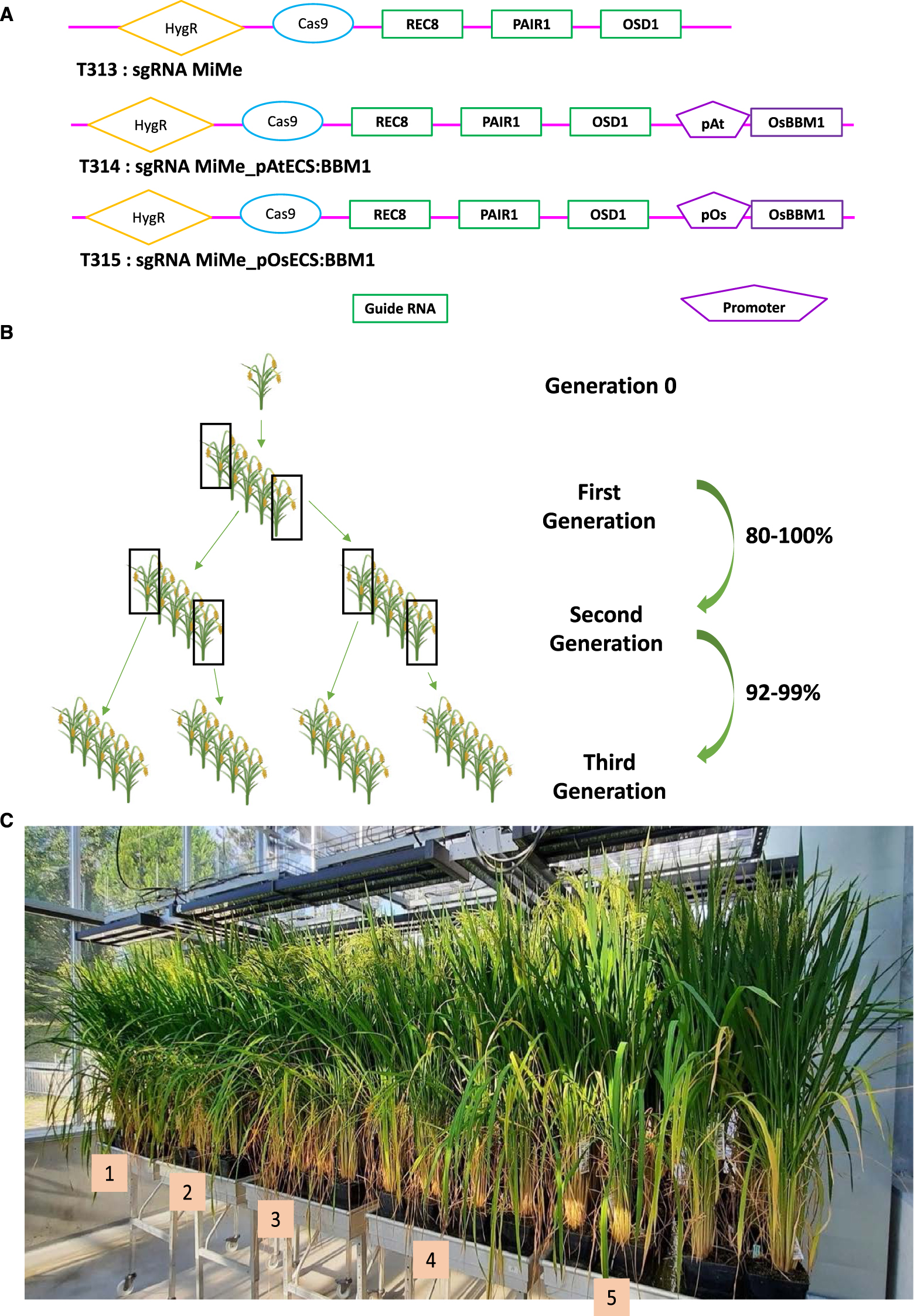
Apomixie synthétique à haute fréquence chez le riz hybride en une seule étape [15]. (A) L’apomixie synthétique est obtenue chez le riz hybride par introduction dans son génome d’un construit unique représenté schématiquement ici, portant le gène CAS9 et des guides ARN (gRNA) spécifiques de chacun des 3 gènes (PAIR1, REC8 et OSD1) devant être inactivés ainsi que la cassette de déclenchement de la parthénogenèse dans la cellule œuf (ici gouvernée par un promoteur d’Arabidopsis (T314) ou du riz (T315) ayant une activité spécifique de la cellule-œuf). Le premier construit (T313) est un construit témoin pour produire des plantes seulement apoméiotiques MiMe, dont la descendance est à 100 % tétraploïde. Les deux autres construits (T314 et T315) destinés à convertir l’hybride à l’apomixie vont conduire à la production de plantes triple mutantes MiMe (n = 28), dont 80 % génèrent des grains clonaux diploïdes avec une fréquence supérieure à 80 %. (B) La ploïdie des descendants de quatre plantes apomictiques sélectionnées atteint 95–100 % de plantes clonales diploïdes sur les deux générations suivantes. (C) Le phénotype des descendances de seconde génération des quatre plantes apomictiques (bacs 2–5) est identique à celui de l'hybride de départ (bacs 1), comme leur séquence génomique, vérifiée par ailleurs.
Un caractère important à examiner était celui du format et de la qualité de grain. Le format du grain des hybrides apomictiques est comparable à celui des grains récoltés sur l’hybride F1. L’analyse de la ploïdie de l’albumen en cours de formation a montré que celui-ci était hexaploïde comme attendu initialement– et non triploïde – et donc bien issu de la fusion de 3 noyaux diploïdes. Enfin, l’analyse de la qualité du grain, qui est une composante importante de l’acceptabilité d’une variété par le consommateur, a été réalisée. Les grains apomictiques ont montré des teneurs en amidon et amylose comparable à celle des grains récoltés sur l’hybride F1 BRS CIRAD 302, connu pour l’excellent niveau de ces caractères [15].
4. Amener les hybrides apomictiques au champ
Les toutes prochaines étapes visent à améliorer la fertilité des hybrides apomictiques qui est encore réduite de 20 à 40 % par rapport à l’hybride F1. Différentes causes possibles de ce défaut sont en cours d’exploration : pénétrance insuffisante de MiMe ou défaut de temporalité, de niveau et/ou de territorialisation de l’expression de OsBBM1. La stabilité de l’induction parthénogénétique devra être testée en plein champ dans des conditions environnementales réelles et également défavorables, qui ne sont pas représentées en serre. Ces essais sur le terrain permettront aussi de confirmer le maintien de la vigueur hybride au travers de l’apomixie sur de nombreuses générations. Bien que la stabilité du génome, du transcriptome et du méthylome ait été démontrée au cours des premières générations d’apomixie synthétique sous serre [15, 16], il sera important de l’étudier plus avant dans des conditions de terrain, et d'évaluer les conséquences à plus long terme de ce mode de reproduction sur l’épigénome. Nous avons également récemment appliqué l’apomixie synthétique à d’autres hybrides, notamment des hybrides distants indica/japonica, qui présentent une hétérosis encore supérieure, de l’ordre de 30 %.
Au-delà du rendement en grain et de sa stabilité, partagés avec les hybrides F1 sexués, les hybrides propagés par apomixie synthétique présentent des avantages supplémentaires : l’albumen des grains présente un génotype unique F1 prévisible et non plus un génotype F2 en ségrégation plus aléatoire, à qui a été attribuée au moins pour partie la qualité de grain variable récoltée sur les hybrides commerciaux. La cellule œuf parthénogénétique de l’hybride apomictique ne pouvant être fécondée, la pureté des semences est maintenue lors de leur multiplication, ce qui est important pour les pays du Sud ne disposant pas de système de distribution de semences adéquat. La création et la multiplication d’hybrides devraient à terme être facilitées, permettant aux petits riziculteurs d’acquérir et de multiplier par eux-mêmes les semences fournies par les instituts techniques nationaux. La facilitation de la création de formules hybrides devrait permettre de diversifier les combinaisons hybrides adaptées localement mises à disposition après co-conception avec les utilisateurs. Elle évitera aussi l’utilisation sur une grande échelle d’un cytoplasme mâle stérile unique qui peut s’avérer source de sensibilité. Enfin, la diversification des combinaisons hybrides testées devrait permettre de cibler efficacement la tolérance aux contraintes abiotiques et aux pressions biotiques comme objectifs de sélection.
Les obstacles liés à la propriété intellectuelle (par exemple, pour le système CRISPR/Cas) et à la réglementation devront être levés pour faciliter l’optimisation et la mise en œuvre de l’apomixie synthétique chez les plantes cultivées par les laboratoires et les systèmes nationaux de recherche agricole. En ce qui concerne les questions réglementaires, plusieurs stratégies, appliquées avant ou après la génération des évènements apomictiques synthétiques, devraient permettre d’éliminer les séquences d’ADN-T superflues (c’est-à-dire le système CRISPR/Cas et la cassette du gène sélectionnable) dans l’hybride apomictique diffusé. Il ne restera que la cassette de parthénogenèse intégrée, qui peut être fabriquée uniquement avec des éléments du riz [15], ce qui fait que les hybrides apomictiques seraient considérés comme intragéniques et non transgéniques. Si cette cassette est transférée à la cellule œuf d’un riz conventionnel via les spermatozoïdes du pollen diploïde du riz apomictique, elle conduira à un embryon triploïde non viable.
La gestion de l’agrobiodiversité doit également être prise en compte : d’une part, comme mentionné ci-dessus, l’apomixie synthétique devrait faciliter la diversification des combinaisons hybrides diffusées en les adaptant aux besoins et aux contraintes locales des agriculteurs et des consommateurs, ce qui contraste avec la diffusion habituelle de quelques méga hybrides F1 de riz cultivés sur des dizaines de milliers d’hectares. En ce sens, cela devrait favoriser le maintien de la diversité génotypique dans les paysages. D’autre part, les hybrides apomictiques ne peuvent plus être utilisés pour les croisements par construction, ce qui empêche leur utilisation ultérieure pour générer une nouvelle diversité par l’agriculteur et le sélectionneur : si l’apomixie synthétique devient populaire au point de remplacer les lignées pures, il sera crucial de mettre en place un système permettant de mettre obligatoirement les lignées parentales à la disposition des sélectionneurs et des agriculteurs dans des dépôts publics de ressources génétiques.
5. Conclusion
Nous avons montré qu’une haute fréquence de production de semences clonales était possible par apomixie synthétique, rendant ce mode de reproduction compatible avec une utilisation en agriculture. Il permet une transmission fidèle de la séquence et du phénotype hybride dans la descendance tout en préservant la qualité de grain. De façon plus fondamentale, nos travaux montrent que l’intégration d’un composant additionnel induisant un développement autonome de l’albumen (sans fécondation) n’est pas nécessaire pour atteindre une haute fréquence d’apomixie. D’autre part, ils démontrent que la contribution épigénétique apportée par le gamète mâle ne semble pas nécessaire pour la manifestation de l’hétérosis dans une espèce sexuée obligatoire. L’ensemble de ces résultats ouvre la voie à la recherche internationale pour améliorer le système jusqu’à son application sur le terrain [17]. À terme, l’apomixie devrait permettre aux sélectionneurs d’exploiter plus efficacement le potentiel d’hybrides F1 présentant une tolérance aux contraintes abiotiques et aux pressions biotiques, qui seront donc mieux équipés pour relever les défis mondiaux posés par le changement climatique et l’augmentation de la demande alimentaire.
Déclaration d'intérêts
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas d'actions ou ne reçoivent pas de fonds de toute organisation qui pourrait bénéficier de cet article, et n'ont déclaré aucune affiliation autre que leurs organismes de recherche.
Remerciements
Les auteurs remercient leurs collaborateurs Pr. Raphaël Mercier (INRAE Versailles puis MPIPZ, Cologne, Allemagne) et Pr. Venkatesan Sundaresan (UC Davis, Davis, USA), ainsi que les autres co-auteurs qui ont contribué au succès de l’étude.




 CC-BY 4.0
CC-BY 4.0