1 Introduction
Les couches minces de Cd1–xZnxS peuvent être utilisées comme fenêtre optique dans différents types de photopiles en couches minces, telles que Cd1–xZnxS/Cu2S 〚1〛, Cd1–xZnxS/CuInSe2 〚2,3〛 et Cd1–xZnxS/CdTe 〚4,5〛. Les méthodes les plus utilisées pour le développement pratique des cellules solaires sont les méthodes sous vide (évaporation, pulvérisation cathodique…), la pulvérisation réactive chimique, dite « spray » 〚6,7〛 et la méthode de dépôt chimique en phase vapeur 〚8〛. Quelques travaux ont utilisé des techniques de dépôt à partir des solutions dites par « voie humide » telles que l’électrodéposition par électrolyse et le dépôt chimique en solution (CBD : Chemical Bath Deposition) 〚9,10〛. Dans ce travail, on se propose de présenter les conditions théoriques et expérimentales optimales d’obtention des couches minces de Cd1–xZnxS de bonne qualité par CBD et de décrire l’influence de certains paramètres, température et composition x en zinc en solution définie par x = nZn/(nZn + nCd) – où nM est la quantité de matière M(II) en solution – aussi bien sur la vitesse de dépôt que sur les propriétés structurales, morphologiques et optiques de ces couches.
2 Étude théorique de la chimie des solutions du dépôt de sulfure
Diagrammes de solubilité conditionnelle de CdS et de ZnS
Suite à l’hydrolyse de la thiourée en milieu alcalin, qui libère des ions sulfure, la formation du sulfure de cadmium (II) et de zinc (II) peut avoir lieu 〚11〛 selon les équilibres :
Les solubilités conditionnelles sont données par :
Compte tenu des données thermodynamiques (Tableau 1) disponibles concernant la complexation de cadmium (II) et de zinc (II) par l’ammoniaque, la thiourée, les ions hydroxyde et les ions sulfate, on a pu établir des diagrammes de spéciation de solutions de ZnSO4, CdSO4, NH4OH et SC(NH2)2 et montrer que, dans les conditions expérimentales décrites ci-dessous, les sulfures de cadmium et de zinc se forment quel que soit le pH, s’il est supérieur à 7, et que la précipitation de CdS est plus rapide et plus facile que celle de ZnS (Fig. 1).
Constantes cumulatives des différents complexes de Cd(II) et de Zn(II) à 25 °C 〚11〛.
| log β(L,n) | ||||||
| Cd(II) | ||||||
| n | 1 | 2 | 3 | 4 | 5 | 6 |
| OH– | 4,30 | 7,70 | 10,30 | 12 | ||
| NH3 | 2,60 | 4,65 | 6,04 | 6,92 | 6,60 | 4,90 |
| SC(NH2)2 | 0,60 | 1,60 | 2,60 | 4,60 | ||
| Zn(II) | ||||||
| OH– | 4,40 | 14,40 | 15,50 | |||
| NH3 | 2,27 | 4,61 | 7,01 | 9,06 |

Solubilités conditionnelles de CdS et de ZnS.
3 Conditions expérimentales d’élaboration
Les couches minces de Cd1–xZnxS ont été élaborées en utilisant la thiourée (Tu = SC(NH2)2) comme précurseur des ions sulfures et une solution d’ammoniaque (25% en NH3) comme agent complexant. Les solutions de cadmium (II) et de zinc (II) ont été préparées à partir des produits solides de sulfate de cadmium (3 CdSO4·8 H2O) et de sulfate de zinc (ZnSO4·7 H2O). Le pH de la solution est ajusté à 11,7 à l’aide d’une solution d’acide sulfurique (1 mol l–1).
Les substrats sont des verres ordinaires de dimensions 25 mm × 45 mm × 1 mm. Ils sont d’abord nettoyés dans l’eau régale (mélange d’acide nitrique et chlorhydrique 1:2), ensuite à l’eau bidistillée, puis dégraissés au méthanol et attaqués à l’acide fluorhydrique (5%) pendant quelques minutes, rincés à l’eau bidistillée et enfin séchés à l’étuve à 60 °C.
4 Résultats et discussion
4.1 Influence de la température et de la proportion en zinc (II)
L’étude de l’effet de la température sur la vitesse de dépôt des couches minces de Cd0,9Zn0,1S a été menée dans un intervalle de température compris entre 50 et 80 °C, dans un bain de composition 〚Cd(II)〛 = 1,26 10–2 mol l–1, 〚Zn(II)〛 = 1,4 10–3 mol l–1, 〚Tu〛 = 2,8 10–2 mol l–1 et 〚NH3〛 = 1,74 mol l–1 à pH = 11,7.
La Fig. 2 représente la variation de Δm/S en fonction du temps de dépôt pour différentes valeurs de température, ce qui permet de déterminer la vitesse moyenne de croissance mesurée par Δm = mf – mi avec mi la masse de la lame après traitement et sans dépôt et mf la masse de la lame après dépôt. La balance utilisée est de type Sartorius, donnant une incertitude de 0,05 mg.

Variation de Δm/S en fonction du temps de dépôt pour différentes valeurs de température. 〚Cd(II)〛 = 1,26 10–2 mol l–1 ; 〚Zn(II)〛 = 1,4 10–3 mol l–1 ; 〚Tu〛 = 0,028 mol l–1 et 〚NH3〛 = 1,74 mol l–1 ; pH = 11,7.
La vitesse de croissance varie exponentiellement en fonction de 1/T (Fig. 3). À partir de la pente de la droite d’Arrhenius, il est possible de déterminer l’énergie d’activation relative à ce processus. L’ordre de grandeur de la valeur déterminée (Ea = 47,7 ± 0,6 kJ mol–1) confirme que le processus de dépôt est limité, soit par des étapes d’adsorption, soit par des réactions à la surface 〚12〛. Quant à la formation du dépôt, elle mettrait en jeu des étapes de combinaison d’ions à la surface. Il s’agit d’un mécanisme de type « ion par ion » 〚12〛.

Diagramme d’Arrhenius relatif au processus de dépôt de Cd0,9Zn0,1S. 〚Cd(II)〛 = 1,26 10–2 mol l–1 ; 〚Zn(II)〛 = 1,4 10–3 mol l–1 ; 〚Tu〛 = 0,028 mol l–1 et 〚NH3〛 = 1,74 mol l–1. pH = 11,7.
Dans une seconde étape, l’étude de l’influence de la concentration en zinc (II) a été effectuée à 70 °C. Les concentrations en zinc (II) et en cadmium (II) varient respectivement entre 1,40 10–3 et 1,12 10–2 mol l–1 et 2,8 10–3 et 1,26 10–2 mol l–1, alors que celle de la thiourée et de l’ammoniac sont maintenues à 0,028 et 1,74 mol l–1. Les différentes courbes de croissance obtenues admettent la même allure que celle décrite précédemment (Fig. 4). Le maximum de Δm/S tend à diminuer en fonction de la fraction molaire en zinc, mais sa position reste pratiquement inchangée à environ 1800 s de temps de réaction.
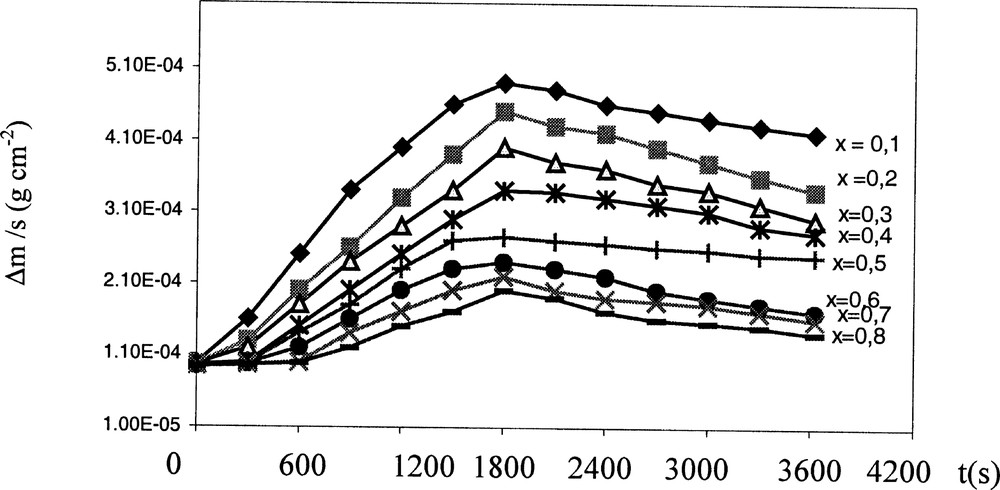
Variation de Δm/S en fonction du temps de dépôt pour différentes valeurs de x. 〚Cd(II)〛 = 2,8 10–3–1,26 10–2 mol l–1 ; 〚Zn(II)〛 = 1,4 10–3–1,12 10–2 mol l–1 ; 〚Tu〛 = 0,028 mol l–1 ; 〚NH3〛 = 1,74 mol l–1 et θ = 70 °C. pH = 11,7.
Par ailleurs, la Fig. 5 illustre une diminution de l’énergie d’activation lorsque x(solution) augmente :

Variation de l’énergie d’activation en fonction de x(solution). 〚Cd(II)〛 = 2,8 10–3–1,26 10–2 mol l–1 ; 〚Zn(II)〛 = 1,4 10–3–1,12 10–2 mol l–1 ; 〚Tu〛 = 0,028 mol l–1 ; 〚NH3〛 = 1,74 mol l–1 et θ = 70 °C. pH = 11,7.
Ceci peut être expliqué par le fait que le sulfure de zinc admet une faible énergie d’activation 〚13〛.
4.2 Détermination de la composition des couches
Une analyse par spectrométrie d’absorption atomique à flamme (SAAF) a permis d’obtenir la variation de la fraction molaire en zinc (II) formé sur le dépôt (x(solide)) à celle de la solution de dépôt (x(solution)) (Fig. 6). Cette variation traduit le fait que ZnS adhère difficilement dans les mêmes conditions de formation de CdS 〚12〛. Il apparaît, en outre, que la fraction molaire limite à utiliser ne doit pas dépasser la composition idéale x = 0,3.

Variation de x(solide) en fonction de x(solution). 〚Cd(II)〛 = 2,8 10–3–1,26 10–2 mol l–1 ; 〚Zn(II)〛 = 1,4 10–3–1,12 10–2 mol l–1 ; 〚Tu〛 = 0,028 mol l–1 ; 〚NH3〛 = 1,74 mol l–1. pH = 11,7 et θ = 70 °C.
4.3 Structure et morphologie
La Fig. 7a représente la variation des diagrammes de diffraction de rayons X en fonction de la concentration en solution du zinc(II) des couches minces de Cd1–xZnxS déposées sur du verre ordinaire à 70 °C pendant 2100 s. Ces diagrammes révèlent l’existence de deux pics de faible intensité et de grande largeur à mi-hauteur, dont les directions correspondantes sont (100) et (002). Un traitement thermique de ces couches sous une atmosphère d’azote pendant 3600 s à une température de 500 °C (voisine de la température de préparation de ses couches par la méthode de pulvérisation réactive chimique 〚1〛), conduit à l’apparition de quatre pics correspondant à (100), (002), (101) et (110). Les couches minces polycristallines de Cd1–xZnxS cristallisent donc dans le système hexagonal de type wurtzite (Fig. 7b). Par ailleurs, l’intensité du pic relatif à la direction (002) diminue au fur et à mesure que la fraction molaire en zinc x(solution) augmente. Ceci traduit le fait que l’orientation et la cristallinité des dépôts diminuent au fur et à mesure que x augmente et que l’épaisseur des couches diminue. La Fig. 8 présente les images AFM 3D des couches minces de Cd1–xZnxS déposées sur du verre ordinaire à 70 °C

Variation des diagrammes de diffraction de rayons X du dépôt de Cd1–xZnxS. a. À 70 °C. b. Après recuit pendant 3600 s à 500 °C sous une atmosphère d’azote (〚Tu〛 = 0,028 mol l–1 et 〚NH3〛 = 1,74 mol l–1. pH = 11,7).

Images AFM 3D des couches minces de Cd1–xZnxS déposées sur du verre ordinaire à 70 °C (x = 0,1 ; e = 0,5 μm) ; (x = 0,3 ; e = 0,4 μm) ; (x = 0,6 ; e = 0,3 μm) ; (x = 0,8 ; e = 0,2 μm) (〚Tu〛 = 0,028 mol l–1 ; 〚NH3〛 = 1,74 mol l–1 et pH = 11,7).
Par ailleurs, l’effet de la concentration en zinc(II) sur la morphologie des couches minces a été étudié par microscopie à force atomique (Fig. 9). Il ressort que les couches de Cd1–xZnxS présentent un relief perturbé par des amas protubérants de forme pyramidale de différentes tailles et qui deviennent plus petits lorsque x augmente. Cette petitesse est probablement due à la substitution du cadmium(II) par le zinc(II), élément qui a un rayon atomique plus faible que celui du cadmium(II). Ceci est en accord avec les résultats d’analyse aux rayons X qui montrent un élargissement de la largeur à mi-hauteur et une diminution appréciable de l’intensité des raies des différentes couches lorsque la composition x augmente. Néanmoins, pour x(solution) = 0,1, ces agglomérats sont uniformément répartis sur la surface des couches.

Spectres de transmission et de réflexion des couches de Cd1–xZnxS déposées : (a) à θ = 70 °C ; (b) : après recuit pendant une heure à 500 °C sous 1 atm d’azote. 〚Cd(II)〛 = 1,26 10–2 mol l–1 ; 〚Zn(II)〛 = 1,4 10–3 mol l–1 ; 〚Tu〛 = 0,028 mol l–1 et 〚NH3〛 = 1,74 mol l–1. pH = 11,7.
4.4 Propriétés optiques
Les spectres de transmission et de réflexion des couches minces du sulfure mixte préparées par dépôt chimique en solution, obtenus dans la gamme UV et proche IR (λ = 450 à 2500 nm), montrent que, quelle que soit la longueur d’onde, la transmission augmente lorsque la fraction molaire en zinc(II) augmente. Ce comportement peut être attribué à la différence d’épaisseur des différents dépôts. Par ailleurs, un traitement thermique sous 1 atm d’azote à 500 °C pendant 3600 s entraîne une diminution de la transmission et une augmentation de la réflexion, et ce pour toutes les compositions en zinc(II) (Fig. 9b).
L’exploitation de ces différentes courbes selon la méthode expliquée dans la référence 〚14〛 conduit à la détermination de l’énergie du gap. Le Tableau 2 résume les valeurs de Eg de Cd0,92Zn0,08S, de Cd0,9Zn0,1S et de Cd0,72Zn0,28S, avant et après traitement thermique pendant 3600 s sous 1 atm d’azote à 500 °C.
Variation du gap en fonction de x(solide).
| Cd0,9Zn0,1S | Cd0,4Zn0,6S | Cd0,7Zn0,3S | |
| x(solide) | 0,08 | 0,10 | 0,28 |
| e (μm) | 0,50 | 0,25 | 0,43 |
| Eg (eV) avant recuit | 2,42 | 2,45 | 2,50 |
| Eg (eV) après recuit | 2,27 | 2,37 | 2,45 |
Par ailleurs, la variation du gap en fonction de la composition x en zinc n’est pas monotone : Eg décroît de la valeur 2,36 eV associée à x(solide) = 0 〚1〛, passe par un minimum égal à 2,26 pour x(solide) = 0,08, puis croît jusqu’à atteindre la valeur 3,5 eV pour x(solide) = 1 〚1〛.
Ce résultat est antagoniste au cas du Ga1–xAlxAs, pour lequel la variation du gap en fonction de x est parfaitement croissante et est représentée par une loi du type Eg = 1,51 + 1,36 x + 0,22 x2 (7) 〚15〛. En fait, dans le cas de l’alliage Ga1–xAlxAs, la substitution de gallium par l’aluminium conduit à une croissance du gap, en vertu du fait que l’aluminium possède un rayon covalent plus élevé que celui du gallium et que la structure cristalline reste inchangée, et ce quelle que soit la teneur en aluminium.
En revanche, le comportement inhabituel du gap dans ce cas de Cd1–xZnxS peut être élucidé, en se basant sur le fait que les structures cristallographiques du CdS et du ZnS sont différentes, comme suit : l’introduction du zinc a un effet très perturbateur, en ce sens qu’il survient un bouleversement de la structure cristallographique, consistant en la création de défauts de structure dans le sens d’arrangements atomiques qui frustrent la périodicité parfaite de la structure wurtzite. Ces arrangements correspondraient à des configurations intermédiaires entre la structure wurtzite et la structure cubique à faces centrées (cfc), associée, dans ce cas, à une structure de bandes déformée par rapport à la structure initiale. Ce phénomène persiste jusqu’à la concentration x(solide) = x1 = 0,08 en zinc ; le gap décroît alors à partir de sa valeur associée à x = 0 jusqu’à x1 = 0,08. A partir de x1, la région où le zinc est incorporé s’ordonne selon la structure (cfc) ; la structure cristallographique complète est alors composée d’un mélange cfc et wurtzite. Ainsi, le gap croît, traduisant le fait que la structure cristallographique, et par suite la structure des bandes, évoluent dans le même sens, c’est-à-dire que la structure cfc s’étale au détriment de la structure wurtzite. Ces résultats sont en corrélation avec ceux des rayons X. En effet, nous constatons que les pics relatifs à la structure wurtzite s’estompent au fur et à mesure que x augmente.
Par ailleurs, le recuit fait diminuer le gap, ce qui a pour conséquence un décalage du front d’absorption vers les grandes longueurs d’onde.
5 Conclusion
Cette étude des couches minces de Cd1–xZnxS, élaborées par dépôt chimique en phase liquide en utilisant la thiourée comme précurseur du soufre et une solution d’ammoniaque comme agent complexant et dont le pH vaut constamment 11,7, montre, d’une part, que le processus de dépôt est influencé par la température et par la composition en zinc et, d’autre part, que la meilleure composition en zinc en solution, conduisant à des couches de meilleure cristallinité, uniformes et transparentes est x(solide) = 0,08. Les spectres de rayons X montrent que ces couches cristallisent dans le système hexagonal de type wurtzite. Ces films sont assez transparents dans le visible et les énergies du gap varient entre 2,42 et 2,5 eV. Ces valeurs numériques, dont la variation en fonction de x(solide) est particulière, sont favorables à l’utilisation de ces couches minces comme fenêtre optique dans des photopiles.



