1 Introduction
Le souci de la maîtrise des émissions de gaz polluants (NOx, CxHy, CO...) rejetés par les pots d’échappement des automobiles a amené les constructeurs à équiper les véhicules de dispositifs susceptibles de neutraliser ces molécules gazeuses préjudiciables à l’environnement et, par voie de conséquence, à la santé publique. La vitesse élevée d’émission des gaz à la sortie des moteurs thermiques suppose que les réactions chimiques mises en jeu dans ce but soient très rapides. Aussi, la cinétique de ces réactions est-elle augmentée par des catalyseurs fonctionnant à haute température (∼600 °C → ∼1000 °C), et qui sont déposés sur un support en céramique. Ces catalyseurs appartiennent aux éléments du groupe du platine (PGE) et sont le platine, le palladium et le rhodium. Les deux premiers éléments catalysent les réactions d’oxydation des hydrocarbures et du monoxyde de carbone. Le rhodium associé au platine, catalyse la réduction des oxydes d’azote. Les molécules rejetées sont donc le dioxyde de carbone, l’eau et l’azote.
Les premières études systématiques concernant la dispersion dans l’environnement des métaux précieux des pots d’échappement catalytiques ont montré que des quantités importantes de PGE pouvaient être rejetées dans l’environnement (entre 0,5 et 1 ppm), et qu’elles étaient susceptibles d’être lessivées par la pluie et, par conséquent, de rejoindre les nappes phréatiques 〚1〛. Au cours des dernières années, plusieurs études ont été publiées sur le sujet 〚2–4〛 et ont même révélé la présence de ces éléments dans les glaces du Groenland 〚5〛. On a montré que la concentration en PGE au bord des routes diminue avec la distance mesurée à partir du bord de la route, ainsi qu’avec la profondeur de prélèvement de l’échantillon 〚6〛. Des valeurs en PGE supérieures à 1 ppm ont été notées. De plus, on a mis en évidence le fait que ces éléments étaient susceptibles d’être assimilés par les plantes 〚7, 8〛. En outre, leur nocivité sur le plan biologique est aujourd’hui démontrée 〚9〛.
Le but de la présente étude est de rechercher, le long de quelques axes routiers, l’existence et l’importance relative d’une telle pollution. En outre, à notre connaissance, aucune étude n’a été entreprise jusqu’ici pour déterminer le processus de destruction des revêtements en métaux précieux. Aussi, il nous a paru intéressant de réaliser tout d’abord des expériences de corrosion à haute température avec les molécules gazeuses susceptibles de participer à la dégradation des revêtements des pots d’échappement. Une approche de la spéciation des éléments pourra alors être tentée à la lumière des résultats obtenus.
Nous avons prélevé les échantillons soumis à l’analyse aux abords immédiats des grands axes routiers ou dans le centre ville de deux grandes agglomérations, Grenoble et Aix-en-Provence. Dans tous les cas, seule la couche superficielle du sol a été prélevée (0–3 cm). Le fond géochimique a été déterminé sur un échantillon éloigné du trafic automobile et prélevé dans la vallée de l’Isère, à plus de 2 km des grands axes de circulation. En effet, il est difficile dans les villes importantes de trouver un sol qui ne soit pas rapporté, et dont l’origine puisse être localisée aisément. Les sites de prélèvement, la date, les conditions climatiques et, quand elle est connue, la densité du trafic sont reportés dans le Tableau 1.
Résultats analytiques (en ng g–1) et localisation pour les échantillons étudiés. Les analyses sont faites sur la fraction des sols < 120 μ.
| Réf. | Pt | Pd | Rh | Ir | Lieu, date et conditions climatiques |
| Gr 1 | 2,3 | 5,4 | 0,4 | 0,07 | Porte de France (12/12/96) période pluvieuse |
| Gr 2 | 5,3 | 4,6 | 0,3 | 0,06 | Bd Gambetta (id.) 25 000 véhicules/jour (id) |
| Gr 3 | 57 | 532 | 7,8 | 0,23 | Bd Foch (id.) 24 000 véhicules/jour (id) |
| Gr 4 | 6 | 2,2 | 3,4 | 0,16 | Bd Clemenceau (18/03/97) 30 000 véhicules/jour en période sèche |
| Gr 5 | 38 | 57 | 8,5 | 0,12 | Bd Vallier (id.) 55 000 véhicules/jour (id.) |
| Gr 6 | 2,1 | 2,6 | 0,7 | 0,09 | Place Verdun (id.) 10 000 véhicules/jour (id.) |
| Aix 1 | 38 | 1,9 | 1,9 | 0,06 | Intersection autoroute et RN (17/12/96) en période pluvieuse |
| Aix 2 | 24 | 1,3 | 1,3 | 0,05 | Centre ville (id.) (id.) |
| Aix 3 | 11 | 1,3 | 1,3 | 0,02 | Extérieur ville (id.) (id.) |
| Série 2 | |||||
| Réf. | Pt | Pd | Rh | Ir | Lieu, date et conditions climatiques |
| Gr 7 | 70 | 10 | 6,3 | 0,2 | RN75, km 73 (01/02) 60000 véhicules /jour ; période très pluvieuse |
| Gr 8 | 40 | 5 | 7,5 | 0,2 | RN75, km 72 (01/02) 30000 véhicules/jour ; id. |
| Gr 9 | 36 | 2 | 1,5 | 0,1 | RN75, km 71 (01/02) 30000 véhicules/jour ; id. |
| Gr 10 | 170 | 5 | 10 | 0,25 | D120, (01/02) id |
| Gr 11 | 100 | 11 | 9 | 0,2 | RN85, km 44 (01/02) 30000 véhicules/jour ; id. |
| Gr 12 | 65 | 13 | 7 | 0,1 | RN85, km 46 (01/02) 30000 véhicules/jour ; id. |
| Gr 13 | 110 | 7 | 43 | 0,25 | RN85, km 38 (01/02) 30000 véhicules/jour ; id. |
| Gr 14 | 350 | 33 | 54 | 0,46 | Autoroute Grenoble–Lyon, (01/02) 80000 véh./jour, km 5 ; id. |
| Gr 15 | 82 | 17 | 14 | 0,54 | Même lieu ; id. |
| Gr 16 | 20 | 1,2 | 0,7 | 0,1 | Plaine de l’Isère ; id. |
2 Détermination des PGE
Nous avons mis en œuvre la méthode analytique que nous avons développée pour les études géochimiques sur les PGE. La mise en solution des éléments est réalisée par fusion au peroxyde de sodium à 750 °C dans un creuset de zirconium, qui permet l’attaque de tous les PGE, quelle que soit la nature des phases présentes dans les sols. Après reprise à l’eau puis à l’acide chlorhydrique, la solution est portée à sec pour insolubiliser la silice ; celle-ci, après reprise du résidu sec par de l’eau additionnée d’acide chlorhydrique, est éliminée par filtration sous vide. Une extraction sélective des métaux précieux est obtenue par réduction avec SnCl2 et entraînement avec Se + Te. Une addition d’iodure de potassium permet d’obtenir des taux d’extraction proches de 100% pour Pt, Pd, Rh, Ru, Ir. Les éléments sont alors déterminés par ICP–MS (VG PQ2). Cette technique nous a permis de doser systématiquement les cinq éléments dans tous les échantillons étudiés. Cette technique permet de s’affranchir de la quasi-totalité des interférences signalées lors de la mesure en ICP–MS quand on utilise une extraction des PGE avec du sulfure de nickel. Cette méthode permet la détermination des éléments dans les matrices les plus complexes, avec de très bas niveaux de détection. Les détails et les performances de la méthode ont été donnés dans une publication antérieure 〚10〛.
3 Résultats analytiques
Les concentrations obtenues dans les échantillons prélevés sont données dans le Tableau 1, avec les précisions signalées plus haut, et sont répertoriées en deux séries.
On notera que les valeurs que nous avons trouvées sont du même ordre de grandeur que celles rapportées par les auteurs déjà cités. Les faibles teneurs en iridium relevées permettent d’éliminer l’existence d’une contamination naturelle en PGE par les minéraux inclus dans les chromites du complexe ophiolitique de Chamrousse, situé en amont de Grenoble. On notera, toutefois, une corrélation relative entre les teneurs en Pt et Rh, d’une part, et celles en Ir, d'autre part. Ceci semble montrer que Ir est une impureté des assemblages de PGE introduits dans les catalyseurs.
Les concentrations relatives des différents éléments peuvent apporter des informations quant à leur mobilité dans l’environnement. Toutefois, les fabricants ne communiquent pas les taux de Pt, Pd et Rh présents dans les catalyseurs. De surcroît, ces taux sont modifiés régulièrement pour optimiser le fonctionnement et abaisser la température à laquelle le catalyseur commence à fonctionner. Cet abaissement est obtenu par l’augmentation de la teneur en palladium 〚11〛. Ainsi, d’après les données concernant la demande de PGE pour la fabrication des catalyseurs en Europe pour l’année 2001, le ratio Pt/Pd est de 1:2,5 〚2〛, tandis que le rapport Pt/Rh est compris entre 5 et 12, suivant les fabrications. Les résultats montrent une cohérence des rapports Pt/Rh dans l’environnement avec ceux des catalyseurs. En revanche, les teneurs en palladium montrent une variabilité quelquefois étonnante. Ainsi, l’échantillon Gr3 révèle une teneur très élevée en palladium, ce qui nous a suggéré l’existence d’une dissolution différentielle de Pd, suivie d’une adsorption au point de prélèvement, grâce à des conditions locales particulières d’oxydoréduction. Cette hypothèse d’une dissolution différentielle a été confirmée par des expériences publiées récemment 〚4〛, qui montrent une solubilité du palladium contenu dans les sols très supérieure à celle des deux autres éléments.
Ces observations nous ont conduits à faire un nouvel échantillonnage dans la région grenobloise, après une période très pluvieuse (série 2). On observe des teneurs moyennes beaucoup plus élevées en Pt et Rh que dans la série 1. Cet excès de pollution peut être dû à une vitesse plus élevée des véhicules sur ces voies de circulation. Ceci peut être dû aussi à un effet cumulatif, ces échantillons ayant été prélevés cinq années après ceux de la série 1. On observe surtout des teneurs en palladium très faibles comparées à celles du platine, ce qui semble accréditer l’hypothèse du lessivage de Pd. On notera aussi une augmentation concomitante de la teneur en iridium, ce qui tend à prouver que cet élément accompagne les PGE dans les revêtements catalytiques.
Pour tenter de déterminer le processus et la nature des espèces rejetées par les pots d’échappement, nous avons effectué des expériences de corrosion à haute température pour déterminer quelle molécule présente dans les gaz d’échappement était susceptible de corroder les métaux précieux.
4 Expériences de corrosion
Les expériences doivent être conduites avec les gaz issus des moteurs à explosion. Les molécules majeures sont : CO2, CO, HNO3. On y ajoute l’ion Cl–, présent dans les atmosphères urbaines ou marines, et suspectée par certains auteurs 〚4〛 de participer à la solubilité dans les sols du palladium, en raison de la formation de complexes chlorurés très solubles.
Une étude antérieure, conduite avec des mélanges CO–CO2 〚12〛, a montré que, même à haute température, il n’y avait pas formation de complexes carbonyles avec les PGEs. Les données thermochimiques confirment d’ailleurs que des métaux carbonyles ne peuvent se former dans les conditions de température et de pression prévalant dans les convertisseurs catalytiques. Aussi, l’étude expérimentale a porté sur l’action de HNO3 ainsi que de HCl. On doit bien faire remarquer que le but de ces expériences n’était pas de reproduire exactement les processus se déroulant dans les convertisseurs catalytiques lors du fonctionnement du véhicule, mais plutôt de comparer les pouvoirs corrosifs des molécules gazeuses issues des moteurs. Évidemment, ces expériences devant être effectuées en un temps limité, il convenait d’augmenter la cinétique des réactions. Pour cela, nous avons utilisé la température maximale observée dans les convertisseurs (1000 °C). En outre, les concentrations, donc les activités en molécules actives du flux gazeux utilisé sont plus élevées que celles observées dans les gaz d’échappement. Enfin Pt, Pd et Rh ont été introduits sous la forme de plaques de métal pur, d’une surface aisément déterminable et qui possèdent sous cette forme élémentaire une activité unitaire.
Nous avons utilisé un four tunnel horizontal, muni d’un tube à combustion en porcelaine. Une nacelle en alumine contient une plaque de chacun des métaux étudiés (Pt, Pd, Rh), Le four est porté à une température de 1000 °C. Puis l’enceinte est balayée par un courant d’argon, gaz inerte, utilisé comme porteur, barbotant avant son introduction dans le tube laboratoire dans un laveur renfermant, successivement, une solution de HCl à 25%, et deux solutions de HNO3 à respectivement 64 et 92%. Compte tenu du faible débit du flux gazeux mis en œuvre, on suppose que la pression partielle du gaz corrosif mis en jeu dans chaque expérience est celle qui est normalement en équilibre avec la solution aqueuse de ce réactif. Ces pressions partielles sont données dans la littérature.
À la sortie du four, le courant gazeux est dirigé dans un tube à essais où les produits d’attaque sont collectés dans une solution aqueuse d’hydroxyde de sodium N/10. Celle-ci est additionnée d’« eau régale » pour faire passer en solution les éléments métalliques et est analysée par ICP–MS, sans extraction et concentration des éléments. La durée de chaque expérience est fixée à une heure, afin de pouvoir comparer les pouvoirs corrosifs des différents réactifs.
5 Résultats et discussion
Les résultats sont donnés dans le Tableau 2.
Corrosion des trois PGE des convertisseurs catalytiques. Essais conduits à 1000 °C pendant 60 min. Les valeurs sont données en ng dm–2.
| Solution du réactif | P (bar) du réactif | Rh ng. dm-2 | Pd ng dm-2 | Pt ng. dm-2 |
| HCl 20% | 0,012 | < 1,5 | 40,6 | < 1,5 |
| HNO3 64% | 0,008 | 7 | 25 | <1,5 |
| HNO3 92% | 0,02 | 246 | 4125 | 812 |
On pourrait penser que la corrosion du platine et celle du rhodium sont la conséquence d’une atmosphère gazeuse renfermant des ions chlore. En effet, le chlore forme aisément des complexes avec les PGE. Mais on constate que, avec une solution ayant une pression partielle de HCl de l’ordre de 0,012 bar, ce qui est une valeur très supérieure à celle que l’on peut attendre dans les atmosphères urbaines étudiées, la corrosion de Pt et Rh est négligeable. Celle de Pd est faible. On doit donc en conclure que les polluants chlorés ne sont pas en cause dans le processus de dégradation des convertisseurs. En outre, un complexe du palladium ne peut se former ultérieurement dans le sol lui-même. En effet, nous avons calculé, à partir des données thermodynamiques, que pour un pH de 7,5, valeur moyenne mesurée dans les sols étudiés, la zone de prédominance de PdCl42– dans le diagramme de Pd n’apparaît que pour aCl– = 0,186. Cette valeur est de plusieurs ordres de grandeur supérieure à celle que l’on peut attendre dans les sols, car les concentrations en chlore y sont de l’ordre de 5 ppm. Ceci est en opposition avec l’hypothèse d’une solubilisation du Pd sous cette forme 〚4〛.
En revanche, il est évident que les oxydes d’azote provoquent une dégradation importante du catalyseur, et plus particulièrement du palladium. Toutefois, il est peu probable que la forme soluble du palladium présent dans les sols soit l’ion Pd2+, issu de la dissociation du nitrate. En effet, la concentration moyenne des sols en ions NO3– est de 2 à 5 mg kg–1 (2 à 5 ppm). On en conclut à l’existence d’une hydrolyse de l’ion Pd2+ sous la forme Pd(OH)2·n H2O. Cette dernière molécule est considérée comme un des plus stables complexes hydroxylés bivalents. Nous nous sommes assurés de la présence de cette molécule dans l’environnement en mesurant les paramètres physico-chimiques (pH et potentiel d’oxydoréduction) des sols en cause, et en vérifiant l’existence de la molécule dans le domaine de stabilité correspondant du diagramme de prédominance. Les mesures ont été faites in situ, pour quelques sites typiques, avec, d’une part, une électrode de verre et une électrode au calomel saturée et, d’autre part, avec une électrode de platine et la même électrode au calomel. Les résultats sont consignés dans le Tableau 3. Les données de la littérature 〚13〛 permettent de tracer le diagramme de prédominance à 25 °C (Fig. 1). On voit que les points expérimentaux mesurés sur le terrain tombent dans le domaine de prédominance du complexe hydroxylé soluble, ce qui confirme, d’une façon indubitable, les observations rapportées sur la mobilité de cet élément.
Valeurs de pH et Eh pour quelques sites typiques.
| Échantillon | pH | Eh (mV) |
| Gr 2 | 7,44 | 449 |
| Gr 4 | 7,33 | 520 |
| Gr 5 | 7,73 | 385 |
| Gr 6 | 8 | 468 |
| Gr 7 | 7,90 | 462 |
| Gr 8 | 7,64 | 429 |
| Gr 9 | 8,02 | 430 |
| Gr 10 | 7,70 | 452 |
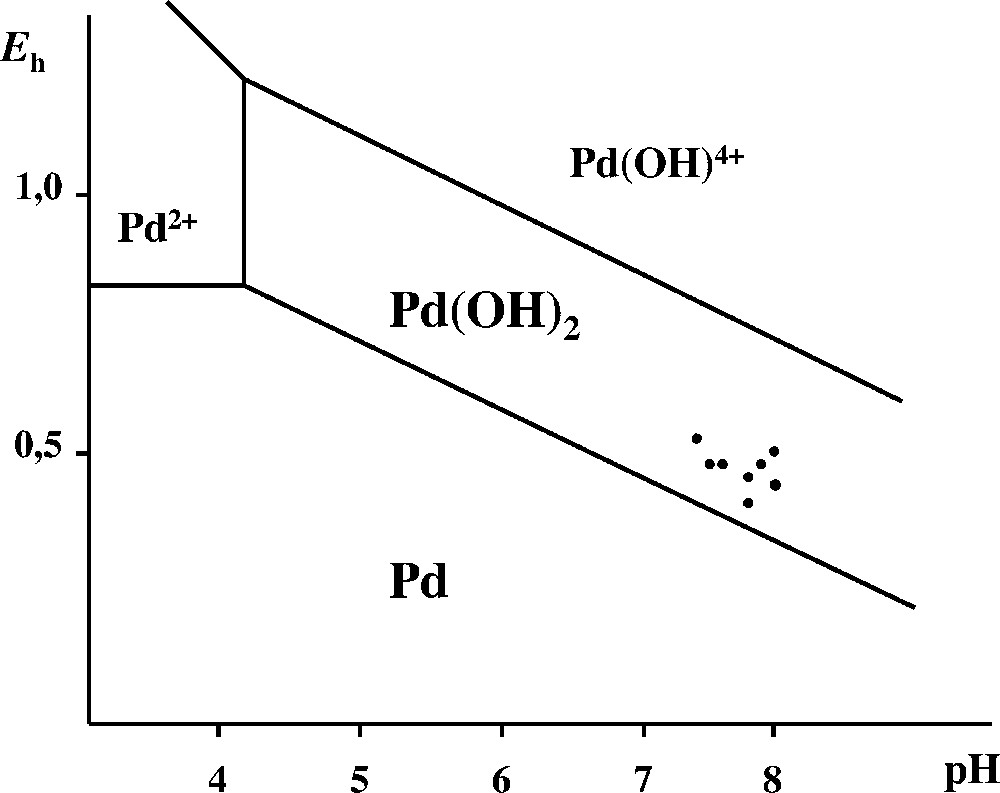
Diagramme de prédominance Eh(V)–pH de quelques espèces du palladium dans le domaine étudié. La limite entre les domaines de Pd(OH)2 et Pd est tracée pour une concentration de Pd en solution de 10 ng g–1 (ppb). Les points mesurés sur les échantillons (Tableau 3) sont tous dans le domaine de Pd(OH)2.
Des auteurs 〚4〛 notent que le ratio Pt/Rh reste constant après une chute de pluie. L’échantillon Gr14 est la fraction grossière prélevée au bord de l’autoroute, alors que Gr15 est la fraction fine issue de la précédente par classement dû au ruissellement. D’une part, les teneurs sont plus faibles dans cette dernière, mais surtout le rapport Pt/Rh est du même ordre de grandeur (5,9 à 6,5), alors que le rapport Pt/Pd varie de 4,8 à 10,6. La mobilité différentielle élevée de Pd est bien mise en évidence.
6 Conclusion
La corrosion du palladium des pots d’échappement catalytiques semble résulter d’une attaque préférentielle de cet élément par les oxydes d’azote émis par les moteurs thermiques. Toutefois, la spéciation du palladium dans l’environnement est la conséquence d’une hydrolyse d’un probable nitrate. Cette hydrolyse conduit à la formation d’un complexe hydroxylé très stable et soluble, qui est mis en évidence par les mesures de pH et de Eh des sols étudiés. Ces paramètres placent en effet ces échantillons dans le domaine de stabilité de ce complexe, qui apparaît sur le diagramme de prédominance du palladium.
En revanche, Pt et Rh semblent moins sensibles à la dissolution dans l’environnement, comme nous l’avons observé avec d’autres auteurs. L’hypothèse d’une émission sous forme métallique ou sous la forme d’une espèce oxydée à haute température et donc difficilement hydrolysable, forme proposée et observée par plusieurs auteurs, est alors plausible, bien qu’une fraction soluble et assimilable par les plantes ait été observée. Son éjection hors des convertisseurs catalytiques serait alors due davantage à un phénomène d’érosion qu’à un phénomène de corrosion, comme dans le cas de Pd.
La dispersion des PGE dans l’environnement pose le problème de la nocivité d’éléments connus pour être des catalyseurs exceptionnels, susceptibles de perturber les réactions biologiques dans les organismes vivants et déjà reconnus pour leurs propriétés allergisantes.
Remerciements
Nous remercions le professeur J.-P. Gratier pour le soutien financier apporté par la fédération de recherche CNRS « Faust », qui a permis le développement de cette étude.



