1 Introduction
Les extraits volatiles des plantes aromatiques sont recherchés depuis l'antiquité pour leurs propriétés biologiques [1]. Au nombre de celles-ci, on reconnaît les propriétés antibactériennes [2] et antifongiques [3] ainsi que l'activité contre les tiques (Amblyomma variegatum).
Dans la littérature, on rapporte que les feuilles d'Eucalyptus tereticornis Sm. sont recherchées en médecine traditionnelle pour leurs propriétés aromatiques et pharmaceutiques, et le pollen des fleurs de cette plante butinée par les abeilles donne un miel très nourrissant et à arôme particulièrement agréable [4].
Sohounhloué et al. [5] ont montré que les huiles essentielles de Clausena anisata, d'Ocimum basilicum et d'Eucalyptus camadulensis ont freiné la prolifération du Prostephanus truncatus (Horn).
Au cours des dix dernières années, de nombreuses études ont tenté de démontrer la synergie d'action des constituants d'huile essentielle sur les différentes sortes de cellules végétales ou animales dans le but de vaincre les réticences que suscite encore l'application de ces essences en pharmacologie et dans les essais cliniques [6–8]. À cet égard, l'utilisation de ces substances naturelles présente un avantage certain sur les produits de synthèse, qui se révèlent toxiques et parfois même cancérigènes, aussi bien pour les cellules animales que végétales [9].
C'est dans le souci de valoriser ses ressources naturelles que nous avons jugé important d'étudier, dans le cadre du présent travail, la composition chimique de l'huile essentielle d'Eucalyptus tereticornis Sm. produite au Bénin, ses propriétés antibactériennes et antifongiques ainsi que son activité contre les tiques.
2 Partie expérimentale
2.1 Matériel et méthode
2.1.1 Matériel végétal et extraction de l'huile
L'huile essentielle est extraite des feuilles d'Eucalyptus tereticornis Sm récoltées à Sèmè-kpodji en mars 2002 par hydrodistillation sur un appareil de type Clevenger.
2.1.2 Analyse de l'huile essentielle
L'analyse des huiles essentielles a été effectuée par chromatographie en phase gazeuse couplée à la spectrométrie de masse (CPG–SM). Le couplage a été effectué sur un appareil Hewlett Packard modèle 5970 (système de détection quadripolaire) équipé d'une colonne capillaire en silice fondue de 2 mm × 0,23 mm de type DB1 ; programmation de température de 50 °C et 200 °C, avec un gradient de 5 °C/min. Les indices de rétention ont été déterminés par chromatographie en phase gazeuse sur deux colonnes capillaires en silice fondue (25 m × 0,25 mm) de type OV-101 et Cabowax 20 M avec une programmation de température identique à celle utilisée par le couplage (appareil Shimatzu GC-14A équipé d'un détecteur à ionisation de flamme et d'un intégrateur modèle C-R4A).
2.2 Milieux de culture
2.2.1 Préparation des milieux de culture
Deux milieux de culture notés M1 et M2 sont préparés.
Milieu M1 : 45,5 g de Sabouraud sont dissous dans 1 l d'eau distillée. Le pH est ajusté à 6,8.
Milieu M2 : 17 g d'agar-agar sont dissous dans 500 ml de moût de bière. On ajoute ensuite 500 ml d'eau distillée stérilisée. Le pH du milieu est ajusté à 6,8.
Ces milieux de culture sont ensuite stérilisés à l'autoclave à 120 °C pendant 20 min.
2.2.2 Culture et isolation des microorganismes
2.2.2.1 Culture des microorganismes
La technique utilisée est celle de dilution en série géométrique de la solution mère S0 par la méthode d'Agar [10].
2.2.2.2 Obtention et isolation des souches pures
Après fusion des milieux M1 et M2, on a procédé à leur coulage à chaud dans des boîtes de Pétri. Ces dernières sont laissées à la température ambiante pendant 48 h. On procède ensuite au repiquage de la zone d'inhibition. Cette opération, répétée trois fois, a permis d'obtenir des souches pures.
2.2.3 Test d'activité antimicrobienne avec les huiles essentielles
2.2.3.1 Obtention de suspensions
Les souches pures ainsi obtenues sont ensemencées dans les tubes à essai contenant les milieux M1 et M2. À partir de ces tubes, on réalise des suspensions pour les divers tests.
2.3 Matériel animal
Les tiques (Amblyoma variegatum) ont été prélevées sur les bovins élevés sur les fermes du Cenou (Campus d'Abomey-Calavi) et de Kpinnou (département du Mono). Elles sont conservées dans des boîtes en plastique stériles, avec trois à quatre trous d'aération, avec du coton imbibé d'eau.
L'expérience consiste à mettre un nombre variable de tiques femelles ou mâles préalablement séparées dans différentes boîtes de pétri. On y ajoute 1 μl de chaque huile essentielle à l'aide d'une micropipette. La durée de vie des tiques est suivie à l'aide d'un chronomètre.
3 Résultats et discussions
3.1 Composition chimique de l'huile essentielle d'Eucalyptus tereticornis
Les constituants majoritaires (Tableau 1) sont le para-cimène (31,14 %), le β-phellandrène (9,77 %), le spathulénol (8,13 %), l'α-phellandrène (6,78 %), le γ-terpinène (7,03 %), le α-phellandrène (6,78 %), le 1,8 cinéole (5,35 %). Cette huile diffère par sa composition de celle extraite des feuilles de la même espèce cultivée à Dogbo (Mono) par Sohounhloue et al. [11], dont les constituants majoritaires sont le trans-trans farnésol (58,51 %), le trans-cis farnésol (12,56 %), le cis-cis farnésol (8,42 %) et le β-pinène (7,83 %).
Composition chimique de l'huile essentielle extraite de feuilles d'Eucalyptus tereticornis Sm récoltées à Sèmè kpodji (Bénin)
| No | Composants | Colonne DB-5 | |
| IR | % | ||
| 1 | α-thujène | 933 | 2,10 |
| 2 | α-pinène | 939 | 1,51 |
| 3 | myrcène | 992 | 0,97 |
| 4 | α-phellandrène | 1000 | 6,78 |
| 5 | α-terpinène | 1016 | 0,50 |
| 6 | p-cimène | 1025 | 31,14 |
| 7 | β-phellandrène | 1030 | 9,77 |
| 8 | 1,8-cinéole | 1032 | 5,35 |
| 9 | γ-terpinène | 1067 | 7,03 |
| 10 | terpinolène | 1098 | 0,66 |
| 11 | terpin-1-en-4-ol | 1177 | 3,53 |
| 12 | cryptone | 1182 | 2,05 |
| 13 | α-terpinéol | 1188 | 0,74 |
| 14 | non identifié | 1276 | 0,96 |
| 15 | non identifié | 1353 | 0,68 |
| 16 | alloaromadendrène | 1461 | 1,18 |
| 17 | bicyclogermacrène | 1499 | 2,21 |
| 18 | spathulénol | 1574 | 8,13 |
| 19 | oxyde de caryophyllène | 1579 | 2,49 |
| 20 | γ-eudesmol | 1635 | 0,91 |
| 21 | β-eudesmol | 1647 | 0,75 |
| 22 | α-eudesmol | 1651 | 0,68 |
| 23 | E-E-farnésol | 1733 | 0,87 |
| TOTAL | 91,0 |
Ces résultats indiquent que nous sommes au Bénin en présence de deux chémotypes d'Eucalyptus tereticornis Sm : le chémotype à farnésol et le chémotype à para-cymène.
3.2 Activité antimicrobienne de l'huile essentielle d'Eucalyptus tereticornis Sm
La Fig. 1 nous donne le résultat du dénombrement des colonies en fonction de la concentration des bouillons de culture.
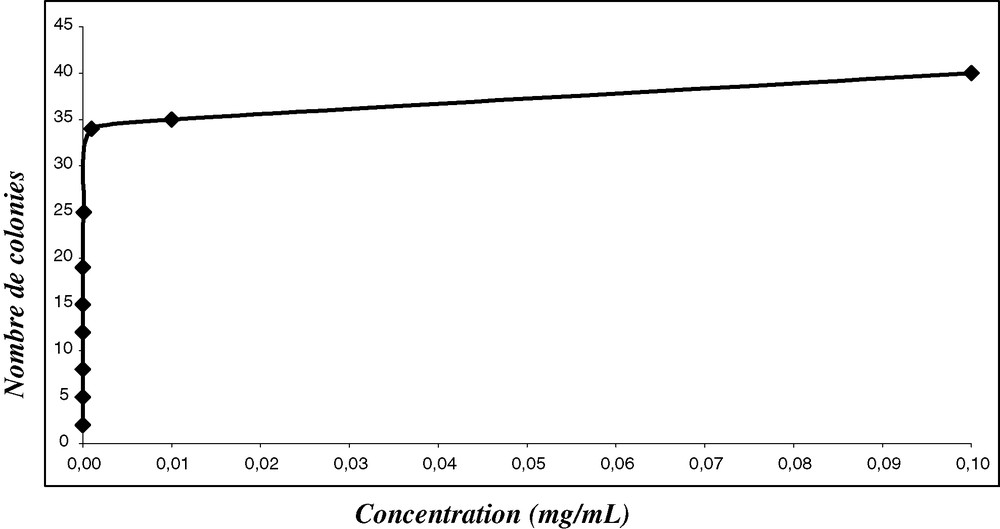
Nombre de colonies dénombrées en fonction de la concentration.
Il ressort de l'analyse de cette courbe que la diminution du nombre de microorganismes est fonction de la dilution.
Les résultats du dénombrement regroupés dans le Tableau 2 montrent les zones de croissance retardée, qui sont représentées par des signes « plus ».
Effets inhibiteurs des substances actives de l'huile essentielle sur les microorganismes
| No des boîtes de Pétri | Eucalyptus tereticornis Sm |
| 1 | – |
| 2 | – |
| 3 | – |
| 4 | – |
| 5 | ++ |
| 6 | +++ |
| 7 | +++ |
| 8 | +++ |
Le signe « moins » (–) montre que l'huile essentielle n'a pas d'action sur les microorganismes contenus dans ces boîtes de Pétri.
L'examen de ce tableau montre que l'huile essentielle d'Eucalyptus tereticornis Sm. a un pouvoir inhibiteur assez étendu à l'égard des microorganismes étudiés.
Après repiquage d'une zone de croissance retardée, on a constaté l'apparition des colonies dans certaines boîtes de Pétri. L'identification des microorganismes a permis de constituer le Tableau 3 et de procéder à la vérification des propriétés antimicrobiennes de l'huile essentielle.
Propriétés antimicrobiennes de l'huile essentielle d'Eucalyptus tereticornis Sm
| No des boîtes de Pétri | Description | Genre | Eucalyptus tereticornis Sm | |
| Effet après repiquage | Propriétés | |||
| 2 | levures isolées grosses de formes ovoïdes et lenticulaires | Saccharomyces spp. | destructeur | fongicides |
| 5 | bactéries Gram (+) corynéformes | Corynebacteriaceae spp. | destructeur | bactéricides |
| 6 | levures encapsulées | Sporobolomyces | destructeur | fongicides |
| 7 | levures en chaîne ou en amas | Torulopsis candida | inhibiteur | fongiostatiques |
| 8 | levures ovoïdes et lenticulaires | Hansenula spp. | destructeur | fongicides |
3.3 Activité contre les tiques (Amblyomma variegatum)
Les Figs. 2 et 3 illustrent l'action des huiles essentielles sur les tiques mâles et femelles.
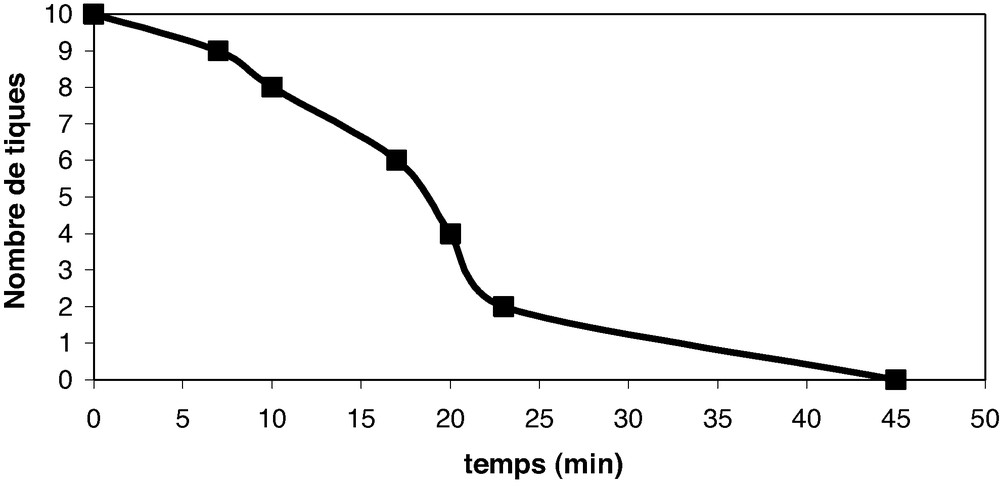
Activité contre les tiques mâles.
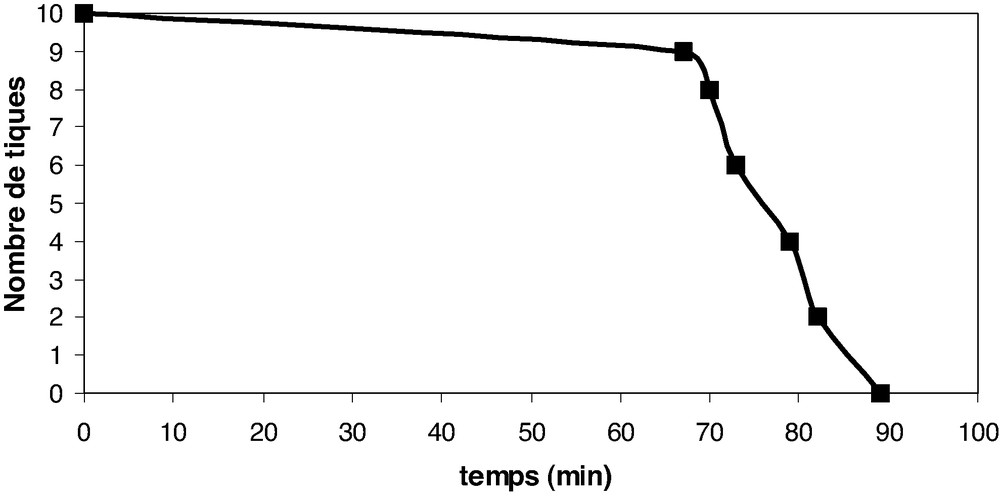
Activité contre les tiques femelles.
L'examen des Figs. 2 et 3 montre que les tiques femelles résistent plus à l'action destructrice de l'huile essentielle d'Eucalyptus tereticornis Sm. que les tiques mâles. Toutes les tiques mâles sont détruites après 45 min alors que les tiques femelles ont résisté jusqu'à 325 min (05 h 25 min).
4 Conclusion
De l'analyse de la composition chimique, il ressort que :
- • l'essence d'Eucalyptus tereticornis Sm. comporte comme composés principaux le p-cimène (31,14 %) ; le β-phellandrène (9,77 %) ; le spathulénol (8,13 %) ; le γ-terpinène (7,03 %), le α-phellandrène (6,78 %) et 1,8-cinéole (5,35 %) ;
- • l'huile essentielle d'Eucalyptus tereticornis Sm présente une activité bactéricide (elle détruit complètement Saccharomyces spp., Sporobolomyces et Hansenula), fongicide (détruit Corynebacteriaceae spp.) et fongiostatique (inhibe la croissance de Torulopsis candida), objets de nos investigations ;
- • l'huile essentielle d'Eucalyptus tereticornis Sm exerce une action destructrice sur les tiques (il est à noter que les tiques femelles résistent davantage à cette essence).


