1 Introduction
Securidaca longepedunculata, de la famille des Polygalaceae (syn. Securidaca spinosa Sim. ; Lophostylis pallida Klotzsch.), est un arbuste de 7 à 10 m de haut, avec une cime claire. L'écorce est épaisse, jaune clair et lisse, avec des petites écailles foncées ; les racines sont très épaisses et odorantes. Les feuilles de l'arbre sont alternes, allongées lancéolées et vert foncé ; les fleurs sont papilionacées, également très odorantes, formant d'octobre à décembre des racèmes au bout de rameaux latéraux courts [1].
La plante est répandue en Afrique, dans les savanes et les galeries forestières ; elle se développe bien sur des sols sableux ou rocheux des savanes humides [1].
En Afrique, cette espèce est très utilisée en médecine traditionnelle, entre autres comme contre-poison (venin de serpents), contre les amibiases, les vers intestinaux, les migraines, la malaria, les hépatiques, etc. [1] Son action répulsive contre les animaux à sang froid [2] (serpents, scorpions, etc.) est également rapportée.
Les huiles essentielles de l'espèce acclimatée au Burkina Faso n'ont pas fait encore l'objet de travaux de caractérisation chimique. Nous rapportons ici les résultats de caractérisation chimique des huiles essentielles de l'écorce des racines de Securidaca longepedunculata, compte tenu de son importance en médecine traditionnelle.
2 Partie expérimentale
2.1 Matériel végétal
Les racines de Securidaca longepedunculata ont été récoltées en mars 2001 et en avril 2002 à Yallé (11° 13′ 060" de latitude nord et 1° 56′ 392" de longitude ouest). La plante et les organes récoltés ont été identifiés par le laboratoire de biologie et d'écologie végétales de l'université de Ouagadougou, où un spécimen a été déposé. Les huiles essentielles ont été extraites à partir de racines fraîches et à partir de racines séchées à l'ombre pendant 5 jours.
2.2 Extraction des huiles essentielles
Les huiles ont été extraites par hydrodistillation, à l'aide d'un appareil du type Clevenger, pendant 3 h. Les huiles essentielles sont collectées par décantation, puis séchées sur sulfate de sodium anhydre. La masse du matériel végétal frais a été considérée pour le calcul des rendements.
2.3 Analyses par chromatographie en phase gazeuse
Les analyses des huiles ont été faites à l'aide d'un chromatographe VARIAN 3800, équipé de deux colonnes capillaires, l'une polaire et l'autre apolaire (Supelcowax 30 m ; 0,25 mm et SPB1 30 m ; 0,25 mm ; dans chaque cas, la taille des particules de la colonne était de 0,25 μm). La température du four était programmée de la manière suivante : 40 à 240 °C (2 °C/min), puis stationnaire à 240 °C pendant 40 min. L'injecteur et le détecteur étaient portés respectivement à 230 et 250 °C, le gaz vecteur utilisé étant l'hélium.
2.4 Analyses par GC/MS
Les spectres GC/MS ont été réalisés sur un appareillage de type Varian 3400, muni d'un injecteur SPI et équipé d'une colonne capillaire DB-WAX (30 m, 0,25 mm, taille des particules : 0,25 μm) ; le spectromètre de masse utilisé, de marque Saturn II, était muni d'une trappe ionique maintenue à 220 °C, avec un impact de 70 eV.
La température du détecteur était de 250 °C, celle de l'injecteur était programmée de 40 °C à 240 °C à raison de 180 °C/min et a été maintenue à cette température pendant 139 min. La température du four était programmée de 40 °C à 240 °C à raison 2 °C/mn et a été maintenue à 240 °C pendant 40 min, la ligne de transfert étant maintenue à 250 °C.
2.5 Résonance magnétique nucléaire 1H et 13C
Les spectres RMN ont été réalisés sur un appareil Bruker AC 80 ; l'échantillon d'huile a été dissout dans l'acétone-d6, le tétraméthyle silane (TMS) a été utilisé comme référence interne. Le spectre 1H a été réalisé à 80 MHz et celui du 13C à 20 MHz.
3 Résultats et discussion
L'huile essentielle obtenue est incolore et plus dense que l'eau (> 1), le rendement d'extraction est de 0,85% (v/m). L'effet du séchage ne semble pas affecter le rendement d'extraction et la composition chimique de l'huile essentielle.
Les analyses, en chromatographie en phase gazeuse, ont montré que l'huile essentielle serait constituée d'un seul composé chimique (100%). Le spectre masse obtenu indiquait deux composés possibles (Fig. 1), qui sont deux isomères de l'hydroxylméthylbenzoate, soit le dérivé para 1 soit le ortho 2 (qui est le salicylate de méthyle).
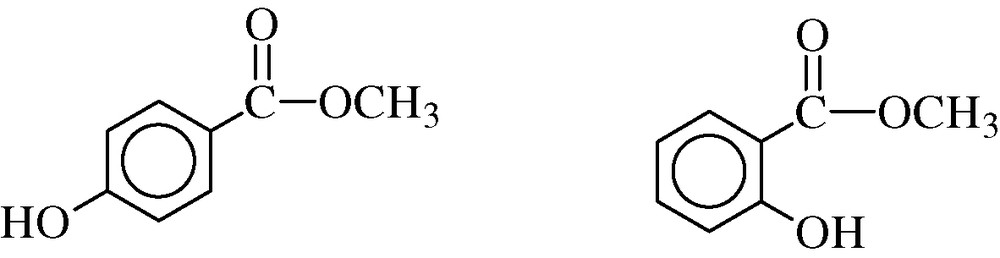
p-hydroxyméthylbenzoate 1 et o-hydroxyméthylbenzoate 2.
Pour élucider la structure du composé, nous avons procédé, en chromatographie gazeuse, à une co-injection de salicylate de méthyle commercial. Après calcul des indices de Kovat's (KI) du produit commercial, une comparaison a été faite avec ceux de l'huile.
Ainsi que l'indique le Tableau 1, les indices de Kovat's du composé unique de l'huile essentielle sont bien comparables à ceux du salicylate de méthyle commercial obtenus dans les mêmes conditions d'analyse. Ainsi le composé unique de l'huile est du salicylate de méthyle.
KI expérimentaux de l'huile essentielle de Securidaca longepedunculata et du salicylate de méthyle commercial comparés aux données de la littérature
| Substance | KI | |
| SPB1 | SPWAX | |
| Huile essentielle | 1167 | 1743 |
| Salicylate de méthylea | 1165 | 1742 |
| Banque de données (dérivé ortho) | 1166 | 1739 |
a Produit commercial (Merck, pureté > 98%).
Ce résultat a été confirmé par l'enregistrement des spectres de résonance magnétique nucléaire du proton et du carbone 13 de l'huile essentielle (Figs. 2 et 3), dont les données expérimentales correspondent à tout point de vue aux données de la littérature [3,4].

Spectre RMN 1H de l'huile essentielle de racines de S. longepedunculata.
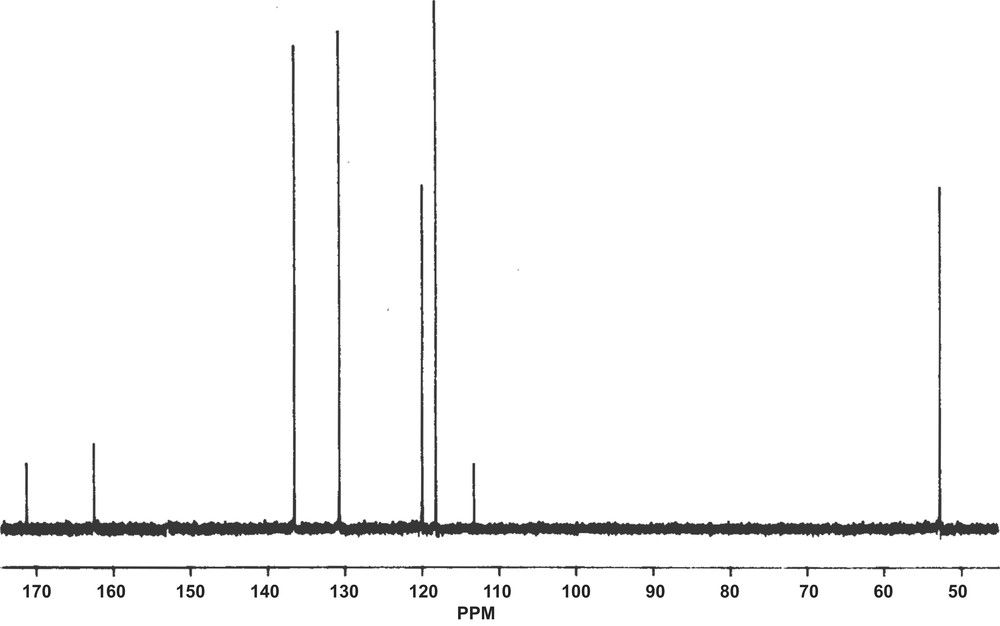
Spectre RMN 13C de l'huile essentielle de racines de S. longepedunculata.
Les paramètres du spectre du proton sont les suivants : un signal à δ = 3,95 ppm (s), l'intégration 3H correspondant au signal des protons du groupement méthyle, un multiplet compris entre 6,8 et 8 ppm, l'intégration 4H correspondant au signal des protons aromatiques et le signal sous forme de singulet à δ = 10,8 ppm (1H) correspondant à celui du proton phénolique.
Paramètres du spectre 13C :
- δC1 = 174,01 ppm, δC2 = 113,18 ppm,
- δC3 = 131,06 ppm, δC4 = 120,16 ppm
- δC5 = 137,24 ppm, δC6 = 118,89 ppm,
- δC7 = 163,49 et δC8 = 52,23 ppm (cf. Fig. 4).
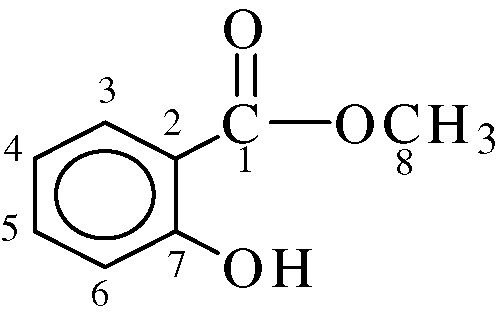
Numérotation des carbones du salicylate de méthyle.
Ces résultats constituent une contribution originale à la caractérisation des huiles essentielles. En effet, les huiles essentielles comportant un produit majoritaire (teneur > 90%) pourraient être caractérisées par la résonance magnétique nucléaire.
La teneur élevée des racines en salicylate de méthyle confirme les travaux de Jayasekara et al. [5], réalisés sur la même espèce, acclimatée au Ghana dans la région de Tamalé. En effet, à partir de l'extrait au méthanol de l'écorce des racines de S. Longepedunculata, ces auteurs ont mis en évidence 90% de salicylate de méthyle. Dans la présente étude, l'extraction a été faite par la technique d'hydrodistillation et a permis d'isoler une huile pure, puisque uniquement constituée de salicylate méthyle.
Des cas d'huile essentielle riche en salicylate de méthyle ont été décrits dans la littérature dans le cas de Betula alnoïdes de la famille des Betulaceae [6,7]. En effet, des auteurs ont montré que l'huile essentielle de l'écorce des racines de cette espèce contiendrait 98,2% de salicylate de méthyle pour l'espèce acclimatée en Inde et 99,4% de salicylate de méthyle pour celle rencontrée au Vietnam.
4 Conclusion
Ce travail regroupe les principaux résultats d'une première étape d'une étude pour la valorisation de plantes aromatiques à propriétés pesticides. Ainsi, la composition chimique des huiles essentielles de l'écorce des racines de Securidaca longepedunculata récoltées au Burkina Faso a été décrite pour la première fois. La particularité de cette huile essentielle est qu'elle contient uniquement du salicylate de méthyle. Outre les techniques traditionnelles de détermination de la composition chimique, l'huile essentielle a pu être caractérisée par résonance magnétique nucléaire. Ainsi, les huiles à forte teneur (> 90%) d'un composé majoritaire pourraient être analysées par cette technique. La prochaine étape du travail consistera à faire des tests pour la mise en évidence des propriétés insecticides des huiles obtenues.
Remerciements
Nous remercions le Centre canadien de recherche pour le développement international (CRDI), dont le soutien financier a permis la réalisation de ce travail, ainsi que Mme Jeanne Millogo-Rasolodimby pour l'identification de l'espèce et Mme France Boudreau pour la réalisation des analyses GC/MS.


