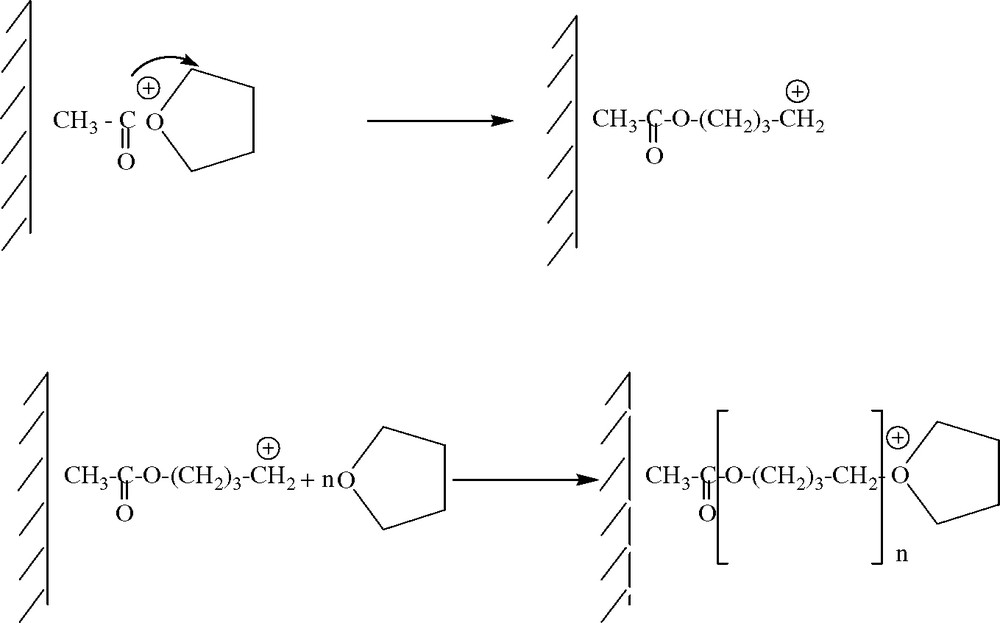
1 Introduction
Les argiles présentent, de par leur acidité naturelle de surface [1,2], des propriétés catalytiques dans les réactions de polymérisation. Solomon et al. [3,4], Njopwouod et al. [5] et Belbachir et al. [6] ont étudié la polymérisation de plusieurs monomères hétérocycliques et vinyliques.
Le THF est le monomère par excellence permettant de caractériser une réaction de polymérisation cationique par ouverture de cycle [7].
Industriellement, la polymérisation du THF est amorcée par l'acide fluorosulfonique ou l'acide sulfurique [8]. Les acides ne sont pas recyclés. Ces déchets liquides posent des problèmes de stockage ou de corrosion et polluent l'environnement. De plus, la présence de groupements hydroxylés durant la polymérisation élargit la distribution des masses molaires. Pour résoudre ce problème, Heitz et al. [9,10] ont préparé un polyTHF avec un groupement acétate en bouts de chaînes, en utilisant un acide protique en présence de l'anhydride acétique [11].
Le gisement de Tamazert (Est algérien) est l'un des plus important d'Algérie ; il est exploité à ciel ouvert. Le kaolin est surtout utilisé dans l'industrie des céramiques. Il est caractérisé par sa blancheur et une bonne cristallinité. C'est dans le but de valoriser ce produit et d'en multiplier les usages que nous l'avons choisi pour cette étude. En effet, le kaolin activé est un catalyseur solide, recyclable et non toxique, qui serait, alors plus simple et facile à mettre en œuvre. Les résultats obtenus avec des argiles dans d'autres réactions de polymérisation [12] montrent que les masses molaires des produits de synthèse sont plus importantes pour le kaolin que celles obtenues avec d'autres argiles, notamment les montmorillonites locales activées.
2 Matériaux et méthodes
2.1 Matériaux
Le kaolin de Tamazert a été gracieusement offert par l'ECVO (Maghnia, Algérie). Il est traité par des lavages successifs, à l'eau distillée, H2O2 (10 volumes) à 70 °C et enfin par HCl (0,1 M) à température ambiante. Il est ensuite séché durant une nuit à l'étuve, à 105 °C.
Le séchage du THF se fait par adsorption sur la maghnite [6], une montmorillonite déshydratée, sous agitation magnétique, et filtration.
2.2 Méthodes
Les mesures de fluorescence X visant à déterminer la composition en oxydes du kaolin ont été effectuées au centre d'analyses du CNRS de Vernaison [13].
Le diffractomètre RX utilisé est un appareil Philips PW 1710, avec une cathode en cuivre, utilisant la raie Cu Kα, avec λ = 1,5406 Å.
Les spectres de MAS RMN du 29Si et du 27Al pour les échantillons de kaolin ont été enregistrés sur des spectromètres Brüker, ASX 300 MHz et ASX 500 MHz.
Ils ont été enregistrés aux fréquences respectives de 59,6 MHz et 130,3 MHz pour le 29Si et le 27Al. Les fréquences de rotation sont de 4 kHz pour le silicium et 11,5 kHz pour l'aluminium.
Toutes les mesures ont été effectuées à température ambiante avec le Q8M8 comme référence pour le silicium et le nitrate d'aluminium en solution pour l'aluminium.
Les temps d'accumulation ont été choisis de façon à éviter la saturation. Ils ont été optimisés à 1 s pour la RMN du 27Al et à 5 s pour celle du 29Si. Les durées des impulsions sont de 0,5 μs pour 27Al et de 5,3 μs pour 29Si. Le nombre d'accumulations est en moyenne de 3600 pour le silicium et de 450 pour l'aluminium.
Pour les mesures de viscosité, le viscosimètre utilisé est de type Ostwald, à tubes capillaires (ϕ = 1,42 mm), dans le toluène, à 30 °C.
Les spectres 1H et 13C RMN ont été enregistrés sur un spectromètre de type Brüker AC 300 dans le CDCl3.
Les masses molaires moyennes ont été déterminées par GPC sur un appareil WISP712 (Waters), avec le THF comme éluant et le polystyrène comme étalon.
2.3 Caractérisations du kaolin de Tamazert
2.3.1 Surface spécifique
La surface spécifique du kaolin de Tamazert naturel (KTMn) a été déterminée par la méthode BET et est de 21,95 m2 g–1. L'échantillon traité (KTMt) avec HCl 0,1 M pendant 24 h, présente une surface spécifique égale à 23,7 m2 g–1.
2.3.2 Fluorescence X
Voir Tableau 1.
2.3.3 Diffraction par rayons X
La Fig. 1 représente le diffractogramme de l'échantillon KTMn. Trois phases cristallines, sont identifiées : la kaolinite (76%), le quartz (9%) et l'illite (5%).
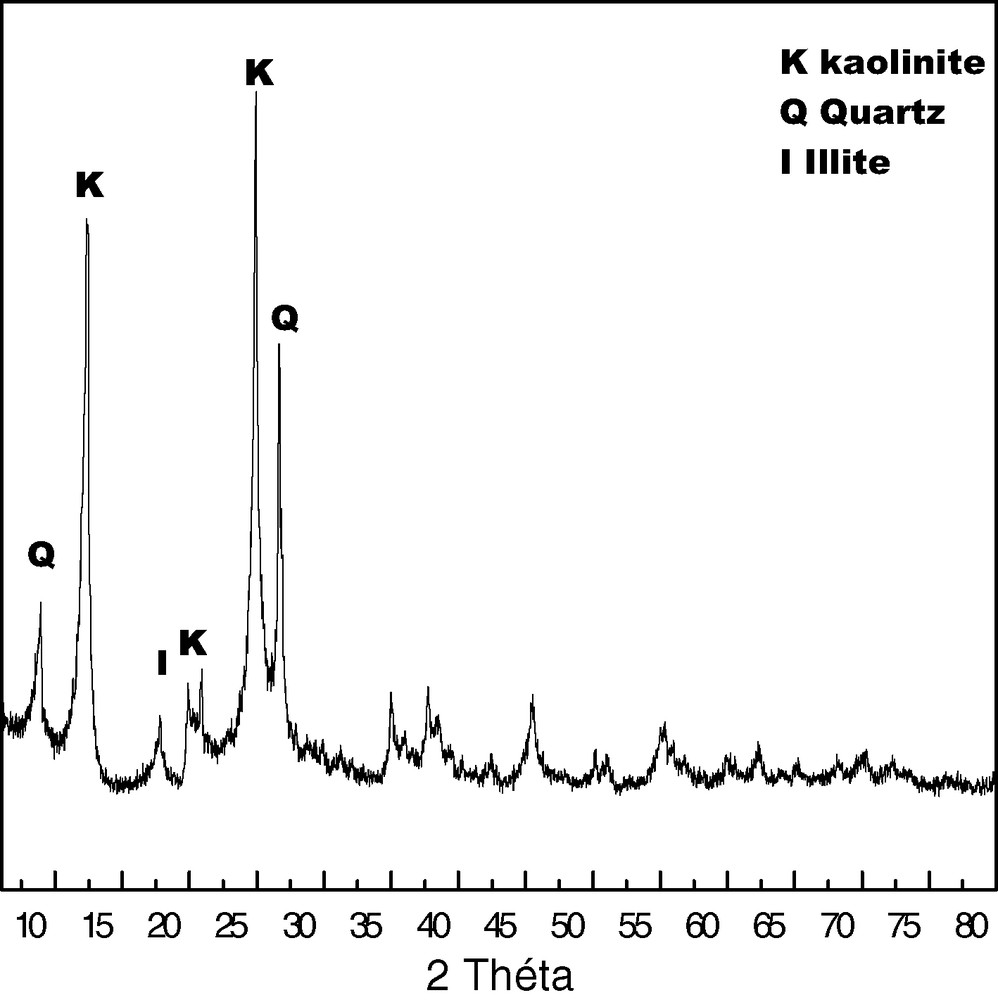
Spectre de diffraction des rayons X de l'échantillon KTMn.
Dans la Fig. 2, on observe que le spectre de KTMt montre un aplatissement des raies, ce qui indique un léger désordre dû à une légère désalumination dans la structure, ainsi que le montre le Tableau 1, sans toutefois atteindre l'amorphisation totale du matériau.

Spectre de diffraction des rayons X de l'échantillon KTMt.
2.3.4 Spectroscopie IR
Le spectre IR du KTMt (Fig. 3) montre l'apparition d'un pic dédoublé, situé vers 3650 cm–1, attribué aux OH de constitution, de deux pics à 3400 et 1600 cm–1, attribués respectivement aux élongations et déformations des liaisons O–H physisorbées. Les élongations des Si–O se manifestent à 1016 cm–1. On note également une bande d'absorption à 912 cm–1, due aux liaisons Al–O.
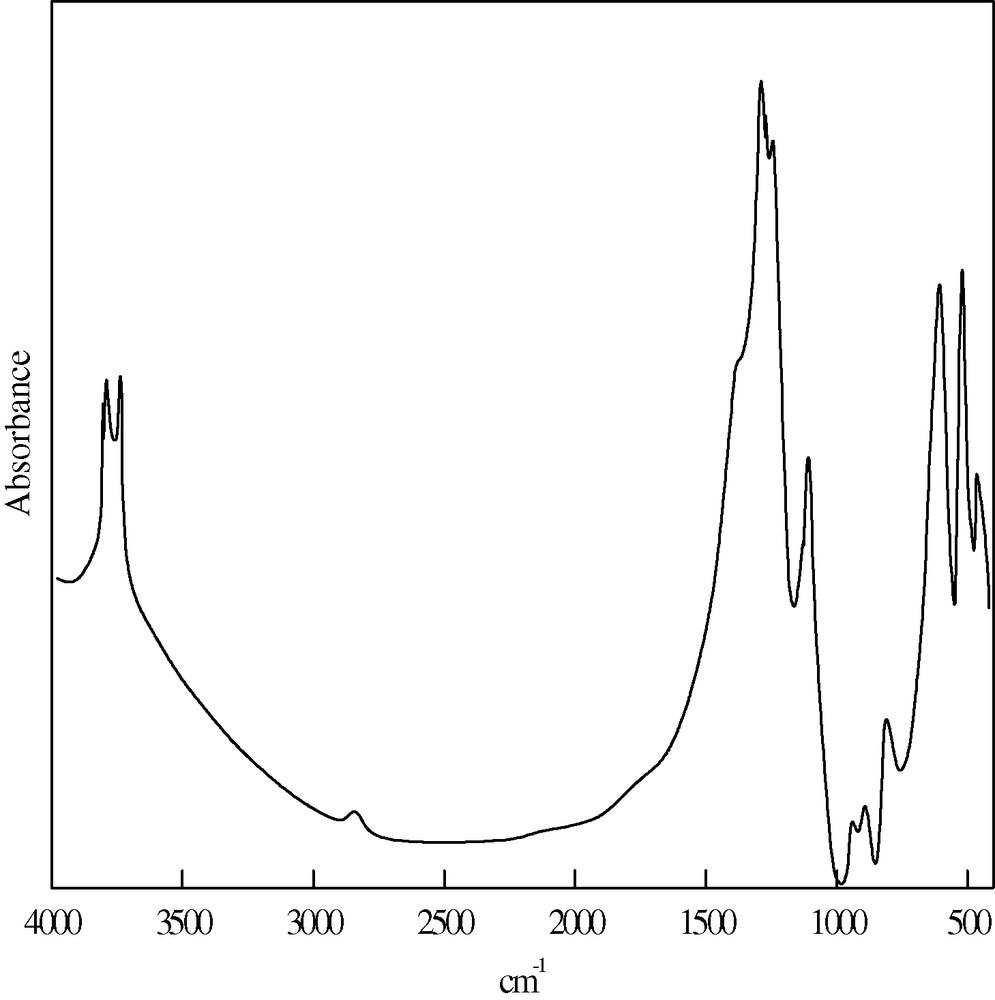
Spectre FT-IR de l'échantillon KTMt.
2.3.5 RMN du 29Si et du 27Al
Le spectre MAS RMN du 27Al obtenu pour l'échantillon KTMn (Fig. 4) présente deux résonances situées à 70 et 3 ppm, assignées respectivement à l'aluminium en site tétraédrique et octaédrique. Nous notons un faible taux de substitution du Si par le Al dans les sites tétraédriques.
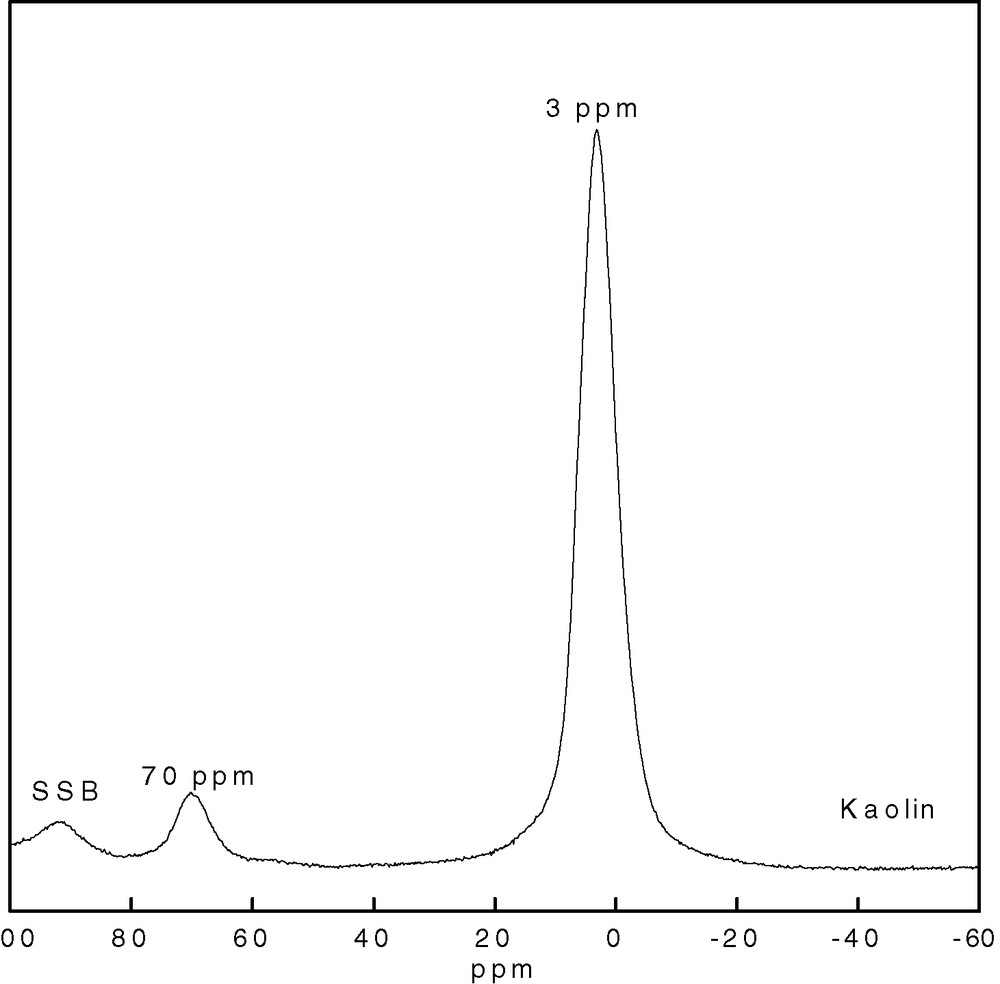
Spectre MAS RMN de 27Al du KTMn (SSB : bandes de rotation latérales).
Le spectre RMN du 29Si pour l'échantillon de kaolin est donné sur la Fig. 5. L'échantillon présente un déplacement à –91,5 ppm avec un épaulement à –86,6 ppm. Le pic principal est attribué au silicium en environnement Q3(OAl), où un atome de silicium est entouré de trois autres atomes Si. Ceci est confirmé par les résultats de la RMN 27Al. La résonance à –86,6 ppm est attribuée à la deuxième population d'atomes de silicium Q2(1Al) où le Si a pour voisins immédiats deux Si et un Al.
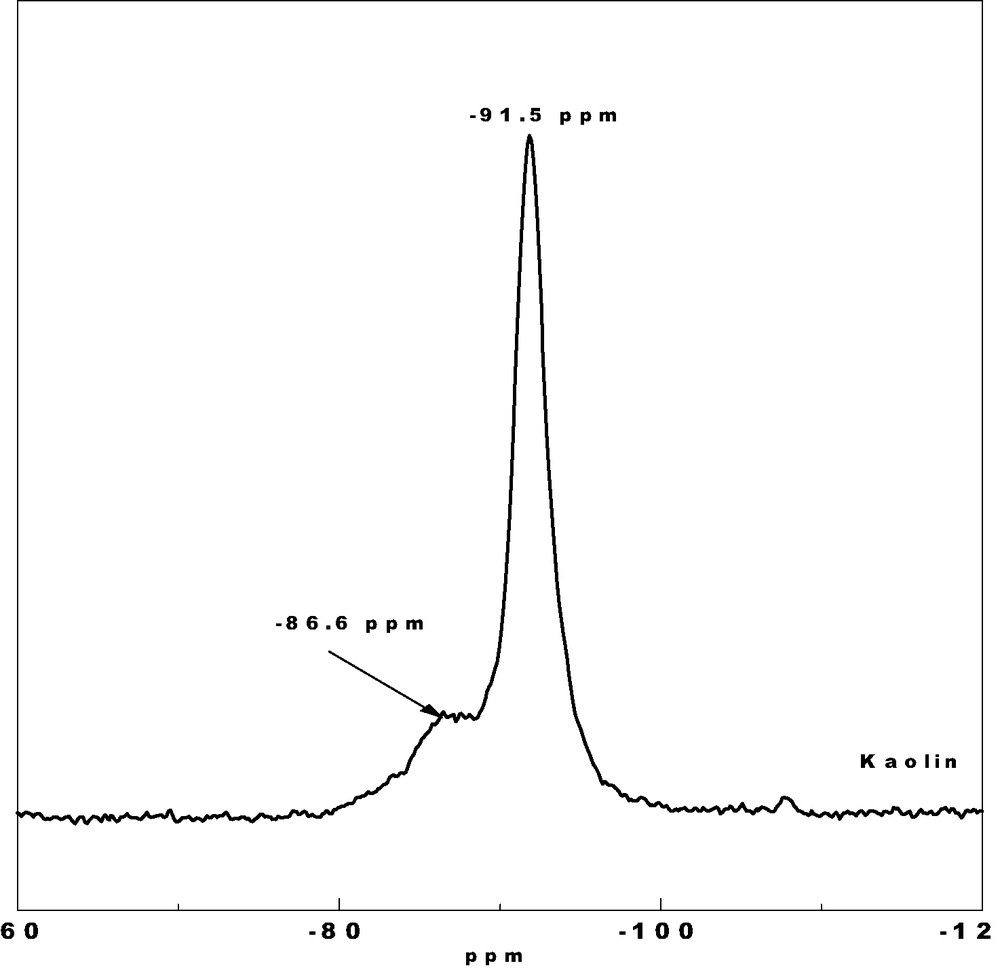
Spectre MAS RMN du 29Si de l'échantillon KTMn.
Les spectres de 29Si MAS RMN (Fig. 6) ne montrent aucune différence en termes de population de silicium dans les deux produits. Ceux du 27Al RMN (Fig. 7) montrent, en revanche, une désalumination du KTMt, avec destruction partielle de la couche octaédrique, indiquée par une nette diminution du pic de l'atome AlVI, situé à 3 ppm.

Spectre 29Si MAS RMN des KTMn et KTMn

Spectre 27Al MAS RMN de KTMn et KTMt.
2.4 Synthèse du polyTHF
Au kaolin traité, déshydraté et refroidi à température ambiante, on ajoute dans un ballon 10 g (0,138 mol) de THF et 1 g (0,0098 mol) d'anhydride acétique, soit 4% en masse du monomère. Des réactions préliminaires ont permis d'optimiser la quantité d'anhydride acétique dans le mélange réactionnel, le taux choisi dans la suite de nos travaux est fixé à 4% en masse, valeur qui permet un taux de conversion et une viscosité intrinsèque acceptables.
Les quantités de kaolin varient de 1% à 15% par rapport au poids du monomère, les réactions sont effectuées sous agitation magnétique, sous argon, à T = 20 ± 2 °C, pour des temps de réaction variables. Le KTMt est récupéré par simple filtration. Le polymère est précipité, dans un excès de méthanol à froid et séché sous vide.
3 Résultats et discussion
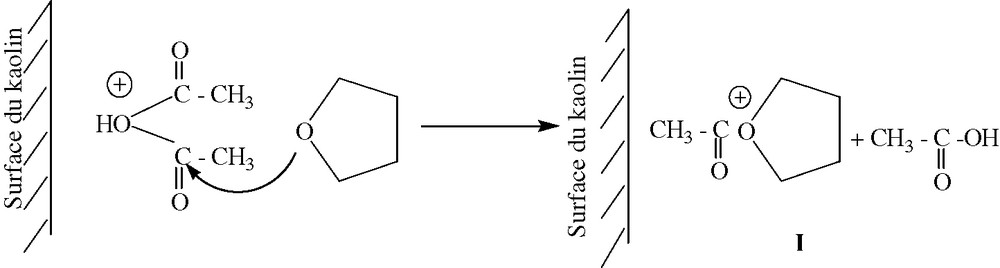
La présence de l'anhydride acétique permet d'effectuer la polymérisation du THF en présence du kaolin traité selon le mécanisme représenté sur la Fig. 8.

Schéma réactionnel de la polymérisation du THF en présence du KTMt.
La Fig. 9 représente le spectre IR du polymère obtenu. Les bandes d'absorption sont caractéristiques au polyTHF, à savoir une première située à 1741 cm–1, correspondant au groupement carbonyle (C=O) de l'ester, une deuxième à 2858 cm–1, attribuée aux vibrations de la liaison C–H du groupement méthyle, et enfin une troisième à 1113 cm–1, confirmant la présence de la fonction éther C–O.
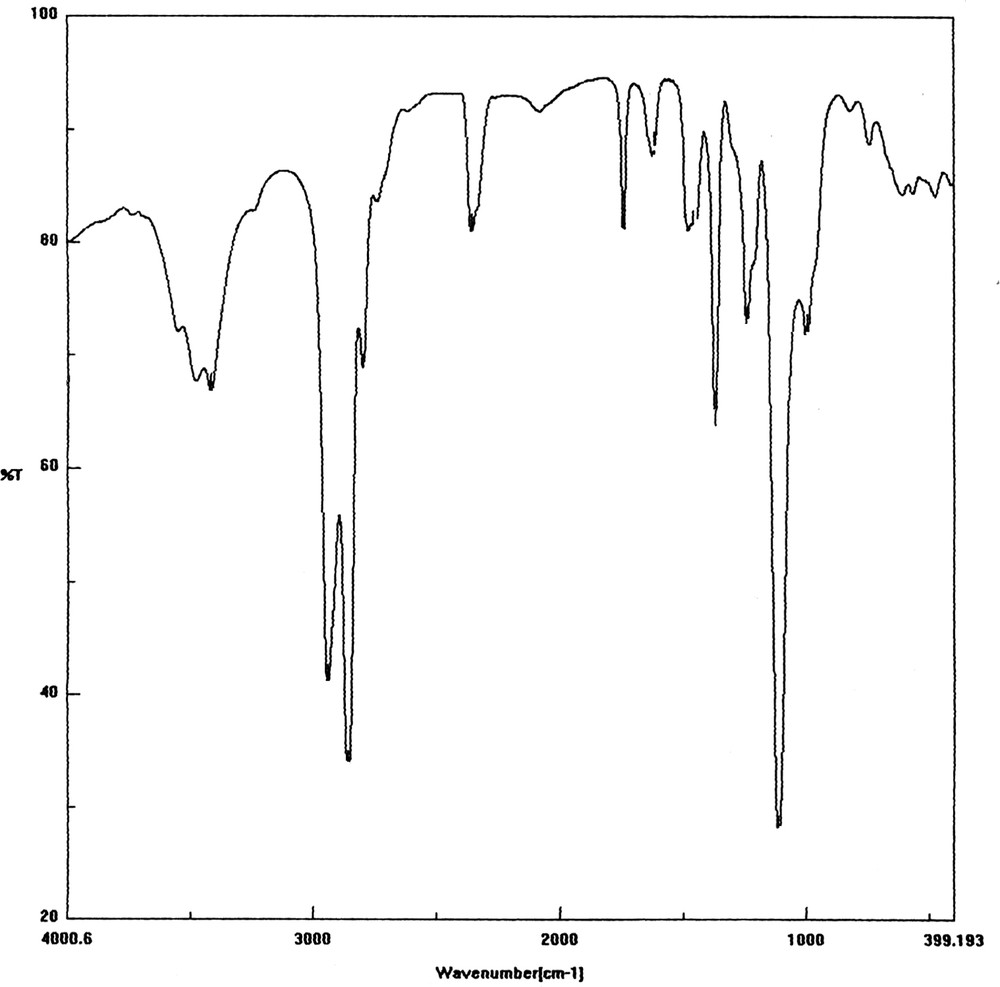
Spectre FT-IR du polyTHF obtenu après 24 h de réaction, pour une fraction de kaolin de 5% et 4% en masse du monomère de AA.
Le spectre RMN du polyTHF (Fig. 10) a été enregistré pour un échantillon obtenu avec une fraction de kaolin de 5% et 4% en masse du monomère d'anhydride acétique, le temps de réaction étant de 48 h.
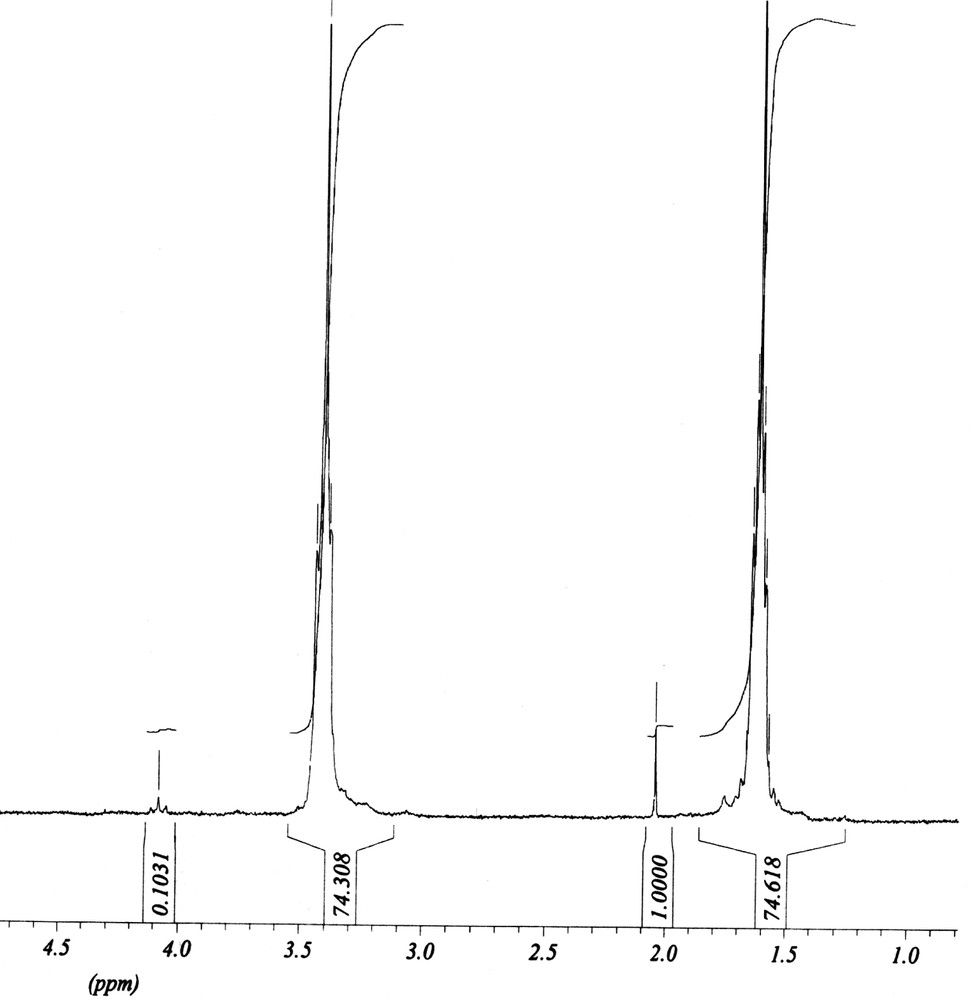
Spectre 1H RMN du polyTHF obtenu pour une fraction de kaolin de 5% et 4% en masse du monomère de AA.
Les déplacements chimiques des différents protons sont représentés dans le Tableau 2. La détermination de la surface des pics relatifs au proton méthylénique du THF et de celles des pics du groupement acétate se trouvant à l'extrémité de la chaîne polymère permet le calcul de la masse molaire moyenne en nombre [14] : , avec n = 112.
Déplacements chimiques des protons du polyTHF
Le chromatogramme GPC obtenu pour le polyTHF synthétisé se résume à un pic étroit, confirmant ainsi l'absence de réactions de transfert [14]. Dans le Tableau 3 sont représentées les masses moléculaires moyennes en nombre et en poids pour des échantillons obtenus pour une fraction de kaolin de10% et des temps de réaction variables.
Résultats de GPC du polyTHF du polyTHF(10% en kaolin, 4% AA)
| Temps de réaction (h) | I | ||||||
| 7 | 4954 | 5970 | 1,2 | ||||
| 17 | 5037 | 6894 | 1,36 | ||||
| 20 | 5220 | 7261 | 1,39 | ||||
| 24 | 5375 | 7790 | 1,45 |
La Fig. 11 représente les variations de la viscosité intrinsèque des polymères obtenus, après 24 h, en fonction de la fraction de kaolin dans le milieu réactionnel. Quand cette dernière augmente, la viscosité intrinsèque diminue rapidement. Les masses molaires viscosimétriques varient dans le même sens.

Variation de la viscosité intrinsèque du polyTHF en fonction de la fraction du KTMt.
Le kaolin possède un caractère acide hérité des cations présents dans le minéral pour assurer l'équilibre de charge résultant des substitutions isomorphiques du Si par Al dans les couches tétraédriques et aux groupements silanols et aluminols de surface et de bord. Un broyage fin de l'argile (0,5–0,8 μm) augmente la quantité des hydroxyles de surface. Le lavage acide confère une plus grande acidité au kaolin suite à la désalumination. Cette acidité peut être estimée par l'échelle de Hammet [1].
La Fig. 12 montre les variations du taux de conversion en fonction de la concentration en kaolin acidifié qui varie de 0 à 15% par rapport à la masse du monomère pour un temps de réaction de 20 h. Le kaolin montre une activité certaine dans la polymérisation du THF ; un taux de conversion du THF de 56% est obtenu avec 15% en kaolin alors que, sans kaolin, dans les mêmes conditions, ce taux reste inférieur à 5%. L'anhydride acétique amorce la réaction de polymérisation, le kaolin la favorise, il agit comme activateur de réaction.
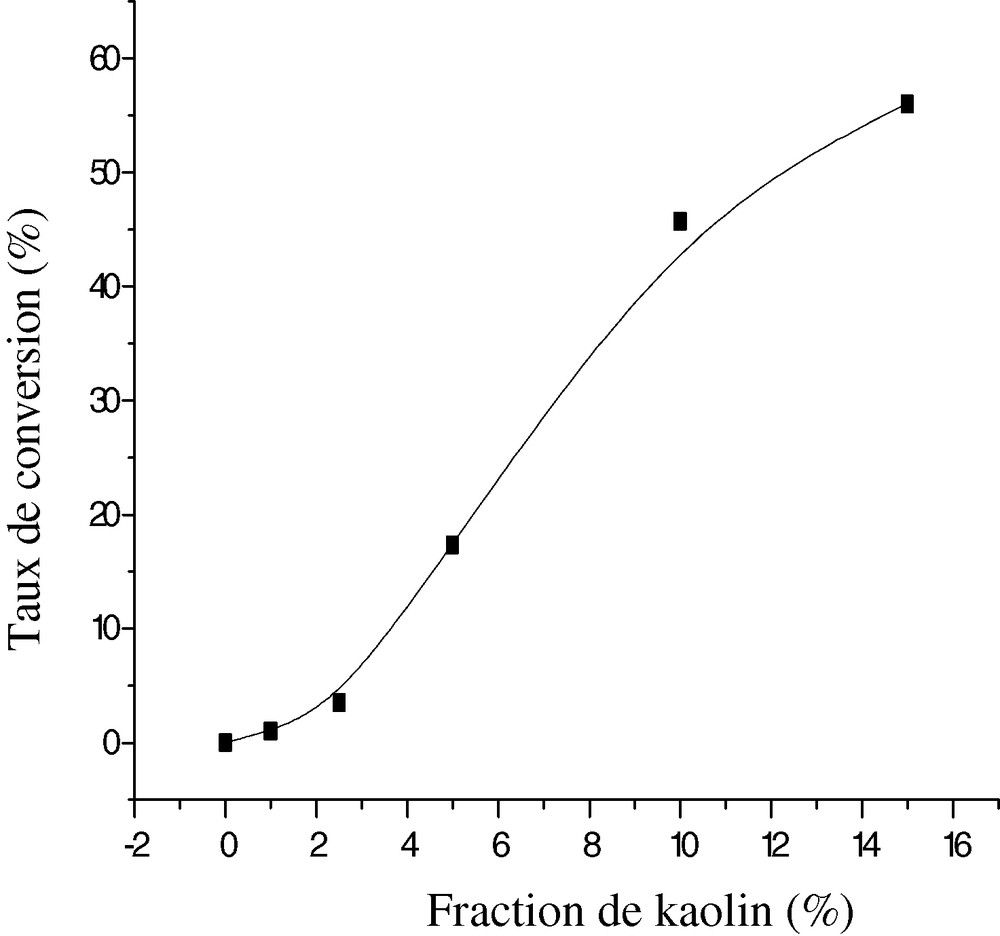
Évolution de la conversion du THF en fonction de la fraction du KTMt, 4% AA et 20 h de réaction.
La Fig. 13 montre les résultats obtenus pour un rapport kaolin/THF de 10%. La quantité de polymère varie de façon linéaire avec le temps de réaction.
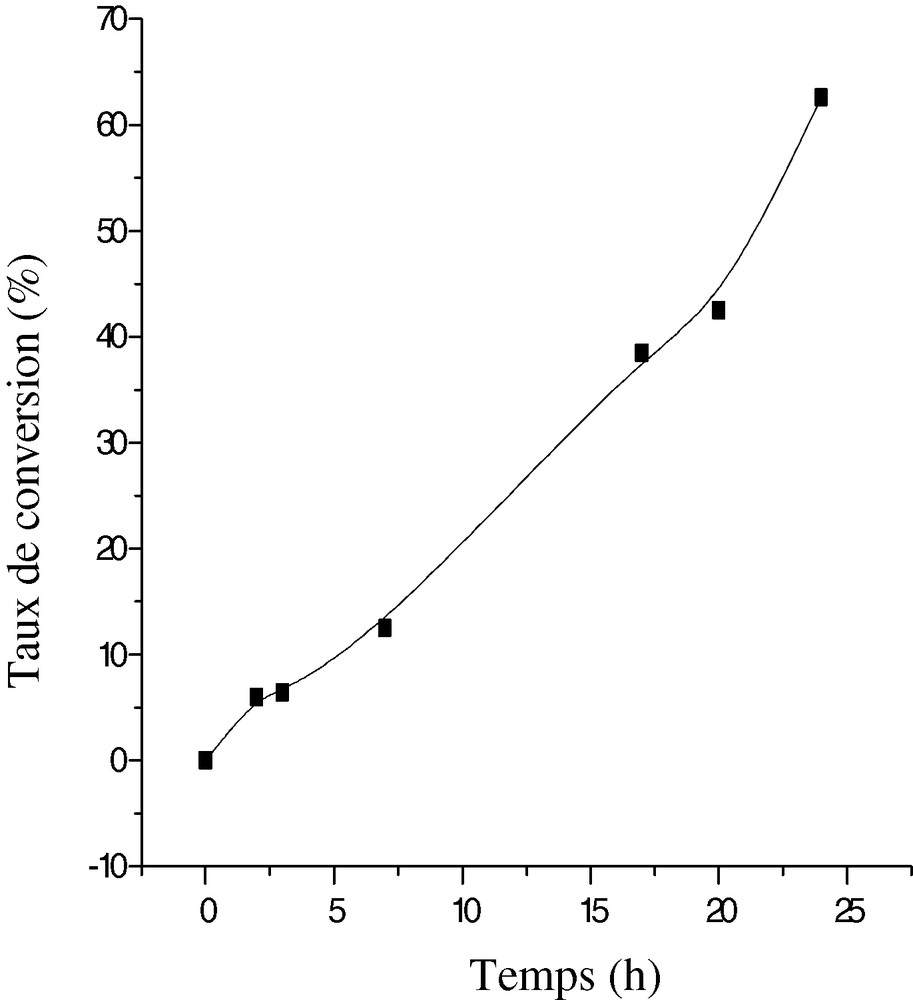
Variation du taux de conversion du THF en fonction du temps de réaction pour une fraction de kaolin de 10% et 4% AA.
L'amorçage du THF est plus sélectif ; il ne peut être polymérisé que par voie cationique. Dans ce cas, il semblerait que l'amorçage soit cationique, car le kaolin améliore les conversions.
Sur la base des résultats obtenus nous pouvons proposer le mécanisme réactionnel suivant.
- (1) Amorçage
La deuxième étape consisterait en une attaque nucléophile de l'anhydride acétique protonée par une molécule de THF, réaction ayant également pour résultats la formation d'une molécule d'acide acétique.
- (2) Propagation
- (3) Transfert
Les résultats de la GPC montrent une distribution étroite des masses molaires et permettent de conclure qu'il n'existe pas de réactions de transfert, ou alors qu'elles restent faibles [14].
- (4) Terminaison
La présence de la molécule d'acide acétique, résultant de l'étape d'amorçage permettrait la terminaison de la chaîne en croissance.

4 Conclusion
L'ensemble des résultats obtenus dans cette étude préliminaire montre qu'il est possible d'activer les polymérisations en masse par ouverture de cycle du THF par le kaolin de Tamazert, en l'absence de tous produits toxiques non récupérables. Le mécanisme d'amorçage semble cationique, le polyTHF n'étant obtenu que par cette voie, et serait dû, en partie, aux sites acides de surface de l'argile. Un traitement acide préalable du kaolin permet d'arriver à des taux de conversion assez importants.
La cinétique de réaction dépend, elle aussi, de la fraction massique de l'argile utilisée, la vitesse de réaction augmentant avec cette dernière. L'efficacité de l'argile est prouvée, car les résultats comparatifs obtenus lors de la polymérisation du THF avec et sans kaolin sont explicites. La présence de l'argile influence les masses moléculaires et la cinétique de réaction.
Des études complémentaires ont été réalisées pour vérifier la structure du kaolin pour une éventuelle réutilisation. Les DRX montrent que la structure du matériau n'est pas altérée, un lavage acide post polymérisation du kaolin permettant d'aboutir au même taux de conversion. Il est intéressant de constater que le matériau est recyclable.
Il est cependant évident que tout l'AA utilisé n'a pas participé à la réaction de polymérisation. L'acide résiduel est solubilisé dans le méthanol utilisé lors de la précipitation du polymère. De ce fait il est difficile de quantifier l'AA restant.