1 Introduction
Les résines composites dentaires de restauration sont de nos jours largement utilisées en odontologie. Ces résines sont basées sur des oligomères difonctionnels modifiés, porteurs de fonctions méthacrylates téléchéliques qui permettent d'obtenir un réseau tridimensionnel après photopolymérisation des doubles liaisons. La structure chimique de l'oligomère est, soit une structure époxyde (résine de Bowen), uréthane, polyéther, soit un mélange des trois [1].
Nous nous proposons dans cet article de présenter les résultats de l'étude cinétique de photopolymérisation du système acrylate/photoamorceur. Les systèmes utilisés sont :
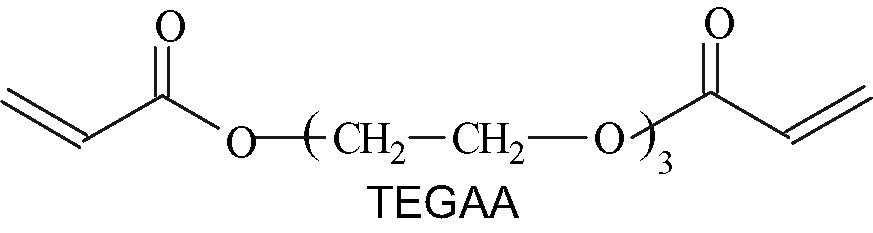
- • le triéthylène glycol diacrylate (TEGAA)/Irgacure1700 ;
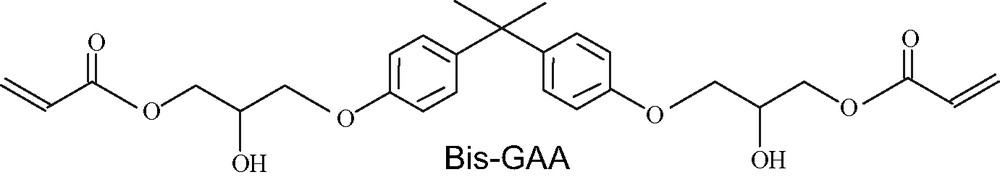
- • le 2,2-bis[4-(3-acryloxy-2-hydroxy propoxy)phényl]propane (Bis-GAA)/Irgacure1700.
L'objectif de cette étude est de déterminer les paramètres cinétiques : l'énergie d'activation Ea, les ordres partiels m et n, la constante de vitesse k et le facteur pré-exponentiel A.
La prise en masse de ces formulations et la structure du réseau obtenu dépendent de plusieurs facteurs. Nous avons choisi de faire varier la température de photoréticulation et la concentration en amorceur pour l'étude cinétique de chaque système.
2 Partie expérimentale
2.1 Réactifs
Le triéthylène glycol diacrylate (TEGAA) et le 2,2-bis[4-(3-acryloxy-2-hydroxy propoxy)phényl]propane (Bis-GAA), sont des monomères bifonctionnels à extrémités acrylates, utilisés dans les résines dentaires. Ils ont été synthétisés au laboratoire et caractérisés par (FT-IR) et RMN H.
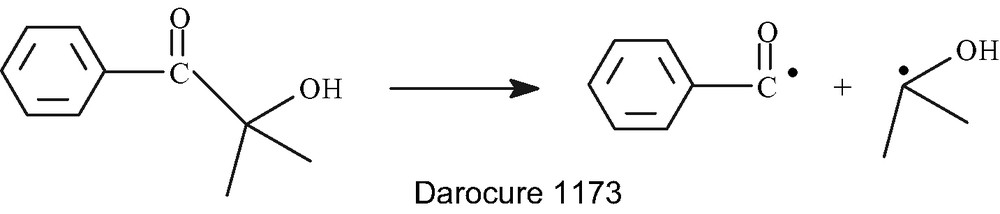
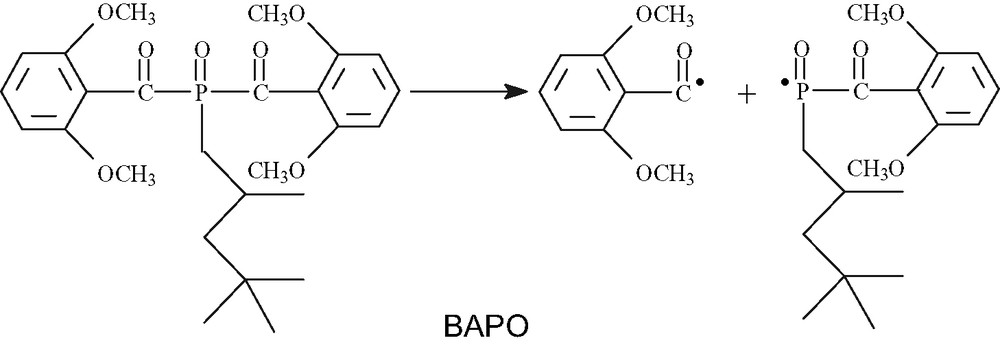
Le photoamorceur utilisé est l'Irgacure, qui est un mélange de 75% (en poids) de Darocure et de 25% d'oxyde de bisacylphosphine (BAPO).
La décomposition de l'Irgacure 1700 donne :
2.2 Préparation des mélanges à réticuler
Système Bis-GAA/Irg.1700 et système TEGAA/Irg.1700. On prend cinq tubes à essai, chacun d'entre eux contenant 25 mg du monomère Bis-GAA. On introduit ensuite le photoamorceur selon différents pourcentages d'Irgacure 1700 (0,5, 1, 2, 4 et 6%) en poids par rapport au monomère. Le mélange obtenu est conservé à froid avant son utilisation pour éviter toute réaction de réticulation. Des prélèvements sont effectués lors de l'étude cinétique de photoréticulation par DPC.
2.3 Préparation des échantillons
On dépose une microgoutte de mélange (système monomère/photoamorceur) dans une capsule en aluminium de 6 mm de diamètre, recouverte d'un film transparent de poly(éthylènetéréphtalate), de 2,5 μm d'épaisseur, pour permettre son étalement homogène sur la surface de la capsule. Les échantillons sont pesés (1,000 à 2,000 mg) à l'aide de la microbalance CAHN modèle C30. Ces capsules sont ensuite soigneusement placées sur les têtes de mesure de la cellule calorimétrique, où elles seront exposées aux rayonnements du module DPC.
2.4 Technique d'analyse
La DPC [2–4] présente l'avantage de combiner les effets thermique et optique et de pouvoir provoquer la photoréticulation, tout en suivant en temps réel la prise en masse de la résine. Toutes nos expériences ont été menées à l'aide d'un photocalorimètre différentiel à balayage (DPC), composé de deux parties : un calorimètre DuPont Dual Sample DSDSC (Double Sampling Differential Scanning Calorimetry) équipé d'une cellule calorimétrique à double tête de mesure, permettant le traitement et l'analyse simultanés de deux échantillons, dans des conditions rigoureusement identiques. Il est surmonté d'une unité d'insolation avec une lampe à vapeur de mercure modèle DPC.
2.5 Mesures photocalorimétriques
Les mesures en DPC se font en régime isotherme. La tête de mesure enregistre tout phénomène thermique résultant de la réaction photochimique. Toute réaction de réticulation est une réaction exothermique. La chaleur dégagée entre l'échantillon et la référence sera mesurée, enregistrée, puis analysée. La chaleur libérée en fonction du temps est traduite par un thermogramme à l'aide d'un module informatique lié directement à l'appareil. Avant la réalisation de chaque expérience, on procède aux opérations suivantes :
- • équilibre de la température de travail ;
- • enregistrement des données ;
- • isotherme de 1 min ;
- • isotherme de 5 min (irradiation) ;
- • isotherme de 1 min.
3 Résultats et discussion
3.1 Analyse des thermogrammes
Un thermogramme caractéristique est présenté (Fig. 1). À l'aide d'un logiciel DPC V4.1A, on peut accéder, pour une température isotherme donnée, aux paramètres de réactivité suivants :
- • l'enthalpie de la réaction (ΔH, en J g–1), qui est directement proportionnelle au nombre de doubles liaisons de monomère ayant réagi ;
- • le temps au maximum du pic, qui est le temps écoulé entre le début de l'irradiation (ouverture de l'obturateur) et le maximum d'énergie libérée de la réaction ;
- • le temps d'induction, qui est défini comme le temps correspondant à % de conversion du monomère ;
- • le pourcentage de conversion (%) au maximum de pic.
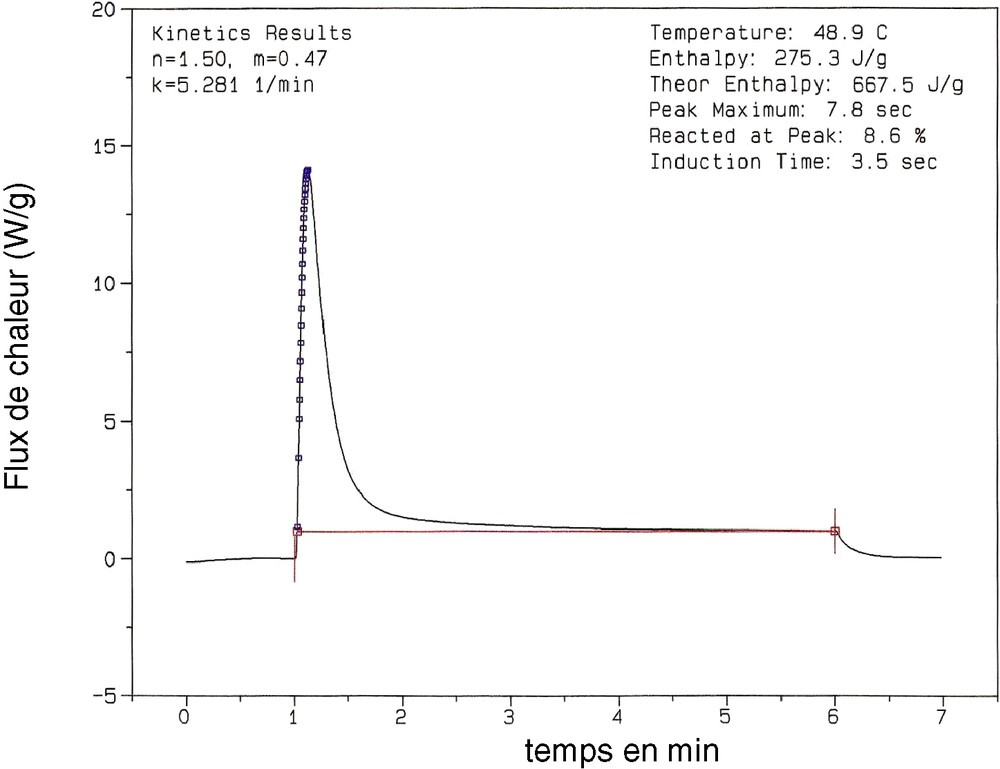
Thermogramme de la photopolymérisation du système TEGAA/Irg.1700 (4%) à 50 °C.
Le pourcentage de conversion αt et la vitesse de réaction dα/dt sont déterminés à partir de la relation :(1)
Cette valeur est donnée par la relation suivante :(2)
Pour les monomères :
- • Bis-GAA, ΔHthéorique = 355,8 J g–1 ;
- • TEGAA, ΔHthéorique = 689,5 J g–1.
La vitesse de la réaction (dα/dt) à l'instant t est la dérivée de la conversion (αt) par rapport au temps t :(3)
Les évolutions de dα/dt et αt en fonction du temps sont représentées sur les Figs. 2 et 3.

Courbe α = f(t) pour différents pourcentages de Irg.1700 dans le système Bis-GAA/Irg.1700 pour une isotherme à 30 °C.
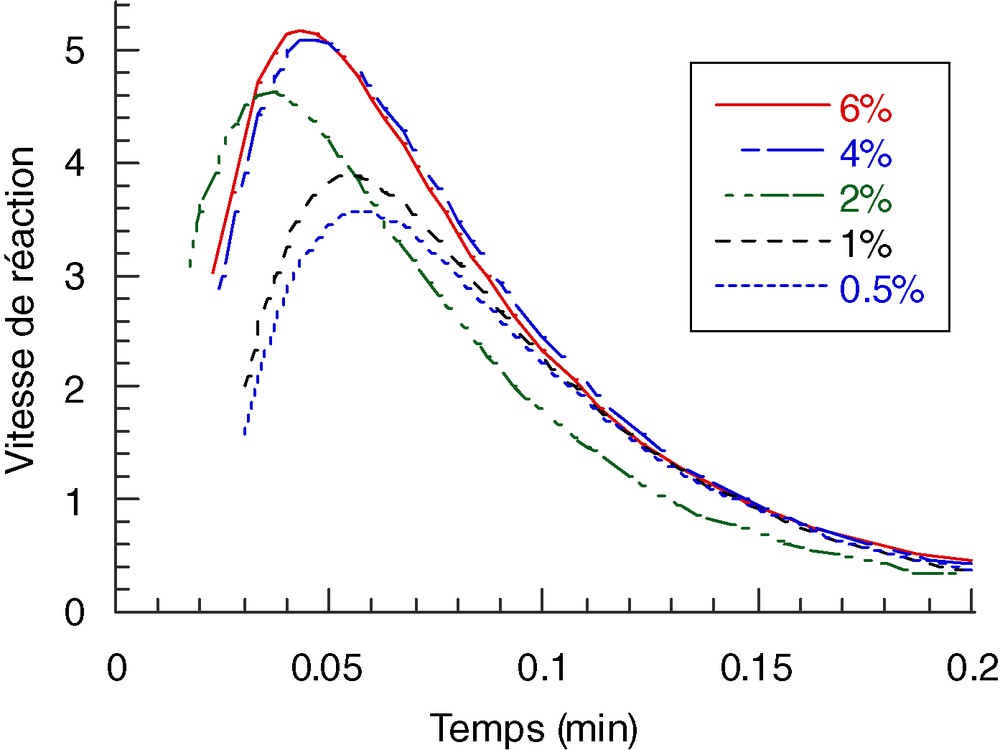
Courbe dα/dt = f(t) pour différents pourcentages de Irg.1700 dans le système Bis-GAA/Irg.1700 pour une isotherme à 30 °C.
3.2 Cinétique de photoréticulation
La cinétique de la réaction photochimique des monomères multifonctionnels obéit à deux types de modèles cinétiques : réactions d'ordre n [6] et réactions autocatalytiques (auto-accélérées) [7]. Pour les réticulations qui suivent une réaction d'ordre n, la vitesse de réaction est donnée par :(4)
Les réactions autocatalytiques sont caractérisées par l'expression :(5)
Pour le modèle auto-accéléré, l'équation (5) semble la mieux adaptée pour décrire la réticulation isotherme des monomères acryliques multifonctionnels [8]. La chaleur dégagée pendant la réticulation est proportionnelle au nombre de doubles liaisons ayant réagi, le taux de conversion est déterminé par la relation (1). D'après Kamal et Sourour [9], la forme intégrale de la relation (1) conduit à l'expression (6), de la forme :(6)
La dérivée de l'équation (6) par rapport au temps donne :(8)
Par ailleurs, la combinaison des équations (5) et (6) permet d'arriver à une expression différente de la vitesse de réaction :(9)
Les équations (8) et (10) peuvent être directement comparées et permettent de déduire les relations entre les paramètres m, n, k et les coefficients A et B.
Par analogie avec les relations (8) et (10), nous avons m + n = 2 et B – 1 = B m, d'où on peut déduire que :(11)
Les mesures photocalorimétriques réalisées en continu tout au long de la réaction permettent d'obtenir la chaleur ΔHt dégagée au temps t et le taux de conversion αt à partir de l'équation (1).
Une fois le taux de conversion déterminé en fonction du temps, nous pouvons représenter l'équation (7) sous sa forme logarithmique :(13)
Si on trace ln [α/(1 – α)] en fonction de ln t, on obtient une droite, qui permet de calculer les coefficients A et B, lesquels, reportés dans les équations (11) et (12), donnent les valeurs de n et de m. L'équation (5) mise sous forme logarithmique donne l'équation (14). De cette équation, nous déduisons la valeur du logarithme de la constante de vitesse k à partir de la droite ln (dα/dt) en fonction de ln [αm(1 – α)n] :(14)
Dans nos travaux, nous avons fixé arbitrairement n = 1,5, tandis que m sera déterminé par le logiciel DPC 4.1, qui calcule la valeur de m de manière à ce que, par ajustement, la représentation graphique de l'équation (14) soit la plus proche possible d'une droite.
3.3 Paramètres de réactivité
Les valeurs des paramètres de réactivité des deux systèmes Bis-GAA/Irg.1700 et TEGAA/Irg.1700 sont reportées dans le Tableau 1. L'étude a été réalisée à cinq températures différentes, en utilisant cinq concentrations de photoamorceur pour chacune d'entre elles.
Paramètres de réactivité pour les deux systèmes Bis-GAA/Irg.1700 et TEGAA/Irg.1700 pour différents pourcentages de photamorceur
| Système | Bis-GAA/Irg.1700 | TEGAA/Irg.1700 | |||||
| T (°C) | Amorceur (%) | Enthalpie (J g–1) | Temps au pic de vitesse (s) | Temps d'induction (s) | Enthalpie (J g–1) | Temps au pic de vitesse (s) | Temps d'induction (s) |
| 30 | 0,5 | 120,9 | 3,4 | 1,8 | 173,2 | 10,2 | 3,5 |
| 1 | 133,9 | 3,2 | 1,7 | 247,0 | 10,2 | 3,6 | |
| 2 | 152,5 | 2,8 | 1,3 | 248,5 | 8,0 | 3,5 | |
| 4 | 168,8 | 2,8 | 1,2 | 280,5 | 7,6 | 3,1 | |
| 6 | 223,6 | 2,6 | 1,2 | 287,4 | 8,0 | 3,4 | |
| 40 | 0,5 | 143,8 | 3,2 | 1,5 | 196,2 | 7,0 | 3,4 |
| 1 | 143,8 | 3,6 | 1,5 | 227,4 | 7,6 | 3,8 | |
| 2 | 163,4 | 2,8 | 1,4 | 256,0 | 7,2 | 3,3 | |
| 4 | 168,4 | 3,0 | 1,4 | 287,7 | 7,6 | 3,5 | |
| 6 | 195,6 | 2,6 | 1,1 | 294,4 | 7,8 | 3,3 | |
| 50 | 0,5 | 130,7 | 3,2 | 1,6 | 235,6 | 8,4 | 3,8 |
| 1 | 152,8 | 3,0 | 1,4 | 267,0 | 8,0 | 3,6 | |
| 2 | 168,9 | 2,8 | 1,4 | 275,3 | 7,4 | 3,5 | |
| 4 | 174,3 | 3,0 | 1,5 | 275,9 | 7,8 | 3,5 | |
| 6 | 185,4 | 2,6 | 1,2 | 287,0 | 8,2 | 3,4 | |
| 60 | 0,5 | 147,2 | 3,0 | 1,4 | 253,8 | 9,0 | 4,0 |
| 1 | 153,2 | 3,0 | 1,4 | 287,6 | 8,8 | 3,7 | |
| 2 | 163,2 | 3,0 | 1,4 | 293,5 | 8,2 | 3,4 | |
| 4 | 174,3 | 2,4 | 1,1 | 313,8 | 9,0 | 3,4 | |
| 6 | 176,4 | 2,6 | 1,1 | 320,6 | 8,0 | 3,2 | |
| 70 | 0,5 | 116,6 | 3,2 | 1,6 | 268,1 | 8,8 | 3,7 |
| 1 | 140,7 | 3,0 | 1,4 | 287,8 | 9,6 | 3,6 | |
| 2 | 157,9 | 2,8 | 1,3 | 313,7 | 8,4 | 3,5 | |
| 4 | 157,9 | 2,8 | 1,2 | 327,1 | 7,8 | 3,1 | |
| 6 | 174,5 | 2,6 | 1,1 | 333,7 | 7,0 | 2,9 |
Il est intéressant de remarquer que le temps d'induction et le pic de vitesse sont atteints plus rapidement lors de l'insolation du Bis-GAA. En effet, on remarque que le temps au maximum du pic du Bis-GAA est environ fois plus faible que celui du TEGAA, et cela pour toutes les températures et concentrations étudiées. Il en est de même pour le temps d'induction. Ceci traduit une vitesse de polymérisation plus grande et donc une prise en masse plus rapide du Bis-GAA. La différence de réactivité des deux monomères est liée à leur viscosité. Le TEGAA ayant une viscosité plus faible a une cinétique moins rapide. Notons toutefois que pour les deux systèmes, la densité du réseau est identique compte tenu des taux de conversion très proches.
Le Tableau 2 montre que, pour les deux systèmes, le taux de conversion et la vitesse au maximum du pic augmentent avec la concentration en photoamorceur. En revanche, la température d'isotherme n'influe pas sur ces deux facteurs. Les Figs. 2 et 3, représentant les systèmes Bis-GAA/Irg.1700 et TEGAA/Irg.1700, illustrent l'effet de la concentration en photoamorceur sur la conversion ainsi que sur la vitesse de photopolymérisation. On peut noter, pour les deux systèmes, que la réaction s'arrête à des taux de conversion de 30 à 50%, indiquant que le milieu réactionnel contient encore des fonctions acrylates n'ayant pas réagi. La Fig. 2 illustre cette limite de réactivité par la présence de paliers à des pourcentages de conversion tendant vers 50%. Ce comportement s'explique par le ralentissement de la réticulation et par l'arrêt de la croissance des chaînes à l'approche de la gélification du milieu [10]. Comme on assiste à une diminution de la mobilité des radicaux et des sites polymérisables, la probabilité de rencontre des espèces radicalaires et des doubles liaisons acrylate devient donc très faible. Le piégeage des radicaux et une diffusion ralentie du monomère entraînent un arrêt de la croissance des chaînes et, par conséquent, une polymérisation incomplète (effet Trommsdorff). Néanmoins la densité de réseau est suffisamment grande pour donner un matériau durci et résistant.
% de conversion et vitesse de réaction au maximum du pic (pM) du Bis-GAA/Irg.1700 et TEGAA/Irg.1700
| Système | Bis-GAA/Irg.1700 | TEGAA/Irg.1700 | |||
| Température (°C) | Amorceur (%) | Conversion au pM (%) | Vitesse au pM dα/dt | Conversion au pM (%) | Vitesse au pM dα/dt |
| 30 | 0,5 | 8,8 | 3,57 | 6,9 | 0,85 |
| 1 | 9,0 | 3,87 | 7,9 | 1,15 | |
| 2 | 10,5 | 4,62 | 9,2 | 1,30 | |
| 4 | 11,8 | 5,09 | 9,2 | 1,40 | |
| 6 | 11,8 | 5,18 | 10,1 | 1,42 | |
| 40 | 0,5 | 10,1 | 4,03 | 7,1 | 1,19 |
| 1 | 10,5 | 4,15 | 7,6 | 1,24 | |
| 2 | 10,8 | 4,60 | 8,2 | 1,30 | |
| 4 | 11,6 | 4,98 | 8,9 | 1,38 | |
| 6 | 12,1 | 5,44 | 9,6 | 1,41 | |
| 50 | 0,5 | 9,4 | 3,86 | 7,8 | 1,04 |
| 1 | 10,2 | 4,30 | 8,5 | 1,20 | |
| 2 | 11,2 | 5,02 | 8,6 | 1,26 | |
| 4 | 12,4 | 5,53 | 8,6 | 1,27 | |
| 6 | 12,4 | 5,83 | 10,0 | 1,34 | |
| 60 | 0,5 | 8,7 | 3,42 | 7,6 | 0,93 |
| 1 | 11,1 | 4,52 | 9,2 | 1,15 | |
| 2 | 11,4 | 4,88 | 9,2 | 1,23 | |
| 4 | 11,4 | 5,39 | 10,2 | 1,24 | |
| 6 | 12,3 | 5,73 | 10,4 | 1,41 | |
| 70 | 0,5 | 8,5 | 3,57 | 7,7 | 0,92 |
| 1 | 9,9 | 4,12 | 9,1 | 1,03 | |
| 2 | 10,9 | 4,78 | 9,9 | 1,30 | |
| 4 | 11,2 | 4,77 | 10,5 | 1,46 | |
| 6 | 11,3 | 4,98 | 10,5 | 1,66 |
L'allure des courbes cinétiques de la vitesse de polymérisation (Fig. 3) est due à deux phénomènes indépendants :
- • une période d'induction initiale, résultant de l'effet inhibiteur de l'oxygène sur les radicaux formés au cours de l'étape d'amorçage. Lorsque la concentration en O2 dissous dans le mélange diminue, le monomère réagit avec les radicaux amorceurs [11], réaction qui se caractérise par une augmentation linéaire de la vitesse de polymérisation. Si l'augmentation de la vitesse réactionnelle est bien marquée pour les concentrations en amorceur comprise entre 0,5 et %, elle est cependant non significative entre 4 et 6%. Ceci indiquerait un effet limitant de la concentration en amorceur sur la vitesse de photopolymérisation ;
- • la diminution graduelle de cette vitesse est due à la gélification, puis à la vitrification du milieu réactionnel. La vitrification cause le blocage total des espèces réactives, qui sont figées à l'intérieur du réseau polymère, et se traduit par l'arrêt progressif de la réaction.
On constate, d'après les valeurs de la vitesse des deux systèmes (Tableau 2), que la vitesse de polymérisation du Bis-GAA est quatre fois plus élevée que celle du TEGAA.
Pour les deux monomères, la vitesse et la conversion au maximum du pic augmentent avec la concentration en amorceur. L'extrême rapidité de la réaction fait que, plus la quantité de radicaux amorceurs est élevée, plus grand sera le nombre de double liaisons amorcées. L'effet de la température sur les deux systèmes n'étant pas bien marqué, les différences de taux de conversion et de vitesse au pic de vitesse ne sont pas suffisamment significatives. Pour le Bis-GAA et pour un pourcentage donné en amorceur, les résultats enregistrés aux différentes températures sont très proches. Il en est d'ailleurs de même pour le TEGAA. La comparaison des résultats relatifs aux deux monomères montre que le Bis-GAA est le plus réactif. La présence de noyaux phényles dans cette molécule lui confère une rigidité qui permet aux doubles liaisons d'être en conformation favorable à la réaction vis-à-vis du radical. La chaîne moléculaire du TEGAA est de conformation plus souple, rendant les doubles liaisons moins disponibles au fur et à mesure de l'avancement de la réaction.
3.4 Paramètres cinétiques
3.4.1 Ordre réactionnel
D'après le Tableau 3, nous observons, pour chaque système, des valeurs de l'ordre partiel m proche de 0,5 et des valeurs de l'ordre global de la réaction proche de 2. Ceci explique que la cinétique des réactions de photoréticulation est auto-accélérée.
Ordre partiel m (n=1,5) et constante de vitesse k pour deux systèmes Bis-GAA/Irg.1700 et TEGAA/Irg.1700, pour différents pourcentages de photoamorceur
| Système | Bis-GAA/Irg.1700 | TEGAA/Irg.1700 | ||||
| Température (°C) | Constante de vitesse k (min–1) | m | n + m | Constante de vitesse k (min–1) | m | n + m |
| 30 | 22,501 | 0,61 | 2,11 | 3,902 | 0,48 | 1,98 |
| 40 | 22,930 | 0,58 | 2,08 | 4,099 | 0,51 | 2,01 |
| 50 | 23,095 | 0,60 | 2,10 | 4,739 | 0,50 | 2,00 |
| 60 | 25,009 | 0,51 | 2,01 | 4,776 | 0,56 | 2,06 |
| 70 | 26,523 | 0,59 | 2,09 | 4,841 | 0,50 | 2,00 |
| 30 | 36,060 | 0,58 | 2,08 | 5,055 | 0,48 | 1,98 |
| 40 | 37,884 | 0,59 | 2,09 | 6,065 | 0,51 | 2,01 |
| 50 | 41,293 | 0,65 | 2,15 | 6,071 | 0,48 | 1,98 |
| 60 | 41,829 | 0,59 | 2,09 | 6,154 | 0,49 | 1,99 |
| 70 | 42,098 | 0,67 | 2,17 | 6,402 | 0,50 | 2,00 |
| 30 | 24,513 | 0,57 | 2,07 | 5,499 | 0,50 | 2,00 |
| 40 | 26,515 | 0,48 | 1,98 | 5,664 | 0,52 | 2,02 |
| 50 | 27,683 | 0,59 | 2,09 | 5,717 | 0,49 | 1,99 |
| 60 | 28,645 | 0,67 | 2,17 | 6,796 | 0,47 | 1,97 |
| 70 | 29,849 | 0,68 | 2,18 | 7,145 | 0,53 | 2,03 |
| 30 | 22,043 | 0,59 | 2,09 | 4,500 | 0,56 | 2,06 |
| 40 | 22,239 | 0,54 | 2,04 | 4,593 | 0,49 | 1,99 |
| 50 | 24,929 | 0,54 | 2,04 | 5,281 | 0,57 | 2,07 |
| 60 | 25,446 | 0,53 | 2,03 | 5,915 | 0,49 | 1,99 |
| 70 | 26,317 | 0,57 | 2,07 | 6,221 | 0,50 | 2,00 |
| 30 | 22,487 | 0,53 | 2,03 | 6,033 | 0,52 | 2,02 |
| 40 | 24,639 | 0,55 | 2,05 | 6,075 | 0,54 | 2,04 |
| 50 | 26,855 | 0,55 | 2,05 | 6,222 | 0,51 | 2,01 |
| 60 | 28,509 | 0,59 | 2,09 | 7,889 | 0,50 | 2,00 |
| 70 | 28,543 | 0,59 | 2,09 | 8,334 | 0,56 | 2,06 |
3.4.2 Énergie d'activation
L'énergie d'activation intervient dans la relation d'Arrhenius, qui lie la constante de vitesse à la température :(15)
La représentation graphique de l'équation (16) en fonction de la température permet de déterminer l'énergie d'activation Ea et le facteur pré-exponentiel A :(16)
Énergie d'activation et facteur pré-exponentiel pour les deux systèmes Bis-GAA/Irg.1700 et TEGAA/Irg.1700, pour différents pourcentages de photoamorceur
| Système | Photoamorceur (%) | Énergie d'activation Ea (× 10–3) (kJ mol–1) | Facteur pré-exponentiel Ar (s–1) |
| Bis-GAA/Irg.1700 | 0,5 | 3,505 | 1,474 |
| 1 | 3,544 | 2,472 | |
| 2 | 4,060 | 2,071 | |
| 4 | 4,194 | 1,919 | |
| 6 | 5,388 | 3,238 | |
| TEGAA/Irg.1700 | 0,5 | 5,059 | 0 ,489 |
| 1 | 5,928 | 0,918 | |
| 2 | 5,961 | 0,941 | |
| 4 | 7,677 | 1,531 | |
| 6 | 7,640 | 1,964 |
4 Conclusion
Les résultats obtenus montrent des taux de conversion peu élevés. La prise en masse extrêmement rapide de nos systèmes limite la diffusion et la mobilité des réactifs. En effet, les résines produites renferment en leur sein des résidus de monomères et de radicaux n'ayant pas réagi. L'amélioration de ces taux de conversion passerait par un meilleur contrôle de la cinétique. Ajoutons à ceci l'inconvénient d'un durcissement instantané, qui crée des tensions internes dans le matériau, susceptibles d'engendrer des variations géométriques post-polymérisation. Notons enfin que l'analyse de l'ensemble des résultats montre que le traitement théorique de Kamal et Sourour appliqué au modèle autocatalytique est apte à décrire les cinétiques des réactions de photoréticulation de nos systèmes.


