1 Introduction
La saponite est un phyllosilicate trioctaédrique, dont le feuillet élémentaire est constitué de deux couches tétraédriques occupées par des cations Si4+ et Al3+ entourant une couche octaédrique comportant des cations Mg2+. La substitution des cations Si4+ par des cations Al3+ dans la couche tétraédrique confère une charge négative au feuillet, charge généralement compensée par des cations alcalins ou alcalino-terreux se logeant dans l’espace interfoliaire. La formule chimique par demi-maille de la saponite est la suivante :
Deux problèmes majeurs se posent lors de la synthèse de saponite [1–4] : La formation simultanée de substitutions octaédriques Mg2+/Al3+ et de substitutions tétraédriques Si4+/Al3+ et l’incorporation possible de cations Al3+ et Mg2+ dans l’espace interfoliaire. Différentes méthodes de synthèse ont été réalisées à basse température (entre 30 et 90 °C) et sous pression atmosphérique ou dans des conditions hydrothermales et sous forte pression [5]. Dans tous les cas, la durée de cristallisation est longue et les produits obtenus sont des mélanges de phases cristallisées et amorphes.
Les synthèses hydrothermales sont généralement effectuées en milieu neutre ou basique. Les ions OH– jouent alors le rôle d’agents minéralisateurs, permettant la mise en solution des sources des éléments constitutifs du phyllosilicate. De par leur similitude de taille, les ions F– peuvent facilement substituer une partie des ions OH– et ainsi être intégrés dans la charpente des phyllosilicates. Ces ions présentent en outre l’avantage d’être de bons agents minéralisateurs en milieu acide [6].
Le but de ce travail est d’étudier l’influence du pH sur la synthèse de la saponite en milieu fluoré et d’essayer de comprendre son mécanisme de formation.
2 Synthèse et caractérisation de saponites
2.1 Synthèse de saponites
Les saponites sont préparées à partir d’hydrogels dont la composition molaire est la suivante :
1 SiO2:0,167 Al2O3:1 MgO:0,167 Na2O:0,05 HF:192 H2O
Les sources de réactifs sont ajoutées à température ambiante et sous agitation permanente, dans l’ordre suivant : H2O, source de fluor, source de magnésium, source d’aluminium, source de sodium et source de silicium. Dans tous les cas, la source de fluor est l’acide fluorhydrique et celle de silicium, de l’aérosil 380. La nature des autres réactifs est variable en fonction du pH de l’hydrogel initial souhaité (Tableau 1).
Nature des réactifs employés lors de la synthèse en fonction du pH de l’hydrogel
| pH de l’hydrogel | Source de magnésium | Source d’aluminium | Source de sodium |
| 3 | acétate | nitrate | nitrate |
| 4,5 | nitrate | nitrate | acétate |
| 6 | acétate | diacétate basique | acétate |
| 8 | hydroxyde | acétate | acétate |
| 9 | hydroxyde | hydroxyde | acétate |
| 11 | hydroxyde | diacétate basique | hydroxyde |
| 12,5 | acétate | diacétate basique | acétate |
Le mélange est agité vigoureusement entre chaque addition de réactifs. L’hydrogel mûri durant 2,5 h est transvasé dans une chemise en PTFE (polytétrafluoroethylène), elle-même placée dans un autoclave en acier d’une capacité de 120 ml. Celui-ci est ensuite porté à 220 °C sous pression autogène. La durée de synthèse est de 48 h. L’autoclave est refroidi à température ambiante. Le pH (pHf) du liquide surnageant dans la chemise est mesuré. Le solide est ensuite séparé par filtration, lavé à l'eau distillée et séché au-dessus d’une étuve à 80 °C pendant 48 h. Le produit « brut » obtenu est placé dans un humidificateur en présence d’une solution saturée du sel NH4Cl (humidité relative P/P0 = 0,80) durant 3 j avant d’être caractérisé.
2.2 Caractérisation des saponites
Les analyses chimiques ont été réalisées par spectrométrie de fluorescence X. L’appareil utilisé est un Magix Philips de puissance 2,4 kW.
La structure des saponites a été étudiée par diffraction des rayons X (DRX) et par spectroscopie de résonance magnétique nucléaire (RMN) avec rotation à l’angle magique (MAS). Les diffractogrammes de poudre ont été enregistrés sur un diffractomètre Philips PW1800 comportant une anticathode en cuivre (Cu Kα 1,5418 Å) excitée par une tension de 35 mV et une intensité de 50 mA. L’enregistrement des diagrammes est effectué entre 1 et 70° (2θ), avec un pas de 0,02° pour 2 s. Les spectres RMN MAS de l’isotope 29Si sont enregistrés sur un spectromètre Bruker MSL-300 (B0 = 7.04 T) à 59,6 MHz. La vitesse de rotation est de 4 kHz. Pour un angle de π/4, la durée du pulse est de 1,8 μs et le temps de recyclage de 90 s.
Les spectres RMN MAS de l’isotope 27Al sont enregistrés sur un spectromètre DSX-400. Le temps de recyclage est de 1 s, le temps de pulsation de 0,7 μs pour un angle de π/12. Ces conditions permettent d’assurer une excitation sélective.
3 Résultats et discussion
3.1 Caractéristiques des saponites (Tableau 2)
La mesure du pH du surnageant après synthèse révèle que les variations de pH au cours de la cristallisation sont de l’ordre d’une unité pH dans tous les cas.
Caractéristiques de l’hydrogel et formule chimique du phyllosilicate obtenu
| Hydrogela | Composition du phyllosilicate (% massique) | Phyllosilicate | ||||
| pHi | pHf | Na | Mg | Al | Si | Formule par demi-maille |
| 5,5 | 4,5 | 0,09 | 15,50 | 7,82 | 27,40 | (Mg2,3Al0,6 0,1)(Si3,6Al0,4)O10(OH,F)2 |
| 8 | 6 | 0,14 | 19,10 | 7,02 | 25,10 | Mg0,2(Mg2,7Al0,3)(Si3,3Al0,7)O10(OH,F)2 |
| 9 | 8 | 0,55 | 20,10 | 6,32 | 24,90 | Na0,1Mg0,2(Mg2,8Al0,2)(Si3,3Al0,7) O10(OH,F)2 |
| 11 | 10 | 0,336 | 19,20 | 7,00 | 25,00 | Mg0,2(Mg2,8Al0,2)(Si3,3Al0,7) O10(OH,F)2 |
| 12,5 | 12 | 3,07 | 19,60 | 8,04 | 22,30 | Na0,5Mg0,2(Mg2,9Al0,1)(Si3Al) O10(OH,F)2 |
a Quantités relatives : Si/Al = 3 et Si/Mg = 1.
Les diffractogrammes des produits synthétisés en milieu acide (pH = 1–3) (Fig. 1) présentent une bande large située entre 18 et 30° (2θ), caractéristique de la présence de silice amorphe. En milieu neutre ou basique (pH = 7,5–12), les solides obtenus sont mal cristallisés. Par ailleurs, un élargissement de la raie (060) est noté avec l’augmentation du pH. La valeur de la périodicité d060 donne des informations sur l’occupation des sites octaédriques des composés : ainsi, une valeur égale à 0,148 nm indique que deux sites sur trois sont occupés par des cations trivalents ,alors qu’une valeur de 0,152 nm signifie que tous les sites sont occupés par des cations divalents. Dans le premier cas, le phyllosilicate est qualifié de dioctaédrique, alors que, dans le second, il sera qualifié de trioctaédrique. À pH = 10, la largeur de cette raie couvre le domaine di- et trioctaédrique. Des raies (001) et (060) fines et intenses sont présentes sur le diffractogramme de l’échantillon obtenu à partir d’un hydrogel de pH = 4,5. Les périodicités d001 et d060 correspondantes sont respectivement égales à 1,42 et 0,152 nm. Il apparaît ainsi que, dans les conditions de synthèse employées, le pH optimum pour avoir une saponite bien cristallisée est de 4,5 (pH final).

Diffractogrammes de rayons X des phases obtenues en fonction du caractère acido-basique de l’hydrogel.
Une raie présente à 2° (2θ) sur les diffractogrammes des produits préparés à pH = 1, 3, 7,5–12 n’a pu être indexée.
Les spectres de RMN MAS de l’isotope 27Al (Fig. 2) présentent deux bandes, situées dans les intervalles [40, 70 ppm] et [–10, 2 ppm], correspondant respectivement aux coordinences tétra- et octaédriques de l’aluminium. Ce fait est à rapprocher de la coordinence de l’aluminium 4 en solution basique [Al(OH)4–] et de la coordinence 6 de l’aluminium en solution acide [Al(H20)63+]. La déconvolution des spectres permet de calculer l’aire des deux bandes. La surface relative de la bande correspondante à l’aluminium tétraédrique [ST/(ST + SO)] est constante et égale à 0,50 jusqu’à pH = 8, puis augmente de façon significative jusqu’à dépasser 0,80. À pH = 12, l’aluminium se trouve majoritairement en couche tétraédrique (Fig. 3).
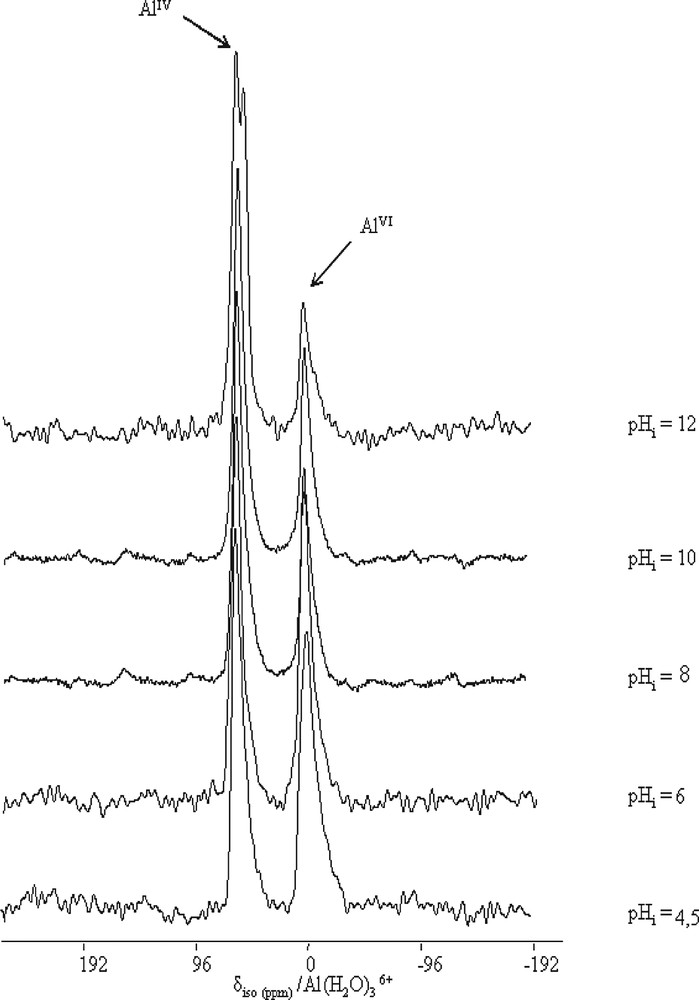
Spectres RMN MAS de l’isotope 27Al des saponites préparées en fonction du caractère acido-basique de l’hydrogel.
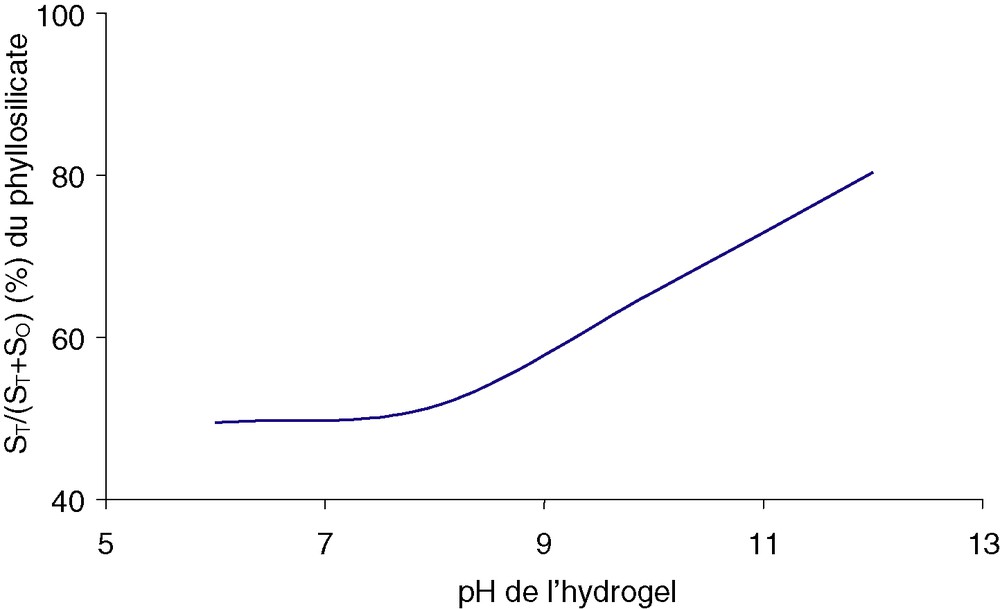
Surface relative du pic de l’aluminium tétraédrique du phyllosilicate en fonction du pH de l’hydrogel.
Les analyses chimiques montrent qu’en milieu acide (pH = 4,5), les rapports Si/Al et Si/Mg (1,25) dans le phyllosilicate sont supérieurs aux mêmes rapports dans l’hydrogel (respectivement 3 et 0,33). La quantité d’aluminium incorporée dans les couches tétraédriques est inférieure à la quantité disponible, sauf à pH = 12. La quantité de magnésium incorporée dans la couche octaédrique est également inférieure à la quantité disponible. La différence entre quantité disponible et quantité incorporée diminue lorsque l’hydrogel devient plus basique. Les éléments métalliques sont d’autant plus intégrés dans la structure que l’hydrogel est plus basique. Le phyllosilicate obtenu à pH = 12 a une charge négative notable et peut être qualifié de saponite. Ces différences montrent ainsi une incorporation plus grande de l’aluminium par rapport au magnésium.
Pour les phyllosilicates obtenus à pH < 12, la charge négative de la couche tétraédrique est compensée de plus en plus par la charge positive de la couche octaédrique et de moins en moins par les cations interfoliaires. L’existence des substitutions octaédriques non négligeables dans ces phyllosilicates et leur charge négative petite ne permet pas de les considérer comme des saponites. Ces phyllosilicates obtenus en milieu acide présentent également une compensation de charges tétraédrique–octaédrique.
3.2 Mécanisme de formation proposé du feuillet
Le traitement hydrothermal d’un hydrogel fluoré contenant les éléments Si, Al, Mg et Na à 5,5 < pH < 12,5 conduit à un phyllosilicate trioctaédrique. Celui-ci est pourvu ou dépourvu de cations de compensation, selon que l’hydrogel est basique ou faiblement acide.
Les quantités d’aluminium et de magnésium incorporées dans la structure du phyllosilicate augmentent lorsque l’hydrogel devient plus basique, la quantité d’aluminium incorporée étant supérieure à celle de magnésium.
En milieu acide, la quantité d’aluminium intégrée dans la couche octaédrique du phyllosilicate augmente avec la quantité d’aluminium de l’hydrogel, alors que la quantité intégrée dans la couche tétraédrique varie peu. En milieu basique, la quantité d’aluminium intégrée dans la couche tétraédrique augmente aux dépens de celle intégrée dans la couche octaédrique.
La cristallisation du phyllosilicate diffère selon que l’hydrogel est basique ou acide. Deux mécanismes interviennent.
3.2.1 Mécanisme en milieu basique
Le silicium et l’aluminium sont respectivement sous forme d’anions silicates et de tétrahydroxoaluminate (III) de sodium Na4(SiO4) et Na[Al(OH)4] solubles. Le magnésium est sous forme de dihydroxyde de magnésium ou brucite Mg(OH)2 ou Mg3(OH)6 peu soluble.
Un équilibre s’établit entre la dissolution et la précipitation de la brucite. Comme l’hydrogel contient de l’aluminium à côté du magnésium, la brucite octaédrique incorpore de l’aluminium à partir des ions tétraédriques [Al(OH)4]–. La quantité d’aluminium incorporée est petite du fait du changement de coordinence de cet élément. La couche octaédrique ainsi formée est de type hydrotalcite. Cette incorporation induit une charge positive . La couche octaédrique positive attire des ions tétraédriques Si(OH)3O– et [Al(OH)4]–. L’adsorption et la polycondensation de ces anions sur les deux surfaces de la couche octaédrique forme deux couches tétraédriques de part et d’autre de la couche octaédrique. La quantité d’aluminium incorporé est notable du fait de la conservation de sa coordinence. Ce processus conduit à un feuillet chargé négativement de type saponite, par exemple :
La charge négative apportée par les substitutions tétraédriques est compensée principalement par des cations interfoliaires.
La réaction effectuée à partir des différents réactifs utilisés s’écrit :
3.2.2 Mécanisme en milieu acide
Le silicium est sous forme d’acide polysilicique peu soluble. L’aluminium et le magnésium sont respectivement sous forme d’acétates d’aluminium et de magnésium Al(CH3COO)3 et Mg(CH3COO)2 solubles.
Un équilibre s’établit entre la précipitation et la dissolution de l’acide polysilicique. Comme l’hydrogel contient de l’aluminium à côté du silicium, l’acide polysilicique tétraédrique incorpore de l’aluminium à partir des ions aluminium octaédriques. La quantité d’aluminium incorporée n’est pas très importante, du fait de son changement de coordinence. Cette incorporation augmente la charge négative de l’anion de l’acide polysilicique, par exemple : H4,4[Si3,6Al0,4O10]. Les ions H+ de deux couches tétraédriques d’acide polysilicique sont échangés contre des ions polyvalents octaédriques [Al(H2O)6]3+ et [Mg(H2O)6]2+. Ces cations lient les deux couches tétraédriques entre elles et, avec d’autres cations, forment une couche octaédrique entre les deux couches tétraédriques. La quantité d’aluminium incorporée est notable du fait de la conservation de la coordinence de cet élément. Ce processus conduit à un feuillet électriquement neutre :
La charge négative apportée par les substitutions tétraédriques est compensée principalement par des substitutions octaédriques.
La réaction effectuée à partir des réactifs utilisés s’écrit :
4 Conclusion
La synthèse de la saponite a été étudiée en milieu acide et basique. Il semble peu probable qu’un mécanisme de formation unique puisse exister dans tout le domaine acide–base étudié (1 < pH < 12). En effet, la polycondensation des cations entre eux ou avec la silice ne peut se faire que si les polyèdres de coordination des ions Al3+ ou Mg2+ contiennent des groupes hydroxyle. Le pH de précipitation de l’ion Al3+ est supérieur à 5 et celui de l’ion Mg2+ supérieur à 9. À partir de là, le mécanisme proposé dans la littérature et reposant sur la formation préalable d’une couche de brucite [Mg(OH)2] suivi de la polycondensation de la silice sur cette couche peut-être retenu en milieu basique (pH > 8). En milieu acide, un autre mécanisme peut se substituer au précédent : comme l’hydrogel contient de l’aluminium à côté du silicium, l’acide polysilicique tétraédrique incorpore de l’aluminium à partir des ions octaédriques [Al(H2O)6]3+. La quantité d’aluminium incorporée n’est pas très importante du fait de son changement de coordinence. Cette incorporation augmente la charge négative de l’anion de l’acide polysilicique H4,4[Si3,6Al0,4O10]. Les ions H+ de deux couches tétraédriques d’acide polysilicique sont échangés contre des ions polyvalents octaédriques [Al(H2O)6]3+ et [Mg(H2O)6]2+. Ces cations lient les deux couches tétraédriques entre elles et, avec d’autres cations, forment une couche octaédrique entre les deux couches tétraédriques. La quantité d’aluminium incorporée est notable, du fait de la conservation de sa coordinence.
L’effet minéralisateur de l’anion F– est surtout important en milieu acide à neutre. Dans ces conditions, il peut mobiliser le silicium (et dans une certaine mesure l’aluminium) sous forme de complexes hydroxyfluorés polycondensables. En milieu plus basique, ces complexes n’existent plus et ce sont les ions OH– qui permettent de mobiliser le silicium et l’aluminium sous forme d’anions silicate et aluminate. De même, lorsque le milieu devient très acide (pH < 4), les complexes purement fluorés formés ne sont pas polycondensables.


