1 Introduction
Une grande partie des connaissances moléculaires au niveau des membranes a été obtenue à partir de modèles membranaires biomimétiques variés allant des systèmes vésiculaires aux bicouches lipidiques supportés [1]. Ces derniers modèles devaient, de par leur robustesse, permettre l'utilisation de techniques sophistiquées pour des études structurales et dynamiques permettant ainsi de mieux comprendre les interactions protéines–lipides ou encore les fonctions membranaires [2]. Une des stratégies consiste à ancrer la bicouche lipidique sur un lit continu ou discontinu de polymère [3]. Parmi les autres stratégies de reconstitutions possibles, la structure biomimétique que nous développons actuellement, est fondée sur la formation de bicouches lipidiques décollées du support à l'intérieur d'un oxyde d'aluminium nanoporeux (AAO). Ce type de structure crée un compartiment entre le support et la bicouche de façon à faciliter l'insertion de protéines transmembranaires. Cette structure biomimétique est développée dans le but d'étudier les activités catalytiques des protéines de la chaîne respiratoire. En effet, la géométrie et la grande surface de bicouche du système peuvent être vues comme un modèle simplifié des membranes internes des chloroplastes ou des mitochondries [4].
La spectroscopie de RMN des solides est une technique particulièrement bien adaptée pour étudier de façon non destructrice et in situ l'organisation et la dynamique moléculaires au sein des systèmes supportés. Afin d'améliorer la résolution des spectres, des modèles biomimétiques ont été spécialement développés pour les études par RMN. Ils consistent à orienter la membrane lipidique dans laquelle se trouvent les protéines dans une orientation privilégiée par rapport au champ magnétique (
Dans le but d'explorer l'arrangement des phospholipides dans les nanopores de l'AAO, une étude des spectres de RMN du deutérium à l'angle magique en statique ou en faible vitesse de rotation a été entreprise. Afin d'aider à la caractérisation géométrique, les spectres ont été comparés à ceux obtenus pour un modèle expérimental plus simple de lipides adsorbés sur un polymère enroulé en cylindre dans le rotor.
2 Matériels et méthodes
2.1 Préparation des échantillons
Le support poreux d'AAO est commercialisé comme filtre (Anodisc 47, Whatman). Ces filtres en oxyde d'aluminium, obtenus par anodisation (anodic aluminium oxide) ont des diamètres de pores de 200 nm, une épaisseur de 60 μm et une densité de pores de 2,54 × 109 pores par cm2 (80 % de porosité). La première étape consiste à faire réagir le 3-aminopropyl-diméthylethoxysilane avec le support. La deuxième étape permet la condensation d'un dérivé de la biotine, le sulfo-NHS-LC-biotine (biotinamidocaproïque-3-sulfo-N-hydroxysuccinimide ester). Pour la troisième étape, les supports dérivés sont placés dans une solution de streptavidine. La quatrième étape correspond au trempage pendant au moins une heure dans des vésicules unilamellaires (SUV). Les SUV, obtenues par sonication, sont composées de DMPC-d54 (99 %) et de 0,5 % de 1,2-dipalmitoyl-sn-glycero-3-phosphatidylethanolamine-N-biotinyle, pour une concentration finale de 5 mM dans de l'eau dépourvue de deutérium. La fusion est obtenue par quatre cycles de congélation–décongélation. Après chaque étape, des rinçages extensifs sont effectués avec le tampon correspondant et toutes les étapes de la construction doivent être réalisées à 30 °C. Le protocole détaillé a été décrit précédemment [8].
Pour le modèle de phospholipides adsorbés sur un polymère de polyéthylèneterephtalate (PET), 10 mg de DMPC-d54 sont dissous dans du chloroforme puis déposés sur une bande de PET. Le chloroforme est ensuite évaporé sous vide dans un dessiccateur pendant une heure puis, réhydraté dans une atmosphère saturée en eau pendant deux jours à 55 °C.
2.2 Les expériences de RMN
Les expériences ont été réalisées soit avec un spectromètre Bruker Avance DMX 400-WB soit avec un spectromètre Bruker ASX-300 équipé respectivement d'une sonde CP-MAS 7 mm et d'une sonde CP-MAS 4 mm. Les anodiscs sont découpés à un diamètre de 5 mm et 60 disques sont empilés dans le rotor rempli avec de l'eau appauvrie en deutérium. Les spectres en rotation (3 kHz) ont été acquis à 61,4 MHz avec une séquence d'écho quadripolaire [9]. Les deux impulsions à 90° d'une durée de 3,5 μs sont séparées par un délai de 333 μs afin de synchroniser les impulsions de radiofréquences avec la rotation de l'échantillon. Le temps de recyclage utilisé est de 250 ms. La température a été maintenue à 30 °C. La méthode de simulation de ces spectres a été récemment décrite [10].
3 Résultats et discussion
Pour ces études par RMN, une orientation macroscopique des bicouches est obtenue par un empilement de disques du support de telle sorte que la normale à la bicouche soit distribuée autour d'un cylindre orienté à l'angle magique (Fig. 1) [8,10]. Afin de réaliser cette étude, nous avons choisi d'utiliser un phospholipide deutérié, le DMPC-d54 dont tous les protons des deux chaînes hydrophobes sont substitués par des deutérons.
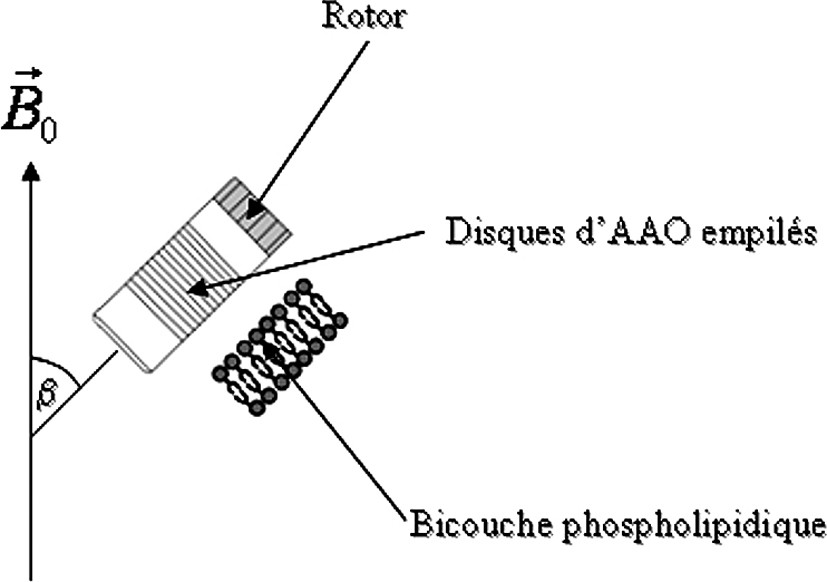
Arrangement des disques dans le rotor et représentation d'une bicouche à l'intérieur d'un nanopore.
3.1 Spectres de RMN du 2H statique à l'angle magique
La Fig. 2A présente le spectre statique à l'angle magique obtenu pour une bicouche phospholipidique de DMPC-d54 décollée du support par le pontage streptavidine–biotine. Le spectre de la Fig. 2B correspond à un modèle de distribution aléatoire des normales aux bicouches obtenu expérimentalement par des vésicules multilamellaires (MLV). Ce spectre de type « poudre », représentatif de la distribution sphérique des lipides sur une vésicule, constitue une superposition de toutes les résonances provenant de toutes les orientations possibles des liaisons C–2H par rapport à

Spectres statiques de RMN du 2H du DMPC-d54 (A) en MLV enregistré à 46 MHz et (B) en bicouches phospholipidiques supportées dans l'AAO, enregistré à 61,4 MHz.
3.2 Spectres de RMN du 2H en rotation à l'angle magique
Les expériences de RMN du 2H en rotation à l'angle magique permettent, pour des vitesses relativement faibles, de moyenner partiellement les interactions quadripolaires et d'obtenir ainsi des bandes de rotation. Glaubitz (2000) a montré que dans ce type d'expériences, un échantillon macroscopiquement orienté (Magic-angle-oriented spinning sample) donnait des spectres dont les intensités de ces bandes étaient fonction de l'orientation de cet échantillon [11].
Le spectre d'une distribution aléatoire représenté expérimentalement par les MLV (Fig. 3A) et le spectre simulé correspondant (Fig. 3B), sont comparés au spectre simulé d'une distribution cylindrique parfaite (Fig. 3C). Dans ce dernier cas, on observe la disparition des bandes de rotation impaires par rapport aux spectres des MLV. Nous pouvons utiliser cette particularité pour déterminer la géométrie des membranes à l'intérieur des pores du support d'oxyde d'aluminium.
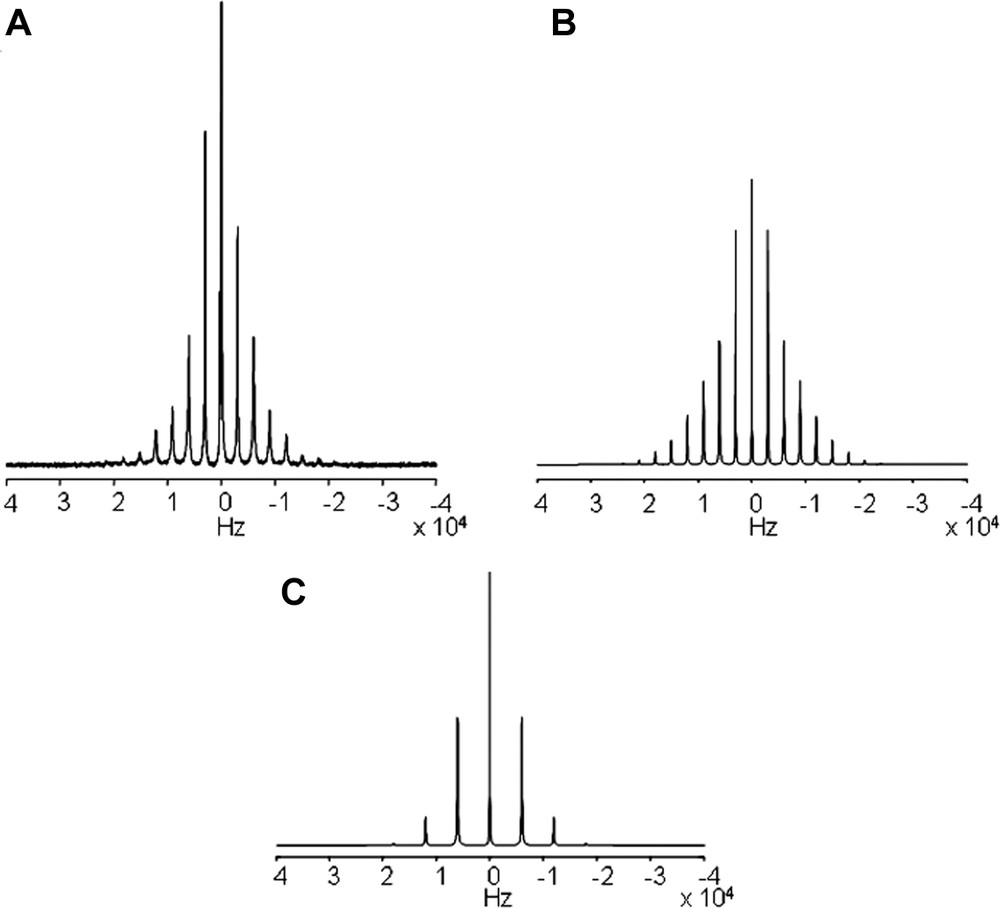
Spectres MAS (3 kHz) du 2H enregistrés à 61,4 MHz du DMPC-d54. (A) spectre expérimental de MLV et (B) spectre simulé correspondant. (C) Spectre simulé d'une distribution cylindrique idéale des lipides.
Le spectre obtenu dans les mêmes conditions pour une bicouche phospholipidique de DMPC-d54 décollée du support par le pontage streptavidine–biotine est représenté sur la Fig. 4A. La résolution de ce spectre expérimental est satisfaisante compte tenu de la faible quantité de lipides (1,7 mg). Cependant, on observe des largeurs de raies plus importantes que dans le cas des MLV, cela peut être imputé à la présence d'espèces paramagnétiques dans le support [8]. La simulation de ce spectre (Fig. 4B) a été obtenue en utilisant 89 % de lipides orientés et une mosaïcité de 5(±1)°.
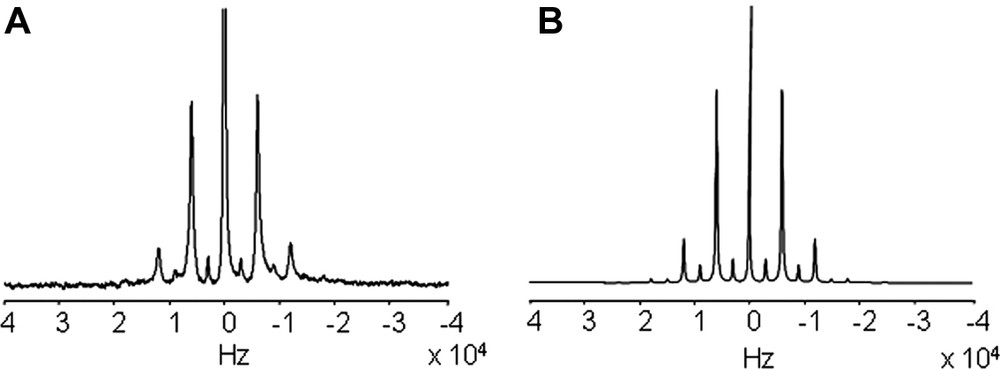
Spectres MAS (3 kHz) du 2H enregistrés à 61,4 MHz du DMPC-d54. (A) spectre expérimental de bicouches phospholipidiques supportées dans l'AAO et (B) spectre simulé correspondant.
Afin de confirmer cette dépendance orientationnelle de l'intensité des bandes de rotation, nous avons utilisé un modèle simplifié dans lequel les phospholipides sont adsorbés sur un polymère de PET enroulé cylindriquement dans le rotor à l'instar du modèle proposé par Sizun et Bechinger (2001) [12]. Les spectres de RMN du 2H obtenus sont représentés sur la Fig. 5. La simulation de ce spectre a été réalisée en utilisant 65 % de lipides orientés et une mosaïcité de 18(±1)°.
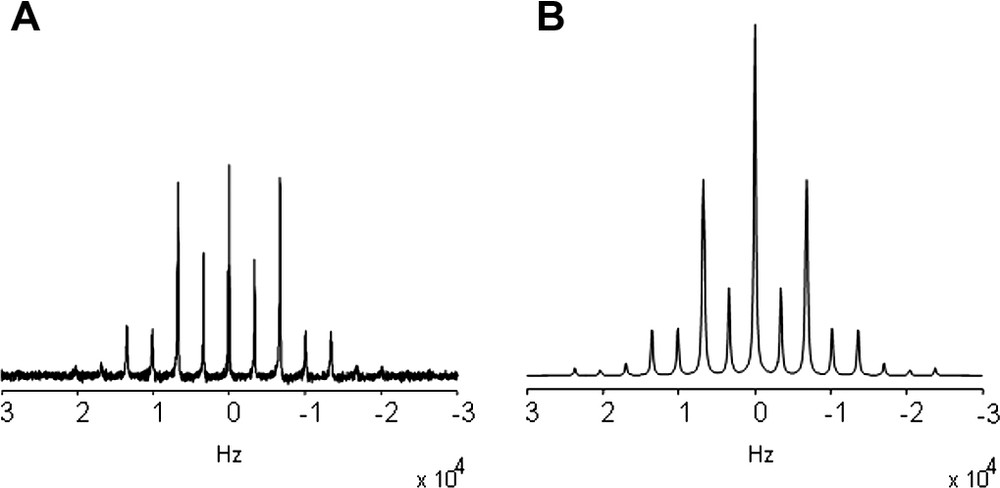
Spectres MAS (3333 Hz) du 2H enregistrés à 46 MHz du DMPC-d54 (A) spectre expérimental de bicouches phospholipidiques adsorbées sur PET et (B) spectre simulé correspondant.
Dans cette étude nous avons vu que les expériences MAS sont mieux adaptées que les expériences en statique dans le cas d'un noyau quadripolaire pour obtenir précisément des informations structurales sur le degré d'alignement des phospholipides dans un modèle orienté.
Les spectres MAS obtenus pour chacun des deux modèles mettent en évidence la dépendance orientationnelle de l'intensité des bandes de rotation et leur allure est caractéristique d'une distribution cylindrique des phospholipides. On peut noter que le degré d'alignement varie en fonction du modèle. Pour le modèle AAO, une des origines de la fraction des lipides non orientés et du degré de mosaïcité peut être expliquée par le fait que les pores ne sont pas idéalement cylindriques ni parfaitement coaxiaux. Les simulations montrent clairement que le pontage moléculaire permet d'obtenir une très bonne orientation de la bicouche puisqu'on obtient 89 % de lipides orientés et une mosaïcité de 5°. Dans le cas du modèle déposé sur une feuille de polymère, la moins bonne orientation peut être imputée à la moins bonne maîtrise de l'épaisseur des bicouches lors du dépôt du film. Si on compare la valeur obtenue ici avec celle obtenue pour les expériences statiques en RMN du phosphore 31 (85 %), on peut envisager un effet de désorption provoqué par la rotation [12].
Remerciements
Nous remercions chaleureusement Alexandre Arnold, Michèle Auger et Dror Warschawski pour le temps qu'ils ont bien voulu nous accorder sur ce sujet.


