1 Introduction
Les phosphates naturels d'origine apatitique sont très connus pour leur insolubilité en milieu peu acide [1,2]. C'est pourquoi, dans l'optique de la transformation de ces matériaux en général et de leur utilisation pour la fertilisation des sols (à cause de leur teneur en phosphore, un des éléments essentiels pour le développement des plantes), plusieurs travaux portant sur l'étude de la dissolution de certains de ces phosphates naturels ont été réalisés [3–7].
Le présent travail a pour objectif l'étude des effets de l'acidité et de la nature des acides sur la dissolution du phosphate naturel de Hahotoé-Kpogamé (Togo), appartenant à la famille des apatites [8], par des solutions de quelques acides conventionnels.
2 Matériels et méthodes
2.1 Produits utilisés
2.1.1 Le minerai de phosphate
Le minerai de phosphate utilisé dans le cadre de cette étude est celui exploité à Hahotoé-Kpogamé (Togo). Sa caractérisation chimique a montré qu'il s'agissait d'un phosphate tricalcique ayant une concentration élevée en anhydride phosphorique (taux de P2O5 supérieur à 30%) et contenant des traces de plusieurs métaux lourds, dont certains sont toxiques [8,9].
2.1.2 Les acides
Les acides utilisés dans le cadre de la présente étude sont des solutions ou des produits solides d'origine commerciale. Les caractéristiques de ces produits sont décrites dans le tableau ci-dessous (Tableau 1).
Caractéristiques des acides utilisés au cours de l'étude
| Acide | Origine | Pureté (%) | Masse molaire (en g) | Densité |
| Acide acétique (CH3COOH) | Prolabo-Normapur | 99 | 60,50 | 1,12 |
| Acide oxalique dihydraté (C2H2O4·2H2O) | Jeulin | 97 | 126,07 | – |
| Acide citrique monhydraté (C6H6O7·H2O) | Jeulin | 99 | 210,14 | – |
| Sel dissodique de l'éthylène-diamine tétra-acétique (EDTA) dihydrate (C10H14N2Na2O8·2H2O) | Touzart & Matignon | 99 | 372,25 | – |
| Acide nitrique (HNO3) | Prolabo-Normapur | 65 | 63,01 | 1,40 |
| Acide sulfurique (H2SO4) | Prolabo-Normapur | 95–97 | 96,08 | 1,84 |
2.2 Méthodes
2.2.1 Échantillonnage
2.2.1.1 Préparation des solutions acides
L'étude de l'action des acides ci-dessus sur le phosphate naturel a été réalisée à partir de l'attaque du minerai par différentes solutions de ces acides. Pour chaque acide, les solutions d'attaque, de concentrations respectives 10−1, 5 × 10−2, 10−2 et 10−3 mol l−1, ont été préparées par dilution.
Le pH de ces solutions a été mesuré à l'aide d'un pH-mètre de type SIBATA POT-101M.
2.2.1.2 Lixiviation (attaque) du phosphate par les solutions acides
Une masse d'1 g (granulométrie < 250 μm) de phosphate marchand, pesée sur une balance du type Shimadzu BX3200D, a été prélevée et introduite dans un bécher de 250 ml, préalablement rincé à l'eau déminéralisée. On ajoute 100 ml de la solution d'acide. Le mélange est maintenu sous agitation. Il a été réalisé, pour chaque solution, des réactions d'une durée de 2, 7, 15 et 30 jours.
Le mélange réactionnel est ensuite filtré. Le filtrat obtenu a fait l'objet d'une analyse par dosage du phosphore, afin d'évaluer l'action de la solution acide sur le phosphate.
Pour la détermination de la teneur totale du minerai en phosphore en vue du calcul des pourcentages en anhydride phosphorique dissous, il a été réalisé une dissolution totale du minerai. Pour ce faire, 1 g de phosphate à analyser est introduit dans un bécher de 250 ml. On ajoute 10 ml d'eau déminéralisée et 15 ml d'acide perchlorique (Prolabo Normapur, d = 1,61, pureté 65% et masse molaire = 100,46 g). Le bécher, fermé à l'aide d'un verre de montre, est chauffé avec son contenu au bain de sable à 300 °C pendant 1 h, puis laissé à refroidir pendant 8 à 15 min. La solution obtenue à l'issue de cette attaque acide est transvasée dans une fiole de 500 ml. On la dilue en ajoutant de l'eau jusqu'au trait de jauge.
2.2.2 Dosage de l'anhydride phosphorique
C'est la méthode colorimétrique qui a été utilisée pour ce dosage. Elle est basée sur la lecture de la densité optique (D.O.) d'un complexe phosphovanadomolybdique. Ce complexe est obtenu en introduisant une solution vanadomolybdate préparée à partir d'un mélange de solutions de sels de métavanadate d'ammonium [NH4VO3 (5 g dans 50 ml d'acide perchlorique et 2 l d'eau)] et d'heptamolybdate d'ammonium [(NH4)6Mo7O24 (100 g dans 2 l d'eau)] et d'une solution d'acide perchlorique (800 ml d'acide concentré dans 2 l d'eau). Cette solution vanadomolybdate est mise en excès dans le filtrat afin de s'assurer de la complexation de tous les groupements phosphates contenus dans les filtrats prélevés et dans les solutions étalons, de concentrations en anhydride phosphorique bien connues.
La lecture des densités optiques a été effectuée à l'aide d'un spectrophotomètre de type GENESY-10VIS, à la longueur d'onde d'absorption du complexe λ = 430 nm [10].
3 Résultats et discussions
3.1 Action des solutions acides sur l'apatite
L'action sur l'apatite des solutions des différents acides a été étudiée à partir du dosage de l'anhydride phosphorique présent dans les filtrats recueillis après lixiviation du minerai par ces solutions. Les résultats de ces dosages sont décrits dans les paragraphes ci-dessous :
- • les solutions d'acide acétique ont un effet de dissolution très faible sur le minerai. Cette dissolution diminue lorsque le pH augmente (Tableau 2, Fig. 1) ;
- • la variation de la quantité d'anhydride phosphorique dissoute en fonction du pH des solutions d'acide citrique est identique à celle observée dans le cas des attaques du matériau par les solutions d'acide acétique. Cependant, l'effet de dissolution du minerai par ces dernières solutions est beaucoup plus important (Tableau 3, Fig. 2) ;
- • le dosage de P2O5 dans les filtrats des solutions du sel d'EDTA montre également une diminution de l'effet de dissolution lorsque la solution est moins acide (Tableau 4 et Fig. 3) ;
- • le premier constat que l'on peut faire à partir des résultats du dosage de P2O5 (Tableau 5) dans les filtrats des solutions d'acide oxalique est que la dissolution du minerai par les solutions concentrées de cet acide est plus importante qu'avec les solutions des trois acides précédents (Tableaux 2–4). Par ailleurs, comme pour les autres acides, on note une baisse du taux de dissolution quand la solution devient de moins en moins acide (Fig. 4) ;
- • les masses d'anhydride phosphorique dissoutes dans un gramme de minerai par les solutions d'acide nitrique sont reportées dans le Tableau 6. On remarque une forte dissolution du minerai par les solutions très acides (pH < 2). En revanche, lorsque le pH augmente, la dissolution devient de plus en plus faible (Fig. 5) ;
- • la dissolution du phosphate par les solutions d'acide sulfurique est identique à celle obtenue avec les solutions d'acide nitrique. C'est ainsi qu'on observe un taux élevé de dissolution pour les solutions de pH inférieur à 2 et un faible taux pour des solutions moins acides (Tableau 7, Fig. 6).
Masse de P2O5 dissoute par gramme de minerai par les solutions d'acide acétique
| Concentration (mol l−1) | pH | Masse dissoute de P2O5 (mg g−1 de minerai) | |||
| 2 j | 7 j | 15 j | 30 j | ||
| 0,001 | 3,92 | 0,45 | 1,22 | 1,51 | 2,25 |
| 0,010 | 3,37 | 5,11 | 5,19 | 6,11 | 6,97 |
| 0,050 | 2,98 | 8,42 | 12,89 | 12,92 | 14,16 |
| 0,100 | 2,88 | 10,05 | 16,24 | 16,33 | 18,54 |
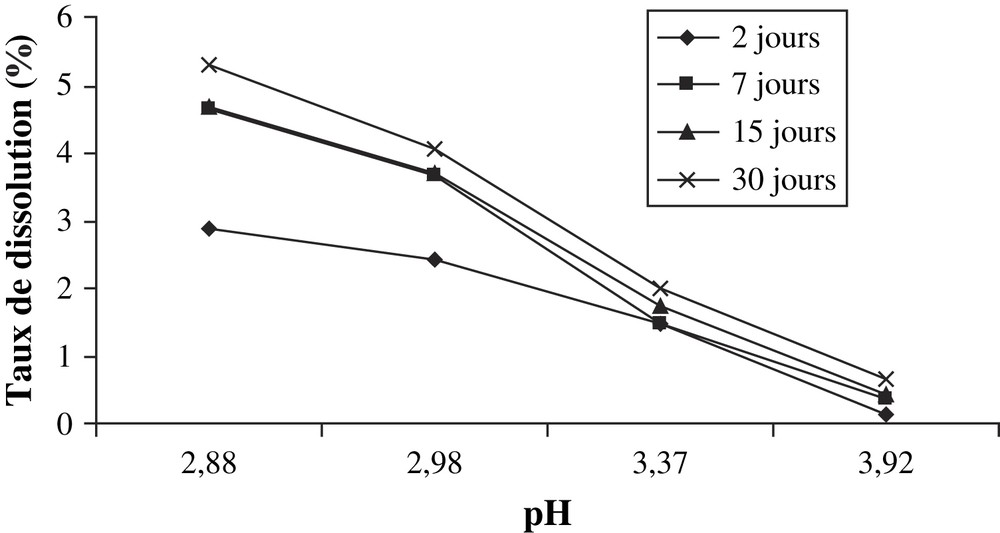
Taux de P2O5 dissous en fonction du pH des solutions d'acide acétique.
Masse de P2O5 dissoute par gramme du minerai par les solutions d'acide citrique
| Concentration (mol l−1) | pH | Masse dissoute de P2O5 (mg g−1 du minerai) | |||
| 2 j | 7 j | 15 j | 30 j | ||
| 0,001 | 3,18 | 4,15 | 4,19 | 4,31 | 4,83 |
| 0,010 | 2,55 | 6,23 | 25,33 | 29,28 | 29,10 |
| 0,050 | 2,15 | 9,28 | 55,22 | 69,72 | 72,02 |
| 0,100 | 1,98 | 19,19 | 88,22 | 91,38 | 103,48 |
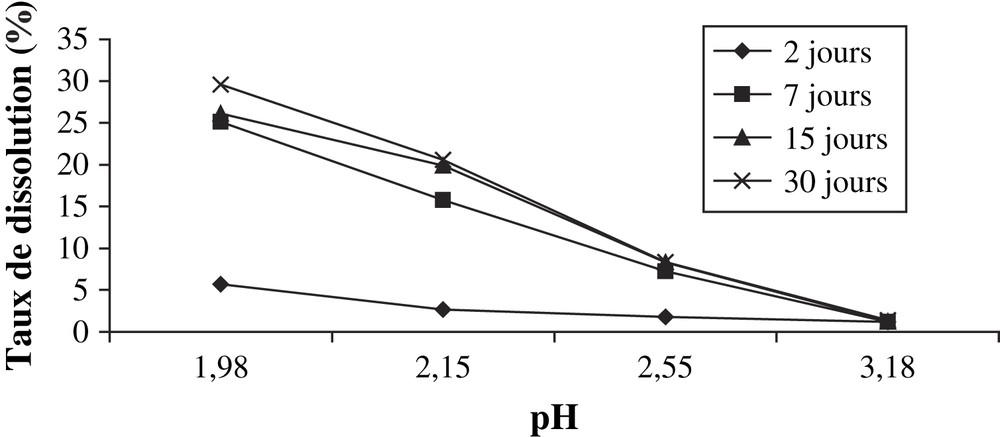
Taux de P2O5 dissous en fonction du pH des solutions d'acide citrique.
Masse de P2O5 dissoute par gramme du minerai par les solutions d'EDTA
| Concentration (mol l−1) | pH | Masse dissoute de P2O5 (mg g−1 de minerai) | |||
| 2 j | 7 j | 15 j | 30 j | ||
| 0,001 | 4,75 | 5,57 | 8,07 | 9,771 | 10,67 |
| 0,010 | 4,50 | 12,35 | 29,33 | 29,94 | 41,57 |
| 0,050 | 4,34 | 12,90 | 49,55 | 59,44 | 83,37 |
| 0,100 | 4,24 | 13,66 | 69,22 | 81,44 | 99,78 |
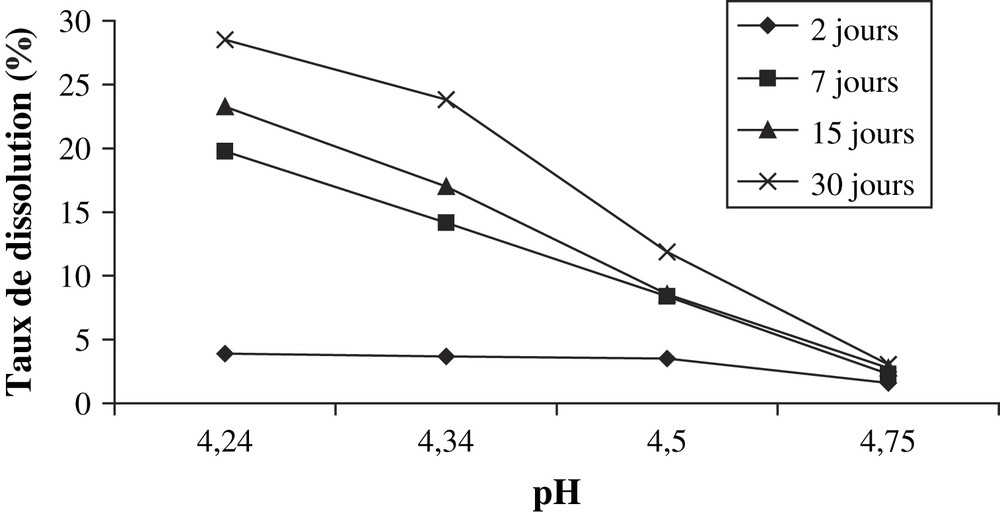
Taux de P2O5 dissous en fonction du pH des solutions du sel d'EDTA.
Masse de P2O5 dissoute par gramme du minerai dans les solutions d'acide oxalique
| Concentration (mol l−1) | pH | Masse dissoute de P2O5 (mg g−1 de minerai) | |||
| 2 j | 7 j | 15 j | 30 j | ||
| 0,001 | 2,93 | 4,69 | 5,22 | 5,50 | 7,40 |
| 0,010 | 2,02 | 32,37 | 45,25 | 51,35 | 56,50 |
| 0,050 | 1,43 | 52,04 | 192,89 | 224,60 | 262,20 |
| 0,100 | 1,22 | 69,28 | 211,44 | 266,90 | 277,35 |
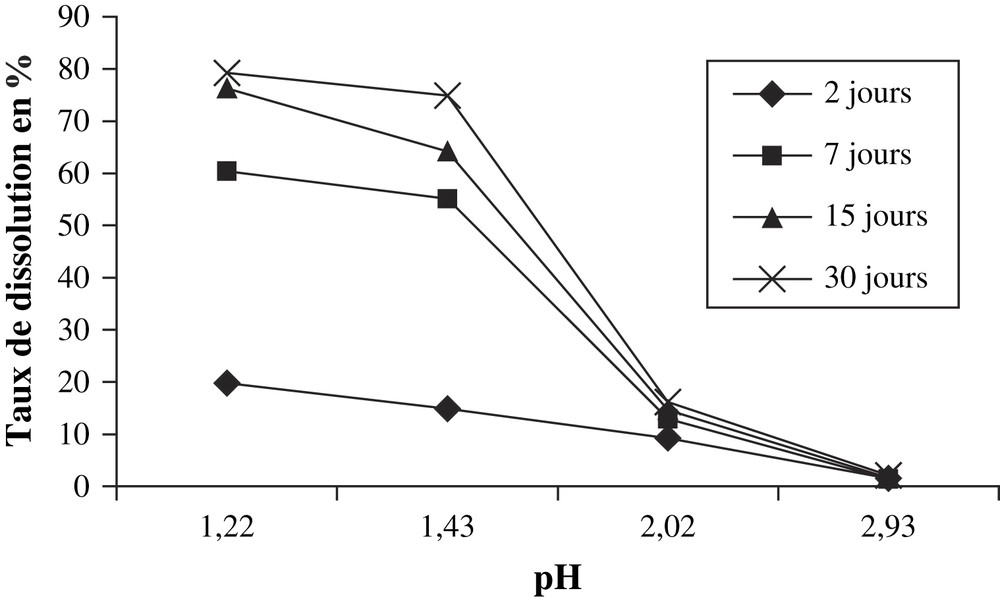
Taux de P2O5 dissous en fonction du pH des solutions d'acide oxalique.
Masse de P2O5 dissoute par gramme de minerai par les solutions d'acide nitrique
| Concentration (mol l−1) | pH | Masse dissoute de P2O5 (mg g−1 du minerai) | |||
| 2 j | 7 j | 15 j | 30 j | ||
| 0,001 | 2,99 | 4,04 | 9,08 | 13,10 | 13,87 |
| 0,010 | 2,01 | 22,30 | 24,75 | 27,86 | 32,60 |
| 0,050 | 1,35 | 75,41 | 93,44 | 108,10 | 118,23 |
| 0,100 | 1,01 | 138,83 | 169,68 | 220,80 | 236,44 |
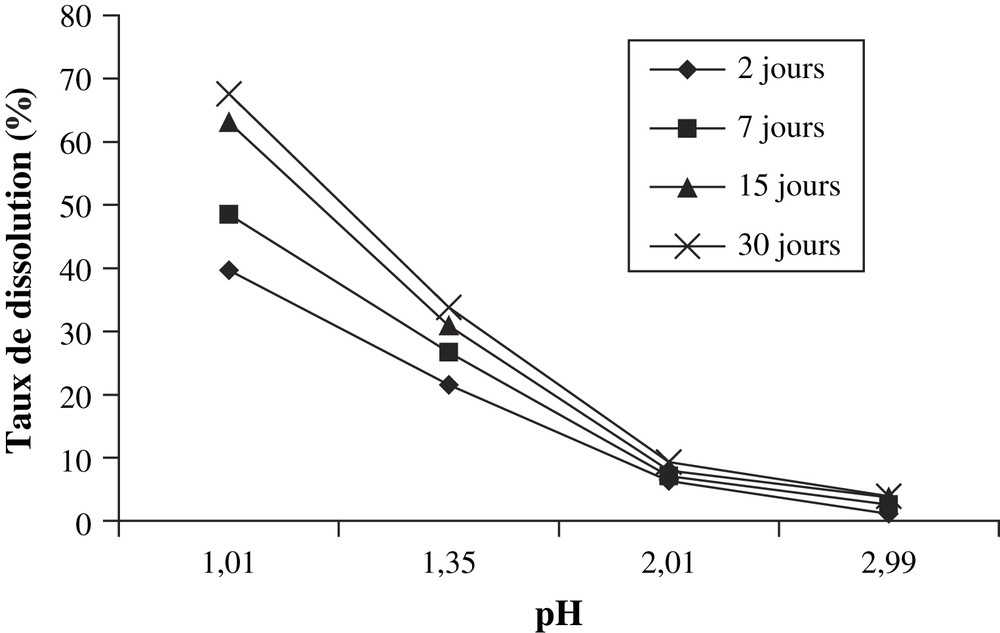
Taux de P2O5 dissous en fonction du pH des solutions d'acide nitrique.
Masse de P2O5 dissoute par gramme du minerai par les solutions d'acide sulfurique
| Concentration (mol l−1) | pH | Masse dissoute de P2O5 (mg g−1 de minerai) | |||
| 2 j | 7 j | 15 j | 30 j | ||
| 0,001 | 2,80 | 6,23 | 7,65 | 16,85 | 21,50 |
| 0,010 | 1,75 | 39,45 | 50,16 | 63,50 | 81,77 |
| 0,050 | 1,02 | 119,14 | 210,90 | 268,00 | 299,70 |
| 0,100 | 0,75 | 209,84 | 262,50 | 298,60 | 309,39 |
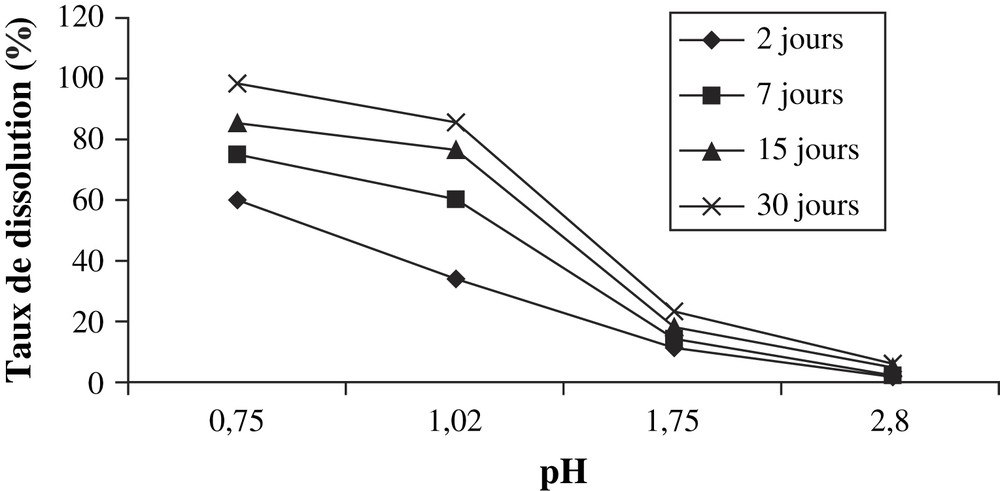
Taux de P2O5 dissous en fonction du pH des solutions d'acide sulfurique.
3.2 Étude comparative de la dissolution du minerai par les solutions d'acides
3.2.1 Comparaison des effets des acides organiques
L'action des solutions des acides organiques, quelle que soit la durée d'attaque, présente deux aspects, selon que ces solutions sont concentrées ou non.
C'est ainsi que les taux de dissolution de l'apatite dans les solutions organiques de concentration 0,1 mol l−1 montrent que la solution d'acide oxalique (pH = 1,22) présente le taux le plus élevé (Fig. 7) ; ensuite viennent la solution décimolaire d'acide citrique, dont le pH = 1,98, et celle de l'EDTA (pH = 4,24). L'action de la solution décimolaire d'acide citrique est plus énergique que celle du sel d'EDTA, parce que c'est le sel dissodique de ce dernier acide qui a été utilisé.
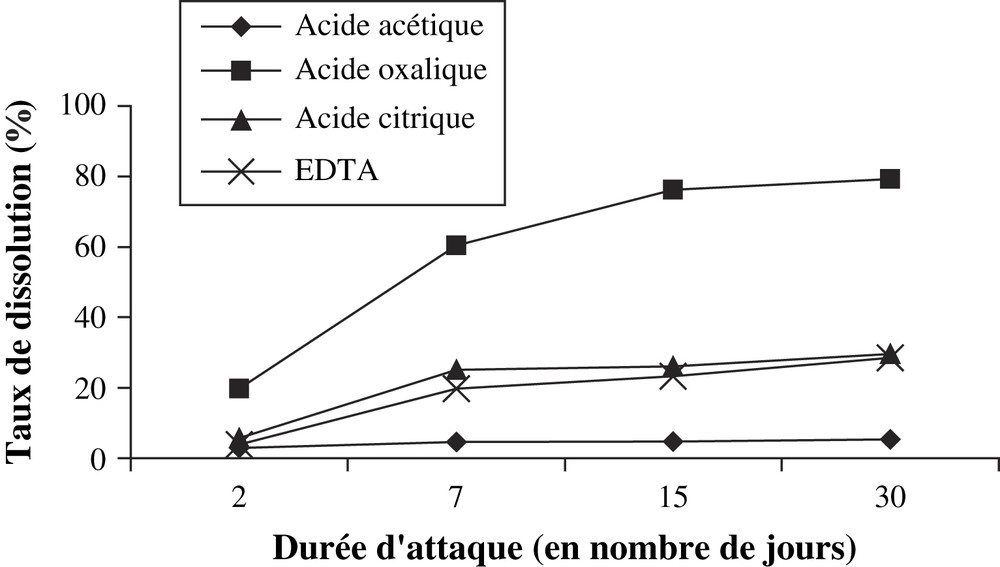
Comparaison des effets de dissolution des solutions d'acides organiques de concentration 0,1 mol l−1.
La dissolution du minerai dépend donc de l'acidité de la solution. Cependant, la solution décimolaire d'acide acétique, malgré son acidité (pH = 2,88), qui est supérieure à celle de la solution d'EDTA, dissout moins l'apatite (Fig. 7). On peut conclure que, pour ces acides organiques, en plus de l'attaque de l'apatite par les ions hydronium (H3O+), un autre phénomène chimique contribuerait à la dissolution du minerai.
Ce phénomène a été mis en évidence lors de l'étude de l'action des solutions de faible acidité (10−3 mol l−1). En effet, pour ces solutions, le taux de dissolution le plus élevé est obtenu pour la solution d'EDTA, suivie respectivement des solutions des acides oxalique, citrique et acétique (Fig. 8). La dissolution du phosphate par les solutions de faible concentration semble dépendre davantage du nombre (n) de groupements carboxyliques dans l'acide. Cependant, l'action de la solution d'acide oxalique (deux groupements) est légèrement plus importante que celle de l'acide citrique (trois groupements) (Fig. 8). Cela est dû probablement à la contribution de l'acidité de la solution d'acide oxalique, qui est plus élevée (pH = 2,93) que celle de la solution d'acide citrique (pH = 3,18).
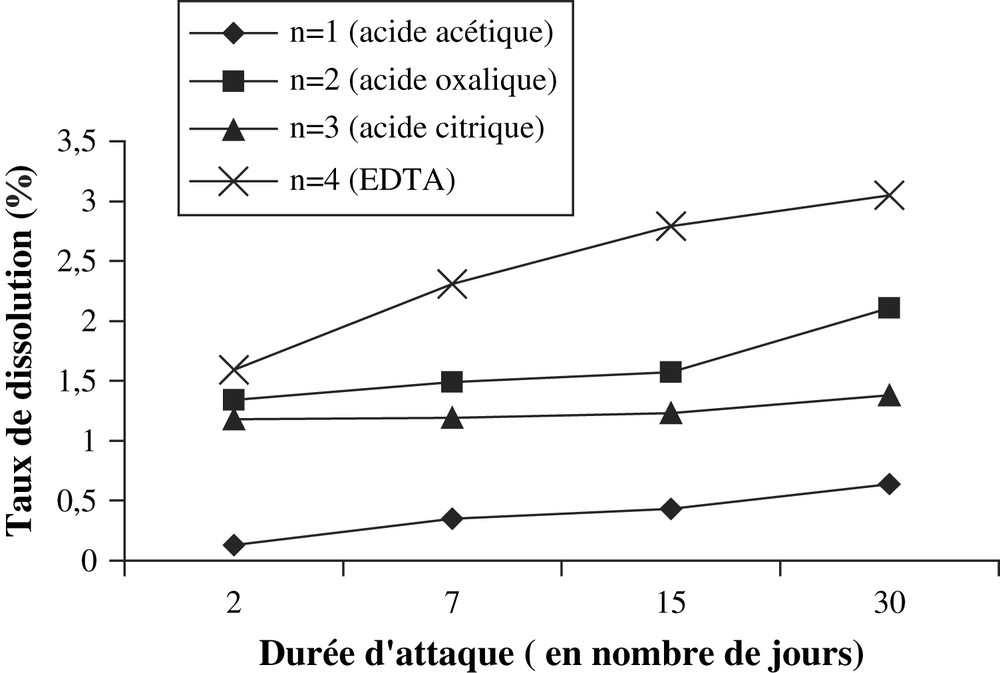
Comparaison des effets de dissolution des solutions d'acides organiques de concentration 0,001 mol l−1.
Plusieurs auteurs [11–16] ont signalé que la dissolution de l'apatite par les solutions d'acides organiques de faibles concentrations est due en grande partie aux phénomènes de complexation de l'élément métallique par les groupements carboxyliques de ces acides. La dissolution du phosphate de Hahotoé-Kpogamé par les solutions de concentration 10−3 mol l−1 d'acides organiques, où la présence des ions hydronium est négligeable, serait donc liée à ce phénomène de complexation.
3.2.2 Comparaison des effets des acides organiques et minéraux
Une comparaison de l'action des solutions des acides minéraux (acides nitrique et sulfurique) et des acides organiques (acide oxalique et EDTA) sur le phosphate a été réalisée (Fig. 9). Pour les solutions de forte concentration, l'effet de dissolution des acides minéraux et de l'acide oxalique est largement supérieur, à cause de la forte acidité de ces solutions (pH < 2). Quand les concentrations des solutions de ces acides diminuent, on note une chute brutale de la dissolution. En revanche, pour les solutions d'EDTA, cette diminution du taux de dissolution de l'apatite par suite de la dilution est beaucoup plus lente. Les actions de la solution 5 × 10−2 mol l−1 en acide acétique et de celle de concentration 10−3 mol l−1 en acide nitrique (Tableaux 2 et 6) montrent qu'à pH pratiquement égal (2,99 et 2,98 respectivement pour l'acide acétique et l'acide nitrique) et après deux jours de réaction, l'effet de dissolution de la solution organique est pratiquement le double de celui de l'acide minéral.
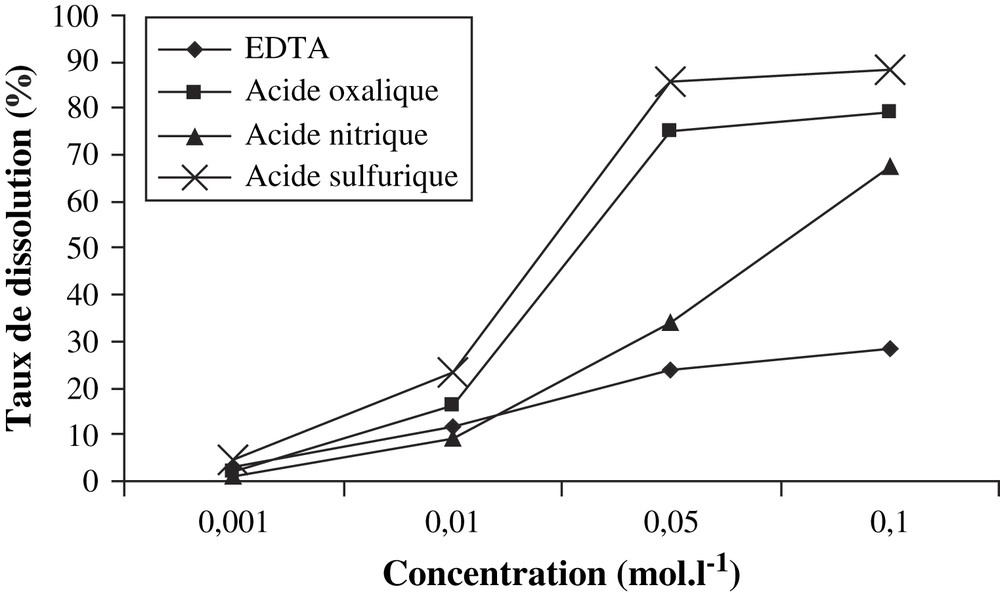
Comparaison des effets de dissolution des solutions d'acides organiques et d'acides minéraux.
En milieu fortement acide, la dissolution du minerai est due à l'action des ions hydronium ; c'est ce qui expliquerait le fort taux de dissolution du minerai par les solutions concentrées des acides minéraux. L'acide oxalique, bien qu'étant un acide organique, présente le même comportement que les deux acides minéraux, à cause de son caractère très acide. Pour les acides organiques, notre étude confirme les résultats déjà disponibles dans la littérature, à savoir qu'en plus de leur acidité, d'autres phénomènes chimiques contribuent à la dissolution de l'apatite [4,11–16], ce qui est mis en évidence par le taux non négligeable de cette dissolution à pH faible.
4 Conclusion
L'étude de la dissolution du phosphate de Hahotoé-Kpogamé, qui est d'origine apatitique, par des solutions de concentrations variables de quelques acides conventionnels a mis en évidence l'influence du pH et de la nature de ces acides.
En effet, l'exploitation des résultats du dosage de l'anhydride phosphorique des filtrats obtenus après lixiviation du minerai par ces solutions a permis de constater que le taux de dissolution du minerai est très élevé pour les solutions très acides (pH faible), quelle que soit la nature de l'acide (organique ou minéral). Cependant, pour les solutions faiblement acides (pH élevé), la dissolution du minerai se poursuit pour les acides organiques, alors qu'elle est quasi nulle pour les acides minéraux. Ce constat est en accord avec plusieurs résultats déjà publiés dans la littérature, qui attribuent cette forme de dissolution à des phénomènes de complexation de l'ion métallique par les groupements carboxyliques de ces acides. Des travaux de caractérisation des filtrats après attaque doivent être réalisés pour le confirmer.


