1 Introduction
Bien que notre planète soit recouverte à 70 % d’eau, on estime à seulement 1 % des réserves totales la quantité d’eau réellement disponible pour l’homme. Cette eau est de plus très inégalement répartie puisqu’un être humain sur cinq n’a pas accès à une eau de consommation saine [1] et sa qualité ne cesse de se dégrader par différentes sources de pollutions humaine et naturelle. Dans certains pays en voie de développement et faiblement industrialisés, on peut citer parmi ces sources, l’industrie textile dont les rejets sont lourdement chargés en métaux lourds et en colorants, stables et faiblement biodégradables [2,3].
Le traitement des effluents industriels, en quantités toujours plus importantes, représente donc une préoccupation environnementale majeure. Quel que soit le secteur d’application, la rigueur croissante des législations sur le rejet des effluents et plus précisément ceux contaminés par les métaux lourds nécessite de mettre en pratique des techniques de traitement adaptées et offrant la possibilité d’un recyclage de certains produits ainsi que la réutilisation des eaux épurées, surtout dans les pays arides, en usage spécifique.
Ainsi plusieurs procédés de dépollution ont été développés pour éliminer les métaux lourds des effluents industriels comme la précipitation chimique précédée ou non d’une réduction, l’échange ionique, l’osmose inverse ou dans une moindre mesure, l’extraction par solvants [1,4–6]. Sans être exhaustif, on peut également citer les biotechnologies, en particulier pour éliminer le chrome présent dans les effluents des tanneries [7].
Cependant, la plupart de ces technologies sont coûteuses, surtout lorsqu’elles sont appliquées pour les effluents à haut débit. C’est pourquoi la technique d’adsorption sur des supports biologiques, disponibles et bon marché, peut constituer une alternative intéressante, techniquement fiable et surtout économiquement viable, dans les processus de dépollution. Les qualités bioaccumulatrices de ces supports vis-à-vis des métaux ont d’ailleurs été confirmées [8]. Dans ce contexte, plusieurs travaux de recherche ont été menés ces dernières années pour tester toute une panoplie d’adsorbants potentiels parmi lesquels on peut citer les algues vertes ou brunes, l’amidon, les alginates, les cônes de pin, les biomasses fongiques, la chitine, le chitosan… [2–14]. La cellulose qui est le polymère le plus abondant sur le globe terrestre [15,16] s’avère le plus adapté pour le piégeage de colorants [17], de polluants organiques [18–20] et inorganiques [21–23] du fait de ses propriétés physiques particulières, sa bonne stabilité chimique et sa robustesse [24–27].
Contrairement à certains substrats tels le chitosan qui possède des propriétés d’adsorption significatives, la cellulose a l’inconvénient de présenter une capacité d’adsorption faible qui peut toutefois être sensiblement augmentée par sa modification chimique via la création en surface de groupements capables d’interagir avec les polluants.
L’objectif principal de ce travail est de modifier de la cellulose par le Pyridine-3-chlorhydrate de chlorure de carbonyle (PCCC) dans des conditions douces pour ensuite étudier l’influence de quelques paramètres clés sur sa capacité d’adsorption de cations Pb2+. En effet, le plomb et ses produits dérivés sont connus pour leur toxicité depuis l’antiquité et ont des effets néfastes sur le système nerveux, les reins et le foie. On peut les trouver dans les eaux usées comme le résultat d’activités industrielles (traitement de surfaces, batteries, insecticides…). En outre, il a été montré que sur des biosorbants et en présence d’autres cations métalliques, le cation Pb2+ s’adsorbe préférentiellement [28]. Dans ce travail, une modélisation des isothermes d’adsorption et une étude thermodynamique sont ensuite présentées afin de comprendre la nature des mécanismes réactionnels mis en jeu lors du phénomène de biosorption. Notons que le support utilisé a déjà donné des résultats prometteurs lors d’études d’adsorption du Bleu de Méthylène (résultats en cours de publication).
2 Partie expérimentale
2.1 Préparation de la cellulose modifiée
La cellulose qui a servi de base à cette étude est de la « cellulose Kraft », fournie par la firme « Cellulose Maroc ». Ce matériau se présente sous forme de pâte qui, avant un quelconque usage, est broyée à l’aide d’un broyeur de marque SIEBTECHNIK. Le substrat obtenu est tamisé et seule la granulométrie 0,5–1 mm est conservée. Les particules sont ensuite activées par immersion pendant une minute dans une solution aqueuse d’acide sulfurique à 3 %, filtrées puis lavées à l’eau distillée et séchées à 40 °C. Elles subissent ensuite un lavage au méthanol à reflux dans un soxhlet pendant six heures afin, d’une part, d’éliminer toute contamination qui pourrait avoir une influence dans les étapes ultérieures et, d’autre part, pour les déshydrater [29]. Cette cellulose est ensuite séchée à l’étuve une nuit à 80 °C. La modification chimique de la cellulose a lieu en deux étapes. La première consiste à solubiliser la cellulose séchée dans le système diméthyl acétamide/chlorure de lithium (DMA/LiCl). Cette méthode est bien connue pour sa facilité de mise en œuvre, sa rapidité et sa reproductibilité [30]. 0,22 g de cellulose sont versés dans 10 mL de DMA, puis chauffés à 120 °C durant deux heures. Le mélange est refroidi à 100 °C. À cette température, on ajoute 0,9 g de chlorure de lithium (LiCl) anhydre et on laisse la réaction se poursuivre pendant 4 h à 100 °C. La seconde étape consiste à fonctionnaliser la cellulose. Au mélange précédent, maintenu à 100 °C, on ajoute 0,9 g de PCCC de formule C6H4ClNO.HCl fourni par ACROS™ et 2 mL de triéthylamine. On augmente ensuite la température jusqu’à 120 °C, température à laquelle le mélange est maintenu sous agitation pendant 12 heures. Le solvant est évaporé jusqu’à obtention d’un solide gris. Ce solide est lavé à l’aide d’une solution aqueuse saturée de K2CO3, puis il subit une série de lavages à l’eau distillée à la température ambiante jusqu’à l’obtention d’une eau de rinçage de pH neutre. Dans le but d’éliminer toute trace éventuelle d’adsorption d’un excédent de PCCC sur la cellulose fonctionnalisée, celle-ci est lavée au soxhlet dans l’éthanol à reflux pendant six heures. Après filtration sous vide, la cellulose greffée obtenue est séchée.
2.2 Caractérisation des supports
Les échantillons préparés, cellulose dissoute et cellulose traitée, ont été caractérisés par les techniques suivantes.
2.2.1 Spectroscopie infrarouge
Une masse de 1 mg de substrat est broyée, puis mélangée à 50 mg de bromure de potassium KBr (99 %) fourni par ALDRICH ™. La poudre obtenue est ensuite pastillée sous une pression de 6 bars. L’analyse s’effectue à l’aide d’un spectrophotomètre PERKIN ELMER Spectrum 2000 et d’un système d’acquisition de données développé par la marque.
2.2.2 Analyses élémentaires
Le but de ces microanalyses est la détermination de la formule approchée de notre composé à l’aide des pourcentages en masse de chaque élément présent dans la molécule. Les analyses sont réalisées sur un analyseur élémentaire THERMOFINNIGAN EA 1112 équipé d’un passeur automatique et d’une colonne chromatographique PORAPAK. Les résultats sont donnés avec une précision absolue de ± 0,2 %.
2.2.3 Analyses thermogravimétriques (ATG)
Typiquement, une masse d’environ 10 mg est introduite dans la nacelle d’une thermobalance SETARAM Setsys TG 12. Après une purge sous gaz inerte, l’échantillon subit un programme de montée en température (5 °C min−1) depuis l’ambiante jusqu’à 600 °C sous un débit d’azote de 80 mL min−1.
2.2.4 Microscopie électronique à balayage (MEB)
Les images sont obtenues grâce à un microscope électronique à haute résolution HITACHI FEG S 4800. Avant analyse, les échantillons secs de cellulose sont métallisés par une couche de carbone pour augmenter leur conductivité. Cette étape s’avère inutile pour les échantillons de cellulose modifiée après adsorption du plomb.
2.3 Isothermes d’adsorption
Pour établir ces isothermes, des solutions aqueuses contenant des ions Pb2+ à différentes concentrations ont été mises au contact d’une quantité donnée de substrat. Une fois l’équilibre atteint, la quantité de plomb adsorbée ainsi que la concentration résiduelle en cation métallique ont été évaluées, ce jeu de valeurs constituant un point de l’isotherme.
Des solutions aqueuses de nitrate de plomb Pb(NO3)2 (fourni par la société ACROS ™) ont été préparées dans une gamme de concentrations allant de 2 × 10−4 à 10−3 mol/L.
Quarante millilitres de solution ont été mis en contact avec 0,1 g de substrat (cellulose fonctionnalisée ou non) et le système a été maintenu sous agitation (250 oscillations par minute) dans un bain thermostaté à 25 °C. Le pH des solutions s’échelonne entre 7,0 et 7,2. Régulièrement et afin d’accéder au temps d’équilibre au-delà duquel il n’y a plus de variation significative de concentration, la concentration en plomb résiduelle a été déterminée pour différents temps de contact (de 3 à 240 min). Cette mesure a été effectuée au moyen d’un analyseur polarographique COPENHAGEN POL 150 équipé d’un logiciel TraceMaster5 après séparation de l’adsorbant du surnageant par filtration sur papier filtre (porosité 0,2 μm).
Parallèlement, la quantité de plomb fixée à l’instant t a été estimée à partir de la relation :
| (1) |
2.4 Détermination des paramètres thermodynamiques
Dans le but de montrer l’influence de la température sur l’adsorption du plomb sur les deux supports cellulosiques, nous avons étudié l’adsorption à différentes températures dans une gamme de 25 à 60 °C à l’aide d’un bain thermostaté. Pour cette série d’expériences, la quantité maximale adsorbée par une masse de 100 mg de substrat en contact avec une solution aqueuse de plomb de concentration 2 × 10−4 mol/L a été déterminée.
3 Résultats et discussion
3.1 Mise en évidence du greffage
L’utilisation de la spectroscopie IR permet, en analysant l’apparition et la disparition de certaines bandes caractéristiques, de mettre en évidence l’aspect qualitatif de l’estérification de la cellulose.
La Fig. 1 reporte les spectres infrarouges de la cellulose fonctionnalisée ou non. On observe une large bande d’absorption aux environs de 3350 cm−1 qui correspond à des vibrations de valence des groupes hydroxyles. La cellulose traitée voit cette bande légèrement rétrécie et déplacée vers 3460 cm−1. Les autres bandes caractéristiques des groupements OH (1455 et 1205 cm−1) sont elles aussi légèrement affectées. Ces modifications s’expliquent par la disparition des fonctions alcools et donc des liaisons hydrogène de la cellulose de départ. On remarque que la baisse d’intensité est corrélée à l’apparition d’une bande vers 1740 cm−1 attribuée à la vibration de la liaison carbonyle C = O et caractéristique des fonctions esters. Le spectre de la cellulose traitée fait apparaître d’autres nouvelles bandes : une, aux alentours de 1300 cm−1, qui confirme la formation d’un ester au cours de la réaction et une autre, pointée vers 1410 cm−1 qui est relative à l’élongation d’une liaison C = N et prouve la présence du cycle pyridinique sur la molécule de cellulose après réaction. Ces résultats montrent que la cellulose a bien été modifiée et qu’une liaison ester a été créée.
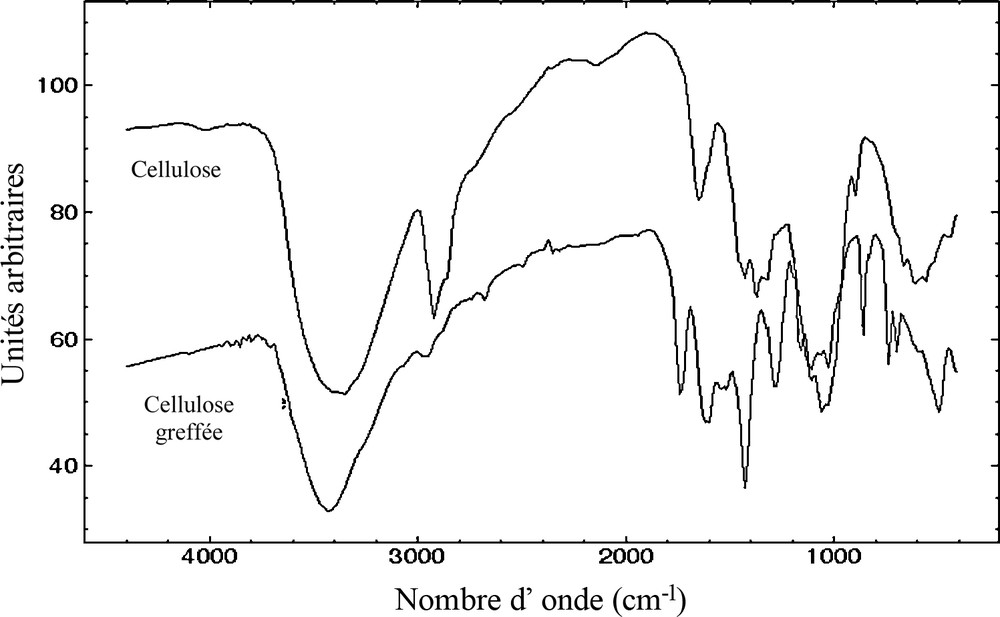
Spectre IR de la cellulose et de la cellulose greffée.
Le Tableau 1 présente les résultats des analyses centésimales (% en masse) effectuées sur les différents substrats. Compte tenu des molécules utilisées, nous nous sommes uniquement intéressés aux éléments C, H et N. L’analyse de la cellulose conduit à une teneur en carbone et hydrogène en bonne corrélation avec sa formule brute C6H10O5. Après dissolution, on constate une légère diminution du taux d’hydrogène alors que le taux de carbone semble identique. La dissolution conduit notamment à la rupture des liaisons hydrogène inter moléculaires [31] et à la déstructuration de la cellulose. Avant dissolution, la cellulose est capable de piéger des molécules d’eau entre ses chaînes de polymères. Au cours de la dissolution, cette eau adsorbée est libérée ce qui entraîne une diminution de la teneur en hydrogène, confirmée par l’analyse élémentaire. Dans le cas de la cellulose dissoute, on note la présence de traces d’azote, à la limite de détection de l’appareil. Cette présence peut être reliée aux résidus probables de solvant (diméthyle acétamide).
Analyses élémentaires de la cellulose et la cellulose après réaction (% en masse).
| Échantillons | %C | %H | %n |
| 1-Cellulose (C) | 44,21 | 6,26 | – |
| 2-Cellulose | |||
| Dissoute (CD) | 44,25 | 5,95 | 0,085 |
| 3-Cellulose traitée (CT) | 50 | 4,98 | 3,51 |
Les résultats relatifs à la cellulose modifiée nous confortent dans l’idée que le greffage a bien eu lieu. En effet, on constate que le rapport massique H/C décroît sensiblement entre la cellulose dissoute et la cellulose traitée et passe de 0,142 à 0,1. Cette variation est en bon accord avec les résultats attendus si on considère qu’au cours de la réaction, la cellulose passe d’une formule brute C6H10O5 à C11H16O6N et donc d’un rapport massique de 0,167 à 0,121. En outre, les analyses révèlent la présence de l’élément azote qui précédemment ne se manifestait que sous forme de traces. Cela met en évidence la présence du cycle pyridinique greffé sur la cellulose. À partir de ces résultats, nous avons pu évaluer que le taux de greffage était voisin de 1. La réactivité de la cellulose vis-à-vis des chlorures d’acyle étant par ailleurs bien connue [29], on peut supposer le schéma réactionnel de la Fig. 2.
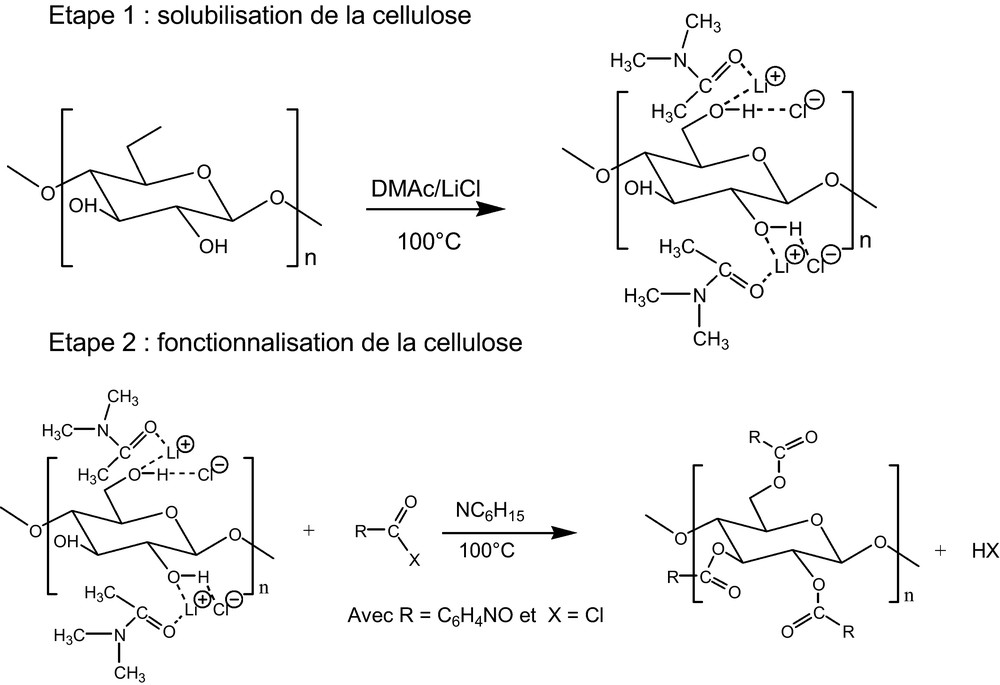
Schéma de réaction pour la modification de la cellulose.
Sur la Fig. 3 sont représentées les courbes obtenues en ATG (a) ainsi que leurs dérivées DTG (b). D’après ces tracés, on peut noter que la cellulose perd une partie de son eau adsorbée aux environs de 100 °C, qu’elle se dégrade entre 240 et 360 °C et que la vitesse de perte de masse présente un pic aux environs de 300 °C. Ces résultats sont en accord avec ceux de la littérature [32–34].
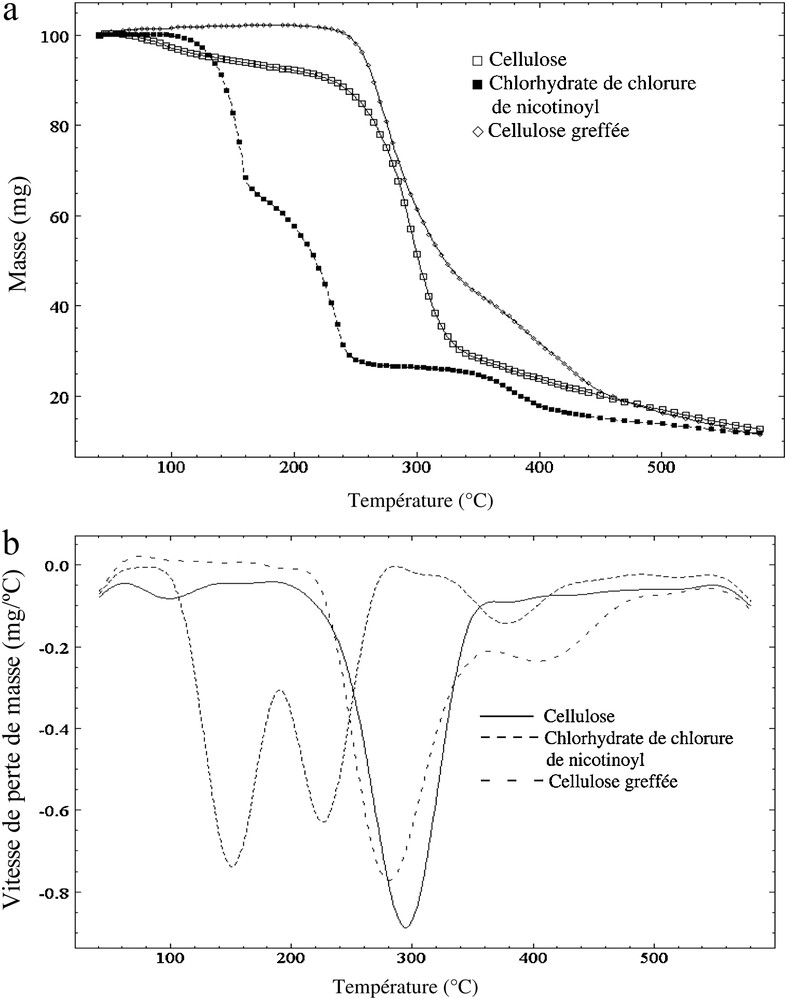
Spectres ATG (a) et DTG (b) de la cellulose, du chlorhydrate de chlorure de nicotinoyl et de la cellulose traitée.
S’agissant du Pyridine-3-chlorhydrate de chlorure de carbonyle (PCCC), les spectres ATG et DTG se décomposent en trois zones. La première qui s’étale entre 100 et 180 °C, montre une décomposition rapide, le pic DTG étant centré à 150 °C. La deuxième zone de décomposition a lieu entre 180 et 250 °C avec une vitesse de perte de masse maximale à 225 °C. La troisième zone s’étale dans une gamme de températures comprise entre 340 et 460 °C et fait appel à des processus de décomposition plus lents, le pic DTG étant observé à 380 °C. À notre connaissance, la littérature ne reporte aucun résultat sur la décomposition de ce composé et l’interprétation de ce spectre n’est pas aisée.
Les tracés ATG et DTG de la cellulose traitée diffèrent fondamentalement des spectres des constituants séparés. Les pics DTG observés à basse température pour le PCCC (150 °C et 225 °C) et la cellulose (100 °C) ont disparu. Le spectre DTG du composé final ne présente que deux pics principaux, le premier à 280 °C c’est-à-dire à une température plus faible que celle du pic principal de décomposition de la cellulose (300 °C), le second, vers 400 °C, soit à une température plus élevée que le troisième pic de décomposition du PCCC (380 °C). Même si l’interprétation demeure difficile, on peut y voir une modification chimique importante des substrats initiaux et donc la formation entre ces molécules d’une liaison chimique confirmant que le greffage a bien eu lieu.
Les fibres de cellulose ont été observées par microscopie électronique à balayage. La Fig. 4 montre leur changement de morphologie avant ou après greffage et après adsorption du plomb. La dissolution de la cellulose dans le système LiCl/DMAc (passage de l’image (a) à l’image (b)) montre la formation d’agrégats ce qui est en bon accord avec la littérature. En effet, Sjöholm et al. [35] ont mis en évidence que pour des pâtes Kraft de feuillus, la proportion d’agrégats augmente lorsque la teneur en LiCl varie de 6 à 10 %. Les solutions utilisées pour ce travail sont dans cette gamme de concentrations et expliquent les clichés obtenus. Par ailleurs, l’image (c) de la cellulose modifiée est clairement différente de l’image (b) d’un point de vue morphologique et structural ce qui tend à prouver la réussite du greffage. Après l’étape d’adsorption (image (d)), la surface de la cellulose greffée devient rugueuse et on note la présence de petites sphéroïdes ce qui tendrait à démontrer l’adsorption du cation métallique.

Images MEB : (a) fibres cellulosiques ; (b) cellulose dissoute ; (c) cellulose greffée ; (d) cellulose après adsorption de Pb2+.
3.2 Adsorption du plomb
3.2.1 Étude cinétique
La Fig. 5 représente la cinétique d’adsorption du plomb sur les deux substrats étudiés, cellulose et cellulose greffée, au contact d’une solution d’ions Pb2+ à une concentration initiale de 2 × 10−4 mol.L−1. On constate que l’adsorption du plomb est nettement plus rapide sur la cellulose modifiée. L’équilibre d’adsorption est atteint en 60 minutes. Au bout de 240 minutes, la quantité adsorbée est de l’ordre de 14,50 mg/g de substrat correspondant à un pourcentage d’adsorption de 35,0 % pour le substrat greffé contre 3,26 mg/g correspondant à 7,9 % pour la cellulose pure. Cette différence peut trouver son origine dans le fait que la cellulose modifiée possède un cycle pyridinique dont le noyau riche en électrons favorise les interactions de type électrostatique avec des espèces cationiques.
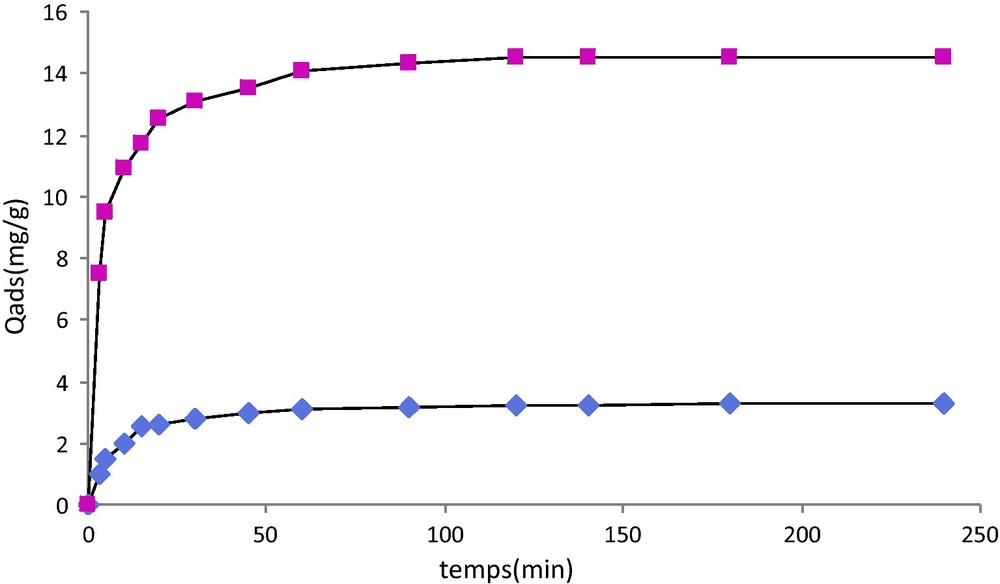
Variation de la quantité adsorbée de plomb en fonction du temps ( Cellulose, Cellulose greffée). Concentration initiale de Pb2+ = 2 × 10−4 mol L−1.
À partir de ces résultats expérimentaux, et dans le souci d’approcher le mécanisme réactionnel réel, nous avons appliqué différents modèles cinétiques. Ces modèles mathématiques ont été choisis, d’une part, pour leur simplicité et, d’autre part, parce qu’ils sont couramment utilisés lorsque l’on s’intéresse à l’adsorption de métaux lourds sur différents adsorbants.
Le modèle cinétique d’adsorption de Lagergreen [36] donne, pour le premier ordre :
| (2) |
En portant log(Qe–Qt) en fonction de t (Fig. 6), on doit obtenir une droite dont la pente permet d’accéder à K1, constante de vitesse d’adsorption (min−1).
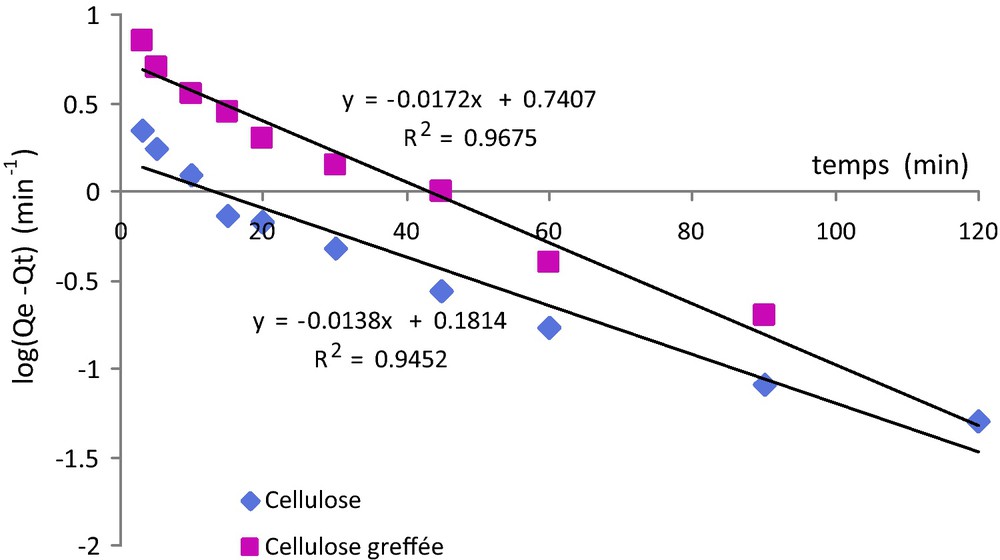
Détermination de la constante de vitesse pour un modèle cinétique du premier ordre.
Pour le pseudo second ordre, la constante de vitesse K2 est donnée par la relation suivante [37,38] :
| (3) |
En traçant t/Qt en fonction de t (Fig. 7), on a accès à K2 (g min/mg).
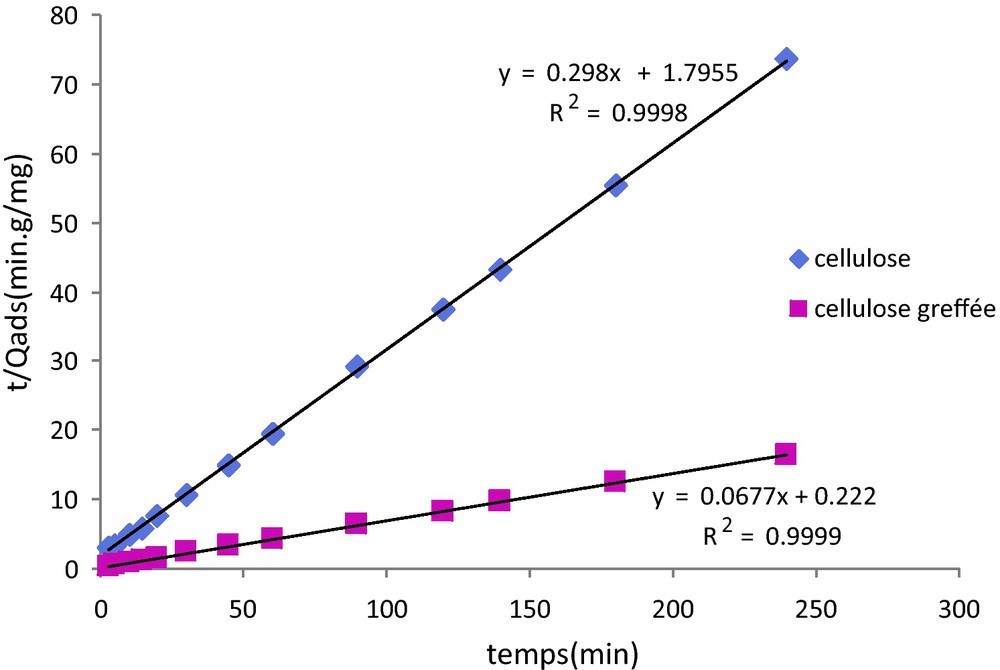
Détermination de la constante de vitesse pour un modèle cinétique du pseudo second ordre.
Pour le second ordre, la constante de vitesse K3 est donnée par la relation suivante [37,38] :
| (4) |
La représentation graphique de 1/(Qe−Qt) en fonction de t (Fig. 8) nous permet d’évaluer K3 (min−1 g/mg).
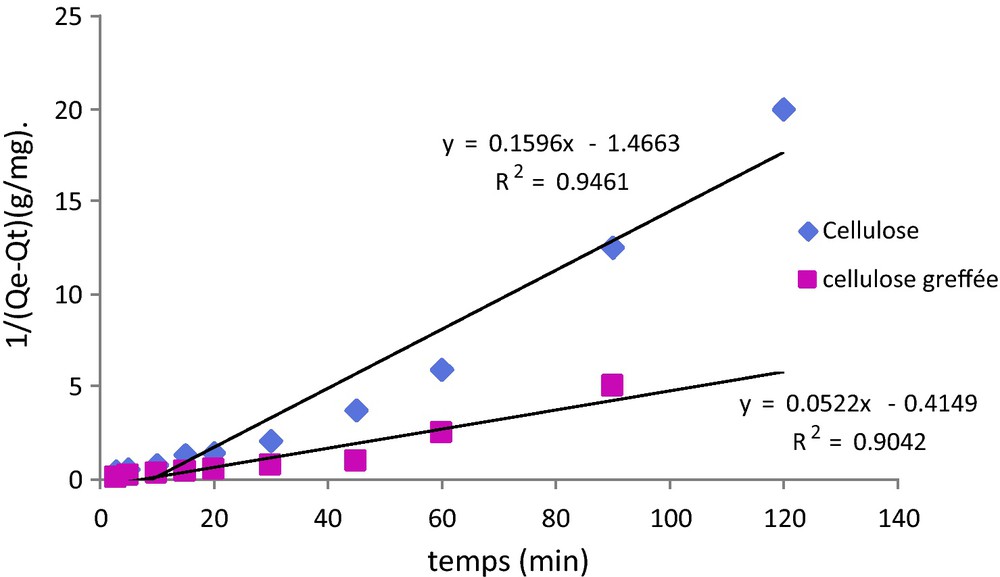
Détermination de la constante de vitesse pour un modèle cinétique du second ordre.
Avec, dans tous les cas : Qe : quantité adsorbée à l’équilibre (mg/g), Qt : quantité adsorbée au temps t (mg/g), t : temps de contact (min).
Si, pour les trois modèles (Fig. 6, 7 et 8), on obtient bien des droites, les coefficients de corrélation mettent en évidence que le modèle le plus adapté pour décrire l’adsorption du plomb sur les deux substrats étudiés est le modèle du pseudo second ordre. Dans ce cas en effet, on obtient des coefficients de corrélation très proches de 1 (R2 = 0,999). Ces résultats sont en bon accord avec ceux de la littérature qui indiquent que l’adsorption du plomb sur des substrats cellulosiques suit une loi de type pseudo second ordre [39–41].
3.2.2 Isothermes d’adsorption et modélisation
Les isothermes d’adsorption du plomb sur les deux supports cellulosiques sont obtenues par la représentation graphique de la variation de la quantité de Pb2+ adsorbée par le substrat (Qe) en fonction de la concentration de Pb2+ résiduelle à l’équilibre (Ce) à 25 °C. La durée de mise en contact plomb-adsorbant a été fixée à deux heures, temps au-delà duquel on est totalement assuré qu’il n’y a plus de variation de la concentration de Pb2+.
La Fig. 9 représente les isothermes obtenues pour les deux substrats. Quel que soit le support, nous observons que les deux courbes ont la même allure : la quantité adsorbée en Pb2+ augmente rapidement, puis plus lentement pour atteindre un plateau. La croissance observée à basse concentration est nettement plus rapide pour la cellulose greffée. Les isothermes montrent que l’on arrive à saturation pour une concentration de 152 mg/L pour la cellulose contre seulement 109 mg/L pour la cellulose greffée. Cela met en évidence une bonne aptitude de la cellulose greffée à épurer des eaux peu chargées en plomb. Par ailleurs, le greffage augmente la capacité d’adsorption du substrat d’un facteur 4 puisqu’elle passe de 5,2 mg/g pour la cellulose à 22,7 mg/g pour le support modifié. Ces valeurs sont comparables à ce qui peut être trouvé dans la littérature dans des conditions expérimentales similaires aux nôtres [40].
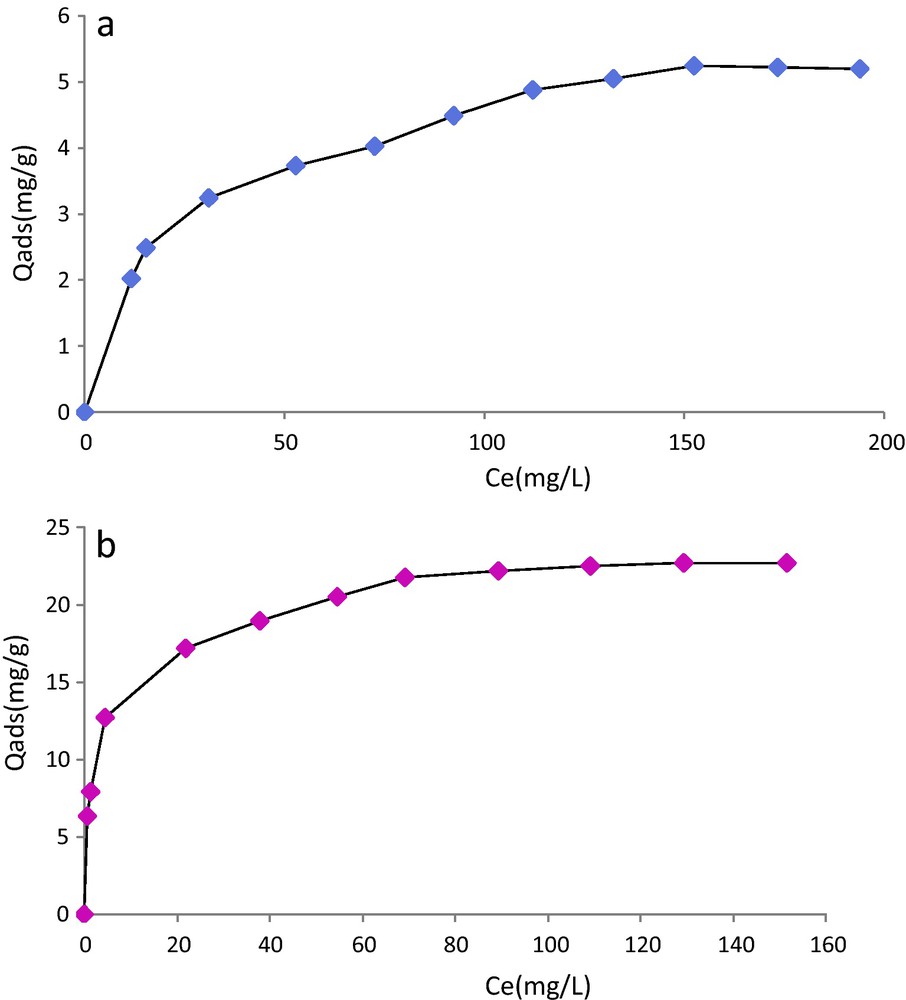
Quantité de Pb2+ adsorbée en (mg/g) sur (a) la cellulose et (b) la cellulose modifiée.
Pour comprendre précisément les mécanismes mis en jeu au cours de l’adsorption de Pb2+ sur nos substrats, nous avons cherché à modéliser les isothermes d’adsorption en appliquant les deux modèles les plus couramment utilisés : Langmuir et Freundlich. Le modèle de Langmuir est basé sur l’hypothèse que la surface est uniforme avec une absence d’interactions entre les molécules adsorbées et qu’elle possède des sites définis d’adsorption [42]. Ce modèle considère que l’adsorption s’opère par la formation d’une monocouche d’adsorbat et conduit à l’équation suivante :
| (5) |
avec : Qm : Capacité maximale adsorbée (mg/g), KL : constante d’équilibre caractéristique de l’adsorbant (L/mg), dépendante de la température et des conditions expérimentales, Ce : concentration de l’adsorbat à l’équilibre (mg/L). La linéarisation de l’équation (5) conduit à:
| (6) |
En traçant Ce/Qe en fonction de Ce, on obtient une droite de pente 1/Qm et d’ordonnée à l’origine 1/KL.Qm.
Le modèle de Freundlich est basé sur une équation empirique qui traduit une variation des énergies d’adsorption avec la quantité adsorbée. Cette distribution s’explique par une hétérogénéité des sites d’adsorption. Contrairement au modèle de Langmuir, l’équation de Freundlich ne prévoit pas de limite supérieure à l’adsorption ce qui restreint son application aux solutions diluées. En revanche, ce modèle admet l’existence d’interactions entre les molécules adsorbées [43]. L’équation de Freundlich est donnée par la formule suivante :
| (7) |
| (8) |
En traçant log(Qe) en fonction de log(Ce), on obtient une droite de pente 1/n et d’ordonnée à l’origine logKF.
Les résultats obtenus avec ces deux modèles pour la cellulose et la cellulose modifiée sont représentés sur les Fig. 10 et 11. Les courbes théoriques sont également portées sur les graphes qui donnent les points expérimentaux. Nous pouvons noter que le modèle de Freundlich n’est pas adapté pour modéliser l’adsorption de Pb2+ sur les deux substrats étudiés. En revanche, le modèle de Langmuir s’applique bien aux résultats expérimentaux obtenus pour les deux supports et cela sur toute la gamme de concentration. Pour les deux supports, il semble que le modèle de Langmuir soit le plus représentatif du mécanisme d’adsorption avec des coefficients de corrélation supérieurs à 0,99. Globalement, il semble donc que l’adsorption du Pb2+se fasse par monocouche sur des sites d’énergie identiques. Ces résultats sont en bon accord avec ceux de la littérature puisque de nombreuses recherches menées sur l’adsorption des cations métalliques sur différents types de supports cellulosiques ont conduit aux mêmes conclusions [44,45].
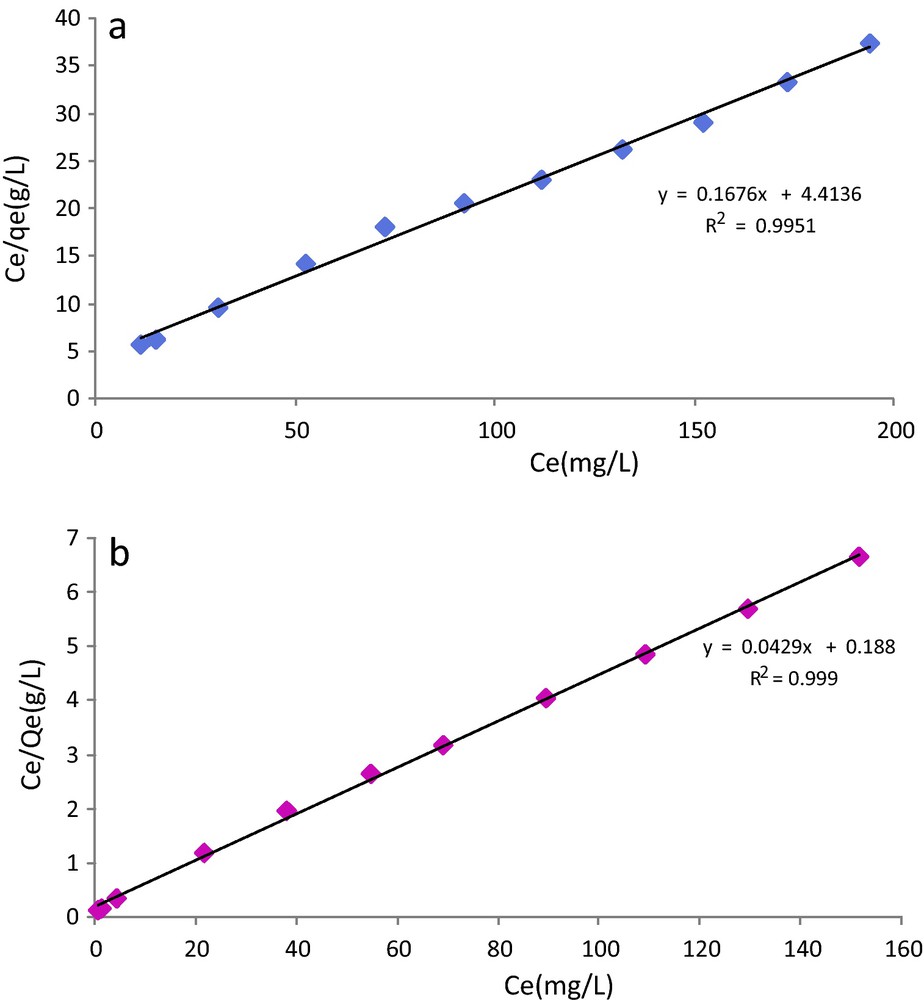
Modèles d’adsorption de Pb2+ selon Langmuir sur (a) la cellulose et (b) la cellulose greffée.
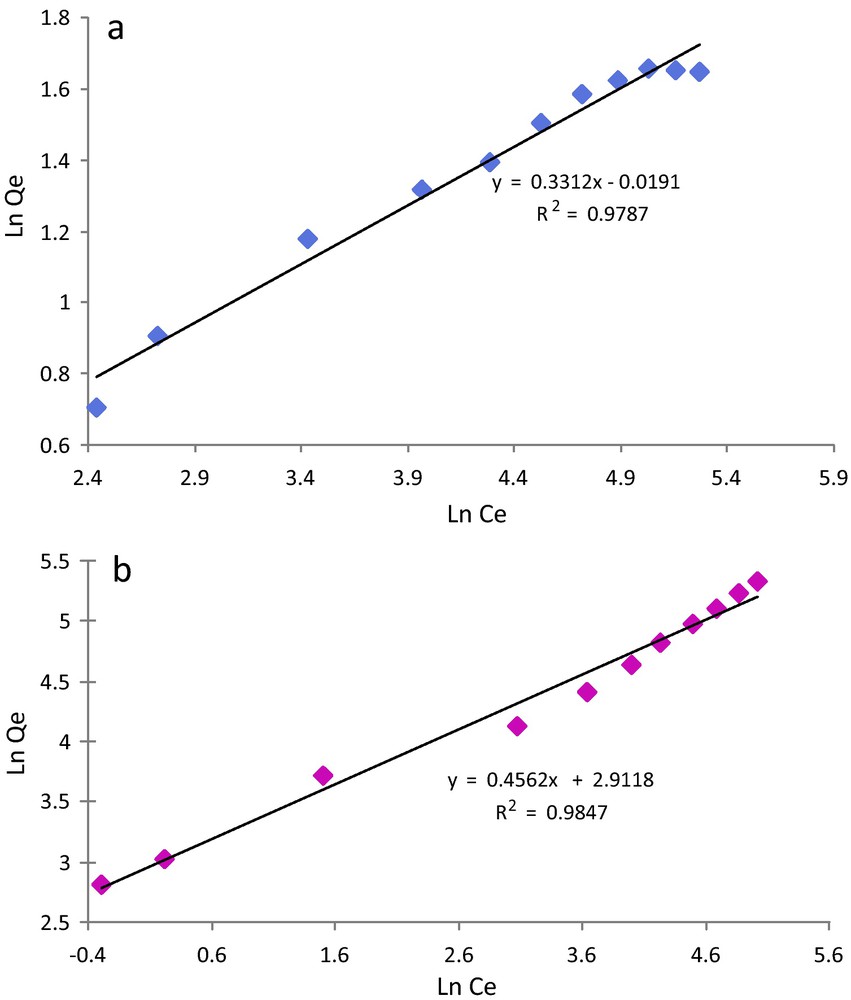
Modèles d’adsorption de Pb2+ selon Frendlich sur (a) la cellulose et (b) la cellulose greffée.
3.2.3 Détermination des paramètres thermodynamiques
La constante d’équilibre de l’adsorption du Pb2+ sur le substrat est donnée par la relation :
| (9) |
Cette constante Kc est reliée à l’enthalpie libre de la réaction (ΔG°) et donc à l’enthalpie ΔH° et l’entropie ΔS° standard d’adsorption soit :
ΔG° = ΔH° − TΔS° = − R.T.Ln(Kc).
Il vient :
Ln(Kc) = − ΔH°/RT + ΔS°/R.
On peut accéder à ΔH° et ΔS° en portant Ln(Kc) en fonction de 1/T. Les résultats obtenus sont présentés dans le Tableau 2.
Grandeurs thermodynamiques associées à l’adsorption.
| Support | ΔH° (kJ mol−1) | ΔS° (J mol−1K−1) | ΔG° (kJ mol−1) à 25 °C |
| Cellulose | 2,447 | −1,79 | 3,081 |
| Cellulose modifiée | −27,417 | −69,09 | −6,829 |
Sur la cellulose modifiée, la valeur négative de l’enthalpie libre ΔG° indique que le processus d’adsorption est de nature spontanée ce qui suggère qu’il est favorable à basse température. Pour ce substrat, la valeur de l’enthalpie standard est négative, ce qui montre que le processus est exothermique. Une élévation de la température va donc dans le sens d’une quantité maximale adsorbée Qm plus faible. L’augmentation de la température entraîne une diminution des interactions ioniques entre le cycle pyridinique riche en électrons et le cation métallique. Si cet effet de température est défavorable quant à l’adsorption, il permet de valoriser le média adsorbant. En effet, un lavage à chaud du substrat saturé permettrait la désorption du cation et donc sa possible réutilisation.
La valeur de ΔH°, voisine de −27,5 kJ mol−1 montre que les interactions entre support et adsorbat sont fortes et que l’adsorption n’est pas limitée par l’étape diffusionnelle. Le signe négatif de ΔS° est en bon accord avec le mécanisme d’adsorption puisque l’on passe d’un état aléatoire (cation métallique en solution) à un état ordonné (cation en interaction avec le substrat).
Dans le cas de la cellulose, le processus d’adsorption est endothermique, ce qui va dans le sens d’une augmentation des quantités adsorbées avec la température. Des variations d’enthalpie positives ont par ailleurs déjà été observées sur des systèmes comparables aux nôtres et pourraient être corrélées à des modifications structurales [46]. Sans vouloir aller trop loin dans l’interprétation, on pourrait supposer un gonflement de la cellulose et une légère oxydation par l’oxygène de l’air pendant la réaction. Ce point mériterait d’être exploré plus avant. La valeur de l’enthalpie montre que les interactions ici sont plus faibles que dans le cas de la cellulose greffée. Quant à la valeur de la variation d’entropie, elle montre que l’on passe d’un état désordonné à un état sensiblement plus ordonné ce qui est en bon accord avec un mécanisme d’adsorption.
4 Conclusions
Au cours de cette étude, nous avons pu montrer par l’utilisation de différentes techniques (spectroscopie infrarouge, microscopie électronique à balayage, analyse élémentaire et analyse thermogravimétrique) que dans les conditions opératoires choisies, il est possible de greffer la cellulose par le PCCC. Le support obtenu est plus efficace dans le piégeage du plomb en solution aqueuse que ne l’est la cellulose. Par exemple, une fois l’équilibre atteint soit t > 60 minutes, la capacité d’adsorption de ce support est estimée à 14,5 mg de plomb par gramme de solide dans le cas d’une solution initialement à 2 × 10−4 mol.L−1. Une étude approfondie a permis de mettre en évidence que la loi cinétique du pseudo second ordre décrit correctement le processus. Les résultats obtenus montrent que les quantités adsorbées dépendent de la concentration initiale en colorant et que l’adsorption suit une loi de type Langmuir. L’analyse thermodynamique a mis en évidence que l’adsorption est spontanée et exothermique sur cette cellulose modifiée. Une élévation de température favorise donc la désorption du cation ce qui ouvre des perspectives de recyclage intéressantes pour l’avenir. C’est dans cette optique que s’inscrivent les travaux futurs qui s’orientent vers la possibilité de réutiliser le support après désorption par lavage à chaud. En outre, le support synthétisé sera aussi testé pour piéger des cations issus d’autres métaux lourds.
Conflit d’intérêt
Aucun conflit d’intérêt à signaler.


