1. Introduction
Les huiles essentielles (HE) sont composées de monoterpènes, diterpènes, sesquiterpènes ou de leurs dérivés oxygénés, ces molécules sont majoritairement présentes dans la nature sous une forme stéréochimique unique [1, 2]. Cette spécificité structurale impacte considérablement leur comportement chimique, leurs activités biologiques et pharmacologiques [3].
A l’instar des nouveaux médicaments où la chiralité des molécules occupe un rôle de premier plan dans leur développement [4], le profil énantiomérique d’une HE représente la distribution en énantiomères des molécules chirales qui la compose, c’est une identification unique qui permet une meilleure visibilité sur son espèce, son origine et son authenticité. Cette signature chirale naturelle fournit des indications précieuses sur la diversité énantiomérique au sein d’une même espèce dans son biotope.
Le limonène est un hydrocarbure terpénique dénommé le 1-méthyl-4-(prop-1-èn-2-yl)cyclohexène (C10H16). C’est un monoterpène monocyclique parmi les plus abondants dans le règne végétal [5]. Composant principal d’un grand nombre d’HE, il est retrouvé dans plus de 300 HE, et principalement, dans la famille des Citrus spp. (30–98 %) [6, 7], ce sont les fruits les plus cultivés dans le monde à des fins industrielles [8], notamment pour le marché des saveurs et parfums [9]. Sa production mondiale progresse à un rythme rapide et devrait atteindre un taux de croissance annuel composé de 4.9 % pour la période 2022–2029 [10].
Le limonène se présente sous forme de deux isomères optiques, les formes dextrogyre (d) et lévogyre (l) ou sa forme racémique, mélange des deux 50/50 [11, 12, 13]. Le d-limonène ou (R)-(+)-limonène, issu des huiles essentielles d’agrumes, est un liquide incolore aux propriétés agréables et caractéristiques. Il constitue une matière première dont la valorisation intéresse de nombreux domaines: alimentaire, pharmaceutique, cosmétique, fabrication de plastiques, ou encore comme solvant d’extraction biosourcé [14]. Une transition vers des technologies plus vertes utilise aussi le limonène pour la conservation des aliments en substitution aux antioxydants synthétiques [7]. Par ailleurs, l’approche par synthèse microbienne du limonène offre une alternative pour l’approvisionnement durable en limonène et dérivés [15].
Cet article présente une mise au point sur la diversité chirale du limonène et la spécificité de ses énantiomères dans les HE. Pour la première fois, le profil stéréochimique naturel de cette molécule est répertorié pour 54 HE diverses et variées. Ces résultats sont issus des nombreux travaux de recherche fondamentale disponibles, ils ont été sélectionnés, analysés, et exploités. L’importance de cette différenciation énantiomérique sur l’activité biologique et pharmacologique est évoquée avec une actualisation importante des propriétés olfactives des énantiomères du limonène [16].
2. Le limonène, une molécule, deux énantiomères
La molécule de limonène possède un carbone asymétrique (C∗) et existe sous deux formes énantiomères, images l’une de l’autre dans un miroir (Figure 1).
Les énantiomères du limonène.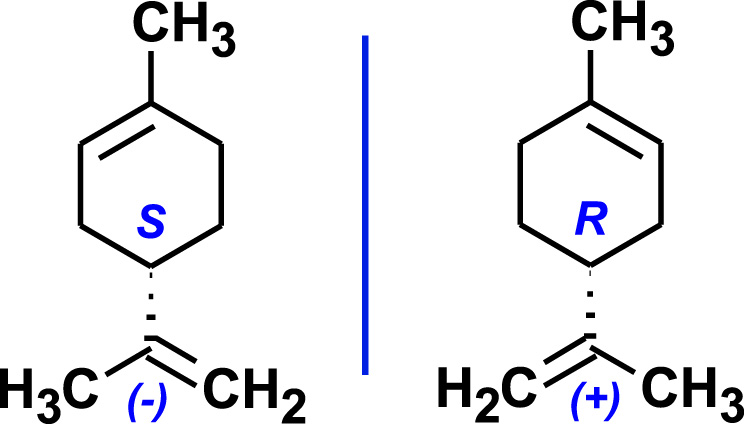
- Le R-(+)-limonène (dextrogyre) dévie à droite le plan de la lumière polarisée, cette forme énantiomère est présente dans de nombreux agrumes. Son pouvoir rotatoire spécifique est .
- Le S-(−)-limonène (lévogyre) dévie le plan de polarisation vers la gauche, cette forme énantiomère est retrouvée dans la menthe verte, le pin et la térébenthine. Son pouvoir rotatoire spécifique est .
- Le mélange racémique (50/50) du (R,S)-limonène est le dipentène.
- Le limonène naturel (R-(+)-limonène) est souvent appelé D-Limonène, une notation ambigüe, très spécifique. La nomenclature D ou L utilisée par E. Fischer vers la fin du dix-neuvième siècle concerne uniquement les sucres et les acides aminés. Les deux stéréo descripteurs conventionnels sont (R)/(S), ils sont suivis du signe du pouvoir rotatoire (+)/(−). Ces deux stéréo descripteurs sont totalement indépendants car il n’existe aucune relation entre la configuration absolue et l’action sur la lumière polarisée d’une molécule. Les écritures en minuscule, (d: dextrogyre) et (l: lévogyre) correspondent respectivement aux signes (+) et (−).
Le limonène, molécule non toxique, liquide faiblement inflammable, non explosive à l’échelle industrielle, est un important débouché comme solvant industriel apolaire. C’est un substitut chimique vert des dérivés du pétrole ou des solvants halogénés, il est récupéré comme nettoyant et dégraissant mais également utilisé en synthèse comme précurseur de p-cymène carvone [17, 18, 19, 20] (Figure 2). Ces dernières années, cette molécule a fait l’objet de nouvelles applications médicinales et alimentaires émergentes, avec essentiellement le R-(+)-limonène, produit secondaire de l’industrie des agrumes. Plusieurs exemples sont cités et les activités biologiques des deux énantiomères comparées.
Transformation du limonène.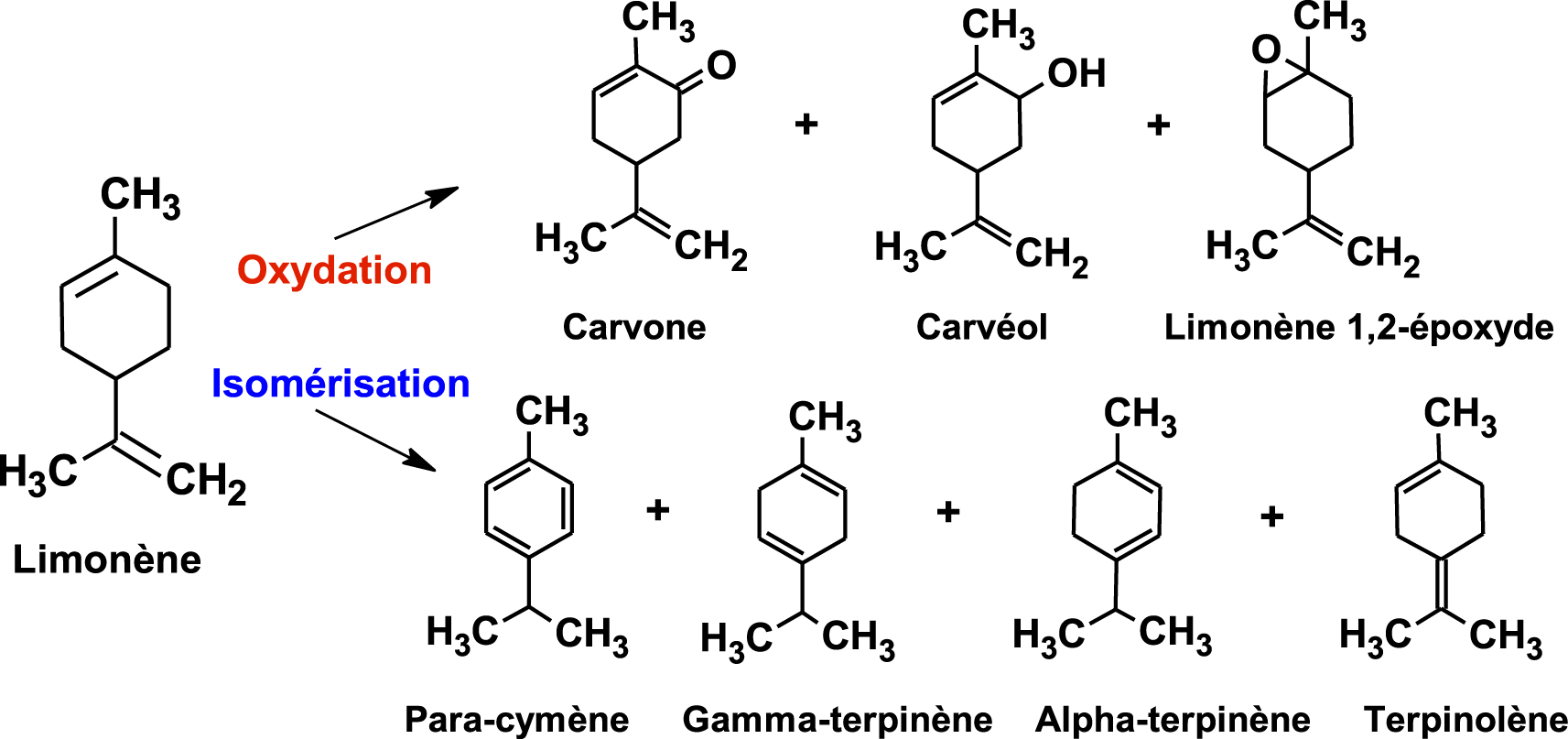
2.1. Enantiomères du limonène et reconnaissance chirale
La chiralité moléculaire est un élément de reconnaissance fondamental inhérent à tous les systèmes vivants, en particulier, aux molécules d’intérêt biologique (polypeptides, enzymes, stéroïdes, prostaglandines, etc.). Les énantiomères majoritaires des molécules principales des HE contribuent à clarifier l’action thérapeutique, pour lesquels la reconnaissance avec un substrat se fait sur la base du modèle clef-serrure [21].
Les acides aminés, briques élémentaires des protéines, sont des récepteurs biologiques qui interagissent avec les molécules chirales, on parle alors de « reconnaissance chirale ». Cette affinité est basée sur un minimum de trois sites d’interaction entre le soluté et le récepteur qui sélectionnera le seul énantiomère ayant la complémentarité satisfaisante (l’eutomère). L’autre énantiomère étant inactif, il ne peut interagir avec le récepteur (le distomère). La Figure 3 montre les interactions entre énantiomères et site de liaison, on constate l’absence d’alignement aux sites A, B, C pour l’énantiomère inactif. La structure tridimensionnelle permet à l’énantiomère actif de se lier et d’avoir un effet biologique, contrairement à l’énantiomère inactif.
Reconnaissance chirale.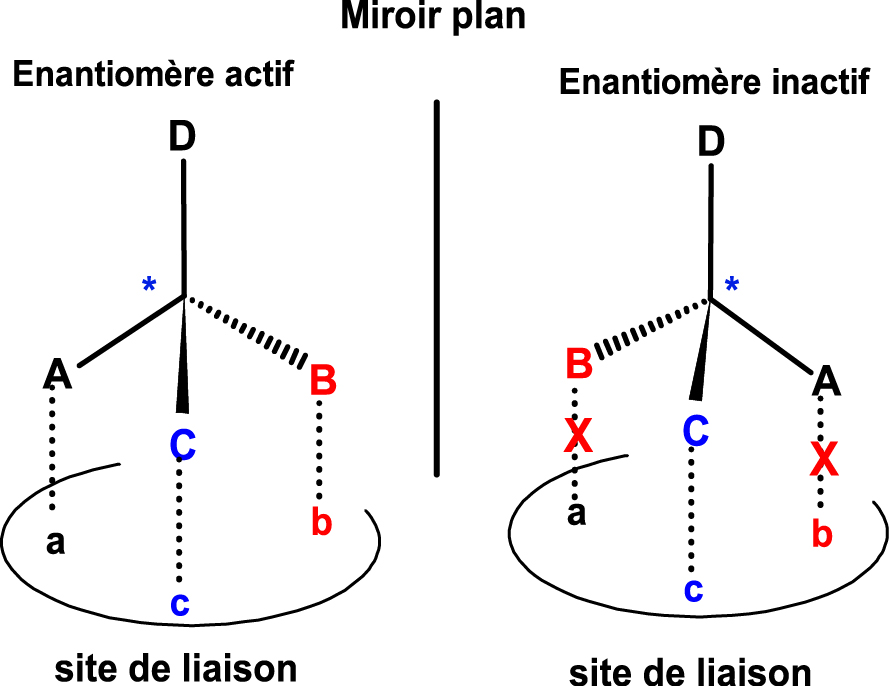
Les énantiomères d’une molécule chirale peuvent avoir des propriétés pharmacodynamiques et pharmacocinétiques très différentes. L’impact de l’énantiosélectivité sur la pharmacocinétique des médicaments chiraux est significatif, en particulier sur le profil métabolique qui peut entraîner une toxicité de l’énantiomère liée aux interactions avec les enzymes et les protéines [22].
2.2. Chiralité et odeur
L’apport du profil énantiomérique des molécules est important à plusieurs titres, notamment pour le contrôle de l’authenticité des HE, la composition des fragrances et des parfums mais aussi celle des denrées alimentaires [23]. La détermination du ratio énantiomérique de substances présentes dans les sources d’arômes est un élément permettant d’obtenir des indices quant à la conformité réglementaire [24].
La perception des odeurs est un processus complexe et de nombreux éléments impactent fortement le ressenti. Les techniques utilisées pour la mesure d’odeurs tiennent compte du langage, de la mémoire et des émotions. De par sa composition moléculaire l’épithélium olfactif est chiral et différencie parfaitement les énantiomères des molécules. La liaison entre la molécule odorante chirale et le récepteur chiral déclenche la série d’événements moléculaires à l’origine de la reconnaissance par le cerveau de l’odeur caractéristique. Ces différences s’expriment soit par la qualité de l’odeur, en provoquant des sensations olfactives différentes, soit par l’intensité de l’odeur, un critère qualitatif qui peut être décrit par la valeur du seuil olfactif [25].
2.2.1. Enantiomères du limonène et odeur
Depuis des décennies, l’odeur du (S)-(−)-limonène est associé aux citrons et celle du (R)-(+)-limonène aux oranges. Cette information qui a été rapportée par de nombreux ouvrages de chimie organique, des centaines de publications et de nombreux contenus pédagogiques vient d’être récemment démentie [16]. Les résultats confirment qu’il n’y a pratiquement pas de (S)-(−)-limonène dans les citrons et que cet énantiomère ne transmet pas l’odeur de citron. Ils montrent que l’HE d’orange se compose principalement de (R)-(+)-limonène qui n’a pas l’odeur de l’orange, même si, parmi la centaine de composants mineurs (<2 %) figurent des molécules qui évoquent l’odeur de l’orange dont le citral, le néral, et le géranial qui contribue à l’odeur de citron. Par ailleurs, une contamination induite par des traces d’impuretés est toujours possible, sachant qu’avec les techniques d’analyses récentes la précision est bien meilleure.
L’origine de l’attribution de l’odeur d’orange au (R)-(+)-limonène et de celle du citron au (S)-(−)-limonène provient de travaux de 1971, repris depuis de nombreuses années dans les ouvrages pédagogiques et les publications [26, 27, 28], et cela, malgré le fait établi que les agrumes sont composés très majoritairement de (R)-(+)-limonène [29, 30]. D’autres sources, moins tranchées, associaient aussi l’odeur du (R)-(+)-limonène à la fois aux odeurs de citron et/ou d’orange et celle du (S)-(−)-limonène aux pins [31] et aux cônes de sapins [32]. Si l’on se réfère à d’autres travaux [26, 33], l’énantiomère (R)-(+)-limonène est décrit comme ayant une odeur d’agrumes frais, ressemblant à l’orange avec un seuil olfactif de 200 ppm et que l’énantiomère (S)-(−)-limonène est semblable à la térébenthine avec une note citronnée et un seuil olfactif plus important de 500 ppm.
3. Quel limonène pour quelle huile essentielle dans la nature ?
L’action d’une l’HE recueillie dans son intégralité s’avère souvent plus importante et peut différer de celle de ses principes actifs pris isolément, néanmoins, l’activité biochimique de ses molécules principales étudiées individuellement contribuent à clarifier l’action thérapeutique notamment selon les énantiomères majoritaires.
Dans le règne végétal, le limonène est omniprésent sous ses deux formes énantiomériques. Le principal métabolite des écorces d’agrumes est la forme (R)-(+)-limonène avec une pureté énantiomérique élevée [34]. La forme (S)-(−)-limonène est identifiée dans l’HE de citronnelle de ceylan Cymbopogon nardus L., celle de la menthe verte Mentha spicata L. ou celle du pin maritime Pinus pinaster plus communément appelée Térébenthine. Très étudié dans la littérature, l’énantiomère (R)-(+)-limonène est décrit comme étant plus actif et la majorité des activités biologiques lui sont attribuées [35]. Dans les HE, l’attribution des énantiomères du limonène est généralement limitée aux (R)-(+)-dans les fruits/agrumes et le (S)-(−)-limonène est plutôt identifié dans les huiles de pin, de térébenthine ou encore de menthe. Dans cet article, les données de la littérature ont été exploitées pour identifier la diversité énantiomérique du limonène dans plusieurs HE. L’impact de leur forme énantiomère sur l’activité biologique a été également examiné. Les Tableaux 1 et 2 réunissent 54 HE composées entre 0,3–99,7 % de limonène, certaines sont naturellement enrichies par l’énantiomère dextrogyre (R)-(+), d’autres par le lévogyre (S)-(−)-, et parfois, on peut trouver les deux énantiomères en proportion presque égales.
L’énantiotype (R)-(+)-limonène dans les HE
| Huile essentielle | Nom latin | Limonène | Enantiomère (R)-(+)-limonène | |
|---|---|---|---|---|
| % | % | Ref | ||
| Anis hysope | Agastache foeniculum | 13,5 | 98,8 | [36] |
| Menthe-réglisse coréenne | Agastache rugosa | 8–10 | 99,7 | [36] |
| Aneth | Anethum graveolens ou sowa | 25–55 | 70–99 | [37] |
| Céleri | Apium graveolens | 75,9 | 98,9 | [38] |
| Carvi | Carum carvi L. | 38–50 | 68–99 | [39, 40] |
| Petit citron vert | Citrus aurantifolia | 47,8–51,1 | 97 | [41] |
| Orange amère | Citrus aurantium L. var. amara fruits | 91–96 | >99 | [42 ] |
| Petit grain bigarade | Citrus aurantium ssp. amara feuilles | 93–96 | 93 | [43] |
| Néroli | Citrus aurantium var. amara fleurs | 6–11 | 97–98 | [42] |
| Bergamote | Citrus bergamia | 23–54 | 98 | [41] |
| Mandarine | Citrus deliciosa Ten | 65–77 | 97–98 | [41] |
| Yuzu | Citrus junos | 22 | 90,5 | [44] |
| Grand citron vert | Citrus latifolia | 50,5 | 96,6 | [41] |
| Citron | Citrus limon peel | 59,5–71,8 | 98–99 | [41] |
| Pamplemousse | Citrus paradisi | 90–97 | 99,7 | [45] |
| Orange douce | Citrus sinensis L. | 91–96 | 99,5 | [41] |
| Coriandre | Coriandrum sativum | 1,7–2,4 | 54 | [46] |
| Eucalyptus globulus | Eucalyptus globulus Labill. | 2–11 | 73,6 | [47] |
| Genévrier | Juniperus communis L. | 4,3 | 77,9 | [48] |
| Lavande fine | Lavandula angustifolia | <1 | >95 | [49 , 50 ] |
| Lavande aspic | Lavandula latifolia | 0,5–3 | 95 | [42] |
| Mélisse de calme | Lippia alba (Mill.) N.E. Brown | 2,9 | 95,4 | [51] |
| Niaouli | Melaleuca quinquenervia | 5–10 | 58 | [52] |
| Menthe poivrée | Mentha x piperita | 1,8–2,8 | 95 | [36] |
| Myrte verte | Myrtus communis CT 1,8-cinéole | 10–28 | 100 | [53] |
| Origan | Origanum vulgare | 0,3 | 95 | [54] |
| Épicéa commun | Picea abies L. | 13,4 | 91,3 | [55] |
| Pin d’Alep | Pinus halepensis | 10,1 | 94,5 | [56] |
| Pin sylvestre | Pinus sylvestris | 15,3 | 95 | [55] |
| Thym | Thymus vulgaris | <6 | >80 | [57 ] |
L’énantiotype (S)-(−)-limonène dans les HE
| Huile essentielle | Nom latin | Limonène | Enantiomère (S)-(−)-limonène | |
|---|---|---|---|---|
| % | % | Ref | ||
| Sapin pectiné ou argenté | Abies alba | 10–73 | 94–97 | [58] |
| Sapin baumier | Abies balsamea | 11,9–23,3 | 97,5 | [59] |
| Sapin blanc du colorado | Abies concolor (Gordon) Lindl. | 5,4–6,9 | 89,8 | [59] |
| Sapin noble | Abies procera | 44 | 100 | [60] |
| Encens | Boswellia carterii B | 10 | 84,8 | [61] |
| Chanvre | Cannabis sativa L. | 10,9 | 86–92 | [62] |
| Cèdre de l’Atlas | Cedrus atlantica | 11,3 | 70,4 | [56] |
| Cyprès de Leyland | Cupressocyparis Leylandii | 15,6 | 98 | [55, 63] |
| Curcuma sauvage | Curcuma aromatica | 0,6–1 | 80.8 | [64] |
| Lemongrass | Cymbopogon citratus | 93 | 100 | [29] |
| Citronnelle de Ceylan | Cymbopogon nardus L. | 96,6 | 96 | [29] |
| Citronnelle de Java | Cymbopogon Winterianus | 3 | 87 | [65] |
| Menthe citronnée | Mentha piperita var. citrata | 8,2–9,7 | 70,5 | [36] |
| Menthe verte | Mentha spicata L. | 12–25 | 98,8 | [42] |
| Pin cembro | Pinus cembra | 32,7 | 100 | [66] |
| Pin tordu | Pinus contorta subsp. murrayana leaf | 2,2 | 100 | [60] |
| Pin des montagnes | Pinus montana | 27–39 | 25–73 | [66] |
| Pin noir | Pinus nigra | 4,2 | 76,2 | [66] |
| Pin maritime (Térébenthine) | Pinus pinaster | 1–7 | 82,2 | [66] |
| Poivre Noir | Piper nigrum | 4,4–18,7 | 60,7 | [67] |
| Lentisque pistachier | Pistacia lentiscus L. | 7–8 | 73 | [68] |
| Romarin | Rosmarinus officinalis CT ABV∗ | <5 | 100 | [69 ] |
| Pruche de l’Ouest | Tsuga heterophylla | 1,1 | 100 | [60] |
| Poivrier de Sancho | Zanthoxylum schinifolium | 1,5 | 83,9 | [70] |
∗ABV: Acétate de Bornyle et Verbénone. AM: acétate de myrtényle.
Le Tableau 1 réuni les HE riches en (R)-(+)-limonène, il compose 93–99,5 % des citrus dont c’est, généralement, le composant majoritaire (6–96 %). L’HE de céleri (Apium graveolens) est composée de 75,9 % de limonène avec 98,9 % d’énantiomère (R)-(+)-. Celles d’Anis hysope (Agastache foeniculum) ou de menthe réglisse coréenne (Agastache rugosa), sont très riches en (R)-(+)-limonène (98,8–99,7 %) (8,0–13,5 % d’HE). Pour le carvi (Carum carvi L.), l’énantiomère (R)-(+)-limonène est majoritaire mais sa sélectivité varie, selon son origine, entre 68–99 %. Avec un pourcentage de limonène entre 10–28 %, l’HE de Myrte verte (Myrtus communis CT 1,8-cinéole) est composée à 100 % d’énantiomère dextrogyre.
D’autres HE, composées entre 0,5–11 % de limonène, sont majoritaires en énantiomère (R)-(+)- tels que: la lavande fine (Lavandula angustifolia) (>95 %), la lavande aspic (Lavandula latifolia) (95 %), la mélisse de calme (Lippia alba (Mill.) N.E. Brown) (95,4 %), l’Origan (Origanum vulgare) (95 %), le thym (Thymus vulgaris) (>80 %), le genévrier (Juniperus communis L.) (77,9 %) ou l’HE d’Eucalyptus globulus (Eucalyptus globulus Labill.) (73,6 %). Pour les conifères, composés entre 10,0–15,1 % de limonène, l’énantiomère (R)-(+)- est majoritaire pour les HE d’Épicéa commun (Picea abies L.) (91,3 %), de Pin d’Alep (Pinus halepensis) (94,5 %) et de Pin sylvestre (Pinus sylvestris) (95 %). Pour le coriandre (Coriandrum sativum) et le niaouli (Melaleuca quinquenervia), la composition en limonène varie entre 3–10 % avec un énantiomère (R)-(+)- en très léger excès 54–58 % pour ces deux HE.
Dans les HE du Tableau 2, l’énantiomère (S)-(−)-limonène est majoritaire, entre 96–100 % dans les HE de citronnelle de ceylan [29, 71, 72, 73] (Cymbopogon nardus L.) (96,6 % d’HE) et de lemongras (Cymbopogon citratus) (93 % d’HE). Il est retrouvé à 87 % dans la citronnelle de java (Cymbopogon Winterianus) (3 % d’HE).
Le (S)-(−)-limonène est retrouvé entre 89,9–100 % dans la famille des sapins (Abies alba, Abies balsamea, Abies concolor (Gordon) Lindl, Abies procera), (5,4–73,0 % de l’HE). Dans la famille des pins, le (S)-(−)-limonène est retrouvé à 100 % dans le pin cembra (Pinus cembra) et dans le pin tordu (Pinus contorta subsp. murrayana leaf), pour respectivement 32,7 et 2,2 % dans l’HE. C’est également l’énantiomère majoritaire à 70,4 % du Cèdre de l’Atlas Cedrus atlantica et à 98 % du Cyprès de Leyland (Cupressocyparis Leylandii), le limonène composant 11,3 et 15,6 % de leurs HE respectives.
Le (S)-(−)-limonène est présent à 84,8 % dans les HE d’Encens Boswellia carterii B (10 % d’HE), 86–92 %, le Chanvre Cannabis sativa L. (10,9 % d’HE) et à 80.8 % dans le Curcuma sauvage Curcuma aromatica (0,6–1 % d’HE). L’énantiomère lévogyre est présent à 76,6 % dans les HE de pin noir (Pinus nigra) et à 82,2 % dans le pin maritime (Pinus pinaster) pour 1–7 % de limonène. Pour l’HE de pin des montagnes (Pinus montana), le limonène est un composant important (27–39 %) mais selon le biotope, l’énantiomère (S)-(−)- fluctue entre 25–73 %.
Dans la famille des menthes, le (S)-(−)-limonène compose 98,8 % (12–25 %) de l’HE de menthe verte (Mentha spicata L.) et 70,5 % (8,2–9,7 %) de la menthe bergamote (Mentha piperita var. citrata), alors que l’HE de Menthe poivrée (Mentha x piperita), c’est 95 % d’énantiomère (R)-(+)-limonène (5–10 %).
Les HE de romarin Rosmarinus officinalis CT ABV et de pruche de l’ouest Tsuga heterophylla sont exclusivement composées d’énantiomère (S)-(−)- (100 %) (<5 % de l’HE). Dans l’HE de poivre noir Piper nigrum le (S)-(−)-limonène est majoritaire à 60,7 % (4,4–18,7 % de l’HE) et dans l’HE de lentisque pistachier Pistacia lentiscus L., c’est 73 % de (S)-(−)- (7–8 % d’HE). Le poivrier de Sancho, un poivre raffiné de la cuisine japonaise au parfum d’agrumes et de citronnelle est composé à 83,9 % de l’énantiomère (S)-(−)-limonène.
4. Effets biologiques et toxicologiques des énantiomères du limonène
Les travaux de recherche sur les bienfaits du limonène naturel sont souvent associés à l’énantiomère (R)-(+)-limonène issu de la famille des citrus. Les études les plus significatives pour cet énantiomère sont présentées et comparées avec l’énantiomère (S)-(−)-limonène, moins décrit, peu exploité, même s’il constitue une source naturelle importante.
4.1. Le (R)-(+)-limonène « naturel » issu des citrus
Les études cliniques et précliniques montrent que la consommation de terpènes déclenche des effets biologiques bénéfiques et constitue une alternative dans le traitement de plusieurs maladies. L’utilisation du (R)-(+)-limonène, seul ou en association avec d’autres médicaments, est ciblé par de nombreux travaux de recherche innovants dans le développement d’une médecine naturelle pour l’amélioration de la santé [74].
Les études expérimentales avec des preuves in vivo, in vitro et épidémiologiques démontrent que le limonène a le potentiel de ralentir la neurodégénérescence liée à l’âge, aide à préserver les fonctions cognitives et a maintenir l’intégrité neuronale [75]. Elles suggèrent que le limonène et les produits végétaux contenant du limonène peuvent constituer des thérapies alternatives aux médicaments actuels et réduire leurs effets indésirables. D’ailleurs, l’HE de citron, composée majoritairement de (R)-(+)-limonène induit des effets anxiolytiques et hypnotiques-sédatifs. L’inhalation d’huile d’orange douce (Citrus sinensis) réduit le niveau d’anxiété et améliore l’humeur des malades chez les dentistes [76].
Le (R)-(+)-limonène a un rôle précieux dans la prévention de plusieurs maladies chroniques et dégénératives [77]. Les études rapportent de nombreux effets thérapeutiques, notamment anticancéreux [78], gastroprotecteur, cicatrisant de l’ulcère gastrique [79], antioxydant [80], anti-inflammatoire [81], et également l’amélioration de la fonction pulmonaire [82]. Il est prometteur pour la recherche anti-SARS-CoV-2 via les HE de citron vert et d’orange pour sa grande affinité nucléophile, sa bonne absorption, l’absence de fragments mutagènes et cytotoxiques dans la molécule qui permet d’inactiver ou de réduire la charge virale [83].
Le (R)-(+)-limonène constitue une excellente source alimentaire pour la prévention du cancer [84]. Plusieurs modes d’activité anticancéreuse ont été observés, y compris la chimio prévention [85]. Il a des effets anti-inflammatoires dans les modèles de l’arthrose [86] et de l’asthme [87, 88]. Le limonène est métabolisé en alcool périllique ou hydroxy-7 paramenthadiène 1-8 (C10H16O), qui fait également l’objet de nombreuses études sur le cancer [89].
Le (R)-(+)-limonène est rapidement absorbé après administration orale et ne présente pas d’effets génotoxiques, immunotoxiques ou cancérigènes. Des données confirment la stabilité du limonène sans disposer d’informations sur la toxicité de ses métabolites. Sur la base de toutes les considérations toxicologiques disponibles, la toxicité systémique du (R)-(+)-limonène est considérée comme faible chez l’humain, il n’est pas génotoxique, ni tératogène ou foetotoxique. Il n’est pas un agent sensibilisant de la peau, mais ses produits d’oxydation par l’air sont irritants [90].
Le (R)-(+)-Limonène a été engagé dans des essais en phase clinique I sur des patients atteints de cancers et semble être bien toléré. Il a des propriétés antiprolifératives, induisant apoptose et effets chimiopréventifs [91]. Des résultats suggèrent que le (R)-(+)-limonène peut exercer une activité chimiopréventive en inhibant l’inflammation, le stress oxydatif et Ras-signalisation ainsi que l’induction de l’état pro-apoptotique [92]. Chez l’homme, cet énantiomère a démontré une faible toxicité à doses répétées [91]. Des études ont déterminé que le (R)-(+)-limonène ne pose pas de risque mutagène, cancérigène ou néphrotoxique.
Des essais biologiques de différentes sources de R-(+)-limonène naturel et du même énantiomère issu de la synthèse ont été testées sur la mortalité des larves de moustiques Aedes aegypti et montrent qu’une source de limonène extraite d’oranges induisait une mortalité plus faible par rapport aux sources synthétiques à la même concentration [93]. Ce dernier résultat constitue un nouvel argument attestant que les sources naturelles d’une molécule causent un taux de mortalité inférieurs à celles des sources synthétiques [94]. D’ailleurs, les sources synthétiques de (R)-(+)-limonène et de (S)-(−)-limonène ne sont pas significativement différentes en termes de répulsion et c’est l’énantiomère (R)-(+)-limonène qui est homologué comme insecticide aux Etats-Unis [95].
4.2. Comparaison de l’activité biologique des deux énantiomères
Au niveau moléculaire, les systèmes biologiques sont homochiraux, ils sont formés à partir de précurseurs chiraux tels que les (S)-(−)-acides aminés et les (R)-(+)-glucides (carbohydrates). Les enzymes et les systèmes récepteurs montrent une préférence stéréochimique pour l’un des isomères optiques pouvant susciter différentes réponses biologiques.
Lis-Balchin avait observé précédemment que le (R)-(+)-limonène était biologiquement plus actif que l’énantiomère (S)-(−)-limonène [96]. Le (R)-(+)-limonène inhibe efficacement la prolifération d’une variété de micro-organismes qui causent des dommages aux cultures ou la détérioration des aliments, y compris Aspergillus niger, Colletotrichum falcatum, Bacillus subtilis et Staphylococcus aureus, même si d’autres études déclarent qu’il n’exerce pratiquement aucune activité antimicrobienne [97]. L’huile de Mentha spicata composée majoritairement de (S)-(−)-limonène a montré une amélioration de la bioactivité par rapport à l’huile d’Anethum graveolens ou sowa composée de (R)-(+)-limonène. Le rôle des composants mineurs de l’huile de Mentha spicata dans l’activité en synergie avec l’isomère (S)-(−)-limonène révèle la possibilité d’utiliser cet énantiomère en association comme agent thérapeutique [97].
Par contre, le S-(−)-limonène s’avère être un composant antimicrobien plus actif que le R-(+)-limonène vis-à-vis de Sarcina lutea et de Staphylococcus saprophyticus, tandis que les deux énantiomères présentent une activité comparable vis-à-vis d’Escherichia coli [36]. Ainsi, on constate l’importance du profil énantiomérique de l’HE pour l’activité microbienne et antibactérienne.
Les données montrent que le R-(+)-limonène peut être utilisé comme anxiolytique en aromathérapie. Lorsqu’il est administré par inhalation, il exerce des effets de type anxiolytique, sans que cet effet soit lié aux récepteurs des benzodiazépines [98]; il provoque un effet sur l’élévation de la tension artérielle systolique, la vigilance et la nervosité, alors que l’énantiomère (S)-(−)-Limonène n’augmente que la tension artérielle systolique et n’a pas aucun effet sur d’autres paramètres psychologiques [99].
L’effet antimicrobien et la toxicité des énantiomères du limonène ont été étudiés, notamment en combinaison avec des huiles essentielles [100]. Des variations de l’activité ont été observées montrant une plus grande sensibilité antibiotique du (S)-(−)-Limonène alors que le (R)-(+)-limonène interagit plus favorablement au niveau toxicité. Une étude précédente rapporte une activité antimicrobienne et une toxicité similaires des énantiomères du limonène [101], cependant, des variations d’interactions sont observées si elles sont combinées avec des composés d’huiles essentielles. Généralement, il est possible que l’activité des composants principaux soit modulée par la présence d’autres molécules en plus faible concentration dans l’HE et la notion de synergie semble plus probable [102].
4.3. Le limonène, allergène potentiel ?
Les terpènes en faible concentration ne sont généralement pas nocifs pour la santé humaine, ce sont leurs produits secondaires d’oxydation qui génèrent des réactions allergiques et d’irritation [103]. Ces produits oxydants identifiés, incluant le limonène, dans la vapeur des cigarettes électroniques pourraient être suffisamment élevés pour provoquer des effets néfastes sur la santé tels que l’irritation des voies respiratoires observée dans les études in vivo [104]. Pour surmonter les défis concernant les allergies, des recherches approfondies sont nécessaires pour adapter des posologies plus sûres.
5. Authenticité des huiles essentielles
La demande croissante d’HE, leur coût, et parfois leur rareté, conduisent à des adultérations nombreuses et de plus en plus sophistiquées [105]. Pour éviter la détection par les méthodes analytiques courantes, un adultérant est ajouté à faible dose (5–8 %). L’authentification des HE est obligatoire pour la sécurité et la protection des consommateurs [106]. La détermination du ratio énantiomérique intègre progressivement un cadre juridique via différentes législations (FDA, Union européenne …) constituant un élément important pour la conformité réglementaire [107].
En dehors des tests recommandés par les pharmacopées et la réglementation (analyses physico-chimiques), l’identification des énantiomères nécessite l’analyse chromatographique chirale pour évaluer l’excès énantiomérique des principales molécules des HE. L’utilisation des phases stationnaires chirales (PSC) est très performante, que ce soit, en phase gazeuse, liquide, supercritique, ou associée à des couplages avec la spectrométrie de masse ou à la résonnance magnétique nucléaire (RMN). L’analyse énantiomérique est qualitative et quantitative, elle permet d’établir l’authenticité et la géographie d’origine des HE [105]. Même sans être adultérée, l’origine et la spécificité naturelle d’une HE peuvent ne pas s’insérer dans les marges réglementaires et la rendre non conforme aux spécifications de normalisation.
La mise en œuvre de protocoles analytiques pour ces contrôles énantiomériques doit tenir compte du coût, de l’efficacité et de la rapidité d’évaluation. L’analyse chirale ne cesse d’évoluer vers une meilleure accessibilité, il est possible désormais de contrôler rapidement la qualité de mélanges complexes contenant des traces de composés volatils chiraux par une analyse post chromatographique chirale de mélanges gazeux [108].
6. Conclusion
Le limonène, molécule polyvalente de la bio économie, est présent dans de nombreuses HE. Nous rapportons la répartition des énantiomères (R)-(+)-limonène et (S)-(−)-limonène dans 54 HE diverses. Elles sont majoritairement riches en l’un ou l’autre énantiomère et celles qui possèdent les deux énantiomères en proportion égales sont plus rares. L’énantiomère (R)-(+)-limonène, issu des citrus, est une bio ressource importante pour l’exploitation industrielle, néanmoins, l’énantiomère (S)-(−)-est identifié dans diverses sources naturelles valorisables, aisément accessibles.
Les propriétés olfactives des énantiomères montrent des odeurs et des seuils olfactifs très différents permettant de préciser la perception olfactive des deux énantiomères. Cet aspect a fait l’objet d’une mise au point, et on peut confirmer, qu’il n’y a pratiquement pas de (S)-(−)-limonène dans les citrons, et que cet énantiomère ne transmet pas l’odeur de citron contrairement aux assertions antérieures.
L’homochiralité des molécules biologiques régit des processus biologiques importants et cette différenciation énantiomérique est évoquée. Les effets biologiques et toxicologiques des énantiomères du limonène sont signalés, notamment en combinaison avec des huiles essentielles. On constate que l’analyse chirale est capitale pour assurer la sécurité des produits dans tous les domaines; chimique, biologique, médical, pharmaceutique, agroalimentaire, aromes, parfums, cosmétiques.
La croissance de la production mondiale des huiles essentielles est souvent parallèle à une augmentation des adultérations effectuées de manière remarquable. Généraliser l’analyse chirale dans les réglementations de la qualité des HE commerciales est nécessaire pour un contrôle plus efficient intégrant le biotope et le processus d’extraction. La précision de l’énantiotype devrait apporter une meilleure visibilité sur les espèces et leurs origines en constituant une empreinte digitale d’authentification. La signature chirale naturelle des HE s’inscrit dans la continuité du chimiotype et fournit des indications précieuses quant aux énantiomères présents au sein d’une même espèce. L’énantiotype devrait s’imposer progressivement pour une utilisation plus sécuritaire des HE et une meilleure compréhension des mécanismes intervenant sur l’évaluation de l’activité pharmacologique.
Déclaration d’intérêts
Les auteurs ne travaillent pas, ne conseillent pas, ne possèdent pas de parts, ne rec˛oivent pas de fonds d’une organisation qui pourrait tirer profit de cet article, et n’ont déclaré aucune autre affiliation que leurs organismes de recherche.
Remerciements
Mes sincères remerciements, aux Professeur Jean Claude Fiaud, Dr. Jacqueline Collin, et Professeure Nadia Aribi, pour leurs relectures méticuleuses et leurs remarques pertinentes.




 CC-BY 4.0
CC-BY 4.0