1 Introduction
Azadirachta indica A. Juss. (Meliacée), communément appelé neem ou margosier, est largement utilisé en Afrique pour ses propriétés insecticides [1] et ses nombreuses vertus thérapeutiques [2]. En médecine traditionnelle, les feuilles, l'écorce de tronc, et les fruits sont fréquemment utilisés dans des préparations thérapeutiques pour traiter l'eczéma, les dermatoses, les rhumatismes [3] et les abcès palustres. En particulier, ce sont au Togo les rameaux feuillés terminaux qui sont réputés efficaces dans le traitement des fièvres liées au paludisme [4]. Les nombreuses exploitations commerciales et industrielles de la plante, principalement dans le domaine de la phytopharmacie, sont dues à des limonoïdes [5], qui sont des triterpènes modifiés et oxygénés responsables des nombreuses activités biologiques constatées [6].
La gédunine, un limonoïde, a été isolée de différentes méliacées, dont Cedrela odorata et Azadirachta indica A. Juss. [6]. Il s'agit d'une substance insecticide à propriété antiappétante, mais possédant également une activité antiplasmodiale intéressante [7]. Des tests in vitro réalisés sur des souches de Plasmodium faliciparium chloroquino-résistantes (W2) ont montré que la gédunine est plus active que la chloroquine et la quinine, avec des valeurs respectives de IC50 de 20, 29,5, 34,9 μg/l. Elle est, en revanche, moins active que la méfloquine et l'artémisinie [6]. L'évaluation de l'activité antiplasmodiale de la gédunine in vivo avec des rats infestés par Plasmodium berghei n'a pas conduit à des résultats satisfaisants. Ceci est probablement dû à la faible solubilité de la gédunine dans l'eau, donc à une faible absorption ou à une métabolisation précoce. Des travaux sont en cours pour définir les conditions favorables à l'utilisation de la gédunine en tant qu'antipaludéen compétitif.
Il est tout à fait remarquable que, dans les procédés de la médecine traditionnelle, l'activité thérapeutique ne soit pas nécessairement liée à une seule substance. Plusieurs molécules agissant en synergie sont parfois responsables de l'activité constatée. De même, si le choix de l'organe de plante se justifie, un autre organe peut être parfois plus performant, à cause d'une concentration élevée en principes actifs, et servir de matière première pour l'extraction de la molécule active. Si la gédunine est responsable de l'activité antipaludique de la plante, il serait intéressant de savoir dans quel organe elle est beaucoup plus présente. Une étude sur l'accumulation de la gédunine dans différents organes de A. indica a donc été entreprise.
2 Partie expérimentale
2.1 Instrumentation
Un pied à coulisse permet de mesurer la taille des fruits d'A. indica. Un appareil à chromatographie liquide Waters (HPLC), composé d'une pompe binaire, d'un contrôleur (Waters 600), d'un détecteur UV (Waters 486) et d'un intégrateur (Waters 746) a permis d'identifier les différents composés. Les spectres infrarouge sont tracés à l'aide d'un spectrophotomètre Hitachi I-2001. Les spectres de résonance magnétique nucléaire 1H et 13C sont enregistrés sur un appareil Brucker AMX-500 et les spectres de masse (SM) sur un spectromètre VG 7070E. La gédunine de référence a été fournie par le Pr. John T. Arnason, de l'université d'Ottawa (Canada).
2.2 Récolte du matériel végétal
Les différents organes de la plante – racine, écorce de tronc, bois, feuilles, fleurs, fruits – sont récoltés sur les mêmes pieds, sur le campus universitaire de Lomé et à l'intérieur du pays. Le matériel frais est mis à sécher au laboratoire, à température ambiante, puis réduit en poudre et conservé à l'abri de l'humidité et de la lumière.
2.3 Extraction de la gédunine
5 g de poudre de matériel séché sont mis à macérer pendant 24 h sous agitation dans 250 ml de toluène distillé. La phase organique est récupérée par filtration et le résidu est à nouveau repris dans le toluène, dans les mêmes conditions. La solution organique accumulée est évaporée sous vide à 40 °C. Le résidu brut est pesé puis repris dans 20 ml d'un mélange de solvants méthanol/acétate d'éthyle (1:1) v/v. Le mélange est filtré sur un filtre millipore en nylon de diamètre 0,2 μm. Le dosage de la gédunine est effectué par HPLC. La phase mobile est un mélange méthanol/eau (65:35, v/v), avec un débit de 1 ml/min. Le volume injecté est de 20 μl et la longueur d'onde d'analyse est de 215 nm. Une gamme étalon de gédunine pure a été préparée à des concentrations de 10, 20, 40, 50, 80 μg/ml. La concentration en gédunine est exprimée en μg/g de matière sèche ou en% par rapport à la matière sèche extraite.
2.4 Isolement et caractérisation de la gédunine
Un échantillon de 500 g de poudre d'épicarpe de fruits verts séchés est extrait trois fois successivement avec 2 l de toluène. Le filtrat est évaporé à sec, et l'on obtient 6,1 g d'extrait brut, avec un rendement d'extraction de 1,2%. Le résidu est purifié par chromatographies successives sur colonne garnies de gel de silice 60 (Kieselgel 0,063 mm 0,04–230 mesh) avec des systèmes de solvants à gradient de polarité croissant : hexane, hexane/acétate d'éthyle (9:1), hexane/acétate d'éthyle/acétone (8,5:1:1), hexane/acétate d'éthyle/acétone/méthanol (8:1:1:1) en utilisant la gédunine pure comme référence.
3 Résultats et discussions
Avant de décider du choix du solvant d'extraction, plusieurs essais ont été réalisés en utilisant de l'éther de pétrole, de l'éthanol, du méthanol et du toluène. La Fig. 1 montre que le rendement d'extraits totaux varie en fonction du solvant et que le rendement d'extraction de la gédunine est plus élevé lorsqu'on utilise du toluène, qui donne une masse d'extraits totaux relativement faible. Le toluène est donc plus performant pour extraire la gédunine des organes séchés d'A. indica.
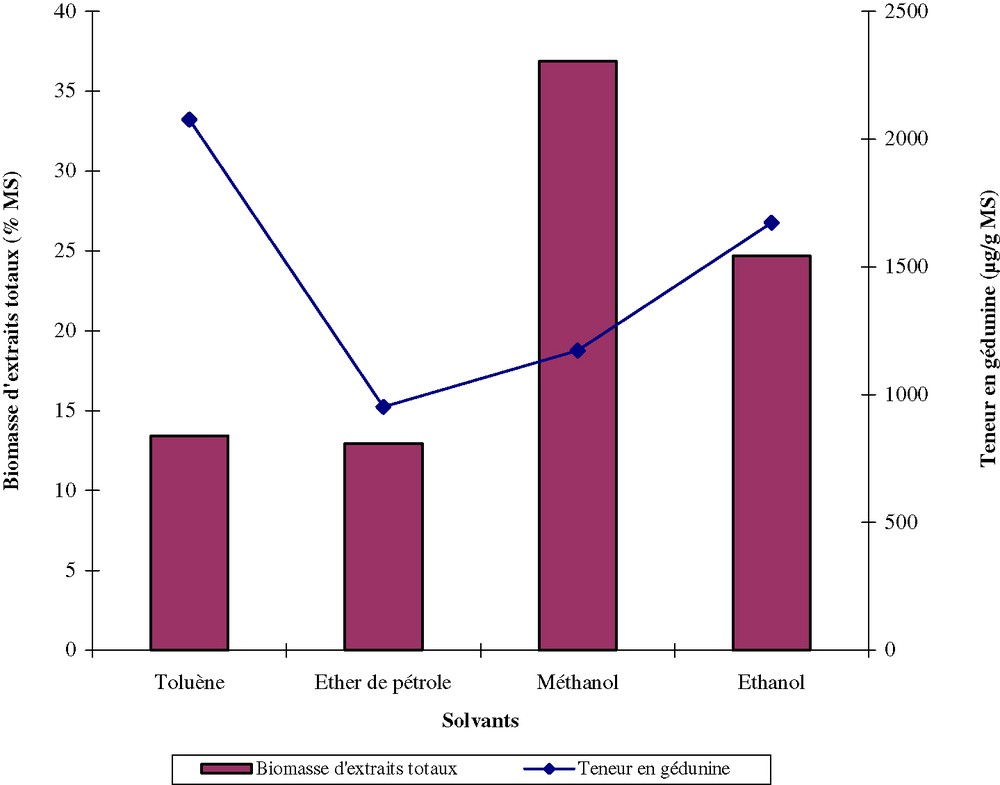
Rendement d'extraction et variation de la teneur en gédunine en fonction du solvant.
Au cours des présents travaux, la teneur en gédunine a été évaluée dans l'écorce de racine, l'écorce de tige, le bois de la tige, les feuilles, l'épicarpe de fruit, la pulpe de fruit, la graine et les fleurs. Les organes proviennent de la même plante et sont récoltés en période de floraison–fructification. La comparaison des moyennes par le test de domaine multiple de Duncan sur cinq répétitions a montré que le solvant exerce un effet significatif sur l'extraction de la gédunine et que le meilleur solvant est dans tous les cas le toluène (Tableau 1). Des extractions en milieu aqueux, soit par décoction, soit par infusion, ont été réalisées. On obtient respectivement 92,95 μg/g et 16 μg/g, alors que la valeur correspondante pour le toluène est de 2396,65 μg/g de matière sèche. La gédunine pure, isolée à partir des épicarpes de fruits, présente des caractéristiques spectrales qui sont conformes à celles de la littérature [5]. On obtient 21,8 mg de produit pur, soit 0,04% par rapport à la matière sèche. La gédunine ainsi obtenue est recristallisée dans le méthanol, pf 220 °C; [a] D = –44° (CHCl3), UV, λm = 216,335 nm. IR (KBr) : 2956, 1730, 1696, 1670, 1696, 1730, 874 cm–1. RMN 1H d(ppm) 1,03 (s), 1,04 (s), 1,18 (s), 1,19 (s), 1,22 (s), 1,57 (dd, J = 11 Hz, J = 12 Hz), 1,7(m), 1,81 (m), 2,00 (m), 2,07 (s), 2,12 (dd, J = 12,7, J = 2,3), 2,46 (dd, J = 12,7, J = 6,2), 3,46 (s), 4,5 (dd, J = 3,4, J = 2,1), 5,55 (s), 5,8 (d, J = 10,22), 6,35 (d, J = 0,97), 7,04 (d, J = 10,25 Hz), RMN 13C (CDCl3) : dppm : 157,0, 125,9, 204,0, 44,0, 46,0, 24,0, 73,0, 42,5, 39,5, 40,0, 15,0, 26,0, 38,7, 69,8, 56,7, 167,4, 78,3, 17,9, 19,9, 120,5, 143,0, 109,8, 141,2, 27,0. SM, m/z = 483 [M + 1], 482, 452, 423, 407, 328, 300, 299, 163, 149, 137, 135, 121.
Teneur en gédunine en fonction du stade de développement des organes
| Organes | Gédunine (μg/g MS) | Gédunine (% de MS) | |
| Jeunes plants | jeunes feuilles | 746 ± 88,5 | 0,06–0,08 |
| feuilles adultes | 124 ± 12,6 | 0,011–0,014 | |
| Plants adultes | jeunes feuilles | 671 ± 100,07 | 0,06–0,08 |
| feuilles adultes | 117,69 ± 22,67 | 0,01–0,014 | |
| Fruits verts | 4577 ± 241,7 | 0,45 | |
| Fruits jaunes | 2447 ± 205,6 | 0,24 |
La Fig. 2 donne l'évaluation de la teneur en gédunine dans les différents organes. La gédunine est indétectable dans les fleurs, le bois de la tige ; elle est présente sous forme de trace dans les écorces de la racine, et la pulpe du fruit. La concentration en gédunine reste, en revanche, élevée dans les extraits d'épicarpes de fruit, où l'on obtient une teneur qui varie de 0,1 à 0,8% selon l'âge et le site de collecte. Par ailleurs, les fruits verts sont plus riches que les fruits jaunes. Des plants de neem dont les fruits de même âge ont la même taille ont été sélectionnés. Des prélèvements de fruits verts ayant presque le même diamètre sont réalisés sur une période de huit semaines. Ces prélèvements sont extraits au toluène et les résidus analysés par HPLC. On constate que la teneur en gédunine diminue au cours du développement du fruit. Pour chaque plante, les fruits de 9–10 mm de diamètre âgés de trois à quatre semaines sont plus riches en gédunine. La concentration en gédunine diminue lorsque le diamètre du fruit augmente. Les faibles taux de gédunine sont obtenus lorsque les fruits ont atteint 12 à 13 mm de diamètre ou un âge de huit semaines. C'est à ce moment que les fruits sont mûrs et tombent de l'arbre. Cette diminution de la teneur en gédunine au cours de la croissance du fruit peut s'expliquer par une fragilité de la molécule relativement complexe et sujette à des transformations rapides. En Afrique de l'Ouest, ce sont les feuilles de neem que les thérapeutes traditionnels utilisent le plus souvent dans leurs diverses préparations. On utilise davantage la graine pour préparer l'huile de neem, tandis que l'épicarpe du fruit n'apparaît dans aucun usage. Le neem fructifie en général deux fois par année et la période de floraison–fructification peut durer quatre mois ; autrement dit, les fruits sont disponibles presque à longueur d'année. Selon Sevenet [8], un pied de neem peut produire environ 50 kg de fruits par an. Les fruits peuvent être cueillis à maturité et l'épicarpe du fruit servira à la production de phytomédicaments à forte teneur en gédunine.
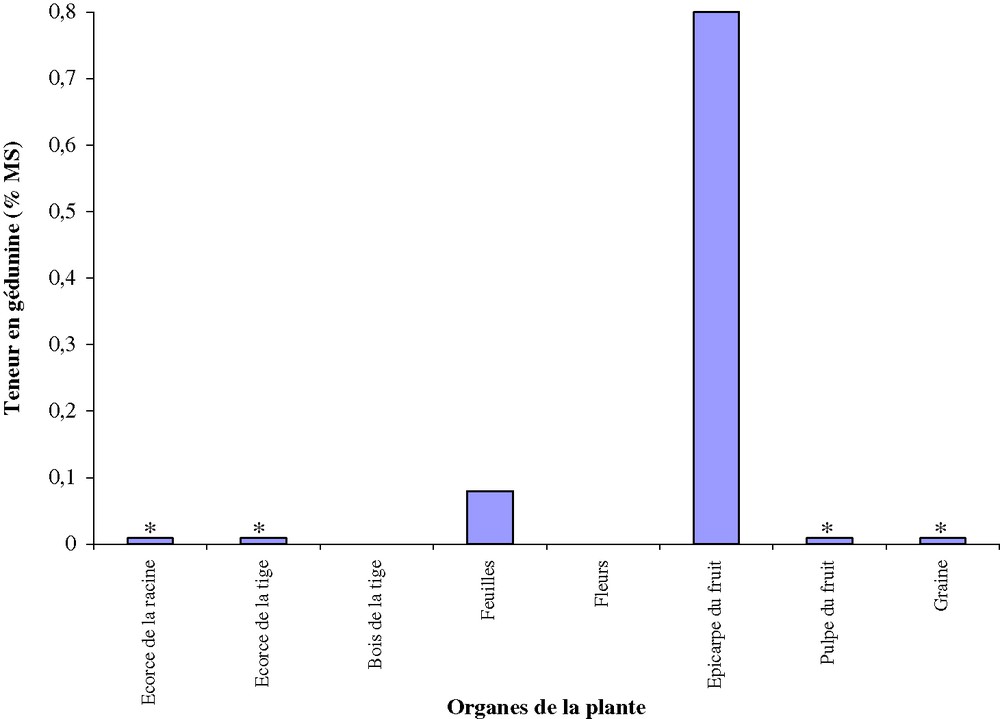
Teneur en gédunine des différents organes de la plante. * < 0,01% de MS.


