1 Introduction
Le diabète constitue un problème de santé publique. En 1995, l'OMS estimait à 135 millions le nombre de personnes qui souffraient du diabète et prévoyait une augmentation de 122 % en 2025. Pour la même période, il est prévu, dans les pays en développement, une augmentation de 170 % du nombre d'individus affectés par le diabète sucré, soit de 84 à 228 millions [1].
La prise en charge des diabétiques nécessite des moyens importants et n'est pas toujours à la portée de la majeure partie de la population africaine.
En Afrique, 80 % de la population utilise les ressources de la médecine traditionnelle pour les soins de santé primaires. De nombreuses recettes à base de plantes sont utilisées en médecine traditionnelle africaine pour la prise en charge du diabète.
De nombreuses études scientifiques ont démontré les propriétés hypoglycémiantes de plantes africaines comme Sclerocarya birrea, Cassia occidentalis et Striga sp. [2–4].
Au Mali, le département « Médecine traditionnelle » (DMT) de l'Institut national de recherche en santé publique (INRSP), mène des études phytochimiques, pharmaco-toxicologiques et cliniques pour la mise au point de médicaments traditionnels améliorés (MTA) utilisés dans le traitement du diabète non insulino-dépendant.
Les constituants chimiques identifiés dans les plantes utilisées dans le traitement du diabète sont très souvent des polysaccharides, notamment des mucilages et des glycanes [5].
Les feuilles de Ziziphus mauritiana sont utilisées comme cicatrisant, hémostatique, antiseptique, stimulant, tonifiant, anti-diarrhéique [6] et antidiabétique [7]. Différentes activités de la plante ont été confirmées [8] : antiscorbutique, anti-inflammatoire, diurétique, émolliente, hypotensive et sédative. L'activité anticomplémentaire des polysaccharides (arabinanes) isolés des feuilles de Z. mauritiana a déjà été démontrée par Yamahada et al. [9].
La présente étude a porté sur la recherche de constituants chimiques et sur l'évaluation de l'activité antihyperglycémiante des feuilles de Ziziphus mauritiana utilisées dans le traitement du diabète en médecine traditionnelle.
Pour cela, nous nous sommes fixé les objectifs suivants :
- • identifier les différents constituants chimiques présents dans les feuilles de Ziziphus mauritiana par des réactions colorées et la chromatographie sur couche mince (CCM);
- • déterminer la composition en monosaccharides des extraits aqueux des feuilles de Ziziphus mauritiana ;
- • évaluer l'activité antihyperglycémiante des extraits aqueux des feuilles Ziziphus mauritiana sur l'hyperglycémie provoquée par administration orale du glucose chez le lapin.
2 Matériel et méthodes
2.1 Matériel végétal
Il est constitué de feuilles de Ziziphus mauritiana Lam. récoltées à Blendio (région de Sikasso, Mali) en novembre 2001. Un spécimen est déposé à l'herbier du département « Médecine traditionnelle » sous le numéro 147.
Les échantillons ont été lavés à l'eau courante, puis séchés à l'ombre sous ventilation à l'abri de la lumière, à température ambiante.
Après séchage, les feuilles ont été broyées pour obtenir une poudre fine, qui a servi pour la préparation des extraits.
2.2 Préparation des extraits
Différents types d'extraits ont été préparés à partir de la poudre des feuilles de la plante.
2.2.1 Décoction
Nous avons effectué une décoction aqueuse à 10 %. 250 g de poudre de feuilles ont été mis dans 2500 ml d'eau distillée et portés à ébullition pendant 1 h. Le décocté refroidi a été filtré et concentré au Rotavapor (marque Büchi R 114), puis lyophilisé.
2.2.2 Macération
Une macération aqueuse a également été effectuée sur 50 g de poudre avec 500 ml d'eau pendant 3 × 24 h. Après filtration, l'extrait a été concentré au Rotavapor et lyophilisé.
2.2.3 Digestion à 50 °C
250 g de poudre ont été mis dans 2 500 ml d'eau distillée et portés à 50 °C pendant 3 h. La filtration a été réalisée sur filtre en fibre de verre. Le filtrat a été concentré sous vide à 50 °C au Rotavapor et lyophilisé. Les extraits lyophilisés ont été conservés dans des dessiccateurs.
2.2.4 Extractions avec des solvants à polarité croissante
250 g de poudre ont été extraits avec 3 × 500 ml d'éther de pétrole et placés sous agitation pendant 3 × 24. Après filtration sur papier Whatmann, le marc est ensuite mis en agitation avec 1500 ml de dichlorométhane pendant 3 × 24 h, puis 1500 ml de méthanol pendant trois jours.
Le résidu de l'extraction précédente a été repris par 3 × 500 ml d'éthanol à 80 % et laissé sous agitation pendant 3 × 24 h.
À la fin de l'extraction avec les solvants organiques, le marc a été séché pendant 24 h, puis ensuite porté à 50 °C, puis à 100 °C avec 1,5 l d'eau distillée, à chaque fois pendant trois heures.
Les solutions ont été filtrées sous vide à l'aide de filtres en microfibres de verre Whatmann.
Les extraits d'éther de pétrole, de dichlorométhane, méthanolique, éthanolique et aqueux ont été concentrés sous vide à 40 °C au Rotavapor.
Après concentration, les extraits d'éther de pétrole et de dichlorométhane ont été laissés à l'air libre. En revanche, les extraits méthanolique, éthanolique et aqueux ont été lyophilisés.
2.3 Études phytochimiques
Les principaux constituants chimiques ont été caractérisés dans les extraits par des réactions colorées, par l'établissement de leurs profils chromatographiques par CCM et par l'identification des différents monosaccharides des polysaccharides contenus dans les extraits aqueux par chromatographie en phase gazeuse.
2.3.1 Caractérisation des principaux constituants chimiques des extraits
Les réactifs de caractérisation classiques ont permis de mettre en évidence les groupes chimiques suivants : les alcaloïdes (réactifs de Dragendorff et de Mayer), les composés réducteurs (réactif de Fehling), les flavonoïdes (réaction de la cyanidine), les saponosides (indice de mousse), les tanins (chlorure ferrique), les stérols et triterpènes (Réaction de Liebermann Buchard) [10,11].
2.3.2 Chromatographie sur couche mince (CCM)[10,12]
2.3.2.1 Mode opératoire
Nous avons travaillé sur tous les extraits des feuilles de Z. mauritiana dans les conditions suivantes.
2.3.2.1.1 Solutions d'essai
10 mg de chaque extrait ont été dissous dans 1 ml du solvant approprié. Les extraits apolaires ont été dissous dans leur solvant d'origine. Les extraits polaires ont été repris avec 1 ml du mélange méthanol/eau (1:1).
2.3.2.1.2 Support
Plaque de silice 60GF254, d'épaisseur 0,25 mm.
2.3.2.1.3 Dépôt
Sur les plaques préparées, nous avons déposé 3 μl de chaque extrait à l'aide d'une micro-pipette.
2.3.2.1.4 Solvants de migration
Trois systèmes de solvants de migration ont été utilisés : ligroine/acétate d'éthyle (2:1) pour les extraits apolaires n-butanol/acide acétique/eau (60:15:25) et chloroforme/méthanol/eau (65:35:5) pour les extraits polaires.
2.3.2.1.5 Observation et révélation
Les plaques ont été séchées et observées à la lampe UV à 254 et 366 nm. Nous avons utilisé les réactifs de Godin et de Dragendorff, ainsi que le chlorure d'aluminium, pour la révélation.
Le facteur de rétention (Rf) a été calculé pour chaque constituant.
2.4 Méthanolyse
Pour déterminer la composition en monosaccharides des extraits aqueux des feuilles de Ziziphus mauritiana, les monosaccharides contenus dans les extraits polysaccharidiques ont été transformés en méthylglucosides en C1, puis en méthylesters glucosides par méthanolyse.
À 1 mg d'extrait aqueux, nous avons ajouté 1 ml d'une solution 4 M HCl/MeOH (acide chlorhydrique/méthanol) et 100 μl de mannitol à la concentration de 1,01 μg μl–1. Le mélange a été agité et placé à l'étuve à 80 °C pendant 20 à 22 h.
Après ce temps, le mélange a été évaporé à sec sous courant d'azote. Le résidu a été lavé et séché à deux reprises avec 200 μl de méthanol [13–15].
2.5 Chromatographie en phase gazeuse
Pour la chromatographie en phase gazeuse, nous avons ajouté à l'échantillon méthanolysé 100 μl de la solution de triméthylsilane (TMS), puis nous avons mélangé avec soin et laissé reposer pendant 20 min. Nous avons injecté 1 μl de cette solution dans un appareil Carlo Erba 4200 utilisant une colonne DB-5.
Nous avons travaillé dans les conditions suivantes : hélium comme gaz porteur, détecteur à flamme (flamme produite par un mélange d'hydrogène/air), programme de température de 140 °C à 170–250–300 °C, avec une augmentation de 1 °C min–1 entre 140 et 170° [13–15].
2.6 Essais biologiques
Nous avons étudié les différents extraits aqueux des feuilles de Ziziphus mauritiana pour confirmer leurs activités antihyperglycémiantes.
2.6.1 Matériel animal
Nous avons travaillé sur des lapins ordinaires adultes, des deux sexes, de poids compris entre 1,5 et 2,250 kg. Pour l'expérimentation, les lapins ont été mis à jeun 12 h avant les prélèvements. Nous avons utilisé des lapins avec une glycémie normale et rendus hyperglycémiques de façon transitoire par administration de glucose à 50 % par voie orale.
2.6.2 Protocole expérimental
2.6.2.1 Détermination de la glycémie
La glycémie de base de tous les lapins a été déterminée par la méthode enzymatique [3]. La glycémie de base de tous les lapins a été déterminée à t = t0, avant administration des extraits.
2.6.2.2 Hyperglycémie expérimentale par surcharge de glucose
Nous avons constitué des lots de cinq lapins. Le prélèvement de sang a été fait par ponction de la veine marginale de l'oreille du lapin. Le sang a été recueilli dans un tube avec anticoagulant inhibiteur de glycolyse et centrifugé à faible vitesse à 3000 tr min–1 pendant une période de 5 min pour récupérer le plasma en évitant l'hémolyse.
Différents lots de lapins ont été traités comme suit :
- • un lot témoin qui a reçu 10 ml d'eau distillée ;
- • un lot de référence traité avec un antidiabétique (Metformine) à la dose de 22,1 mg kg–1 ;
- • des lots d'essai qui ont reçu respectivement par voie orale 100 et 150 mg kg–1 de l'extrait aqueux des feuilles de Ziziphus.
Soixante minutes après l'administration des préparations, la surcharge de glucose a été administrée à raison de 1 g kg–1 poids de glucose à 50 %, p/V dans l'eau distillée, pour provoquer l'hyperglycémie.
Ce temps permet de rapprocher chez le lapin l'instant d'activité maximale hyperglycémiante de la surcharge de glucose de celui d'activité maximale hypoglycémiante de la préparation étudiée.
À partir de l'administration des préparations, les prélèvements de sang ont été effectués toutes les 30 min pendant 3 h : t0 : glycémie de base ; t30 : glycémie 30 min après administration de l'eau distillée, des extraits et du produit de référence ; t60 : surcharge de glucose chez tous les lapins ; t90 : glycémie 30 min après administration du glucose ; t120 : glycémie 1 h après administration du glucose et t180 : glycémie 2 h après administration du glucose.
Pour chaque dose, on a relevé le taux de glucose dans le sang en fonction du temps ; le pourcentage d'inhibition de la glycémie a été calculé par rapport au groupe témoin.
3 Résultats et discussion
3.1 Extraits
Chaque extrait a été caractérisé par sa couleur et son rendement par rapport à la drogue sèche. Ces éléments sont présentés dans le Tableau 1.
Aspects, couleurs et rendements des extraits des feuilles de Ziziphus mauritiana par différents solvants
| Extraits | Couleurs/ Aspects | Rendements (%) |
| Décocté | vert (poudre) | 10,15 |
| Macéré des feuilles | vert (poudre) | 4,84 |
| Digesté à 50 °C | vert (cristaux) | 3,61 |
| Éther de pétrole | vert foncé (pâteux) | 3,33 |
| Dichlorométhane | vert foncé | 1,19 |
| Méthanolique | vert foncé (poudre) | 6,40 |
| Éthanolique | vert (poudre) | 3,34 |
| Décocté après épuisement | marron (floconneux) | 9,87 |
| Digesté après épuisement | marron (floconneux) | 3,91 |
3.2 Principaux constituants chimiques des extraits
3.2.1 Réactions de caractérisation
Les études phytochimiques effectuées sur les feuilles de Z. mauritiana ont donné les résultats reportés dans le Tableau 2.
Résultats de la caractérisation des groupes chimiques dans des extraits de feuilles de Z. mauritiana
| Groupes chimiques | Résultats des réactions en tube |
| Coumarines (fluorescence UV 366 nm) | + + |
| Flavonoïdes : génines flavoniques (Shibata) | + + |
| Flavonoïdes : hétérosides flavoniques (Shibata) | + + |
| Saponosides : mousse | + + + + + |
| Saponosides : indice de mousse | 1000 |
| Tanins : réaction avec FeCl3 | + + + + |
| Tanins : réaction avec HCl | + + + + |
| Tanins catéchiques : réaction de Stiasny | + + + + |
| Tanins galliques : réaction de Stiasny | + + |
| Composés réducteurs | + + + + |
| Oses et holosides | + + + + |
| Polyuronides (mucilages) | + + + + + |
| Stérols et triterpènes : hétérosides triterpéniques (Liebermann) | + + + + |
| Stérols et triterpènes : stéroïdiques (Liebermann) | + + + + |
| Hétérosides cardiotoniques (Raymond–Marthoud) | + + + |
| Leucoanthocyanes | + + + + |
Les essais phytochimiques effectués sur les extraits des feuilles de Ziziphus mauritiana ont révélé la présence de composés réducteurs, de coumarines, de flavonoïdes, d'hétérosides cardiotoniques, de leucoanthocyanes, d'oses et d'holosides, de polyuronides (mucilages), de saponosides et de tanins. Les composés les plus abondants dans les feuilles sont surtout les oses et holosides, les polyuronides (mucilages), les polysaccharides et les saponosides.
Les tests de recherche d'alcaloïdes, de dérivés anthracéniques, d'anthocyanes et d'hétérosides cyanogénétiques ont été négatifs sur nos échantillons.
3.2.2 Chromatographie sur couche mince (CCM)
Les chromatogrammes des extraits polaires : décocté (Rf 0,41, 0,51, 0,60), digesté (Rf 0,51, 0,60) ; méthanolique (Rf 0,46, 0,60, 0,70) dans les systèmes de solvants n-butanol/acide acétique/eau (60:15:25) et CHCl3/MeOH/H2O (65:35:5) présentent de nombreuses taches qui apparaissent jaunes après révélation avec le trichlorure d'aluminium, spécifique des flavonoïdes. Ces taches jaunes sont absentes des extraits aqueux après épuisement ; en revanche, ils présentent une tache violette après révélation avec le réactif de Godin à Rf = 0,65.
Les taches avec les facteurs de rétention 0,07, 0,36 et 0,46 dans le système n-butanol/acide acétique/eau (60:15:25), qui se répètent après observation aux UV, sont certainement des constituants communs aux différents extraits.
Dans les systèmes de solvants CHCl3/MeOH/H2O (65:35:5), de nombreuses taches violettes apparaissant après révélation par le réactif de Godin : ce sont probablement des stérols et des triterpènes.
Les taches des chromatogrammes des extraits d'éther de pétrole (Rf 0,40, 0,45, 0,57, 0,75), dichlorométhane (Rf 0,45, 0,57, 0,89) se colorent aussi en violet après révélation au réactif de Godin. L'extrait de dichlorométhane présente en plus de nombreuses taches, qui se colorent en bleu ou en vert avec le réactif de Godin.
La révélation des différents chromatogrammes avec le réactif de Dragendorff a confirmé l'absence d'alcaloïdes détectables par cette méthode dans les feuilles de Z. mauritiana. Cependant, Jossang et al. ont trouvé des alcaloïdes de type cyclopeptide dans Z. mauritiana [16].
3.2.3 Composition en monosaccharides des polysaccharides des extraits aqueux des feuilles de Ziziphus mauritiana
La CPG a permis d'identifier plusieurs monosaccharides dans ces extraits aqueux.
Le Tableau 3 présente la composition en monosaccharides des polysaccharides du macéré, du digesté total et du digesté des feuilles, après leur extraction par les solvants organiques.
Pourcentage en monosaccharides des polysaccharides du macéré, du digesté total des feuilles et du digesté des feuilles après le passage des solvants organiques
| Monosaccharides | Macéré | Digesté | Digesté après solvants |
| Arabinose | 9,29 | 5,29 | 6,36 |
| Rhamnose | 24,55 | 17,99 | 22,51 |
| Xylose | 4,76 | 3,89 | 4,14 |
| Mannose | 2,22 | 1,69 | 1,64 |
| Galactose | 8,88 | 12,32 | 12,5 |
| Glucose | 25,98 | 10,42 | 9,43 |
| Acide galacturonique (GalA) | 19,19 | 35,56 | 34,03 |
| Acide glucuronique (GlcA) | 4,3 | 12,83 | 9,36 |
| Total | 100 | 100 | 100 |
Le macéré contient majoritairement du glucose (25,98 %), du rhamnose (24,55 %) et de l'acide galacturonique (19,19 %). Les digestés sont caractérisés par leurs teneurs en acide galacturonique (35,56 %), en rhamnose (18 %) et en galactose (12 %).
La Fig. 1 présente la composition en monosaccharides des polysaccharides du décocté de feuilles et de celle des feuilles épuisées par les solvants organiques.
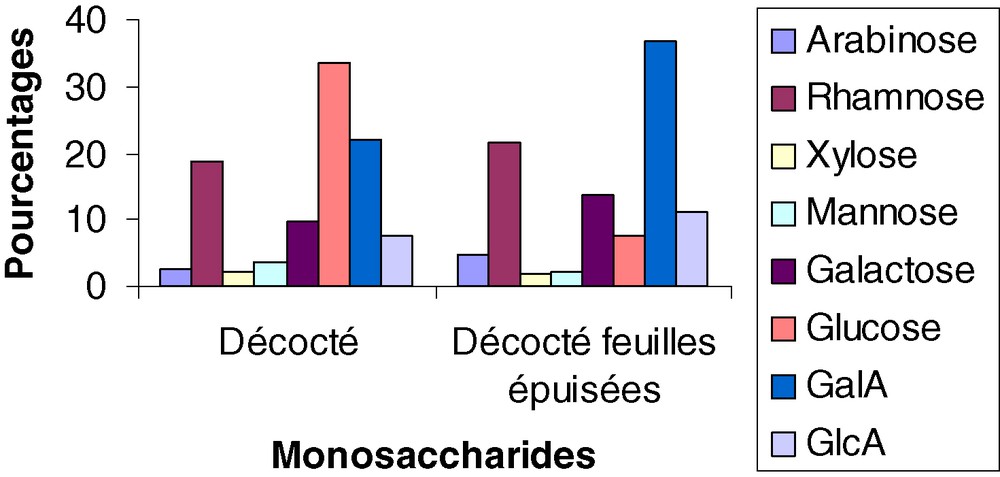
Composition en monosaccharides des polysaccharides du décocté des feuilles et celui des feuilles après extraction par les différents solvants organiques.
Le pourcentage en glucose a été de 33,56 % dans l'extrait aqueux à 100 °C et 7,62 % dans les feuilles épuisées par les solvants organiques qui contiennent principalement de l'acide galacturonique (36,93 %), du rhamnose (21,57 %) et du galactose (13,87 %).
Le plus faible pourcentage en sucre (27,18 %) a été trouvé au niveau du macéré des feuilles. Le mannose a été trouvé en petite quantité dans tous les extraits aqueux.
La méthanolyse et la CPG ont montré une diversité des extraits aqueux en sucres.
Le décocté aqueux, qui est la forme d'utilisation traditionnelle, a donné un rendement à l'extraction de 10,15 %, alors que, par macération, 4,84 % des substances contenues dans les feuilles étaient hydrosolubles.
Les flavonoïdes ayant des propriétés antioxydantes, ils pourraient agir sur les vaisseaux sanguins pour prévenir l'athérosclérose, qui est une des principales complications chez les diabétiques. La présence de tanins, doués de propriétés de renouvellement des tissus, est importante dans le processus de guérison des plaies dues au diabète. Souleles et Shammas ont isolé des flavonoïdes des feuilles de Ziziphus jujuba [17].
Le décocté aqueux contenait 36,87 % de polysaccharides, essentiellement composés de glucose, d'acide galacturonique et de rhamnose, avec respectivement 33,56 %, 22,02 % et 18,67 %. Le macéré de feuilles ne contenait, quant à lui, que 27,17 % de sucres.
Le décocté aqueux des feuilles après épuisement par les solvants organiques avec 45,57 % contenait beaucoup plus de sucres que la forme d'utilisation traditionnelle, le décocté aqueux, qui contenait 36,87 % de polysaccharides. La teneur élevée en acide galacturonique (36,93 %) associée à celle du rhamnose (21,57 %) dans le décocté aqueux épuisé peut laisser supposer qu'il s'agit d'une pectine de type rhamnogalacturonane.
Le Tableau 4 présente les pourcentages d'inhibition de la glycémie du décocté et du macéré des feuilles de Z. mauritiana.
Résultats de l'activité hypoglycémiante du décocté et du macéré de des feuilles de Ziziphus mauritiana chez le lapin
| Pourcentages d'inhibition de la glycémie | ||||
| Doses/Temps | t 30 | t 90 | t 120 | t 180 |
| Décocté | ||||
| 100 mg kg–1 | 12,01 | 7,6 | 2,97 | 5,2 |
| 150 mg kg–1 | 22,04 | 16,36 | 20,06 | 22,31 |
| Macéré | ||||
| 100 mg kg–1 | 46,71 | 30,34 | 33,48 | 19,12 |
| 150 mg kg–1 | 56,02 | 35,46 | 38,49 | 41,96 |
| Metformine | 22,64 | 32,64 | 16,81 | 17,43 |
Au temps t30, le plus grand pourcentage d'inhibition de la glycémie, qui était de 56,02 %, a été obtenu avec le macéré de feuilles à la dose de 150 mg kg–1 alors que le décocté aqueux donnait une inhibition de 22,04 %, au même temps et à la même dose.
Selon Cissé [18], une dose de 300 mg kg–1 de décocté aqueux des feuilles de Ziziphus mauritiana, administrée 90 min avant l'épreuve hyperglycémiante, a montré chez des rats une diminution de la glycémie, avec un pic inférieur de 5 % à celui du témoin.
Il a aussi montré que l'activité hypoglycémiante de Z. mauritiana correspondait à celle de trois plantes associées que sont Sclerocarya birrea, Khaya senegalensis et Moringa oleifera [18]. Les extraits aqueux de Ziziphus mauritiana riches en polysaccharides présentent une action sur l'hyperglycémie provoquée chez le lapin. De nombreuses études ont montré que les constituants chimiques isolés des plantes utilisées dans le traitement du diabète sont principalement des polysaccharides, comme les glycanes, les mucilages et des pectines [5]. Selon les résultats de nos essais phytochimiques préliminaires, les constituants chimiques les plus abondants dans les feuilles de Ziziphus mauritiana sont surtout les oses et holosides, les polyuronides (mucilages) et les saponosides. Le décocté des écorces de racines Ziziphus mauritiana présente 34,35 % de sucres, constitués essentiellement de glucose (79,84 %), pouvant être assimilés à un glucane [7]. Les polysaccharides de type glucane sont doués de propriétés antidiabétiques [19] et des arabinanes à activité anticomplémentaire ont été isolé des feuilles de Z. mauritiana par Yamahada et al. [9]. Ces polysaccharides pourraient expliquer en partie l'activité hypoglycémiante des extraits aqueux des feuilles de Ziziphus mauritiana, confirmant ainsi son indication dans le traitement antidiabétique. Cependant, d'autres études sont nécessaires pour la séparation des polysaccharides, la détermination de leur structure et la mise en évidence de leur mécanisme d'action hypoglycémiante, qui pourrait être fonction du type de liaison entre les monosaccharides et les chaînes latérales des polysaccharides.
Remerciements
Nous remercions le projet CNRST–NUFU–Plantes médicinales pour son soutien financier.


