Tout au long de l’histoire, les découvreurs des éléments leur ont trouvé des noms variés, qui nous informent tantôt sur leurs propriétés, tantôt sur les substances naturelles dont ces éléments ont été tirés, ou parfois sur les circonstances de leur découverte. L’étymologie nous fait ainsi entrer dans l’histoire des sciences, et l’on rencontrera dans cet exposé les noms de chimistes qui ont apporté une contribution particulièrement importante à la liste des éléments connus à ce jour. Parmi ces chimistes, Lavoisier tient une place de premier plan.
Ainsi l’on trouvera successivement : les noms liés aux découvertes fondamentales de Lavoisier, des noms issus de l’astronomie, puis de la mythologie, des noms d’origine botanique, d’autres qui sont liés à la géographie, et enfin des noms tirés directement du grec ancien. En outre, cet exposé rendra hommage à Mendeleïev, le grand architecte en 1869 du tableau périodique, dont le plus grand génie a été de prédire l’existence d’éléments encore inconnus et effectivement découverts par la suite. Hommage sera rendu aussi en épilogue au géologue français Chancourtois, qui présentait sa Vis tellurique à l’Académie des Sciences en 1862, la première démonstration de la périodicité des éléments.
1. Les noms dus à Lavoisier
Lavoisier fut un théoricien révolutionnaire, si l’on ose dire en pensant au sort que la Révolution lui a réservé, autant qu’un expérimentateur de génie.
Lavoisier (1743–1794). Copyrighted work available under Creative Commons Attribution only licence CC BY 4.0.
Ses travaux, à partir des années 1770, ont conduit aux premières mises en évidence d’éléments chimiques en tant que tels, bien connus aujourd’hui sous les noms de carbone, oxygène, hydrogène et azote. Ces noms sont attestés et justifiés dans deux textes fondateurs : la Méthode de nomenclature chimique (1787) de MM. de Morveau, Lavoisier, Berthollet et de Fourcroy, ainsi que le Traité élémentaire de chimie (1789) de Lavoisier, dans lequel celui-ci établit la notion même d’élément chimique, sous l’appellation « substance simple ».
Lavoisier a mis en évidence l’élément carbone à partir de ses expériences sur la combustion du diamant, réalisée à la très haute température au foyer d’un four solaire (muni de la lentille de 80 cm de diamètre construite par le verrier allemand Tschirnhaus) [1].
Four solaire muni de la lentille de Trudaine, utilisé pour les expériences publiques sur la combustion du diamant (This file was provided to Wikimedia Commons by the Science History institute).
Constatant que le gaz de cette combustion était le même que celui obtenu en brûlant du charbon, il a établi l’existence d’un élément commun, nommé d’abord « substance charbonneuse », puis avec de Morveau :
— carbone, du latin carbo, carbonis « charbon de bois ».
L’oxygène et l’hydrogène sont isolés peu après grâce aux expériences de Lavoisier sur la décomposition de l’eau, et sa recomposition.
Dispositif de Lavoisier pour étudier la décomposition de l’eau (Traité élémentaire de chimie, 1789) Digital copy of the Dumas & Grimaux edition text, 1862, BNF, auteur : LaosLos (from a .pdf file).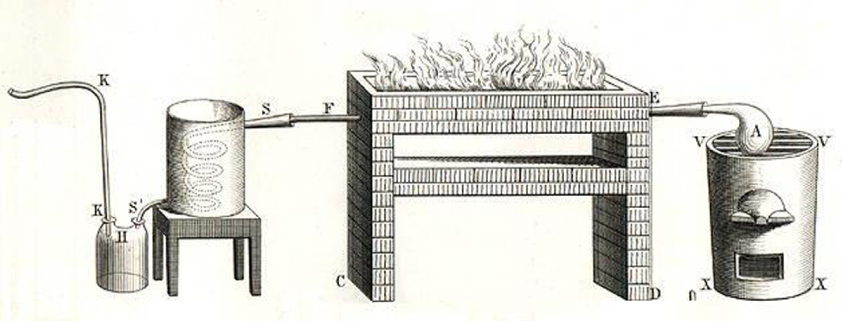
Lavoisier a donné aux deux gaz issus de la décomposition de l’eau les noms suivants :
— oxygène signifiant « qui engendre l’acide », du grec oxus « aigu, piquant, aigre », d’où aussi oxos, « vinaigre ». Il partait du fait que l’oxygène était présent dans les acides acétique, nitrique, sulfurique, etc.
— hydrogène signifiant « qui engendre l’eau », sous-entendu « avec l’oxygène ».
Pourtant, l’eau contient en masse beaucoup plus d’oxygène que d’hydrogène, et l’on sait aujourd’hui que la fonction acide est due à l’hydrogène et non pas à l’oxygène. La pertinence des noms oxygène et hydrogène a d’ailleurs été contestée dès 1787, mais personne sans doute n’a osé changer, voire échanger, des noms dus à Lavoisier.
Ayant montré enfin que l’air se composait d’oxygène et d’un autre gaz (l’azote), auquel il « fallait un nom particulier », Lavoisier a opté en 1787 pour :
— azote, du grec azôtikos « non vital ».
Cette fois pourtant, Chaptal, dès 1790, a préféré le nom nitrogène, signifiant « qui engendre l’acide nitrique », nom que le monde anglo-saxon a adopté très rapidement, en anglais nitrogen, d’où finalement le symbole N adopté par la communauté internationale.
En résumé, Lavoisier a mis fin au règne des 4 éléments de l’Antiquité en remplaçant 3 de ces éléments, la terre, l’eau et l’air, par 4 éléments chimiques, le carbone, l’oxygène, l’hydrogène et l’azote. Ces 4 éléments figurent dans le premier tableau (non encore périodique) des éléments qu’il a publié en 1789, à côté de 19 autres, dont le soufre, le phosphore, l’arsenic et 16 métaux, parmi lesquels 7 seulement étaient connus dans l’Antiquité.
2. Des noms d’inspiration astronomique
— la magie du chiffre 7
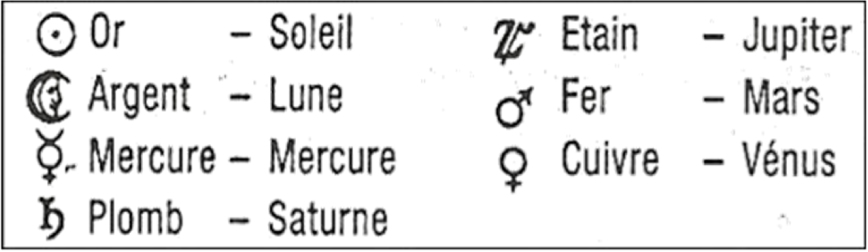
Les Anciens, puis les alchimistes, ont cultivé une sorte de numérologie basée sur le chiffre 7, en associant les 7 métaux connus depuis toujours aux 7 astres non fixes qu’ils pouvaient observer (le Soleil, la Lune et les 5 planètes identifiées à l’époque, Saturne étant la plus éloignée visible à l’œil nu), portant eux-mêmes les noms de 7 divinités mythologiques gréco-latines. Après quelque hésitation pour certaines planètes, les correspondances suivantes se sont imposées [2, p. 154] : le Soleil et l’éclat de l’or, la Lune et sa lumière d’argent, le rouge de Mars et du fer employé pour la guerre, le jaune de la planète Vénus et d’un miroir en cuivre (métal abondant à Chypre, l’île de Vénus), le blanc de Jupiter, d’un éclair et de l’étain, la pâleur de Saturne dont la lenteur (tour du Soleil en 30 ans) s’accorde avec la pesanteur du métal terne qu’est le plomb, et au contraire la vélocité de Mercure (tour du Soleil en 3 mois) qui évoque la fluidité du vif-argent (nommé plus tard mercure) et l’agilité des commerçants.
Cette correspondance métal-astre-divinité a prévalu très longtemps puisque les premiers métaux identifiés au-delà des 7 de l’Antiquité ne sont apparus qu’à la fin du Moyen Âge, avec le zinc, l’antimoine puis quelques autres. Quant à la première planète au-delà de Saturne, elle n’a été découverte par Herschel qu’en 1781, et nommée Uranus, nom du père de Saturne dans la mythologie.
— la planète Uranus et le métal uranium
C’est en 1792 que le chimiste allemand Martin Klaproth identifie un métal nouveau dans la pechblende [3, p. 160, 172]. Ayant fait observer que l’on avait déjà découvert une dizaine de métaux au-delà des 7 de l’Antiquité sans pouvoir mettre en face de nouveaux astres, il s’empresse d’associer la toute récente planète à son nouveau métal, qu’il nomme pour cela uranium (d’abord urane).
Martin Klaproth (1743–1817). Wikimedia Commons; author: Ambroise Tardieu (engraving) after original portrait by Eberhard-Siegfried Henne.
— les planètes transuraniennes et les métaux transuraniens
Au-delà d’Uranus, deux autres planètes ont été découvertes ensuite, et nommées toujours dans la tradition mythologique, Neptune en 1846 et Pluton en 1930 (devenue planète naine en 2006). Ces planètes, dites transuraniennes, se situent au-delà du système solaire observé depuis 1781, comme un prolongement dans l’inconnu, que les irrégularités de l’orbite d’Uranus ont laissé supposer. De même, on a découvert des éléments dits transuraniens, situés au-delà de l’uranium, le plus lourd des éléments naturels, comme un prolongement dans un autre inconnu. Ces découvertes ont été réalisées au cours des travaux de physique nucléaire menés dans les années 1940 aux États-Unis, principalement sous l’égide de Glenn Seaborg (1912–1999) à Berkeley. Ainsi, après l’uranium (élément 92), ont été nommés le neptunium (élément 93) et le plutonium (élément 94) en référence aux planètes Neptune et Pluton. Ces travaux ont mis en évidence des réactions de désintégrations successives du type ci-dessous :
— mythologique, Uranus étant le grand-père de Neptune et Pluton,
— astronomique, l’uranium, le neptunium et le plutonium apparaissant dans l’ordre des planètes,
— radiochimique, de noyau père en noyau fils.
Comme on vient de le constater, les noms d’origine astronomique renvoient également à la mythologie gréco-latine, mais d’autres noms viennent directement de la mythologie, gréco-latine ou autre.
3. Des noms d’inspiration mythologique
Peu après avoir dédié l’uranium à Uranus, Klaproth découvre un autre métal et file sa métaphore mythologique en nommant le titane, en référence aux Titans, des fils d’Uranus.
Citons également le tantale, ainsi nommé par son découvreur, le chimiste suédois Ekeberg, à cause de l’impossibilité pour ce métal de réagir avec les acides dans lesquels il est plongé, rappelant l’impossibilité pour Tantale, plongé dans le Tartare, de se nourrir et de boire : une conséquence inattendue du supplice de Tantale.
La tentation de Tantale dans le Tartare, aux Enfers. Gravure Bernard Picart, Le Temple des muses (1733).
La mythologie grecque n’est pas la seule à transparaître dans le tableau périodique. On peut citer également le thorium et le vanadium, nommés par le grand chimiste suédois Berzelius en référence à Thor et Vanadis, des divinités scandinaves.
Vanadis et Thor, ayant inspiré les noms du vanadium et du thorium. Wikimedia Commons : James D. Penrose: Freyja and the Necklace (1890) ; Mårten E. Winge: Tor’s Fight with the Giants (1872).
Et l’on peut penser aussi à la mythologie germanique, qui explique les noms du cobalt et du nickel. L’histoire se déroule au XVIIIe siècle dans les mines allemandes, dans lesquelles les mineurs menaient une vie effroyablement difficile, pour de multiples raisons. Tout d’abord ces mineurs cherchaient en vain du cuivre, et ils ne pouvaient pas reconnaître ni utiliser le cobalt ou le nickel. D’autre part, ils s’intoxiquaient gravement en grillant des minerais qui étaient des sulfures et des arséniures. Enfin, les effondrements de galeries étaient meurtriers.
Dans les légendes allemandes, les responsables de toutes ces avanies subies par les mineurs étaient les Kobolds, de petits lutins maléfiques qui hantaient les mines souterraines. Les mineurs affublaient les minerais qu’ils trouvaient de ce nom de Kobold (emprunté en français, kobold), dont s’est inspiré le chimiste suédois G. Brandt pour nommer le cobalt, qu’il identifiait en 1735.
Et le nickel ?
Pour amadouer les méchants kobolds, les mineurs leur donnaient par antiphrase un petit nom affectueux, souvent Nickel, diminutif de Nicolas, le nom du saint le plus populaire des régions germaniques. Ainsi, les dictionnaires allemands définissent un Nickel comme étant un Kobold particulier. Les mineurs employaient même le terme Kupfernickel, c’est-à-dire « le petit Nicolas du cuivre », qui vous promet le cuivre et au lieu de cela vous empoisonne. On comprend alors que, lorsque le chimiste suédois Cronstedt a identifié le nickel en 1851, il l’a nommé ainsi en écho au nom donné au cobalt une quinzaine d’années plus tôt.
4. Des noms d’origine botanique
La soude est un produit chimique bien connu pour être caustique (venant, par le latin, du grec kaustikos, du verbe kaiein « brûler »). Mais quel est le premier sens du mot soude ?
La soude, c’est d’abord une plante.
La soude commune (Salsola soda). GFDL license authorized by L. Rignanese on 2-November-2006.
Comme la salicorne, c’est une plante dite halophile (« qui aime le sel marin »), poussant sur les rivages maritimes, là où les sols sont imprégnés de sel.
Il existe de nombreuses espèces de soudes, caractérisées par leur concentration élevée en sels minéraux, que l’on sait maintenant être des mélanges de carbonates et de nitrates, de sodium et de potassium. Depuis l’Antiquité, on brûlait ces plantes pour tirer de leurs cendres diverses substances comme celles nommées aujourd’hui soude et potasse.
Le chimiste anglais Humphry Davy a obtenu par électrolyse de ces substances les métaux qu’il a nommés sodium et potassium en 1808. Il a dérivé potassium de l’anglais potash, « potasse », formé de pot, « pot, récipient », et ash, « cendre », d’où vient aussi potasse en français.
Humphry Davy (1778–1829). Copyright : Wikipedia Commons.
Quant à sodium, Davy l’a dérivé du bas latin soda, qui désignait à la fois la soude, la plante, et la substance tirée de ses cendres. Ce mot soda est d’origine arabe, et on le rapproche du bas latin sodanum, « remède contre la migraine », de l’arabe sudā signifiant « migraine », sans doute en référence à l’effet bénéfique du bicarbonate présent dans ces plantes. Celles-ci se nommaient aussi en arabe qalî, et avec l’article, al-qalî, d’où alcali, le nom donné aux sels basiques tirés des cendres végétales, et l’adjectif alcalin. Ce terme se relie cette fois au verbe signifiant « faire brûler, griller » en arabe.
Berzelius (1779–1848). Copyright : Wikipedia Commons.
Enfin un élève de Berzelius découvre en 1817, à partir d’un minerai trouvé en Suède, un nouveau métal qui s’avère être alcalin, comme le sodium et le potassium. Berzelius le nomme lithium, du grec lithos, « pierre », pour rappeler qu’il avait été « découvert dans le règne minéral, alors que les deux autres [le sodium et le potassium] l’avaient été dans le règne végétal ».
Venons-en à des noms d’éléments d’inspiration géographique, ce qui donne l’occasion d’évoquer les travaux de Mendeleïev, en commençant par rappeler l’état actuel du tableau périodique.
5. Des noms d’origine géographique
— le tableau périodique actuel
Le tableau périodique comporte à ce jour 118 éléments, dont 90 naturels, de l’hydrogène (élément 1) à l’uranium (élément 92) sauf les éléments 43 et 61 obtenus de manière artificielle, de même que les éléments transuraniens, de 93 à 118. Soit au total 90 éléments naturels et 28 artificiels, tous radioactifs.
Ce tableau est présenté sous la forme de 18 colonnes et 7 lignes (Figure 1).
Le tableau périodique actuel.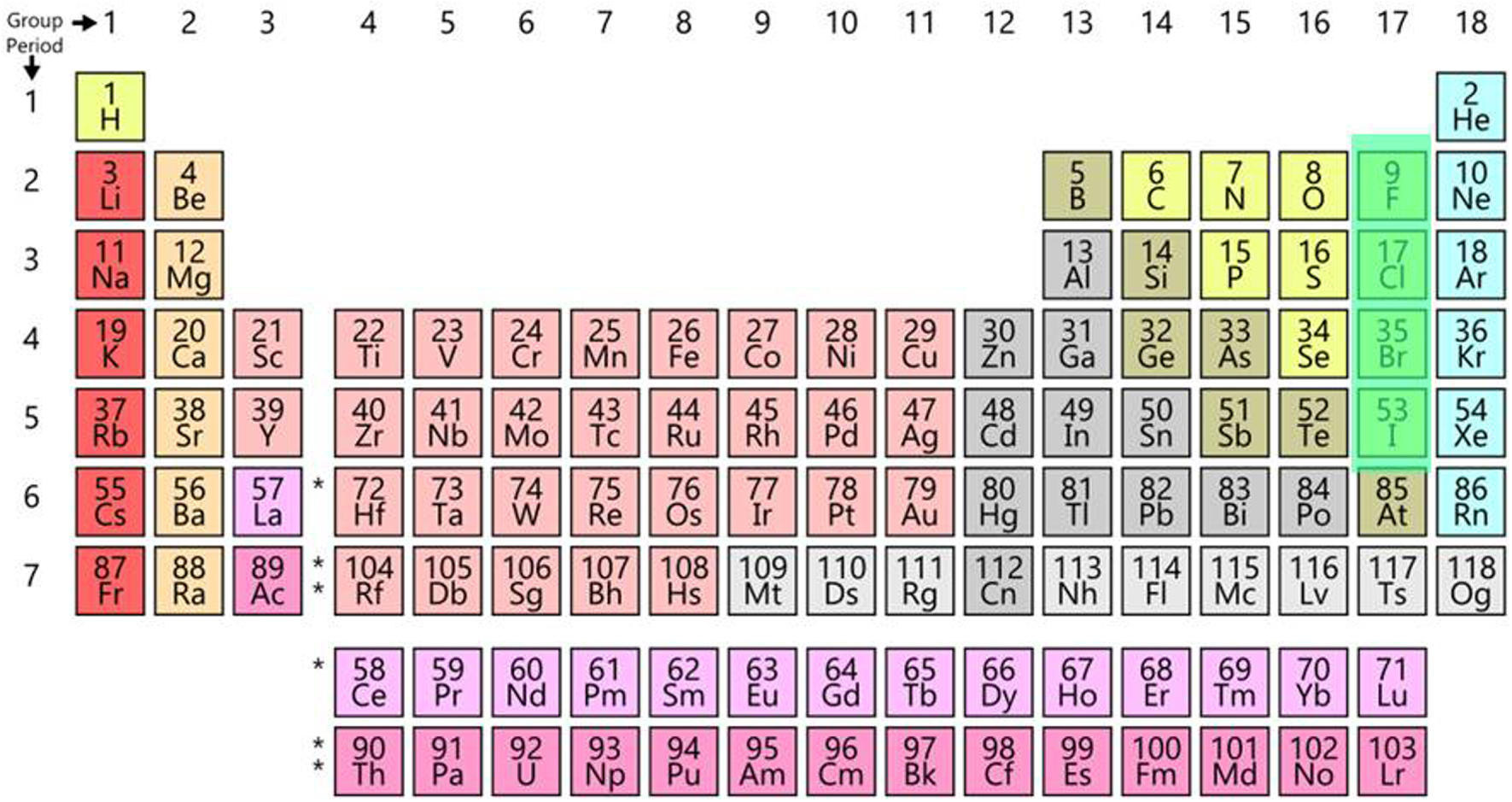
Rappelons les noms des principales familles :
colonne 1 : les métaux alcalins
colonne 2 : les métaux alcalinoterreux
colonnes 3 à 12 : les métaux de transition, dont les terres rares (dans la colonne 3 et la ligne 6) et les actinides, y compris les transuraniens (dans la ligne 7).
colonnes 12 à 16 : les métaux pauvres, métalloïdes et non métaux
colonne 17 : les halogènes (sauf l’astate, un métalloïde)
colonne 18 : les gaz nobles (anciennement gaz rares)
Le tableau établi par Mendeleïev en 1872, suite à sa publication de 1869. Mendeleïev en 1861. Photo Sergey Lvovitch Levitsky.
— la publication de Mendeleïev
Il est intéressant de situer par rapport au tableau actuel la publication de Mendeleïev en 1869 et les années suivantes, notamment son tableau de 1872 (Figure 2) :
le tableau comporte 63 éléments, dont 62 sont valides puisque le didyme (symbole Di) s’avèrera en 1886 être un mélange de 2 terres rares : le praséodyme et le néodyme.
Ce tableau a constitué une avancée considérable dans la compréhension de la périodicité des propriétés chimiques en fonction de la masse atomique des éléments :
— d’une part les 62 éléments connus à cette date sont classés en 17 lignes, correspondant aux 17 premières colonnes des 18 du tableau actuel. Ce classement est d’une remarquable pertinence, les métaux de transition en particulier étant classés pour la première fois dans le bon ordre.
— d’autre part, le génie de Mendeleïev a été de prévoir l’existence d’éléments encore inconnus, effectivement découverts par la suite, et situés aux emplacements prévus dans son tableau. Cette prévision est schématisée sur le tableau de la Figure 2 par 5 flèches (on aurait pu en placer une dizaine). Le premier cas est apparu en 1875, avec le gallium, qui a pris place dans la ligne 13 entre l’aluminium et l’indium, et que Mendeleïev avait anticipé sous le nom de eka-aluminium (eka = 1 en sanskrit).
François Lecoq de Boisbaudran (1838–1912) et le coq de son blason familial. Wikimedia Commons : unknown author.
— le gallium
Et c’est toute une histoire qui est attachée au nom du gallium, découvert en 1875 au moyen de la spectroscopie par François Lecoq de Boisbaudran. En effet, celui-ci a proposé le nom gallium dès 1875 sans en donner la moindre justification, ce qui normalement ne se fait pas. La communauté internationale a tout de même accepté gallium, mais en même temps qu’une interprétation quelque peu polémique se répandait : le découvreur se serait mis en avant en s’inspirant de son propre nom, symbolisé fièrement par un coq (en latin, gallus) sur le blason familial. Une telle attitude ne s’était jamais vue, et, même si par la suite on a nommé des éléments en honorant de grands scientifiques, on a cherché à ne pas le faire de leur vivant.
Après avoir laissé le champ libre aux interprétations, Lecoq de Boisbaudran révèle en 1877, dans les Annales de Chimie et de Physique [4, p. 103], qu’il a nommé le gallium « en l’honneur de la France (Gallia) ». Le problème c’est que cette explication écrite est arrivée tardivement, et que beaucoup ont continué à voir en gallium un dérivé de gallus, « coq ». Pourtant, la justification donnée par Lecoq de Boisbaudran était crédible : près de trente ans plus tôt, le nom du ruthénium avait été formé sur le nom en bas latin, Ruthenia, de la Russie. De plus, en dédiant le gallium à la France, il honorait son pays dans une période de forte tension avec l’Allemagne. Or le chimiste allemand Winkler découvrait en 1886 un nouvel élément, qu’il a nommé sans équivoque germanium d’après Germania, le nom latin de l’Allemagne. Cela fut perçu comme une réponse à Lecoq de Boisbaudran, et a posteriori, cela renforçait le lien entre gallium et Gallia.
En résumé, on peut admettre que gallium renvoie explicitement à la France, la nationalité de son découvreur, et implicitement au nom de celui-ci. À ce propos, le latin gallus, « coq » signifie peut-être tout simplement « (oiseau) gaulois », le coq ayant été considéré comme typiquement gaulois par les Romains, qui plaisantaient sur le jeu de mots Gallus gallus, « coq gaulois » (resté l’emblème sportif de la France !). Dans les deux cas, gallium flatte donc l’orgueil national de la France !
6. Des noms tirés directement du grec ancien
— un événement extraordinaire
Lors de l’éclipse du Soleil de 1868, les astrophysiciens détectent dans le spectre de la couronne solaire une intense raie jaune, d’abord prise pour celle du sodium, puis finalement attribuée à un élément nouveau, alors inconnu sur Terre. Logiquement, cet élément « extraterrestre » est nommé hélium, du grec hêlios, « Soleil », et c’est seulement en 1882 que l’hélium est détecté dans une roche volcanique, puis en 1895 que le chimiste anglais William Ramsey parvient à l’isoler à partir d’un minerai d’uranium.
— la découverte des gaz nobles (anciennement rares)
En fait, lors de sa découverte de l’hélium, Ramsay cherchait à retrouver dans le minerai d’uranium le gaz qu’il avait isolé l’année précédente (1894). Comme ce gaz apparaissait inerte, incapable de réagir avec d’autres substances, il l’avait nommé argon, du grec argos, « inactif », lui-même formé du a- privatif et de ergon, « action, travail » (d’où énergie…). Il apparaissait que l’hélium et l’argon étaient des gaz d’une nature nouvelle, ouvrant la voie à la découverte d’autres gaz, que Ramsay a isolés par une distillation de plus en plus poussée de l’air liquéfié.
Ramsay était aussi un linguiste et il a dérivé (en anglais, emprunté par les autres langues) les noms de ces gaz des adjectifs grecs neos, argos, kruptos, xenos, sous la forme du neutre (en -on) pour traduire l’extrême neutralité de ces gaz monoatomiques :
neos « nouveau » → néon
argos « inerte » → argon
kruptos « caché » → krypton
xenos « étrange » → xénon
Le nom du krypton se comprend car ce gaz a été découvert « caché » dans l’argon (donc impur). Le nom du xénon résulte d’une histoire plus compliquée.
La couleur bleutée des phares au xénon
— le xénon
Le grec xenos signifie d’abord « étranger », d’où aussi par métaphore, « inconnu, étrange ». Or Ramsay en anglais emploie bien l’adjectif stranger, et non pas foreigner [5, p. 106]. Mais alors, pourquoi étrange ? À cause de la couleur bleu intense du spectre d’émission, inattendue, de ce nouveau gaz. Ceux-ci ont d’abord cherché un nom évoquant le bleu, mais en évitant un radical déjà utilisé depuis longtemps en chimie organique. Ainsi par exemple *cyanon, du grec kuanous, « bleu », ne convenait pas car ce radical était déjà depuis longtemps à la base du mot cyanure. Finalement, faute de radical « bleu » disponible, l’idée fut de se baser sur le grec xenos encore inutilisé en chimie, xénon signifiant ici « étrange (à cause d’une couleur bleue inattendue) ».
William Ramsay (1852–1916). Wikimedia Commons: Popular Science Monthly Vol. 67, 1905, unknown author.
— la 18e colonne
Tous ces nouveaux éléments posaient un problème : ils ne trouvaient de place dans aucune case libre du tableau périodique alors en vigueur, ne comportant encore que 17 colonnes. L’existence d’une 18e colonne n’avait pas été prévue par Mendeleïev, ni par personne d’autre. Ce sont bien Ramsay et Rayleigh qui l’ont proposée pour accueillir l’hélium et l’argon, puis très rapidement le néon, le krypton et le xénon. Dans un premier temps Mendeleïev a même rejeté l’idée, pour finalement reconnaître dans une lettre de 1902 que la 18e colonne se justifiait, et constituait « une confirmation glorieuse du caractère général de l’application de la loi périodique » [6, p. 144].
La Vis tellurique de Chancourtois en guise d’épilogue
Mendeleïev n’était pas le premier à mettre en évidence une périodicité dans les propriétés des éléments en fonction de leur masse. D’après les dates de publication, ce mérite revient au géologue Chancourtois, qui a proposé en 1862 un classement des éléments basé sur une hélice tracée sur un cylindre, dite « Vis tellurique ». Ce premier système périodique n’était pas aussi performant que celui publié par Mendeleïev en 1869, mais il n’en constituait pas moins une innovation majeure.
Alexandre-Émile Béguyer de Chancourtois (1820–1886). Wikimedia Commons : date 15 February 2007.
Chancourtois a donc eu l’idée d’ordonner les éléments par masses croissantes en les alignant le long de segments inclinés à 45° pour constituer un tableau que l’on peut qualifier d’oblique.
La Vis tellurique de Chancourtois, conservée à l’École des Mines de Paris
Ainsi, Chancourtois a correctement placé les 2 ou 3 premiers éléments des colonnes 1, 2, 13, 14, 15, 16, et 17 : le sodium se trouvait par exemple placé en-dessous du lithium, le calcium en-dessous du magnésium et le silicium en-dessous du carbone, le chlore en-dessous du fluor, etc. Ensuite, il a enroulé le tableau sur un cylindre, de sorte que les segments à 45° constituent une hélice continue, les familles chimiques se trouvant alors sur les génératrices du cylindre.
Toutefois, ce système perdait toute pertinence à partir de la troisième spire de l’hélice, car Chancourtois n’avait pas classé correctement les métaux de transition, ce que fera Mendeleïev plus tard en préfigurant les colonnes 3 à 12 du tableau actuel.
Même s’il y eut d’autres contributeurs, notamment Lothar Meyer en Allemagne, on peut considérer que les trois principaux bâtisseurs du tableau périodique ont été Chancourtois, pour l’idée initiale, Mendeleïev pour la compréhension de l’essentiel du tableau, et Ramsay pour la 18e colonne, que l’on peut qualifier de clé de voûte du système.
Le tableau périodique est une construction dont les principaux architectes ont été Chancourtois (1820–1886), Mendeleïev (1834–1907) et Ramsay (1852–1916).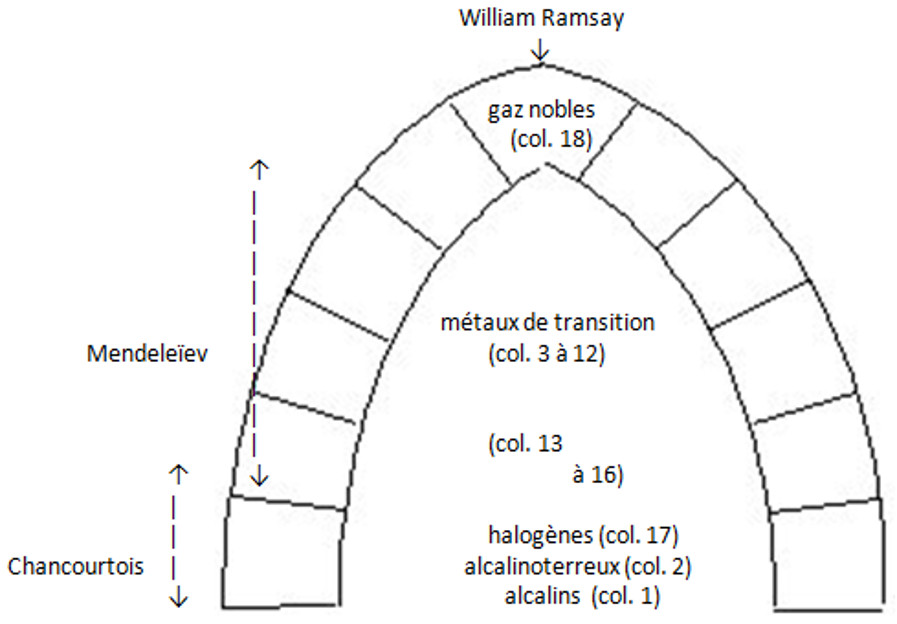
Cela suggère le schéma métaphorique suivant :
Le tableau s’est rempli progressivement grâce aux découvreurs d’éléments, dont ceux apparus dans le présent article ont été parmi les plus gros contributeurs :
Lavoisier d’abord avec les 23 premiers éléments en 1789, Martin Klaproth, Humphry Davy, Berzelius, Lecoq de Boisbaudran, William Ramsay et sa colonne de gaz nobles, Glenn Seaborg et sa ligne de transuraniens.
Nous devons à ces grands personnages de l’histoire de la chimie la découverte de près des deux tiers de la centaine d’éléments chimiques qui constituent notre univers.
Pour en savoir plus :
La prodigieuse histoire du nom des éléments, EDP Sciences/SCF, Paris, 2018 (Pierre Avenas, avec la collaboration de la journaliste scientifique Minh-Thu Dinh-Audouin, préface de Jacques Livage).



 CC-BY 4.0
CC-BY 4.0