Abridged English version
1 Introduction
The silicated gels found in nature may be reasonably regarded as the precursors of well-crystallized minerals [11,12]. The CaSi gels are mainly found within concrete affected by Alkali–Silica Reaction (ASR). ASR consists of chemical attack of reactive silica of aggregate by the interstitial alkaline solution in the presence of portlandite Ca(OH)2. The disorders of ASR within concrete are attributable to the expansive growth in the limited porous space of concrete of CaSi gels produced by ASR, hereafter called natural gels. The chemical composition of these natural gels was studied by Scanning Electron Microscopy–Energy Dispersive Spectroscopy (SEM–EDS) analysis by several authors [1–4,7].
On the other hand, synthetic CaSi gels are readily prepared by precipitation from mother-solutions of calcium chloride CaCl2 and sodium metasilicate (SiO2, Na2O) [10]. These synthetic gels are good analogues of fresh natural gels products of ASR within concrete [7]. The conditions of growth of natural gels within concrete (hyperalkaline medium, porous limited space) and these previous works suggest a correlative evolution of composition and molar volume of gels. This experimental study is a first approach of that by means of synthetic gels.
2 Composition of gels
We studied eight synthetic gels of various compositions. The stoichiometric composition of gels is deduced from the composition of the residual formation solutions in equilibrium with these gels. According to the cement industry usage, the stoichiometric parameter used is the molar ratio C/S=CaO/SiO2, respectively written (C/S)g for the formed gels, and (C/S)0 for the corresponding theoretical values given by initial solutions. The range of studied composition nearly corresponds to an order of magnitude:
The following expression permits a plain analysis of the relative difference of C/S between theoretical value and effective value of the gel over all studied range of composition:
2.1 Method
For any C/S ratio, the overall balanced reaction of a gel formation writes:
| (1) |
Moreover, all the mother-solution concentrations are 0.1 M in each species. Thus, the volumes of used solutions represent the proportions of reacting species according to c,s,x and y in the balanced reaction (1). Lastly, we put conventionally s=1 for 20 ml of 0.1 M (SiO2, Na2O) solution. Then, the previous equation can be written:
According to the C/S value, three cases must be discussed:
- • C/S>1⇔y>x; for x=0, it comes ymin such as ymin=2(C/S−1).
- • C/S=1⇔y=x; xmin=ymin=0.
- • C/S<1⇔y<x; for y=0, it comes xmin such as xmin=2(1−C/S).
So, for each theoretical (C/S)0 value, the required volume of 0.1 M HCl or NaOH solution in overall balanced reaction (1) is respectively 20xmin ml or 20ymin ml.
Experiments were performed without stirring at 20 °C, 1 bar. Each experiment is independent of the others, and at least in duplicate. After 21 days, each equilibrium is fully reached [9,10] and chemical analyses of Ca and Si are performed by Inductive Current Plasma (ICP) on each residual formation solution in equilibrium with the corresponding gel. Na was not determined, the more that the CaSi structures of gels do not seem to incorporate alkalis cations [5,6].
2.2 Results
The data and the results of experiments are given in Table 1. The curve Δ(C/S)/(C/S)0=f[(C/S)0] drawn from these results (Fig. 1) shows a distinct minimum centred on (C/S)0=0.5 for (C/S)g≅0.48.
Variation de C/S
Variation of C/S
| (C/S)0 | Si sol | Ca sol | Si gel | Ca gel | (C/S)g | Δ(C/S)/(C/S)0 |
| (mg l−1) | (mg l−1) | (10−3 mol) | (10−3 mol) | |||
| 2 | 0,38 | 473,60 | 1,999 | 2,816 | 1,409 | 0,296 |
| 2 | 0,39 | 487,80 | 1,999 | 2,781 | 1,391 | 0,304 |
| 1,2 | 2,14 | 190,10 | 1,996 | 2,153 | 1,079 | 0,101 |
| 1,2 | 1,91 | 208,70 | 1,996 | 2,129 | 1,066 | 0,111 |
| 1 | 3,99 | 104,10 | 1,994 | 1,896 | 0,951 | 0,049 |
| 1 | 4,88 | 115,90 | 1,993 | 1,884 | 0,945 | 0,055 |
| 0,8 | 35,86 | 119,40 | 1,944 | 1,469 | 0,756 | 0,055 |
| 0,8 | 54,41 | 133,30 | 1,914 | 1,453 | 0,759 | 0,051 |
| 0,6 | 101,60 | 121,00 | 1,826 | 1,055 | 0,578 | 0,037 |
| 0,6 | 83,00 | 113,20 | 1,858 | 1,064 | 0,573 | 0,045 |
| 0,5 | 105,90 | 106,30 | 1,811 | 0,867 | 0,479 | 0,042 |
| 0,5 | 112,30 | 109,70 | 1,799 | 0,863 | 0,480 | 0,041 |
| 0,5 | 110,60 | 106,40 | 1,803 | 0,867 | 0,481 | 0,038 |
| 0,5 | 112,40 | 110,10 | 1,799 | 0,862 | 0,479 | 0,041 |
| 0,4 | 118,30 | 106,40 | 1,780 | 0,662 | 0,372 | 0,071 |
| 0,4 | 122,10 | 102,00 | 1,773 | 0,667 | 0,376 | 0,059 |
| 0,3 | 137,30 | 103,60 | 1,735 | 0,460 | 0,265 | 0,116 |
| 0,3 | 137,40 | 103,70 | 1,735 | 0,460 | 0,265 | 0,116 |
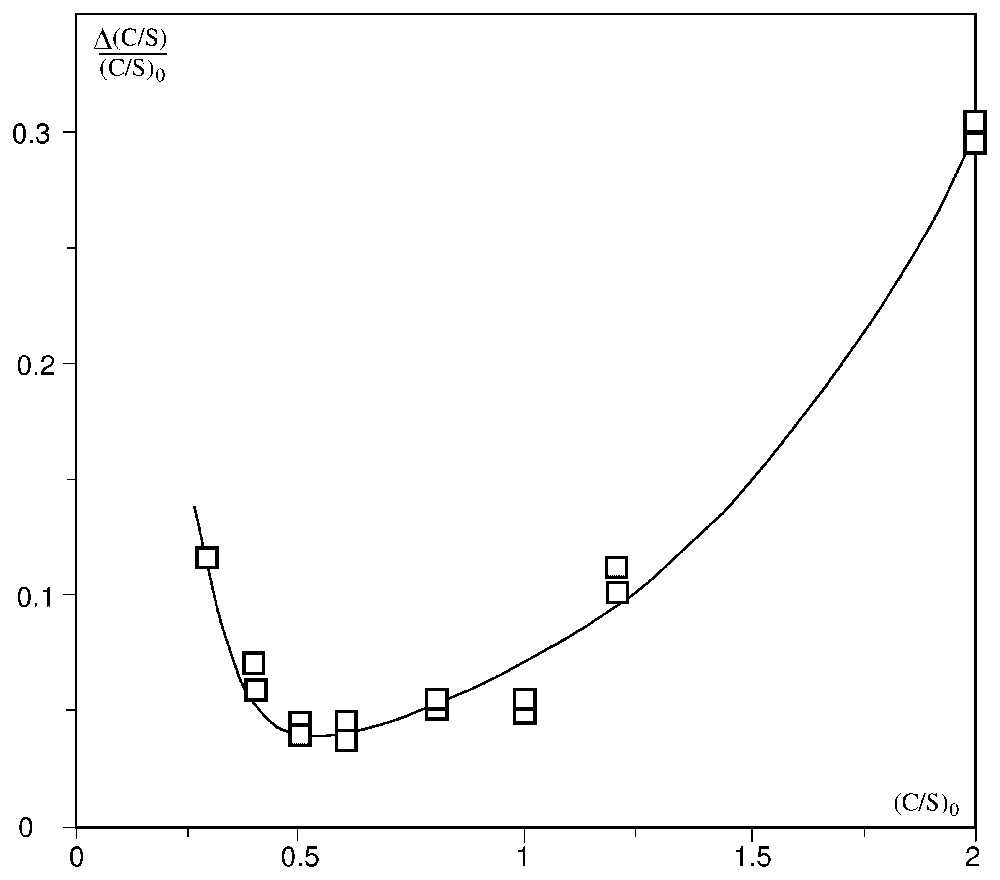
Variation relative de la valeur effective (C/S)g en fonction de la valeur théorique (C/S)0 pour huit gels synthétiques d'après les valeurs du Tableau 1. Ordonnées: Δ(C/S)/(C/S)0; abscisses: (C/S)0.
Relative variation of the effective value (C/S)g as a function of the theoretical value (C/S)0 for eight synthetic gels from the values of Table 1. Ordinate: Δ(C/S)/(C/S)0; abscissa: (C/S)0.
Then, this characteristic value indicates an optimum of composition of synthetic gels in equilibrium with their residual formation solutions.
3 Apparent molar volume of gels
As before, we formed eight gels over the range of composition 0.3⩽(C/S)0⩽2. Nevertheless, the following experiments were conducted using 0.5 M mother-solution concentrations in each species. In these conditions, the amounts of synthetic precipitated gels are more important than with 0.1 M mother-solution concentrations.
3.1 Method
The different values of (C/S)0 are obtained from 0.5 M mother solutions of each species by changing proportions. The sum of initial volumes of reactants in the overall balanced reaction (1) is always exactly 250 ml. For that, we used the same set of calibrated vessels (jars, pipettes) for all experiments. For each experiment, the positive measured variation of overall volume of the system after formation of gel is δVm. As a first approximation, the partial molar volumes of reacting species in solution were not taken into account. Likewise, the correction for the volume of formed water given by the overall balanced reaction (1) for each (C/S)0 value is approximated to be 18 cm3 mol−1 as pure water. This volume of formed water is subtracted from δVm. Thus, within the accuracy of experiments, the remaining variation of volume δVg is attributable to the number of moles of gel formed. According to the definition of the compositional effective parameter (C/S)g and the number s of moles of silica consumed, the apparent molar volume of gel Vg is given by:
Experiments are performed without stirring at 20 °C and 1 bar as previously. Each experiment is independent of the others, and repeated at least three times. Taking into account the accuracy of the measures, each result is the average of the values which display a dispersion lower than 10%.
3.2 Results
The data and the results of experiments are given in Table 2.
Variation du volume global δVm du système en fonction de C/S
Variation of the overall volume δVm of the system as a function of C/S
| (C/S)0 | (C/S)g | SiO2 gel | H2O | δV m | δV g | V g |
| (10−3 mol) | (10−3 mol) | (cm3) | (cm3) | (cm3 mol−1) | ||
| 2 | 1,400 | 25 | 25 | 1,750 | 1,300 | 21,22 |
| 1,2 | 1,072 | 25 | 5 | 1,227 | 1,137 | 21,95 |
| 1 | 0,948 | 50 | 0 | 2,000 | 2,000 | 20,51 |
| 0,8 | 0,757 | 50 | 10 | 1,900 | 1,720 | 19,57 |
| 0,6 | 0,575 | 25 | 10 | 1,000 | 0,820 | 20,82 |
| 0,5 | 0,480 | 50 | 25 | 2,200 | 1,750 | 23,65 |
| 0,4 | 0,375 | 25 | 15 | 1,045 | 0,775 | 22,56 |
| 0,3 | 0,265 | 25 | 17,5 | 0,864 | 0,549 | 17,35 |
Fig. 2 shows the curve Vg=f[(C/S)g] drawn from these results. Within the limits of these experiments, the apparent molar volume Vg is noticeably constant from (C/S)g≅0.5 upwards and decreases clearly from (C/S)g≅0.5 downwards. Then, the apparent molar volume of gels Vg appears close to 21.5 cm3 mol−1 for (C/S)g⩾0.5.
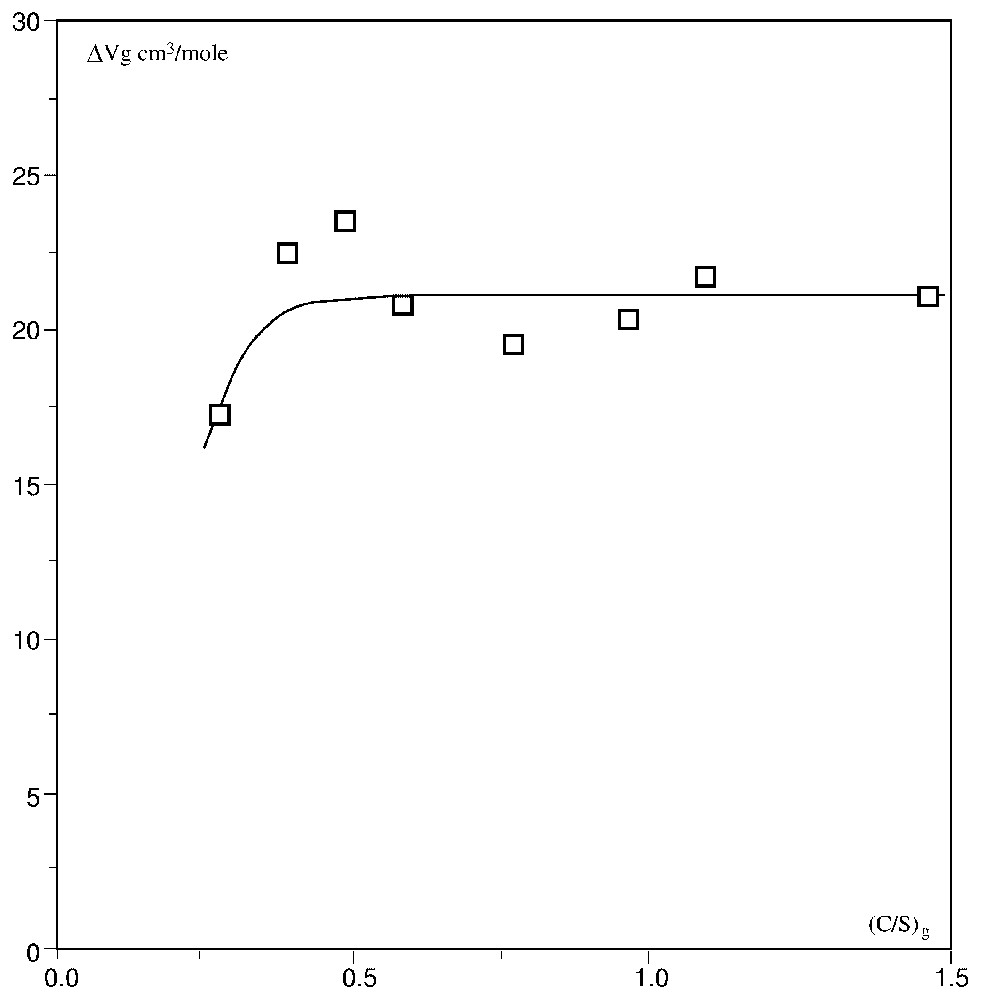
Variation du volume molaire apparent Vg des gels en fonction de la valeur effective (C/S)g pour huit gels synthétiques d'après les valeurs du Tableau 2.
Variation of the apparent molar volume Vg of gels as a function of the effective value (C/S)g for eight synthetic gels from the values of Table 2.
4 Conclusions
The characteristic molar ratio (C/S)g≅0.48 denotes clearly a natural optimum of composition of synthetic gels in equilibrium with their residual formation solutions. These results corroborate the one settled by SEM–EDS analysis of synthetic gels and are also consistent with those which characterize the fresh natural gels products of ASR within their formation medium: reactive silica, portlandite and interstitial alkaline solution [7,8].
The apparent molar volume Vg increases with (C/S)g, but from (C/S)g≅0.5 upward, Vg becomes noticeably constant: the characteristic molar ratio corresponds probably to a rearrangement in the structure of gels. The explanation of this phenomenon needs further experiments to determine the real molar volume of these gels, taking into account the partial molar volumes of all reacting species for the same conditions.
1 Introduction
Les gels silicatés rencontrés dans la nature peuvent être considérés comme les précurseurs de minéraux néoformés [11,12]. Les gels silico-calciques (CaSi) se développent principalement au sein des bétons affectés par la réaction Alcalis–Silice (RAS). La RAS est une attaque chimique de la silice réactive du granulat par la solution hyperalcaline interstitielle, en présence de portlandite Ca(OH)2. Les désordres engendrés par la RAS au sein des bétons sont imputés à la croissance expansive, dans un espace poreux limité, des gels CaSi résultant de ce processus délétère. La composition chimique de ces gels, dénommés par la suite gels naturels, a été largement étudiée par spectrométrie à dispersion d'énergie (MEB–EDS) [1–4,7].
Par ailleurs, des gels de synthèse CaSi de différentes compositions sont aisément préparés par précipitation à partir de solutions connues de chlorure de calcium CaCl2 et de métasilicate de sodium (SiO2, Na2O) [10]. Placés dans des conditions identiques à celles favorisant le développement accéléré des gels naturels frais produits par la RAS au sein d'un béton, les gels de synthèse présentent des caractéristiques morphologiques et stœchiométriques quasi identiques à celles des gels naturels frais [7]. Ces constatations et les contraintes de milieu dans lesquelles les gels naturels se développent au sein d'un béton (milieu hétérogène hyperalcalin, espace poreux limité) suggèrent l'existence possible d'une corrélation entre la composition et le volume molaire de ces gels. Le présent travail constitue une première étude expérimentale de cette possible corrélation, à partir des analogues de synthèse.
2 Composition des gels
Nous avons synthétisé huit gels de diverses compositions. Les compositions de ces gels sont déduites de l'analyse des compositions de leurs solutions de formation résiduelles respectives à l'équilibre avec ceux-ci. Conformément à la notation cimentière habituelle, le paramètre stœchiométrique utilisé est le rapport molaire C/S
2.1 Méthode
Pour un gel de rapport C/S donné, et compte tenu de la conservation de chaque élément, le bilan réactionnel global de la formation de ce gel s'écrit :
| (1) |
Par ailleurs, toutes les concentrations des solutions mères utilisées dans ces expériences sont 0,1 M en chaque espèce. Ainsi, les volumes de solutions utilisés sont dans les proportions des espèces réagissantes suivant les coefficients stœchiométriques c,s,x et y du bilan réactionnel (1). Enfin, ces volumes sont déterminés en posant conventionnellement s=1 pour 20 ml de solution (SiO2, Na2O) 0,1 M. L'équation précédente s'écrit alors :
Compte tenu de la valeur de C/S, trois cas sont donc à envisager :
- • C/S>1⇔y>x ; à x=0 correspond ymin tel que ymin=2(C/S−1).
- • C/S=1⇔y=x ; alors xmin=ymin=0.
- • C/S<1⇔y<x ; à y=0 correspond xmin tel que xmin=2(1−C/S).
Ainsi, pour chaque valeur imposée de (C/S)0, le volume de solution 0,1 M HCl ou 0,1 M NaOH nécessaire pour satisfaire au bilan réactionnel (1) est respectivement 20xmin ml ou 20ymin ml.
Toutes les expériences ont été réalisées à 20 °C, 1 bar, et sans agitation mécanique du milieu réactionnel. Elles sont indépendantes les unes des autres, et chacune d'elles est répétée au moins deux fois. Après 21 jours, chaque équilibre est totalement établi [9,10]. Pour chaque solution de formation résiduelle à l'équilibre avec le gel correspondant, les analyses chimiques du calcium et du silicium sont effectuées par ICP. Le sodium n'a pas été analysé, étant donné que les structures des gels CaSi ne semblent pas incorporer les alcalins [5,6]. En raison de l'addition de HCl, ou de NaOH, suivant la valeur de (C/S)0, le pH mesuré à l'équilibre varie entre 11,6 et 13,6.
2.2 Résultats
Les données et les résultats de ces expériences sont rassemblés dans le Tableau 1.
La courbe Δ(C/S)/(C/S)0=f[(C/S)0] tracée à partir de ces résultats (Fig. 1) montre un minimum très net, centré sur (C/S)0=0,5 et correspondant à (C/S)g≅0,48. Cette valeur caractéristique correspond donc à l'optimum de composition des gels de synthèse à l'équilibre avec leurs solutions de formation résiduelles respectives. Ces résultats confirment ceux obtenus par MEB–EDS, pour des gels synthétiques de diverses compositions, placés dans des conditions favorables au développement de la RAS au sein des bétons [7,8].
3 Volume molaire apparent des gels
En procédant comme précédemment, nous avons repris la synthèse de huit gels sur le même domaine de composition 0,3⩽(C/S)0⩽2 et pour les mêmes valeurs de (C/S)0. Cependant, afin d'obtenir des variations de volume plus aisément mesurables, nous avons utilisé des solutions mères 0,5 M en chaque espèce. Dans ces conditions, les quantités de gels formées sont nettement plus importantes qu'avec des solutions mères 0,1 M, et l'équilibre s'établit en une dizaine de jours seulement.
3.1 Méthode
Les différentes valeurs de (C/S)0 sont donc ici encore obtenues en modifiant les proportions entre les volumes initiaux des solutions mères, suivant les coefficients stœchiométriques c,s,x, et y du bilan réactionnel (1). De plus, compte tenu du but recherché, la somme de ces volumes initiaux est toujours exactement calibrée à 250 ml. Pour cela, toutes les expériences sont réalisées avec un seul et même jeu de verrerie jaugée (classe A), dont les caractéristiques ont été au préalable vérifiées par pesée avec de l'eau distillée. Pour chaque expérience, la variation toujours positive du volume total du système, mesurée après la formation du gel, est notée δVm. En première approximation, les volumes molaires partiels des espèces réagissantes dans les solutions mères n'ont pas été pris en compte. De même, la correction du volume d'eau formée, conformément au bilan réactionnel (1) et suivant la valeur de (C/S)0, est déterminée en prenant, comme pour l'eau pure, 18 cm3 mol−1. Ce volume d'eau formée est soustrait de δVm. Ainsi, dans les limites de ces approximations et de la précision des mesures, la variation finale du volume δVg est imputable au nombre de moles de gel formé. Compte tenu de la valeur du paramètre stœchiométrique effectif (C/S)g et du nombre s de moles de silice consommée, le volume molaire apparent Vg du gel est donné par :
Comme précédemment, toutes les expériences ont été réalisées à 20 °C, 1 bar, et sans agitation mécanique du milieu réactionnel. Elles sont indépendantes les unes des autres, et chacune d'elles est répétée au moins trois fois. Compte tenu de la précision des mesures, chaque résultat est la moyenne des valeurs dont la dispersion n'excède pas 10 %.
3.2 Résultats
Les données et les résultats de ces expériences sont rassemblés dans le Tableau 2. La Fig. 2 montre l'allure de la courbe Vg=f[(C/S)g] construite à partir de ces résultats. Dans la limite de ces expériences, le volume molaire apparent Vg est sensiblement constant pour (C/S)g⩾0,5, et il décroı̂t nettement, lorsque (C/S)g se situe en dessous de cette valeur. Ainsi, le volume molaire apparent Vg des gels semble voisin de 21,5 cm3 mol−1 pour (C/S)g⩾0,5.
4 Conclusions
Le rapport molaire caractéristique (C/S)g
Le volume molaire apparent Vg est fonction croissante de (C/S)g jusqu'à (C/S)g≅0,5, valeur assimilable à 0,48 à la précision de nos mesures, et demeure sensiblement constant au-dessus de cette valeur remarquable. Cette valeur correspond donc très probablement à un réarrangement de la structure de ces gels. L'explication de ce phénomène nécessite davantage d'expérimentations pour déterminer le volume molaire réel de ces gels, notamment en prenant en considération les volumes molaires partiels de toutes les espèces réagissantes dans les mêmes conditions.


