1 Introduction
Les zéolithes sont des matériaux de choix utilisés comme catalyseurs, adsorbants et tamis moléculaires [1]. Parmi ces zéolithes, un type a retenu l'attention, en l'occurrence les zéolithes de type ZSM-5, en raison de leurs propriétés particulières dans de nombreux procédés industriels, tels le déparaffinage des huiles lourdes [2], la transalkylation du toluène [3,4], l'isomérisation des xylènes [4,5] ou la transformation directe du méthanol en un mélange d'hydrocarbures à indice d'octane élevé [6,7]. Ces propriétés, dues à la sélectivité de forme au niveau des réactifs, des complexes intermédiaires ou des produits de réaction [8,9], dépendent de la dimension, de la géométrie des canaux et de la morphologie (taille et forme) des cristaux. Ces paramètres ainsi que le degré de cristallinité et la pureté de la zéolithe obtenue dépendent d'un certain nombre de facteurs : l'alcalinité [10], la température [11], le temps de cristallisation [12], le type et la teneur en cation [13–16], la nature des réactifs [12], la composition chimique du mélange réactionnel [17] et la méthode de préparation [18,19]…
Les premières synthèses ont fait appel à des bases simples, telles que la soude, la potasse ou leur mélange. Elles ont permis la préparation de zéolithes à larges pores X, Y ou mordénite, généralement obtenues à partir de gels de silice–alumine neutralisés par des cations alcalins [20,21]. Depuis, la gamme des produits cristallisés s'est largement étendue, grâce au remplacement partiel ou total des cations alcalins par des cations organiques permettant la synthèse des zéolithes riche en silice. Barrer et Denny [22] ont découvert que la présence simultanée d'ions quaternaires et alcalins conduisait à la formation des structures cristallines plus ouvertes. C'est ainsi que de nombreuses zéolithes ont été synthétisées, en utilisant comme cation alcalin Na+ et des ions quaternaires : tétraméthylammonium TMA+ pour les zéolithes ZK-4 [23], Oméga et errionite [24], tétraéthylammonium TEA+ pour la zéolithe béta [25], tétrabutylammonium TBA+ pour la zéolithe ZSM-11 [26,27] et tétrapropylammonium TPA+ pour la ZSM-5 [28].
Arguauer et Landolt [28] ont donné un domaine préférentiel pour la synthèse des zéolithes ZSM-5, à l'intérieur duquel les variations des différentes proportions en SiO2/Al2O3 et Na/(Na + TPA) ne modifient que la composition et non la structure de la zéolithe. Cundy et al. [29] indiquent que, sous certaines conditions, la taille des particules diminue avec la diminution du rapport Si/Al. Cependant, Persson et al. [30] ont constaté que la taille des particules augmente lorsque le rapport Si/Al diminue.
Erdem et Sand [31] ont accentué sur le rôle essentiel des cations Na+ ou K+, ajoutés sous forme d'hydroxydes, dans la formation des zéolithes ZSM-5 et ont rapporté que ces dernières ne pourraient pas être obtenues en l'absence de cations alcalins. Toutefois, il a été rapporté que la ZSM-5 peut se cristalliser en absence des cations Na+ [10]. Van Griecken et al. [32] ont rapporté que la présence des ions Na+ est nuisible pour l'obtention des cristaux de petite taille. Bien que la diminution de la concentration en ions Na+ n'influe pas de manière significative sur la cristallinité du solide, une diminution importante de la taille des cristaux est facilement observée.
Notre travail porte sur l'influence de la longueur de la chaîne alkyle de l'agent structurant, le rapport Si/Al et le taux de sodium présent dans le gel de départ.
Dans ce but, nous avons préparé une série de zéolithes et caractérisé les phases cristallines obtenues par diffraction des rayons X (XRD). La morphologie des cristaux a été observée par microscopie électronique.
2 Partie expérimentale
2.1 Préparation
La première série de zéolithes protoniques H-ZSM-5 a été préparée avec différents rapports Si/Al, avec comme agent structurant le bromure de tétrapropylammonium.
La seconde série a été préparée en faisant varier la longueur de la chaîne alkyle de l'agent structurant, le rapport Si/Al dans le gel de départ étant maintenu constant. À cet effet, trois templates ont été utilisés : l'ion tétraméthylammonium (TMA+), l'ion tétrapropylammonium (TPA+) et l'ion tétrabutylammonium (TBA+).
Le Tableau 1 donne la composition molaire du gel de synthèse.
Composition molaire du gel de synthèse
| Échantillon | Si/Al du gel de départ | Stœchiométrie du gel de départ |
| Série1 | ||
| A | 36 | 27,6 Na2O, Al2O3, 5,9 TPA+, 72,3 SiO2, 2875 H2O |
| B | 60 | 46,9 Na2O, Al2O3, 11,7 TPA+, 120,5 SiO2, 5564 H2O |
| C | 120 | 93,9 Na2O, Al2O3, 23,5 TPA+, 241,0 SiO2, 11 114 H2O |
| Série2 | ||
| D | 30 | 23,5 Na2O, Al2O3, 4,9 TBA+, 60,2 SiO2, 2789 H2O |
| E | 30 | 23,5 Na2O, Al2O3, 10,2 TMA+, 60,2 SiO2, 2789 H2O |
| F | 30 | 30,9 Na2O, Al2O3, 5,9 TPA+, 60,5 SiO2, 2687 H2O |
Les réactifs utilisés sont : une solution de silicate de sodium (Merck, 29,1% SiO2, 9,1% Na2O, 61,8% H2O), le sulfate d'aluminium (Al2(SO4)3,18 H2O) (Merck, pur), la soude (Merck), l'eau distillée et, comme agent organique, le bromure de tétrapropylammonium (Merck) pour les échantillons A, B et C, le bromure de tétrabutlyammonium (Merck) pour l'échantillon D et le bromure de tétraméthylammonium (Merck) pour l'échantillon E.
Les réactifs utilisés pour l'échantillon F sont : une solution de silicate de sodium (Prolabo, 33% SiO2, 14% Na2O, 53% H2O), le sulfate d'aluminium (Al2(SO4)3,18 H2O) (Merck), la soude (Merck), l'eau distillée et le bromure de tétrapropylammonium (Merck).
La préparation du gel des zéolithes a été réalisée de la manière suivante :
À la solution aqueuse de silicate de sodium, on ajoute, sous agitation, de la soude dissoute dans l'eau distillée, puis on rajoute successivement le sulfate d'aluminium et l'agent organique dissous dans l'eau distillée. Le gel obtenu est ensuite cristallisé en autoclave à une température de 175 °C pendant 48 h. Le produit obtenu est filtré, lavé, séché et calciné à 450 °C pendant 8 h.
La forme protonique de la zéolithe est obtenue par reflux avec une solution d'acide chlorhydrique 0,3 M à 80 °C.
2.2 Caractérisation
La caractérisation structurale des zéolithes est essentielle, car les propriétés catalytiques et d'adsorption sont étroitement liées à la taille et à la configuration des canaux constituant les zéolithes. Ainsi, une première caractérisation a été effectuée par diffraction des rayons X (XRD) ; les résultats obtenus sont ensuite comparés à ceux obtenus par microscopie électronique.
Les diagrammes de diffraction des rayons X sont obtenus à l'aide d'un diffractomètre de poudre de type Philips PW 1710, utilisant la radiation Kα du cuivre sous une intensité de 30 mA. La taille et la morphologie des zéolithes ont été observées au microscope électronique (Philips EM 420 T).
L'indexation des raies est effectuée par comparaison des angles 2 θ et des intensités relatives des raies avec les données de la littérature [26,33]. Après identification de la zéolithe, les paramètres linéaires de maille a, b et c sont déterminés à l'aide d'un programme de calcul itératif, utilisant les carrés des inverses des distances réticulaires.
3 Résultats et discussion
3.1 Analyse par diffraction des rayons X
Le diagramme de diffraction des rayons X de l'échantillon A ayant un rapport Si/Al de 36 et comme agent structurant le bromure de tétrapropylammonium est représenté sur la Fig. 1. Le doublet et le triplet, situés respectivement entre 7–9° et 22–25°, sont caractéristiques de la zéolithe ZSM-5 et apparaissent nettement sur le diagramme de l'échantillon A. Aucune autre phase cristalline n'est apparente.
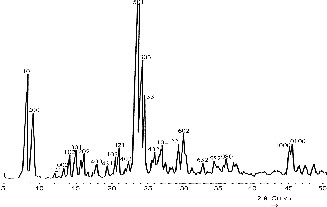
Diagramme de diffraction des rayons X de l'échantillon A (TPA, Si/Al = 36).
Cette caractérisation nous a permis d'identifier tous les plans de diffraction de la ZSM-5, à partir desquels nous avons déterminé les paramètres de maille (a = 20,08 Å, b = 19,94 Å, c = 13,41 Å) de symétrie orthorhombique idéale.
Les échantillons B et C ayant respectivement des rapports Si/Al de 60 et 120 et comme agent structurant le bromure de tétrapropylammonium conduisent également à la formation de la ZSM-5 pure.
3.1.1 Influence de la longueur de la chaîne alkyle
La structure tétraédrique des ions alkylammonium laisse penser que la cristallisation de la zéolithe débute par cet ion, qui définit dès lors la structure finale de la zéolithe. À cet effet, nous avons réalisé l'étude suivante, où l'on a fait varier la longueur de la chaîne alkyle allant du groupement méthyle au groupement butyle.
3.1.1.1 Chaîne alkyle : méthyle
Le diagramme de diffraction X de l'échantillon E préparé à partir de l'ion tétraméthylammonium comme agent organique structurant et ayant un rapport Si/Al de 30 est représenté sur la Fig. 2. Il montre un mélange de phases dont nous avons identifié deux composantes : la zéolithe hydroxysodalite et le quartz. Ce diagramme ne montre aucune raie correspondant à la zéolithe ZSM-5. Cependant, en utilisant le même agent structurant dans le mélange réactionnel contenant un gel de silice-alumine et comme cation inorganique le sodium, Kerr [23] a obtenu une autre zéolithe de type ZK-4 avec un temps de cristallisation de 24 h et une température de 100 °C. En revanche, la synthèse de la zéolithe Oméga exige un temps de cristallisation de 2 à 8 j et des températures situées entre 80 et 150 °C [24,33].

Diagramme de diffraction des rayons X de l'échantillon E (TMA, Si/Al = 30).
3.1.1.2 Chaîne alkyle : butyle
L'examen du diagramme obtenu avec les ions tétrabutylammonium et avec un rapport Si/Al de 30 (Fig. 3) montre toutes les raies caractéristiques de la zéolithe ZSM-5, en particulier le doublet situé entre 7 et 9° et le triplet situé entre 22 et 25°. Ce diagramme fait également apparaître des pics supplémentaires, correspondant à la mordénite. Cette phase semble toutefois se former en moindre quantité que la phase ZSM-5. Contrairement aux résultats rapportés par Jablonski et al. [26] où ils ont obtenu de la ZSM-11 par ajout de l'ion potassium. Giannetto et al. [27] s'accordent à dire que l'ion tétrabutylammonium, conduit à la zéolithe ZSM-11pure avec un temps de cristallisation de 60 heures. Le diagramme de diffraction des rayons X de l'échantillon D donne les raies (10,0,0) et (0,10,0), dans le domaine 2 θ = 44–46°, caractéristiques de la ZSM-5.
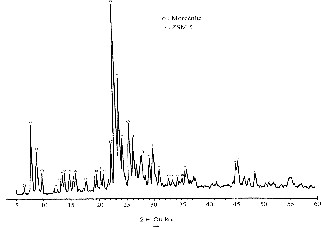
Diagramme de diffraction des rayons X de l'échantillon D (TBA, Si/Al = 30).
3.1.2 Influence du taux de sodium
Le diagramme de diffraction des rayons X de l'échantillon F ayant un rapport Si/Al de 30 et comme chaîne alkyle propyle de l'agent structurant est représenté sur la Fig. 4. Il montre un mélange de phases. Nous avons identifié trois composantes : la ZSM-5, la mordénite et l'analcime.
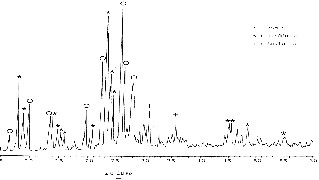
Diagramme de diffraction des rayons X de l'échantillon F (TPA, Si/Al = 30).
La composition du mélange réactionnel de l'échantillon F (30,9 Na2O, Al2O3, 5,9 TPA+, 60,5 SiO2, 2687 H2O), dans lequel le rapport Na/(Na + TPA) relativement élevé par rapport à l'échantillon A (TPA, Si/Al = 36), de rapport Si/Al voisin, influe sensiblement sur la cristallisation de la zéolithe ZSM-5. La formation de phases comme la mordénite ou l'analcime est favorisée par l'excès de sodium du mélange réactionnel. En effet, ce type de zéolithe a été synthétisé à partir des gels de silice-alumine neutralisées par des cations alcalins exempts de cations organiques [20,21].
3.2 Analyse par microscopie électronique
La micrographie de l'échantillon A (TPA, Si/Al = 36) (Fig. 5) est très similaire à celle rapportée dans la littérature [34] pour la zéolithe ZSM-5. On peut observer des cristaux sous formes de prismes hexagonaux et intercroisés, caractéristiques de la zéolithe ZSM-5. Les cristaux présentent des formes géométriques régulières et bien définies.

Morphologie de l'échantillon A (TPA, Si/Al = 36).
Cette micrographie ne montre qu'une seule phase cristalline et l'absence de phase amorphe indique que la cristallisation est totale pour cet échantillon.
3.2.1 Influence du rapport Si/Al
Bien que les échantillons A, B et C ayant respectivement des rapports Si/Al de 36, 60 et 120 présentent la même phase cristalline ZSM-5 pure, les analyses par microscopie électronique révèlent des différences appréciables (Figs. 5–7). La taille ainsi que la forme des cristaux sont très hétérogènes ; de même leur géométrie n'est pas bien définie en comparaison des cristaux de l'échantillon A, dans lesquels la forme hexagonale prismatique apparaît nettement.

Morphologie de l'échantillon B (TPA, Si/Al = 60).

Morphologie de l'échantillon C (TPA, Si/Al = 120).
3.2.2 Influence de la longueur de la chaîne alkyle du template
L'examen des micrographies des échantillons E, D et F confirme les résultats obtenus par diffraction des rayons X (Figs. 2–4).
La micrographie de l'échantillon E (Fig. 8) préparé à partir de l'ion tétraméthylammonium, montre un mélange de trois phases. On distingue nettement des cubes, des prismes allongés et des cristaux fins sans formes géométriques particulières.

Morphologie de l'échantillon E (TMA, Si/Al = 30).
La préparation de la zéolithe à partir de l'ion tétrabutylammonium ne permet également pas d'obtenir la zéolithe ZSM-5 pure. La Fig. 9, correspondant à cet échantillon, montre des cristaux de forme sphéroïde.
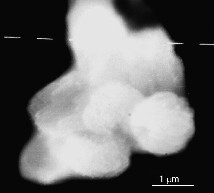
Morphologie de l'échantillon D (TBA, Si/Al = 30).
L'échantillon F, qui présente un rapport Na/(Na + TPA) relativement élevé, montre une structure très lamellaire (Fig. 10). Cet échantillon contient également des cristaux de formes différentes, ce qui indique un mélange de phases. Ces observations sont en accord avec les résultats obtenus par diffraction des rayons X.

Morphologie de l'échantillon F (TPA, Si/Al = 30).
Le taux de sodium semble apporter des modifications profondes dans la structure de la zéolithe obtenue.
4 Conclusion
L'influence des différents paramètres orientant cette synthèse, tels que la nature du template, le taux de sodium et le rapport Si/Al, ont été examinés en utilisant la caractérisation par diffraction des rayons X (XRD) et par microscopie électronique à balayage.
Il ressort de cette étude que, pour obtenir une zéolithe ZSM-5 pure, dont les cristallites possèdent une morphologie uniforme et des formes géométriques régulières, le rapport Si/Al doit être voisin de 36, tandis que l'agent structurant doit avoir une longueur de chaîne alkyle intermédiaire, tel le cas du tétrapropylammonium.
Cependant, la synthèse de l'échantillon F, de composition : 30,9 Na2O, Al2O3, 5,9 TPA+, 60,5 SiO2, 2687 H2O, dans lequel le rapport Na/(Na + TPA) est relativement élevé par rapport à l'échantillon A, ne permet pas la cristallisation de la zéolithe ZSM-5 pure.
Avec le tétraméthylammonium, on obtient un mélange de phases telles que le quartz et l'hydroxysodalite. Si la chaîne est plus longue, l'ion tétrabutylammonium permet d'obtenir un mélange de ZSM-5 et de mordénite ; la forme des cristallites est alors non homogène.
L'environnement cationique et le taux de sodium orientent la structure et influent notablement sur la nature de la phase synthétisée.


