Abridged English version
1 Introduction
Iron-depleted zones appeared during flooding in temporary hydromorphic soils, in contrast to iron-enriched zones at oxic–anoxic interfaces near the water table [6,14]. The presence of these zones depended on the availability of O2 in the soil porosity. Because of the slow diffusion of O2 in water, a prolonged water saturation of a soil promoted the decrease and disappearance of aerobic microbial activities in aid of anaerobic activities [1,4].
Many studies focused on bacterial iron reduction have been performed in an anoxic atmosphere using synthetic minerals and pure strains inoculated in nutritive culture media. However, minerals, organic phases and microbial communities were much more complex and heterogeneous in soils. For this reason, the purpose of this work was to study the bio-reduction of iron oxihydroxides in conditions close to those existing in temporarily waterlogged soils.
2 Soil samples
Soil samples, were collected in a ferralsol [8] at Nsimi-Zoétélé (Cameroon) [11,16]. The soil used in the experiments provided by the horizon situated at 50-cm depth in the zone of water-table oscillation, as indicated by ferric iron precipitation concretions. It was designated as Cam.
Sample from a gleysol was also studied. It was collected in the forest of Fougères (Ille-et-Vilaine, France) at 60–70-cm depth and presented strong hydromorphic characters.
3 Experimental design
The physicochemical characterization of soils was done on sieved (< 2 mm) samples using methods described in Bonneau and Souchier [3]: pH was measured in a water suspension (1:2.5 w/v) after 1 h of agitation, total iron content was determined by ICP–AES after alkaline fusion of soil samples and organic carbon and nitrogen content by a CHNO analyser. Iron considered as potentially reducible by bacteria was solubilised using the DCB (dithionite–citrate–bicarbonate) reagent [10] and measured using ICP–AES spectrometry.
The experiments were conducted in sterile serum bottles and consisted of incubation of 15 g of dry soil, rehumidified with N2-purged demineralised water under an O2-free atmosphere. A known quantity of O2 was added under sterile conditions to obtain a headspace atmosphere composition of 2% O2/98% N2. Abiotic controls were obtained by the addition of 1‰ Na-merthiolate to the solution [2]. The triplicate assays were incubated at 28 °C in the dark.
An oxygen concentration of 2% (atmosphere of the incubation device) was chosen as the initial aerobic starting point. The influence of soil water content on microbial iron-reducing activities was studied at four levels of ‘equivalent humidity’ (EH): 75, 100, 200 and 400% EH (i.e. water holding capacity WHC). This parameter was determined as follows: the soil samples sieved at < 2 mm were saturated with water during 24 h and then drained naturally and weighed as humid soil. EH (WHC) was calculated as:
The experiments were conducted using only the autochthonous microflora, the natural carbon and the iron sources of the soil. Mineralization of organic carbon was followed by measurements of CO2 evolution by infrared spectrometry. This monitoring was used to observe the change from aerobic to anaerobic processes [13].
After incubation, the flasks were opened in an O2-free glove bag. The ferrous iron was measured in filtered (<0.22 μm) incubation solution using a Merck™ colorimetric kit (Eisen Test 8023). Total soluble iron was determined by ICP–AES.
4 Chemical characterization of the soil samples
The soils were acid (Table 1) and relatively poor in organic carbon and nitrogen: 6.7 and 5.5 mg C g−1 dry soil, 0.6 and 0.5 mg N g−1 dry soil, for Cam and Fra, respectively. The C/N ratios were low (approximately 11), suggesting that organic matter was relatively well biodegradable.
Caractérisation chimique des échantillons de sol. Résultats en mg g−1 de sol sec
Chemical characterization of the soil samples. Results in mg g−1 of dry soil
| Échantillons | Cam | Fra | |
| pH | 4,3 | 4,8 | |
| Matière organique | C | 6,7 | 5,5 |
| N | 0,6 | 0,5 | |
| Formes du fer | Fed | 20,0 | 5,6 |
| Fet | 29,1 | 18,5 | |
| Fet–Fed | 9,1 | 12,9 |
The determination of reducible iron (Fed) showed that its distribution was different in both soils. For Cam, DCB-extractable iron, which was not included in silicate lattices, represented 69% of total iron (20.0 mg Fed g−1 of dry soil). For Fra, it was relatively lower and represented 30% of total iron (5.6 mg Fed g−1 of dry soil). These results suggested that both samples contained a fraction of iron potentially reducible by bacteria.
5 Organic carbon mineralization
The inhibition of microbial activity by Na-merthiolate was efficient. Indeed, the production of CO2 due to organic matter mineralization in abiotic controls did not exceed 0.66 mg g−1 of the total organic carbon (data not shown).
The carbon mineralization curves for all the biotic treatments showed the same aspect (Fig. 1) with high quantities of CO2 released in a first step corresponding to an aerobic mineralization phase, followed by a slowing down, corresponding to a lower velocity of organic carbon mineralization in anoxic conditions [9].
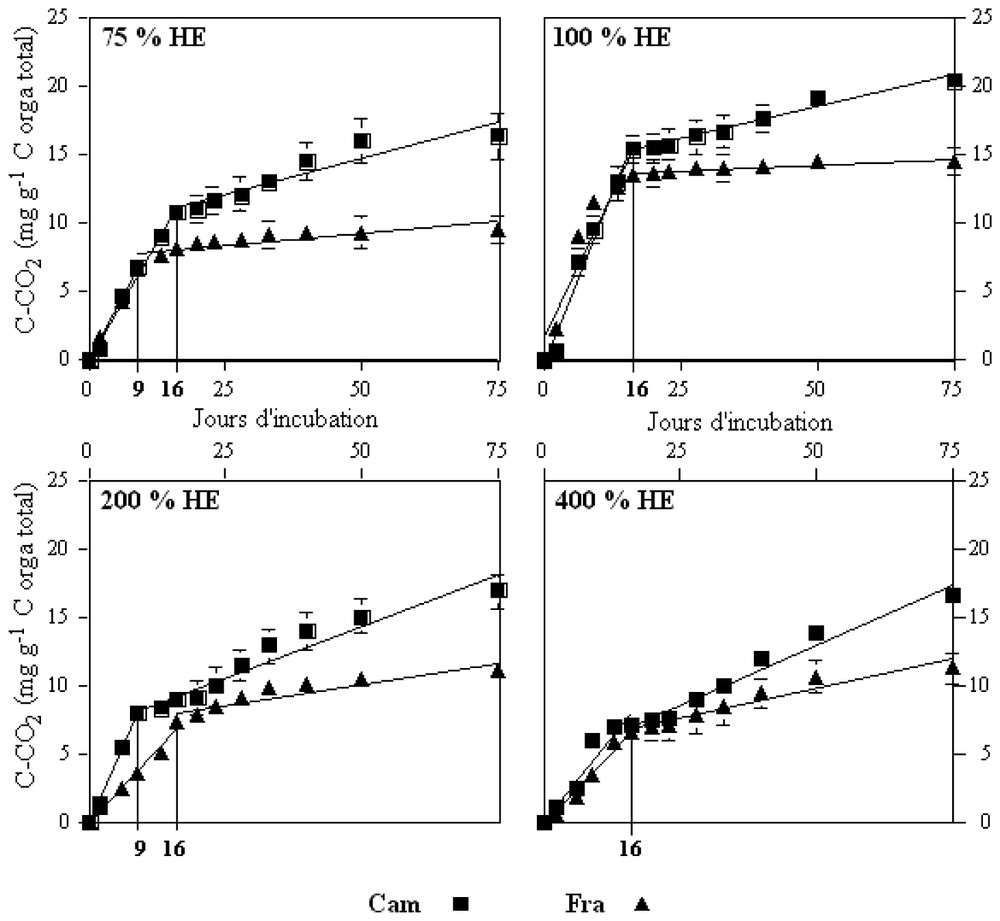
Production de CCO2 dans les expériences biotiques sur les sols Cam et Fra pour différentes humidités (atmosphère initiale à 2% O2). CCO2 en mg g−1 du carbone organique total du sol. HE : humidité équivalente.
Production of CO2C in the biotic assays of soil incubation for different humidity rates (initial atmosphere with 2% O2). CO2C in mg g−1 of total soil organic carbon. HE: water holding capacity.
After 75 days of incubation, the mineralization rate was significantly higher for the 100% EH (WHC) treatment for both soils (Fig. 1, Table 2).
Taux de minéralisation aérobie et anaérobie du carbone organique en conditions biotiques. Résultats en mg CCO2 g−1 du carbone organique total du sol. Aé=aérobie, An=anaérobie
C-mineralization rates calculated for aerobic and anaerobic phases in biotic conditions. Results in mg CO2C g−1 of total soil organic carbon
| Traitements | Taux de minéralisation | Cam | Fra |
| 75% HE | Aé | 10,7 | 6,6 |
| An | 5,6 | 2,8 | |
| Aé/An | 1,9 | 2,3 | |
| Total | 16,3 | 9,4 | |
| 100% HE | Aé | 15,4 | 11,6 |
| An | 5,0 | 3,1 | |
| Aé/An | 3,1 | 3,8 | |
| Total | 20,4 | 14,6 | |
| 200% HE | Aé | 9,0 | 7,3 |
| An | 8,0 | 3,9 | |
| Aé/An | 1,1 | 1,9 | |
| Total | 17,0 | 11,2 | |
| 400% HE | Aé | 7,2 | 6,7 |
| An | 9,4 | 4,6 | |
| Aé/An | 0,8 | 1,4 | |
| Total | 16,7 | 11,3 |
For waterlogged treatments (200 and 400% EH), the first phase corresponding to aerobic mineralization of carbon was lower than that for the other treatments (Fig. 1). As O2 was weakly soluble in water (7.77 mg l−1, at 28 °C under 1 atm [7]), the waterlogging (200–400% EH) induced a low diffusion of O2 in the soil solutions. This corresponded to a lower bacterial O2 consumption. For the 75% EH treatment, the carbon mineralization at the end of incubation was, for both soils, near that obtained for 200 and 400% EH (Fig. 1), although the aerobic mineralization was in this case predominant.
The ratio of aerobic versus anaerobic mineralised carbon described well the microbial activities during these two phases. For example, the ratio of 3.1 (Table 2) for the Cam soil at 100% EH (WHC) indicated that aerobic microorganisms were very active at this soil water content. Moreover, for the higher humidity rates, the anaerobic mineralised organic carbon was quantitatively more important (Table 2). These results showed that, in humid and waterlogged soil, the anaerobic bacteria were activated by the lack of O2 and that the anaerobic mineralization activity vs the aerobic was dominant at high soil humidity rates.
6 Bacterial iron reduction
Abiotic controls showed no detectable soluble iron (ferrous or total) during the incubations (data not shown). This showed that (1) soil minerals were not chemically dissolved and (2) iron-reducing bacteria were completely inhibited by Na-merthiolate.
Under biotic conditions, soluble iron (ferrous and total) contents were below the detection limit, at the beginning of the incubation. After 21 days, soluble ferrous iron was detected in all treatments, suggesting that the dissolution of iron was due to the activity of autochthonous iron-reducing bacteria. The highest ferrous iron contents were measured in the 100% EH (WHC) treatment (Fig. 2) and the lowest for high soil humidity rates (200 and 400% EH).
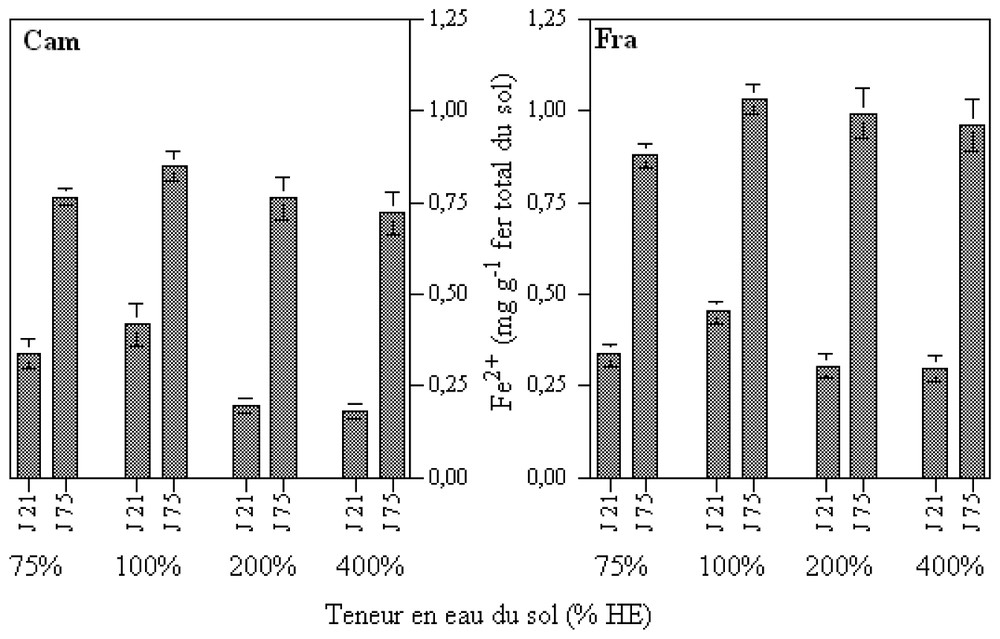
Teneurs en fer solubilisé après 21 et 75 jours d'incubation en conditions biotiques. Teneurs en Fe2+ exprimées en mg Fe g−1 de fer total.
Solubilised iron contents after 21 and 75 days of incubation in biotic conditions. Ferrous iron contents expressed in mg Fe g−1 of total iron.
Between 21 and 75 days of incubation, the solubilised ferrous iron contents increased for all the treatments. However, the difference between low humid (75–100% EH) and waterlogged (200–400% EH) samples decreased during this period. Nevertheless, as earlier in the incubation (21 days), the soluble ferrous iron contents remained the highest for the 100% EH treatment in the soil Cam.
7 Conclusion
The reduction and dissolution of ferric iron contained in soil minerals, as well as soil organic carbon mineralization into gaseous CO2, occurred only under biotic conditions. An oxido-reductive coupling occurred in the bioreactors between the bacterial reduction of ferric iron and the mineralization of organic carbon.
Autochthonous microorganisms mineralised the soil organic matter in all the treatments. The aerobic mineralization was higher in the 75 and 100% EH treatments than in the 200 and 400% EH waterlogged treatments in which the anaerobic production of CO2 was predominant. This observation was the consequence of the low solubility of oxygen in water.
The reduction–dissolution of ferric iron was not directly correlated to the rates of anaerobic mineralization, as ferrous iron release was the highest in the case of the treatment 100% EH (WHC). High water content was thus not a prerequisite for significant iron-reducing bacterial activity.
In natural environments, bacterial weathering of iron-bearing minerals depended on the soil water content and on the O2 partial pressure in the pore volume. The combination of these two parameters suggested that the switching between desiccation and humidification was a favourable condition for the activity of autochthonous iron-reducing bacteria.
1 Introduction
Dans les sols présentant une hydromorphie temporaire, on note des zones d'appauvrissement en fer où l'engorgement se manifeste, et des zones d'enrichissement à l'interface oxique–anoxique au niveau du battement des nappes [6,14]. L'existence de ces zones est dictée par la présence de l'oxygène dans le volume poral des sols. Ceci induit, dans le cas d'une saturation prolongée d'un sol, la disparition des activités microbiennes aérobies au profit d'activités anaérobies [1,4]. De nombreuses études sur la réduction bactérienne du fer sont pratiquées sous atmosphère anoxique, avec des matériaux synthétiques et des souches bactériennes pures inoculées dans des milieux de culture nutritifs, alors que, dans un sol, les phases minérales, organiques et les communautés microbiennes sont complexes et hétérogènes. C'est pourquoi, l'objectif de ce travail est d'étudier l'effet de la teneur en eau sur la bio-réduction d'oxy-hydroxydes de fer par les bactéries autochtones du sol, afin de simuler des conditions très proches de celles existant dans des sols temporairement engorgés.
2 Matériel et méthodes
2.1 Les échantillons de sol
Le site atelier de Nsimi-Zoétélé (Cameroun) a été étudié dans plusieurs programmes de recherche s'intéressant au fonctionnement biogéochimique de bassins versants tropicaux [11,16]. Ce site présente des sols à altération géochimique dominante, classés comme Ferralsols [8]. Le profil pédologique entre 0 et 1,5 m est composé de quatre horizons. Celui situé en surface, de 5 cm d'épaisseur, est humifère grumeleux actif. L'horizon situé en dessous (épaisseur de 35 cm) est minéral, argileux et de couleur rouge. De 40 à 120 cm de profondeur l'horizon est argileux, de couleur ocre et montre des taches de précipitation de fer ferrique, caractéristiques des phénomènes d'oxydo-réduction, qui ne sont plus observées au-delà de 70 cm de profondeur. L'horizon profond (120–150 cm) est sablo-argileux, de couleur claire.
Une nappe temporaire, présente durant les deux saisons de pluie (cinq à sept mois de l'année), se forme à environ 40 cm de profondeur, sur au plus 30 cm, et disparaît progressivement pendant les saisons sèches. Le plafond de la nappe permanente est situé à 110 cm de profondeur [12].
L'échantillon de sol étudié est prélevé à 50 cm de profondeur dans la zone de battement de nappe, où la présence de taches de précipitation de fer ferrique est la plus importante. Cet échantillon est désigné par Cam.
Le second sol prélevé en France, en forêt de Fougères (Ille-et-Vilaine) est un Gleysol [8]. Le profil pédologique entre 0 et 1 m de profondeur est composé d'un horizon organo-minéral noir, de 0 à 15 cm de profondeur, de structure micro-grumeleuse. L'horizon situé en dessous, d'une épaisseur de 25 cm, est réductique à texture limoneuse et de couleur bleu/vert. Un horizon de transition limoneux à sablo-limoneux en profondeur, présent de 40 à 80 cm, est saturé quasiment tout au long de l'année. En dessous de 80 cm, on trouve l'arène granitique de texture sablo-limoneuse abritant une nappe d'eau permanente [15]. L'horizon échantillonné se trouve dans la zone de battement de nappe (60–70 cm). Cet échantillon est désigné par Fra.
2.2 Caractérisation chimique des échantillons de sol
Les mesures et expériences sont menées sur les échantillons de sol séchés à température ambiante et tamisés à 2 mm. Le pH des échantillons est mesuré dans une suspension de sol (rapport massique sol/eau déminéralisée de
La teneur en fer total est déterminée après fusion alcaline des échantillons de sol [3]. L'analyse est effectuée en spectrométrie d'émission atomique à plasma induit (ICP–AES, Jobin Yvon™ JY 238 Ultrace). L'extraction sélective du fer, par le réactif CBD (citrate–bicarbonate–dithionite), effectuée à chaud [10], permet de mettre en solution le fer libre (désigné par Fed), c'est-à-dire non inclus dans le réseau des silicates. Ce fer libre correspond au fer potentiellement réductible par les communautés bactériennes du sol. L'analyse du fer libre après extraction est déterminée par ICP–AES.
2.3 Dispositif expérimental
Les expériences sont menées dans des flacons sérum stériles (autoclavage à 110 °C, 30 min). 15 g de sol sec sont réhumidifiés avec de l'eau déminéralisée dégazée (bullage N2), sous atmosphère inerte (100 % N2) en sac à gant (I2R™ Glove Bag Instruments for Research and Industry). Les flacons sont ensuite purgés avec N2 durant 5 min pour obtenir des conditions d'anoxie strictes. L'O2 est injecté dans les flacons avec une seringue en conditions stériles afin d'obtenir une composition atmosphérique de 2 % d'O2 et de 98 % de N2 dans les flacons. La même procédure est appliquée sur des témoins abiotiques obtenus par l'ajout de merthiolate de sodium à 1 g l−1 [2] dans la solution d'humidification du sol. Les expériences biotiques et abiotiques sont pratiquées en triplet. Les incubations sont conduites de façon statique à 28 °C à l'obscurité.
2.4 Conditions expérimentales
La teneur de 2 % d'O2 a été choisie afin d'obtenir des conditions aérobies en début d'incubation et d'observer la mise en place de l'anaérobiose dans les bioréacteurs. L'influence de la teneur en eau pondérale des sols sur l'activité ferri-réductrice de la microflore autochtone est étudiée pour différentes valeurs d'humidité équivalente (HE) : 75, 100, 200 et 400 % HE. Ce paramètre est déterminé de la façon suivante : une quantité connue de sol tamisé à 2 mm est saturée en eau pendant 24 h. L'excès d'eau est éliminé par égouttage. La pesée des échantillons de sol sec et après égouttage permet d'obtenir les valeurs de HE : (poids sol humide – poids sol sec)/poids sol sec [5].
2.5 Activités microbiennes
Les expériences sont effectuées avec la microflore autochtone et les réserves en carbone organique et en fer des échantillons de sol. Les activités minéralisatrices du carbone organique du sol sont suivies par la mesure, en spectrométrie infrarouge (Binos 1004 Gas Analyzer), du dégagement de CO2 dans les bioréacteurs. Ce paramètre est suivi à la fois pour décrire la biodégradabilité des matières organiques, mais aussi comme indicateur de la mise en place de l'anaérobiose dans le système. En effet, la consommation par la microflore autochtone de l'oxygène initialement introduit dans l'atmosphère des bioréacteurs se traduit par le passage de voies métaboliques aérobies à des voies anaérobies. Ce changement d'activité métabolique est observé par des vitesses de minéralisation du carbone organique différentes [13].
Après incubation, les flacons sont ouverts sous atmosphère de N2 en sac à gant. Le sol humide est prélevé, pesé et mis en suspension dans une eau déminéralisée et dégazée. Après centrifugation, le surnageant est filtré à 0,22 μm, en conditions anaérobies. Le fer ferreux soluble est dosé par colorimétrie (kit de mesure Merck™ Eisen Test 8023). La teneur en fer total est déterminée par ICP–AES.
3 Résultats
3.1 Caractérisation chimique des échantillons de sol
Les échantillons de sol sont acides montrant des pH mesurés (Tableau 1) de 4,3 (Cam) et 4,8 (Fra). Leur teneur en matières organiques est faible, avec des valeurs de carbone organique de 6,7 et 5,5 mg g−1 sol sec et d'azote organique de 0,6 et 0,5 mg g−1 sol sec respectivement pour les échantillons du Cameroun (Cam) et de Fougères (Fra).
Les rapports C/N sont peu élevés (aux environs de 11), suggérant la présence de matières organiques réactives et facilement biodégradables.
Les teneurs en fer total sont faibles (Tableau 1). La caractérisation du fer bioréductible (Fed) montre des différences entre les deux sols. Dans l'échantillon de sol Cam, le fer libre (Fed), non inclus dans le réseau des silicates, représente 69 % du fer total, soit 20,0 mg Fe g−1 de sol sec. Pour l'échantillon Fra, le fer libre est minoritaire et ne représente que 30 % du fer total, soit 5,6 mg Fe g−1 de sol sec. Ces résultats montrent que les deux échantillons de sol contiennent une fraction de fer pouvant potentiellement subir une dissolution réductive par voie bactérienne.
3.2 Minéralisation du carbone organique
L'inhibition de l'activité bactérienne par le merthiolate de sodium dans les témoins abiotiques est satisfaisante, puisque la production de CO2 due à la minéralisation des matières organiques ne dépasse pas 0,66 mg g−1 de carbone organique du sol (résultats non présentés).
La Fig. 1 présente la minéralisation du carbone organique par les communautés microbiennes autochtones des deux sols étudiés. Ces courbes présentent toutes la même allure quel que soit le traitement : des vitesses de libération du CO2 importantes dans un premier temps, correspondant à la phase aérobie de la minéralisation, suivies d'un ralentissement de la libération du CO2. Cette rupture de pente correspond à la mise en place d'une minéralisation anaérobie du carbone du sol avec une vitesse de minéralisation plus faible [9].
Le taux de minéralisation du carbone organique du sol à 100 % HE après 75 j d'incubation (fin de l'expérience) est significativement supérieur à celui obtenu pour tous les autres traitements, et ce pour les deux sols (Fig. 1, Tableau 2).
Pour de forts engorgements du sol (200 et 400 % HE), la minéralisation du carbone en phase initiale aérobie est moins importante que pour les autres traitements (Fig. 1). Ceci peut être expliqué par une solubilisation faible de l'oxygène dans la solution du sol (solubilité de O2(g) dans l'eau : 7,77 mg l−1 à 28 °C, 1 atm [7]) à 200 et 400 % HE, limitant fortement l'accessibilité de l'O2(g) aux bactéries. Cela correspond à une consommation de l'oxygène dissous initialement présent, suivie de la mise en place de l'anoxie dans les bioréacteurs (Fig. 1, 200 et 400 % HE). Pour une humidité équivalente de 75 %, la minéralisation du carbone dans les deux sols en fin d'incubation est sensiblement la même que celle obtenue pour 200 et 400 % HE (Fig. 1), bien que, dans ce cas, la minéralisation initiale aérobie soit prédominante.
L'étude de la répartition du carbone minéralisé durant les phases aérobie (Aé) et anaérobie (An) fournit des informations sur l'activité des communautés bactériennes (Tableau 2). Pour le traitement à 100 % HE, le rapport Aé/An est de 3,1 pour le sol Cam et de 3,8 pour le sol Fra, ce qui montre combien les communautés bactériennes minéralisatrices du carbone par voie aérobie sont actives à cette teneur en eau du sol.
Par ailleurs, on constate que, plus la teneur en eau du sol est élevée, plus la quantité de carbone organique minéralisée durant la phase d'anaérobiose est importante (Tableau 2). Lorsque le sol est engorgé (200 et 400 % HE), le taux de minéralisation total est plus faible qu'à 100 % HE (17 et 16,7 contre 20,4 pour Cam ; 11,2 et 11,3 contre 14,6 pour Fra). Pourtant, la quantité de carbone minéralisé par voie anaérobie est significativement plus élevée aux forts engorgements du sol, se traduisant par des rapports Aé/An de plus en plus faibles de 100 à 400 % HE. Ces résultats montrent qu'en sol très humide ou engorgé, les communautés bactériennes anaérobies autochtones sont très actives.
3.3 Réduction bactérienne du fer
En conditions abiotiques, les teneurs du fer en solution sont nulles ou en dessous des limites de détection (résultats non présentés). Ceci montre (1) l'absence de dissolution chimique des minéraux présents dans les deux échantillons de sol et (2) une inhibition de l'activité ferri-réductrice des communautés bactériennes autochtones des deux sols par le merthiolate de sodium.
En conditions biotiques, les concentrations en fer ferreux en solution sont similaires à celles obtenues par ICP–AES pour le fer soluble total. La concentration de fer ferreux en solution au début de l'incubation (
Les mesures effectuées en fin d'incubation montrent des teneurs en fer ferreux soluble en hausse entre 21 et 75 jours d'incubation et ce, pour tous les traitements. Bien que les écarts de teneurs entre les échantillons peu humides (75 et 100 % HE) et les échantillons fortement engorgés (200 et 400 % HE) aient diminué entre 21 et 75 jours d'incubation, la libération de fer ferreux soluble dans le sol Cam reste la plus forte pour 100 % HE.
4 Conclusion
La dissolution réductive du fer, tout comme l'oxydation du carbone organique, n'a lieu que dans les expériences effectuées en conditions biotiques, en présence des communautés microbiennes autochtones. Ceci permet de constater que se met en place un couplage d'oxydo-réduction dans les bioréacteurs. Il correspond à la réduction du fer ferrique des sols en ions ferreux par voie bactérienne, pendant que le carbone organique est oxydé en dioxyde de carbone gazeux.
Les micro-organismes autochtones minéralisent la matière organique naturelle et ce, quelle que soit la teneur en eau du sol. La minéralisation aérobie du carbone est la plus forte pour 75 et 100 % d'humidité équivalente (HE), alors que la production anaérobie de CO2 prédomine pour les plus fortes teneurs en eau (200 et 400 % HE). Ceci est dû à la faible solubilité de l'oxygène dans l'eau, limitant sa disponibilité pour les bactéries du sol.
La dissolution réductive du fer ferrique n'est pas directement liée à des taux de minéralisation anaérobie prédominants, puisque la libération de fer ferreux est maximale pour une humidité équivalente de 100 %. De fortes teneurs en eau ne sont donc pas nécessaires pour observer des activités bactériennes ferri-réductrices significatives, qui se manifestent efficacement en milieu non saturé en eau.
Dans les milieux naturels, l'altération par voie bactérienne des constituants du sol porteurs de fer ferrique réductible va donc dépendre de la teneur en eau et en oxygène du volume poral des sols. La combinaison de ces deux paramètres suggère que les alternances dessiccation–humidification des sols soient des conditions propices à l'activité ferri-réductrice des bactéries autochtones.



Vous devez vous connecter pour continuer.
S'authentifier