Prologue
L'Organisation des Nations unies ont proclamé 2022 Année internationale du verre, soulignant le rôle du verre dans les domaines scientifique, économique, artistique et culturel. Le verre est essentiel à de nombreuses technologies vitales, car il facilite la transition vers un monde plus durable et embellit nos vies.
Cette résolution des Nations Unies est un événement unique et historique pour le verre. Il est le résultat d'un long voyage initié en 2018 qui a été rendu possible grâce au soutien de 1500 universités et centres de recherche, sociétés et associations savantes, musées, artistes, fabricants et par des entreprises dans 79 pays et sur 5 continents. La résolution officielle a été adoptée à l'Assemblée générale des Nations unies le 18 mai 2021.
Le verre est évidemment le matériau de notre quotidien que nous trouvons dans la vaisselle, les emballages alimentaires, les bouteilles de boissons, la parfumerie-cosmétique et la pharmacie. Nous sommes entourés de verre dans nos maisons, nous l'utilisons pour le transport (verre flotté, laine de verre, laine de roche, ou fibre de verre textile) et les applications technologiques dans l'optique et l'énergie (photonique, batterie). Le verre est aussi un atout pour les prothèses (les verres bioactifs pour les implants osseux, par exemple) et nous ne devons pas oublier que le verre est également un important recueil pour les souvenirs de l'humanité et l'histoire de notre planète et de l'univers. Ce numéro spécial de C. R. Géosciences rassemble plusieurs articles sur ces différents aspects après une brève introduction sur ce matériau, le verre. Cormier et al. [2022] décrivent la structure du verre et se concentrent sur le mélange cationique basé sur la diffraction des rayons X et des neutrons à haute température. Leur article montre également le lien entre le verre et le liquide. Ensuite, l'article édité par l'équipe Bauchy détaille les défis et les opportunités des techniques de calcul nécessaires pour comprendre la structure et les propriétés des verres et des liquides [Liu et al. 2022]. Le verre n'est pas seulement le verre qu'on utilise au quotidien comme le montre l'article de Pradel et Piarristeguy [2022] qui montrent que le verre n'est pas seulement composé d'oxyde, mais que le monde du verre est plus complexe car il est possible d'obtenir des verres avec tous les éléments [Pradel et Piarristeguy 2022] et avec toutes les liaisons chimiques ; un article complémentaire sur les verres métalliques sera publié dans le CR Physique [Champion 2022]. Le verre a toujours accompagné l'humanité et il nous permet de transcender nos croyances et nos peurs, comme le montrent les symboles, les histoires et les mythes entourant les vitraux ornementés. L'article de Hunault et al. [2022] présente un vitrail emblématique, la rose de la Sainte-Chapelle, ainsi que la manière dont sa restauration a permis d'en apprendre davantage sur son origine et son histoire. McCloy et Schuller [2022] traite de la vitrification des déchets. Le verre a de multiples usages dans notre quotidien et il deviendra de plus en plus présent demain, comme le montre l'article de Blanc et al. sur les fibres optiques et le développement des capteurs [Blanc et al. 2022].
Brauer et Hupa [2022] démontrent que le verre peut également être utilisé pour reconstruire des parties du corps humain. Ils expliquent comment depuis les premiers travaux de Hench et al. [1971], il est possible d'utiliser le verre pour régénérer les tissus osseux. Actuellement, plusieurs compositions de verre sont utilisées en médecine et en dentisterie [Brauer et Hupa 2022] et il est facile d'imaginer que dans les années à venir, la proportion des verres bioactifs augmente encore.
Le verre est aussi un témoin de notre passé, car l'étude des verres trouvés soit dans les météorites soit dans les cristaux sous forme d'inclusions vitreuses nous permet de retracer l'histoire de notre planète. Ces verres peuvent avoir différente teneur en eau, qui est le principal composant volatil des magmas et joue un rôle important dans les mécanismes d'éruption. L'article de Le Losq et al. se concentre sur la façon dont l'eau affecte la polymérisation des verres et des liquides [Le Losq et al. 2022]. Une autre clé pour comprendre les processus éruptifs est l'évolution de la cristallisation magmatique [Vetere et al. 2022]. Enfin, Moretti [2022] se concentre sur l'interaction les composés volatils et le magma, montrant comment ceux-ci affectent l'état redox, et donc l'état de spéciation des gaz libérés par les systèmes volcaniques actifs.
1. Introduction
Le verre est un matériau homogène qui peut se former à partir de presque tous les éléments du tableau périodique (figure 1) et de tous les types de liaisons chimiques. Ce matériau se distingue des autres états de la matière (solide cristallin, liquide, gaz et plasma) d'une part par son état solide qui se caractérise par une absence d'ordre à grande échelle et d'autre part par la présence d'une transition de second ordre, dite température de transition vitreuse. Le lecteur trouvera des publications détaillées et récentes sur toutes les familles de verres et leurs propriétés dans la publication « Handbook of Glass [Musgraves et al. 2019]”. Dans cette introduction, nous présenterons quelques-uns des concepts généraux reconnus par l'ensemble de la communauté scientifique et enseignés dans les universités et les écoles d'ingénieurs.
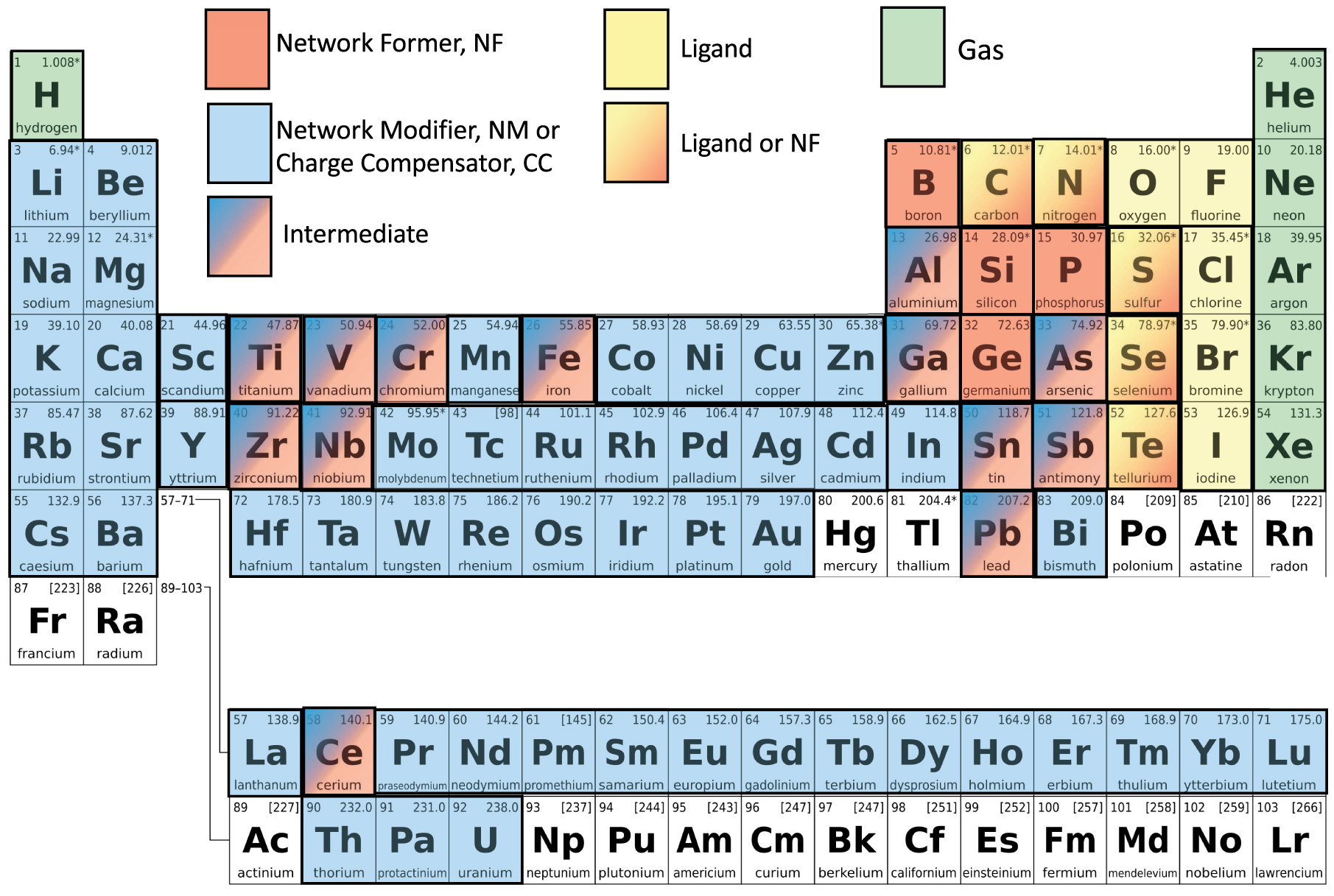
Tableau périodique avec rôle possible des éléments dans du verre ou du fluide. Les éléments en blanc peuvent être vitrifiés sans aucun rôle spécifique. Les éléments en blanc ne sont presque jamais étudiés dans la structure du verre, mais ils peuvent être présents dans le verre, probablement en tant que gaz ou modificateur de réseau.
Un verre est un solide amorphe. Le terme solide implique une viscosité élevée, généralement supérieure à 1011 Pa⋅s. Cette viscosité limite l'écoulement du matériau. Le terme amorphe implique l'absence d'ordre à grande échelle, ce qui révèle une analogie avec l'état liquide. Un verre est donc un solide dont certaines propriétés sont proches de celles des liquides. Parks et Huffman parlent même d '« un quatrième état de la matière » [Parks et Huffman 1926].
L'état vitreux peut se produire pour de nombreuses compositions chimiques tant que le phénomène de cristallisation est évité. Il existe des verres minéraux et d'autres verres courants à base de composés de silicate, d'oxydes, de sels, de métal, de verres organiques tels que les caramels, les bonbons durs ou gélifiés. En effet, il est possible d'obtenir des verres quel que soit le type de liaison chimique : covalente, ionique, métallique, de Van der Waals ou hydrogène. L'état du verre est donc caractéristique de la matière condensée et il peut y exister une palette infinie de composition chimique des verres, chacun avec sa propre structure. Comme nous le verrons, chacun d'eux, individuellement, peut être défini comme un matériau ou une substance à part entière avec ses propres caractéristiques physiques et chimiques telles que la température de transition vitreuse (Tg), le diagramme de rayons X ou le spectre Raman, l'analyse chimique élémentaire, la densité, l'indice de réfraction, etc.
De nombreux méthodes de préparation permettent d'obtenir des matériaux amorphes. Ils sont généralement élaborés par refroidissement rapide d'une phase liquide, mais il est également possible de les obtenir à partir d'une phase gazeuse, par amorphisation d'une phase cristalline ou par des méthodes sol-gel [Descamps 2017]. La méthode la plus courante de formation du verre est le gel d'un liquide lors d'un refroidissement rapide. Lors du refroidissement d'un liquide, il y a une augmentation continue de la viscosité jusqu'à atteindre une valeur qui permet de considérer le matériau comme solide. On peut donc imaginer que la structure du verre est similaire à celle d'un liquide, dont tous les mouvements atomiques sont bloqués. Les verres ont, comme les liquides, une structure désordonnée avec seulement un ordre à petite échelle. Par exemple, la silice, une phase vitreuse, est constituée de tétraèdres de SiO4, associés entre eux par un atome d'oxygène mais sans périodicité du réseau à grande échelle, comme c'est le cas dans les cristaux. On dit que l'atome d'oxygène reliant deux atomes de silicium forme un pont. La figure 2 montre une représentation schématique en 2D des tétraèdres de SiO4 pour le cristal et le verre.
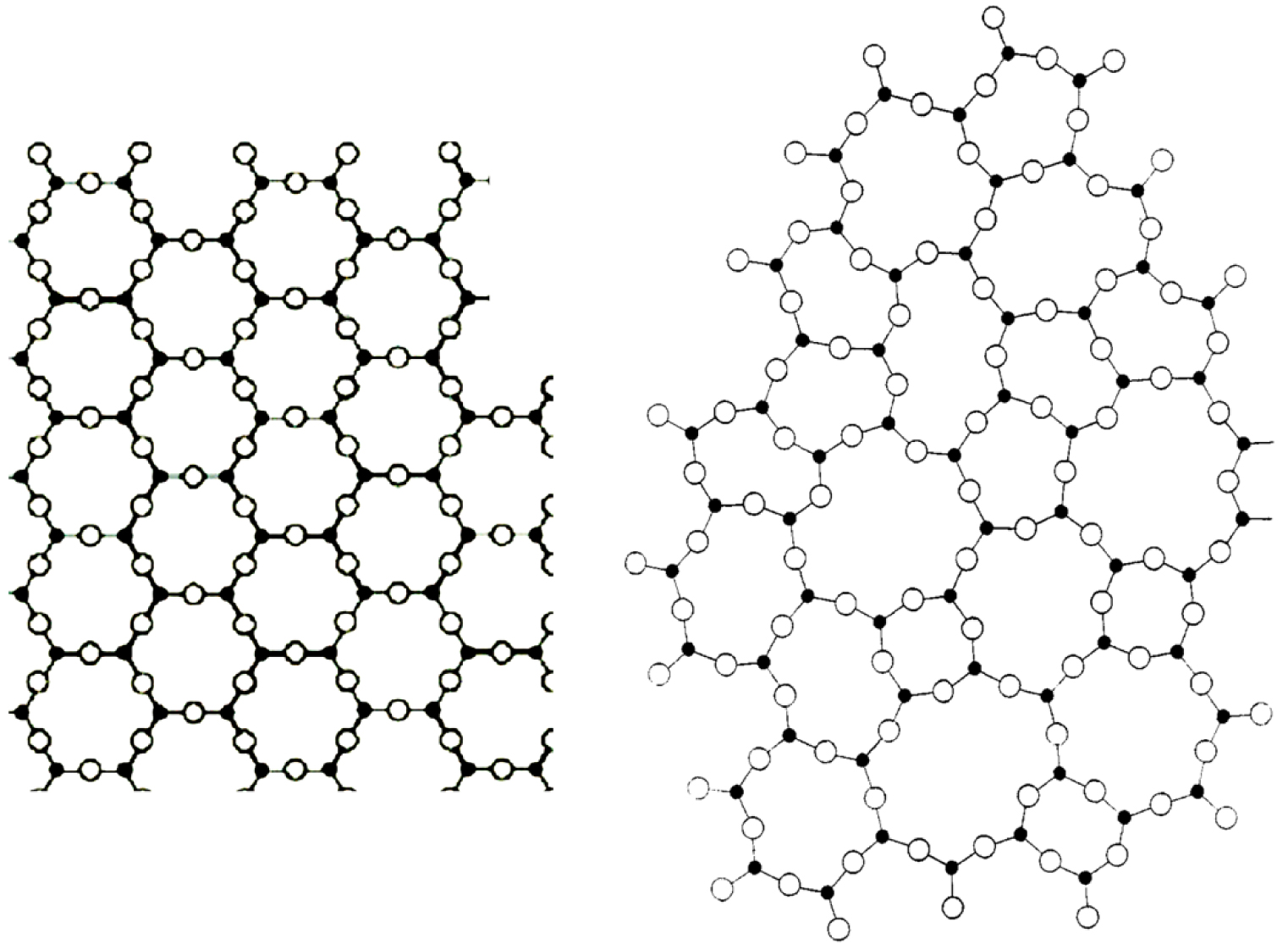
Représentation 2D de : (a) une structure cristalline composée d'atome de Si (cercle noir) et d'oxygène (cercle blanc), il y a un motif géométrique (hexagone) et une périodicité tandis qu'en (b) des arrangements atomiques sont présents (cycles avec 3, 4, 5, 6 tétraèdres) mais ces arrangements ne sont ni réguliers ni périodiques [selon Zachariasen 1932]. A noter que les deux structures ont le même nombre d'atomes de Si, mais n'occupent pas la même surface en raison d'une densité plus faible pour le verre que pour le cristal [modifié de Neuville et Cormier 2022].
2. Une structure désordonnée ?
Dans la section 1, nous avons mentionné un verre composé uniquement de silicium et d'oxygène dont les rôles respectifs sont celui de formateur de réseau et de ligand, mais comment différencier la structure de la silice de celle d'un cristal de quartz ? La figure 3 montre clairement pour SiO2, amorphe ou cristallin (quartz ou low-cristobalite), les différences spectrales obtenues par deux sondes structurales différentes (diffraction des rayons X, spectrométrie Raman).
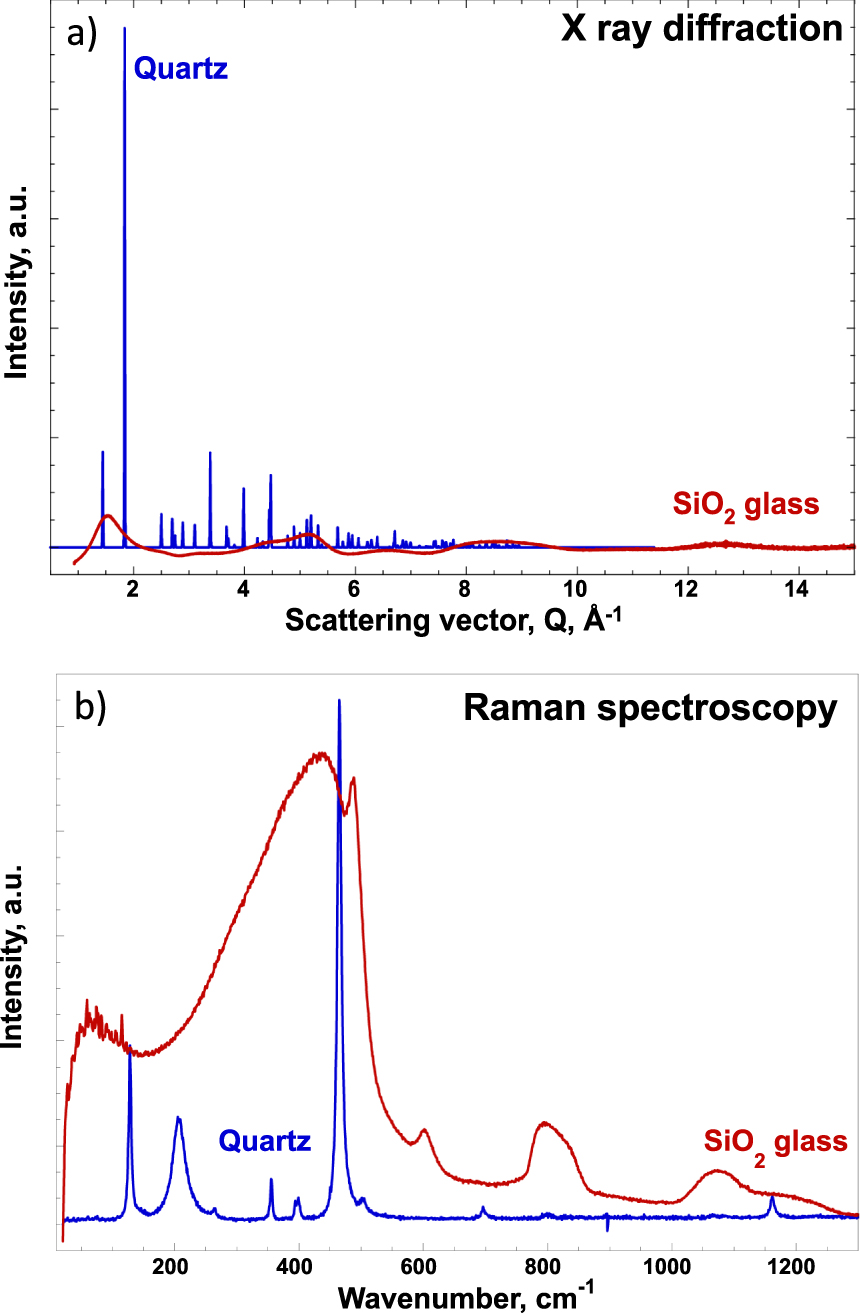
(a) diffraction des rayons X, (b) spectrométrie Raman en bleu (quartz ou low-cristobalite) et SiO2 amorphe en rouge. Pour des raisons pratiques, les spectres sont reportés en unités arbitraires. Les conditions d'acquisition des spectres des phases cristallines et amorphes sont différentes pour une même technique et d'une technique à l'autre [remanié de Cormier et Neuville 2022].
Quel que soit le type de verre utilisé dans la technique expérimentale, les données de phase cristalline montrent des pics fins tandis que celles du verre montrent des pics larges. Plus précisément, la diffraction des rayons X montre des pics de Bragg très intenses jusqu'à une distance de 8 Å −1 pour le cristal de quartz et des bandes larges de très faible intensité pour le verre. L'ordre à petite échelle, pour des distances inférieures à 3 Å , caractérise le polyèdre de coordination SiO4, les distances interatomiques et les angles de liaison, ainsi que la possibilité d'avoir des liaisons hétéropolaires (Si–O). Pour résumer, à courte distance, il y a un ordre local qui concerne la première couche de coordination. Ceci est régi par la liaison chimique qui impose le nombre de voisins (coordinence), les distances interatomiques et la symétrie du site, par exemple un tétraèdre SiO4 dans les silicates.
La région la plus éloignée entre 3 et 20 Å correspond aux séquences et arrangements entre polyèdres. C'est à cette échelle que l'on distingue la phase cristalline de la phase amorphe. Une analyse détaillée de cette région fournit des informations importantes sur la connaissance des angles entre les polyèdres, le type de connectivité (partage de coins, de bords ou de faces), la dimensionnalité 2D ou 3D du réseau et, potentiellement, l'existence d'hétérogénéités structurales/compositionnelles. Pour la diffraction des rayons X, la perte de signal à longue portée ou à haute énergie matérialise la différence entre un état structural ordonné et désordonné [Cormier et Neuville 2022]. La spectrométrie Raman met également en évidence les différences entre le spectre du quartz et celui du verre de silice. En particulier, le spectre Raman de la silice révèle des structures spécifiques du verre, qui n'existent pas dans les phases cristallines : ce sont des cycles à trois ou quatre tétraèdres SiO4 caractérisés par des pics à 490 et 605 cm-1, appelés respectivement D1 et D2. De plus, il est à noter que l'efficacité spectrale Raman d'un cristal de quartz et de silice amorphe est très différente. En effet, le spectre Raman du quartz est acquis en 10 s contre 100 s pour celui du verre de silice.
En résumé, à moyenne distance, l'ordre est défini par les relations entre les différents sites, par exemple l'angle entre deux tétraèdres SiO4 dans les silicates. Cet ordre dans les verres est difficile à caractériser expérimentalement et fait l'objet de nombreuses études expérimentales et simulations numériques [Liu et al. 2022]. Sa caractérisation est essentielle car cette échelle d'organisation est directement liée à l'origine de la plupart des propriétés des verres, telles que la densité, la conduction ionique ou la durabilité chimique. Enfin, à grande distance, il n'y a pas de périodicité des structures, contrairement aux cristaux.
Ce court paragraphe montre que, quelle que soit la technique structurale utilisée, il est particulièrement difficile de saisir la nature et l'étendue de l'ordre à moyenne échelle caractéristique du désordre structural du verre. En outre, ce déficit d'information est l'un des principaux défis actuels dans la connaissance structurale des verres.
3. La température de transition vitreuse
Contrairement au cas d'un solide cristallisé, le verre n'a pas de température de fusion. Inversement, la solidification d'un verre correspond à une augmentation continue et progressive de la viscosité lors du refroidissement d'un liquide, sans apparition d'une structure cristalline. Sur la figure 4, nous avons reporté les variations de viscosité en fonction de la température réciproque, pour plusieurs silicates fondus. Il n'y a pas de rupture des courbes de viscosité entre les valeurs obtenues à haute température à l'état liquide et celles obtenues à basse température à l'état vitreux. Ceci montre la transition continue du verre au liquide pour une propriété telle que la viscosité. La transition vitreuse est un phénomène cinétique qui caractérise la perte d'équilibre thermodynamique interne. En effet, les propriétés d'un verre ne dépendent plus seulement de la pression et de la température, mais aussi de la vitesse, |q|, à laquelle la température de transition vitreuse se produit (pour une discussion détaillée, voir Neuville et Le Losq [2022]).
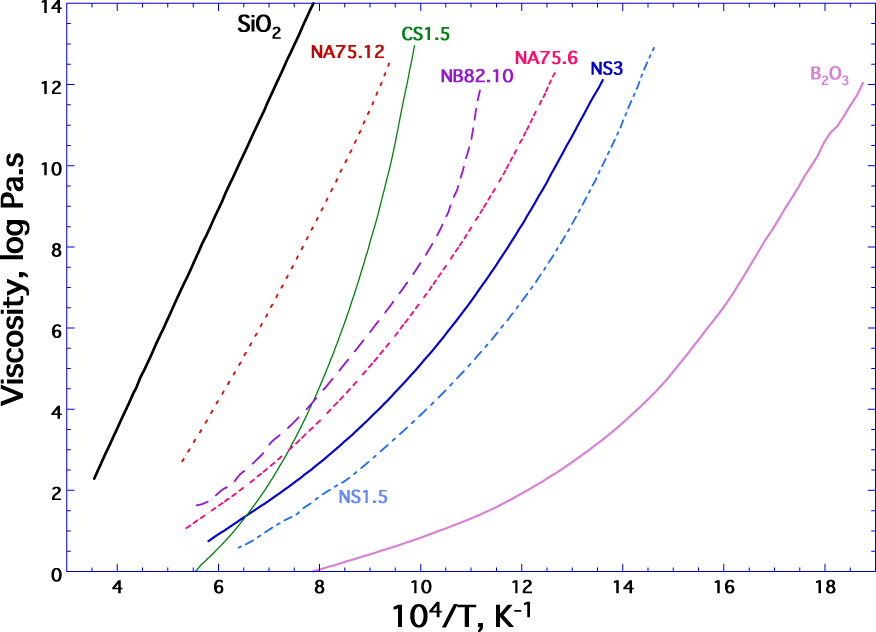
Viscosité en fonction de la température réciproque pour un verre de silice, SiO2, verres de silicate de sodium, NS3 et NS2, contenant respectivement 75 et 66 % molaire de SiO2 et le restant étant Na2O, les compositions NS1.5 et CS1.5 correspondent respectivement à 60 SiO2–40 Na2O et 60 SiO2–40 CaO (% molaire) de Neuville [2006] pour CS1.5, NS1.5, NS2. Les compositions NA75.6 et NA75.12 contiennent 75% molaire de SiO2 chacune et 6 ou 12% molaire de Al2O3, le restant étant Na2O [données de Le Losq et al. 2014] pour NS3 et NAX. Y compositions, Napolitano et al. [1965] pour B2O3 ; de Sipp et al. [1997] pour NB82.10 = Pyrex.
La caractérisation la plus simple et la plus ancienne de cette transition a été décrite par Parks et Huffman [1927]. Ils notent qu'en chauffant un verre, « il passe continuellement de l'état amorphe à l'état liquide, ses propriétés évoluant de manière régulière avec la température, sans discontinuité ». En effet, comme ils l'écrivent, « alors qu'il n'y a pas de température précise comparable au point de fusion d'un cristal, il existe néanmoins un intervalle de température, net et reproductible, au sein duquel de nombreuses propriétés changent à une vitesse qui s'approche de celle observée lors de la fusion d'un cristal. En bref, il y a un intervalle de ramollissement au lieu d'un point de fusion. Le verre tel qu'il existe au-dessous de cet intervalle de ramollissement diffère si nettement du liquide qui existe au-dessus qu'il pourrait bien être considéré comme un état différent de la substance. »
La transition vitreuse correspond à une zone de température et de pression dans laquelle des propriétés telles que la chaleur spécifique subissent une transition de second ordre [Moynihan et al. 1976a, b]. Par conséquent, les propriétés physico-chimiques d'un verre dépendent de la vitesse à laquelle la température varie et donc de son histoire thermique.
Il est théoriquement possible d'obtenir des variations temporelles identiques pour toutes les propriétés, telles que la dilatation thermique ou la viscosité. Il est donc clair qu'il y a un temps de réponse à la variation de température. Nous appelons ce temps 𝜏, le temps de relaxation. Nous le définissons comme suit : un liquide possède un grand nombre d'états de configuration différents [Goldstein 1976, 1969, 2011]. Chaque état correspond à un minimum d'énergie potentielle. Lorsque la température décroit, le temps de relaxation structurale d'un liquide, 𝜏, augmente. Lorsque 𝜏 est suffisamment grand, il ne peut plus effectuer de réarrangements structuraux coopératifs [Goldstein 1976, 1969]. Ainsi, le nombre de configurations pouvant être atteintes par un système diminue avec la température et, à température suffisamment basse (T < Tg), le liquide gèle : le système ne peut plus changer son état de configuration (une discussion plus détaillée peut être trouvée dans Neuville et Le Losq [2022]). De plus, l'état de configuration du verre ne change pas lors du refroidissement Tg à 0 K. On peut noter que la spectroscopie vibrationnelle Raman et infrarouge suggère que la structure d'un verre est une image de la configuration instantanée du liquide [Kashio et al. 1980 ; Kusabiraki and Shiraishi 1981a, b ; Neuville and Mysen 1996].
La viscosité est une propriété importante et largement utilisée par l'industrie du verre. Elle a donc été, dans un souci d'uniformité, normalisée. La température de la transition vitreuse est définie industriellement comme la température à laquelle la viscosité est de 1012 Pa⋅s, pour une vitesse de refroidissement de l'ordre de quelques °Cmin−1, ce qui correspond aux vitesses de refroidissement du verre dans les procédés industriels. Cette valeur de viscosité correspond à des temps de relaxation de l'ordre de 15 min.
D'un point de vue thermodynamique, on peut affirmer que la température et la pression ne suffisent pas à caractériser l'état du verre. Tool et Eichlin [1931] ont introduit le concept de température fictive, Tfic, pour caractériser le verre à pression constante. On peut la définir comme la température à laquelle le verre serait dans un état stable s'il pouvait être chauffé instantanément. La température fictive peut être définie lors du refroidissement par dilatométrie ou par calorimétrie, comme étant la température de transition vitreuse.
Il est possible de donner une définition thermodynamique formelle de la température fictive en la considérant comme un paramètre d'ordre. On rappelle que la transition vitreuse ressemble à une transition du second ordre pour laquelle V, H, 𝜂 sont des fonctions continues mais pas Cp, 𝛼, K [voir les revues Neuville et Le Losq 2022].
4. Rôle chimique des éléments dans le verre
4.1. Les cations
La structure des verres fait intervenir une grande famille d'éléments divisés en plusieurs groupes, formateurs de réseau, modificateurs de réseau ou compensateurs de charge, éléments intermédiaires, éléments colorants, raffinage.
(i) Les "formateurs de réseau" sont les oxydes qui peuvent former un verre seuls. Ces éléments sont, principalement, sous leurs formes cationiques : Si4+, B3+, Ge4+… Ces cations formateurs de réseau ont des liaisons cation-oxygène très covalentes, et donc directionnelles, qui assurent la structure tridimensionnelle du verre. Ces éléments forment des polyèdres de petite taille avec un oxygène de type ligand (par exemple tétraédrique pour Si et Ge ou triangulaire pour B). Dans le cas des verres silicate, deux cations sont reliés entre eux par des oxygènes dits pontants mais dans les verres thio-silicate, ils sont reliés par un soufre pontant [Pradel et Piarristeguy 2022]. Ces polyèdres reliés forment un réseau tridimensionnel désordonné. Ainsi, il est possible de construire un verre, avec plusieurs ligands, O, S, Se, Te. Pour cette courte introduction, nous ne parlerons que du ligand O dans les verres d'oxydes.
À noter que l'oxyde de silicium, SiO2, ou silice, est l'oxyde majoritaire des verres commerciaux, et est le principal formateur du réseau vitreux. Dans le cas de la silice, les entités tétraédriques sont notées Qn où n représente le nombre d'oxygènes pontants portés par l'atome central Q (typiquement Si). Le verre de silice est donc constitué de Si entouré de 4 oxygènes pontants, tous reliés à d'autres tétraèdres pour former le réseau tridimensionnel d'espèces Q4 avec des ponts Si–O–Si (Figure 2b). Cette structure est caractérisée par une viscosité très élevée d'une part et une dépendance arrhénienne de la viscosité avec la température d'autre part (Figure 3). L'oxyde de bore B2O3 agit également comme un formateur de réseau, mais il forme des triangles planaires BO3. Sa structure a donc un caractère fortement bidimensionnel, ce qui explique pourquoi la viscosité de B2O3 est significativement plus faible que celle du réseau tridimensionnel de silice (environ 14 ordres de grandeur près de 1000 °C, Figure 3). En plus de réduire la viscosité, l'oxyde de bore est ajouté aux verres car il améliore considérablement les propriétés thermiques et mécaniques du verre comme dans le cas du verre Pyrex® (composition NB82.10, Figure 4).
(ii) Les "modificateurs de réseau" sont des oxydes qui ne forment pas du verre par eux-mêmes. Il s'agit principalement d'éléments alcalins et alcalino-terreux. L'introduction de Rn+On∕2 (n = 1 or 2) modifie la continuité du réseau tridimensionnel constitué par le formateur de réseau. Le réseau est rompu avec la formation d'oxygènes non-pontants, qui ne sont plus liés uniquement aux formateurs de réseau. Les éléments alcalins et alcalino-terreux jouent un rôle similaire en ce qui concerne la structure et les propriétés principales des formes verre et fondu, mais ont des caractéristiques différentes. Ainsi, l'oxyde de sodium, Na2O, transforme la silice en silicate par attaque chimique et est principalement utilisé pour abaisser la température nécessaire à la fusion du composé SiO2. Au contraire, l'oxyde de calcium, car il forme des liaisons Ca–O légèrement plus fortes que les liaisons Na–O, augmente la température de fusion du mélange et améliore également plusieurs propriétés telles que la durabilité du verre. Ces 3 oxydes, SiO2, Na2O et CaO représentent plus de 95% de la composition pondérale des verres industriels et sont donc généralement appelés verre de silicate sodo-calcique. D'un point de vue pratique, une grande majorité des verres commerciaux contiennent également de l'oxyde de potassium, K2O, et de l'oxyde de magnésium, MgO. L'oxyde de magnésium est généralement ajouté parce qu'il améliore les propriétés mécaniques et la résistance hydrolytique des verres comme l'oxyde d'aluminium. Cependant, ces deux oxydes ont également tendance à augmenter la température du bain de silicate et les températures de travail du verre. Par addition de Rn+On∕2 à la silice, on crée des oxygènes non-pontants qui établissent des liaisons ioniques R⋯O avec le cation Rn+. La liaison R⋯O est plus faible que celle impliquée dans les ponts Si–O–Si, ce qui entraîne une forte diminution de la viscosité. Ceci est clairement visible en comparant la courbe de viscosité des compositions de verre SiO2 et NS3 (Figure 4). La formation d'oxygènes non-pontants peut être facilement étudiée par plusieurs techniques telles que la spectroscopie Raman ou la résonance magnétique nucléaire (RMN). Leurs proportions augmentent avec la teneur en sodium, ce qui augmente les entités faiblement connectées, Q3, Q2…, contribuant à la diminution de la viscosité. Sur la figure 4, NS1.5 a une viscosité inférieure à NS3, ce qui résulte d'une augmentation de la teneur en sodium de 25 à 40 mol%. Comme nous l'avons vu avec NS3, des oxygènes non-pontants sont formés lorsque des éléments modificateurs de réseau (Li+, Na+, K+, Mg2+, Ca2+, Fe2+…) sont ajoutés pour dépolymériser le réseau 3D fabriqué par le formateur de réseau. Sur la figure 4, en comparant la courbe de viscosité de NS1.5 qui est inférieure à celle de CS1.5, il est clair que le sodium participe davantage à la rupture du réseau que le calcium.
(iii) Les "compensateurs de charge", les éléments alcalins et/ou alcalino-terreux peuvent changer de rôle et devenir des compensateurs de charge en présence (AlO4)− et (BO4)− qui sont des tétraèdres avec une charge déficitaire par rapport aux tétraèdres SiO4. L'aluminium s'insère dans le réseau dans un site tétraédrique, similaire à Si4+. Mais, étant un cation Al3+, le tétraèdre AlO4 a un déficit de charge qui nécessite une compensation pour le stabiliser énergétiquement, ce qui est accompli par la proximité d'un élément alcalin ou alcalino-terreux. Le cas du bore, B3+, est différent car il est le résultat d'un changement dans la coordination du bore. Le verre B2O3 est un réseau de triangles BO3, entièrement stabilisé avec une courbe de faible viscosité, qui peut être transformé en réseau (BO4)− tétraédrique par l'addition d'un oxyde alcalin ou alcalino-terreux, ce qui nécessite une compensation de charge autour de (BO4)− similaire à (AlO4)−. La formation de ces tétraèdres (BO4)− augmente la connectivité du réseau, ce qui est évident du fait que la courbe de viscosité du verre NB82.10 est plus visqueuse que celle observée pour le B2O3 fondu (Figure 4).
(iv) Les "éléments intermédiaires", affichent un comportement en tant que formateurs de réseau, mais ne peuvent en général pas former du verre seuls. Il est à noter que Al, peut former des verres, appelés verres inversés [Neuville et al. 2008a, b, 2010 ; Licheron et al. 2011 ; Drewitt et al. 2012, 2017]. Les principaux éléments intermédiaires sont Al3+, Pb4+, Ti4+ or Fe3+. L'aluminium est principalement en coordination 4 [Stebbins et Xu 1997 ; Neuville et al. 2004a, b, c ; Neuville 2006 ; Neuville et al. 2008a, b ; Stebbins 2008 ; Le Losq et al. 2014 ; Drewitt et al. 2022 ; Neuville and Le Losq 2022]. En ajoutant Al2O3 à la composition de verre NS3, la viscosité augmente fortement et redevient quasi-Arrhénienne, comme illustré sur la figure 3 pour la viscosité de NA75.6 et NA75.12 (composition de verre albitique) qui contiennent respectivement 6 et 12 mol% de Al2O3. Un comportement similaire est observé en considérant la viscosité de la wollastonite fondue, CaSiO3, et de l'anorthite, CaAl2Si2O8. Les compositions de verre d'albite et d'anorthite sont des systèmes entièrement polymérisés et forment un réseau tridimensionnel de et des tétraèdres de SiO4 avec Na+ ou Ca2+ dans les trous du réseau tridimensionnel, jouant le rôle de compensateur de charge de l'aluminium. Al3+ en coordination quadruple joue alors un rôle de formateur de réseau. Al3+ peut aussi être en coordination quintuple [Neuville et al. 2004a, b, c ; Neuville 2006 ; Neuville et al. 2008a, b ; Le Losq et al. 2014 ; Drewitt et al. 2022 ; Neuville et Le Losq 2022] ; dans cet état, il est même possible de définir un rôle de réticulateur (c'est-à-dire un élément qui assure une connexion forte entre les éléments du réseau, selon Patrick Royall et al. [2008]).
Les éléments intermédiaires peuvent changer leur rôle en fonction de la composition chimique du verre et de leurs proportions dans le verre [cf. Neuville 2006 ; Neuville et al. 2008a], de la température [cf. Stebbins et al. 1992 ; Stebbins et Farnan 1992 ; Stebbins 2008 ; Neuville et al. 2008b] et la pression [cf. Allwardt et al. 2005, 2007] mais aussi selon la fugacité d'oxygène [cf. Moretti 2005].
(v) Les éléments de transition, peuvent jouer le rôle d'agents colorants ou décolorants [Hunault et al. 2022]. Une discussion plus détaillée sur les verres colorés se trouve dans Cormier et coll. [1999], Galoisy et al. [2005], Hunault et al. [2014, 2016], et dans la revue de Ligny et Möncke [2019].
4.2. Les anions
Les cations constituent au maximum 50% d'un verre, le reste étant des anions. Dans le sous-réseau anionique, l'élément le plus important est généralement l'oxygène qui occupe des positions différentes. On distingue en effet (Figure 5) :
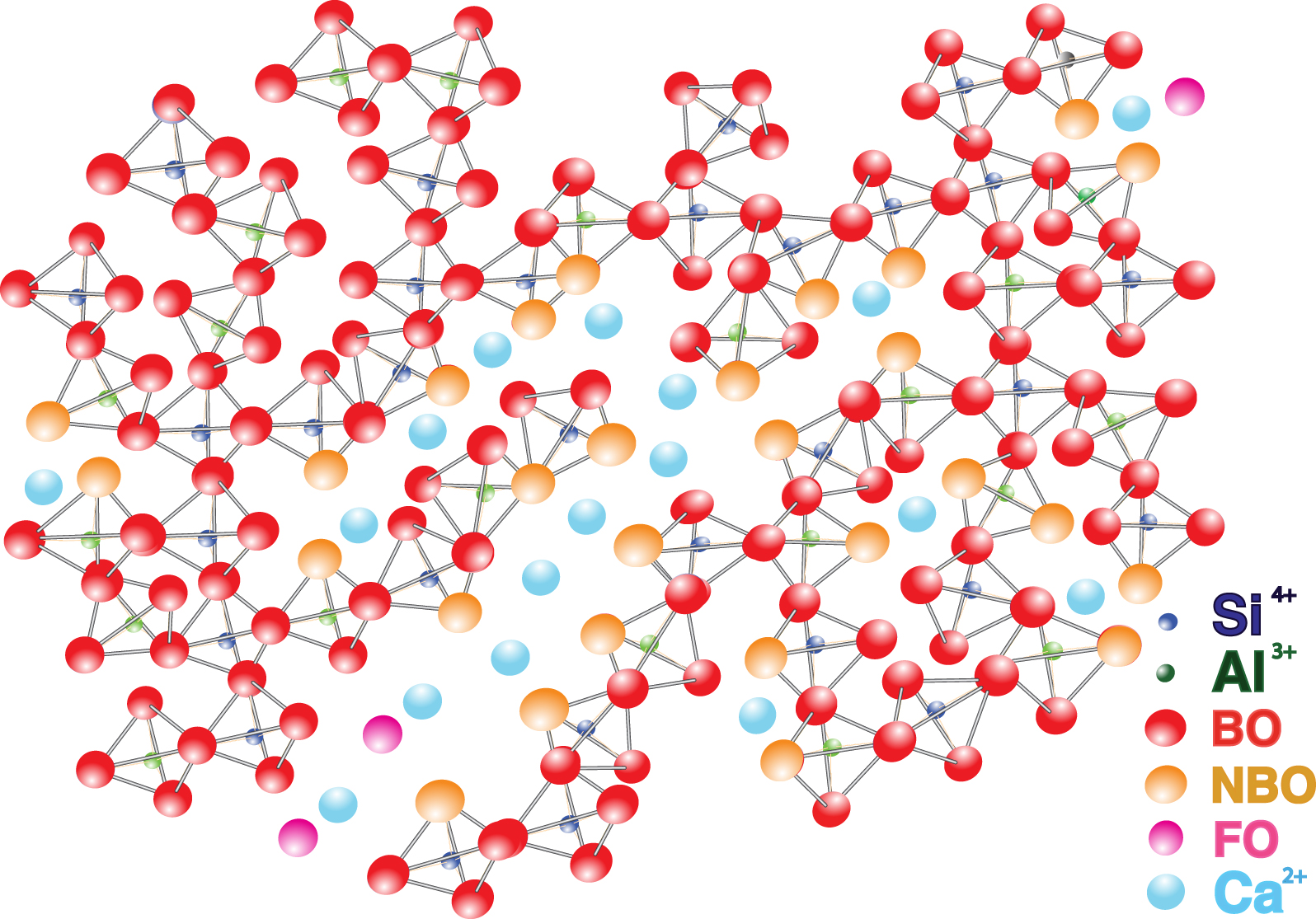
Représentation structurale d'un verre d'alumino-silicate de calcium.
- les oxygènes pontants, OP, qui relient les tétraèdres entre eux et qui n'ont pas de charge efficace parce qu'ils sont polarisés par deux liaisons covalentes ;
- des oxygènes non-pontants, ONP, associés à un seul tétraèdre. Ils présentent donc une charge résiduelle car ils sont partiellement polarisés par une seule liaison covalente ;
- les oxygènes libres, OL, associés à aucun tétraèdre et qui sont donc moins polarisés ;
- oxygènes en triclusters, connectés à trois polyèdres, généralement un ou deux tétraèdres et un pentaèdre. Ces oxygènes en triclusters ne représentent qu'un faible pourcentage et jouent un rôle mineur dans la structure et les propriétés des verres et des liquides [Iuga et al. 2005].
Cette vision d'un réseau constitué d'oxygènes aux rôles différents est complémentaire de celui décrit par les cations. Certaines techniques expérimentales telles que 17O RMN, permettent de visualiser ce réseau anionique et de mettre en évidence la connectivité du réseau [Eden 2012 ; Stebbins et al. 2001].
Ce réseau anionique est également observé dans les verres de chalcogénures dans lesquels le soufre ou le sélénium jouent un rôle de ligand identique à celui de l'oxygène. Dans ces verres, il est possible de montrer, comme déjà mentionné, l'existence de soufre pontant ou non-pontant [Pradel et Piarristeguy 2022].
5. Une idée universelle de la structure de verre ?
Les idées développées dans les paragraphes précédents montrent qu'un verre, considéré par son réseau cationique ou anionique, a un caractère désordonné. Cependant, Greaves et al. [1981] ont montré en utilisant la spectroscopie de structure près du front d'absorption de rayons X (XANES) au seuil K de Na que l'ordre à courte distance autour de Na+ dans les verres de silicate était relativement bien établi. De plus, ces cations ont une distribution non aléatoire au sein du réseau silicate [Greaves 1985]. Suite à ces études pionnières, des études spectroscopiques (Structure fine par absorption des rayons X étendus, RMN, diffraction des neutrons…) ou rhéologiques (viscosité et calorimétrie) ont montré que les distances cation-oxygène et la coordination cationique sont bien définies [Taylor et Brown 1979a, b ; Calas et Petiau 1983 ; Cormier et al. 2001a, b, 1998, 2022 ; Eckersley et al. 1988 ; Le Losq et al. 2017 ; Neuville et al. 2007 ; Neuville 2006 ; Neuville et al. 2004a, b]. D'autres études ont confirmé l'existence d'ordres de moyenne portée autour des cations modificateurs dans la structuration du réseau silicate ou aluminosilicate [Gaskell et al. 1991 ; Greaves 1985 ; Cormier et al. 2001a, b ; Meyer et al. 2004 ; Greaves et Sen 2007 ; Kargl et Meyer 2008 ; Caurant et al. 2010 ; Le Losq et al. 2017]. Selon ces études, les cations ne sont pas simplement distribués aléatoirement au sein de la structure du verre, ce qui implique une modification du modèle classique proposé par Warren et al. [Warren 1941 ; Warren and Biscoe 1938]. Greaves [1985] a proposé le réseau aléatoire modifié (MRN, Modified Random Network) distribué dans des domaines enrichis en cations modificateurs, séparés des domaines enrichis en cations formateurs de réseau. Il est possible de distinguer des canaux ou des grappes, plus ou moins connectés où sont concentrés des modificateurs de réseau, des oxygènes libres et non-pontants, ainsi que des éléments volatils. Les simulations dynamiques moléculaires sur les silicates de sodium et de potassium mettent également en évidence l'existence de telles structures à l'état liquide [Kargl et Meyer 2008 ; Meyer et al. 2004]. L'existence de canaux de percolation peut expliquer la diffusion rapide des ions découplée du réseau dans les verres et les liquides proches de Tg [Greaves and Sen 2007] ce qui peut aussi expliquer la nucléation et la croissance comme le proposent Neuville et Le Losq [2022]. De plus, elle est en accord avec l'observation de zones de non-mélange le long des joints binaires MO–SiO2 (avec M = Mg, Ca, Na), ce qui peut s'expliquer par l'immiscibilité entre les couples M–Q3 et les espèces Q4 [Neuville 2006].
Greaves et Ngai ont proposé une version "modifiée" du modèle MRN pour les tectosilicates vitreux [Greaves et Ngai 1995] : le modèle CCRN (Compensated Continuous Random Network), ou modèle aléatoire continu compensé, prédit que des cations compensateurs de charge sont également présents dans les canaux mais aux limites et à proximité d'éléments ou d'entités tels que (AlO4)− ou (BO4)− qui nécessitent une compensation de charge. L'existence de sous-réseaux, l'un enrichi en formateurs de réseau et l'autre en modificateurs de réseau est en accord avec les simulations de Shintani et Tanaka [2006], qui suggèrent que des structures montrant un ordre quasi-cristallin existent dans le liquide surfondu proche de Tg et influencent fortement la dynamique du système. Il existe donc probablement un lien entre les hétérogénéités structurales et compositionnelles [Moesgaard et al. 2010]. Ces canaux de percolation enrichis en éléments modificateurs de réseau peuvent également être les points de départ de zones de non-mélange et/ou de nucléation [Dargaud et al. 2011, 2012]. Cette image d'un verre et d'une masse fondue organisés en canaux de percolation est maintenant reconnue comme une approche universelle de la structure des verres d'oxydes et aussi des verres de chalcogénures.
6. Conclusion
Que ce soit par sa structure ou ses propriétés, un verre avec une composition chimique donnée est un matériau unique. Les verres les plus anciens de notre système solaire ont plusieurs milliards d'années et pourraient être observés à la surface de la Lune (4,53 milliards d'années). Sur Terre, les verres naturels les plus anciens sont plus jeunes, car le verre est un matériau hautement modifiable en présence d'eau, ce qui provoque son altération en quelques millions d'années : il est donc difficile sur Terre de trouver des verres de plus de quelques centaines de millions d'années.
Indépendamment du lieu et du moment de fabrication, qu'ils soient naturels ou artificiels, si la composition chimique et les conditions de formation sont identiques, les verres fabriqués seront identiques en termes de structure et de propriétés. La composition chimique et les conditions de formation sont donc les critères qui détermineront le type de verre à obtenir. Il est important de souligner que le verre n'est pas l'addition de plusieurs oxydes mais un nouveau matériau résultant de la réaction du mélange de matières premières.
Dans cette brève introduction, nous avons montré que le verre est un matériau à structure désordonnée, caractérisé par l'absence d'ordre à longue distance, et présentant un phénomène de transition vitreuse. Le rôle structural des éléments chimiques dans un verre est relativement restreint entre le formateur de réseau, le modificateur de réseau, le compensateur de charge, les éléments intermédiaires et de transition. Le rôle des éléments peut varier en fonction de leur concentration et des conditions de formation (pression, température, fugacité d'oxygène, etc.). Toutes ces caractéristiques font du verre un matériau unique et omniprésent.
Conflits d’intérêts
L’auteur n’a aucun conflit d’intérêt à déclarer.
Remerciements
Un grand merci à François Chabaud qui m'a donné l'occasion de faire ce numéro sur le verre dans le cadre de l'année internationale du verre et merci aussi à tous les auteurs qui ont fait de très beaux articles qui permettent de montrer l'universalité du verre. Les dialogues amicaux en cours avec Laurent Cormier, Annie Pradel, Delia Brauer et Roberto Moretti sont très appréciées.




 CC-BY 4.0
CC-BY 4.0