1 Introduction
Les otolithes sont des concrétions aragonitiques de l’oreille interne des Téléostéens. Ils se forment dès les phases initiales de l’ontogenèse et sont donc présents à l’éclosion. La partie centrale de l’otolithe (nucleus) enregistre les conditions environnementales du stade larvaire, les parties périphériques celles du stade adulte 〚1,2〛 . Taiaro, atoll fermé de l’archipel des Tuamotu, (Polynésie française), est peuplé par 31 familles de poissons récifaux, représentant 125 espèces 〚3〛, qui passent normalement leur stade larvaire dans l’océan 〚4,5〛, avant de coloniser le lagon où ils vivent au stade adulte. Cependant, de nombreux œufs et larves, qui appartiennent à dix familles, ont été répertoriés 〚6〛 dans le lagon. Cette présence de stades précoces dans le lagon pose deux hypothèses :
- • (i) cette faune résulte d’un renouvellement des espèces par l’apport de larves et d’œufs lors de phénomènes météorologiques extrêmes ;
- • (ii) cette faune est l’expression d’un cycle biologique complet par adaptation au milieu fermé.
Les caractéristiques physico-chimiques des eaux du lagon et de l’océan étant assez différentes, il devrait être possible, à partir de la composition isotopique du nucleus, d’identifier le milieu de croissance au stade larvaire. Une première étude isotopique (C–O), qui n’a porté que sur des fragments d’otolithes périphériques de deux espèces 〚7〛, complétée par une étude génétique 〚8〛, favorise la seconde hypothèse.
Notre étude porte sur un nombre plus grand d’espèces (Cheilinus sp, Lethrinus sp, Chaetodon ulientensis, Acanthurus triostegus et Epinephelus merra) et sur les deux stades évolutifs (larvaire et adulte) des otolithes. Son originalité réside également dans la caractérisation isotopique (C–O) des nucleus (phase larvaire) et des parties périphériques (stade adulte). Cette démarche peut permettre de discriminer les populations aux stades larvaire et adulte, mais aussi de trancher entre les deux hypothèses précédemment émises.
2 Matériel et méthodes
Les otolithes (sagittae) étudiés proviennent de poissons péchés dans le lagon de l’atoll de Taiaro et de l’océan ouvert adjacent, l’océan Pacifique. L’atoll de Taiaro (15°44’S ; 144°10’W) a un diamètre de 5 km pour une superficie d’environ 9 km2 et une profondeur maximale de 26,4 m 〚9〛. Cet atoll est entièrement isolé de l’océan par les effets conjugués de la fermeture des chenaux de communication entre le lagon et l’océan et une très légère surrection de l’atoll 〚9〛. Le niveau du lagon est situé à 60 cm en dessous de l’océan. Cette situation particulière lui confère certaines caractéristiques physico-chimiques 〚7,9〛. La température des eaux du lagon est comprise entre 30,4 en surface et 29,7 °C à 29,4 m de profondeur. Elle est globalement supérieure de 0,5 à 1,0 °C par rapport à l’eau de surface de l’océan. La salinité des eaux du lagon, quelle que soit la profondeur, est de 42,6 ± 0,2 (‰), en raison de la forte évaporation et de l’homogénéisation de la colonne d’eau par les alizés. Les eaux de l’océan sont moins salines (36,6 ± 0,2‰) 〚9〛, valeurs cohérentes avec les données de salinité de l’océan équatorial 〚10〛. Les valeurs de δ18O (∼1,8‰ SMOW) des eaux du lagon, homogènes sur toute la colonne d’eau, montrent un enrichissement d’environ 1‰ par rapport aux eaux de l’océan 〚7〛 par effet d’évaporation. Les valeurs de δ13C (CO2 total dissous) des eaux de surface de l’océan, de l’ordre de +1,4‰ (PDB), sont enrichies d’environ 1,2‰ par rapport aux eaux de la colonne d’eau du lagon, du fait de l’eutrophisation de ce système.
Les poissons ont été péchés lors de l’expédition internationale franco-australienne de 1994 〚3〛. Cinq espèces vivant à la fois sur la pente externe (côté océan) et dans le lagon ont été récoltées à 20 m de profondeur par pêche sous-marine. Quel que soit le site de prélèvement, les poissons présentent les mêmes caractéristiques de taille. Les otolithes (sagittae) sont extraits de l’oreille interne des poissons et conservés à sec jusqu’au traitement au laboratoire.
En vue du dosage isotopique, les otolithes, parfaitement nettoyés, sont préalablement fixés sur une lame, face externe sans sillon visible. À l’aide d’une fraise dentaire (0,8 mm de diamètre), sous loupe binoculaire, la matière carbonatée est prélevée dans le nucleus, puis dans les parties périphériques des otolithes. Une poudre blanche homogène est ainsi obtenue. Pour éviter la contamination par les couches périphériques, le nucleus est dénudé. La matière organique des otolithes (< à 1% poids) a été éliminée par chauffage (380 °C) sous vide pendant 45 min. Pour l’analyse isotopique (C–O) des carbonates, environ 100 μg de poudre subissent une attaque acide (H3PO4 à 90 °C) dans un banc de passage automatique couplé à un spectromètre Optima. Les valeurs de composition isotopique sont exprimées en notation delta en pour mille (δ ‰) par rapport au standard V-PDB (Vienna Pee Dee Belemnite, 〚11〛), avec :
où R est le rapport isotopique 18O/16O ou 13C/12C de l’échantillon et du standard. La reproductibilité, calculée à partir d’un standard interne de calcite, est de 0,04‰ et 0,05‰, respectivement pour le carbone et l’oxygène.
Les valeurs de composition isotopique à l’équilibre entre carbonate biogénique et les eaux ont été calculées à partir des équations de Grossman et Ku 〚12〛, respectivement pour l’oxygène et le carbone. Pour l’oxygène, les valeurs de fractionnement isotopique ou les températures calculées sont en bon accord à celles déduites des équations suivantes 〚13,14〛. Les équations utilisées s’expriment en fonction de la température, respectivement pour l’oxygène et le carbone sous la forme :
où δ ar et δ e représentent la composition isotopique de l’oxygène ou du carbone de l’aragonite et de l’eau.
3 Résultats
Les compositions isotopiques (O–C) des otolithes sont données dans le Tableau 1 et illustrées dans la Fig. 1 sous forme d’histogrammes. Les valeurs de δ18O et δ13C des otolithes provenant du lagon sont respectivement comprises entre –1,1 et 0,4‰ et –7,6 et –2,8‰ (PDB). Les parties périphériques ont des valeurs de δ18O entre -0,8 et 0,3‰, avec une moyenne de –0,2‰ (±0,3). Les nucleus présentent globalement des valeurs très légèrement négatives, comprises entre –1,1 et 0,1‰ et une moyenne de –0,3‰ (±0,3). Les valeurs de δ13C des parties périphériques montrent une gamme de variations de l’ordre de 6‰ et sont comprises entre –7,4 et –2,8‰, ce qui correspond à une moyenne de –4,6‰ (±0,8). Comme pour les valeurs de δ18O, les compositions isotopiques du carbone des nucleus sont légèrement négatives et se situent entre –7,6 et –3,6‰ pour une moyenne de –5,8‰ (±1,1).
Compositions isotopiques des otolithes. Éch. : échantillon ; L.C. : lieu de capture ; P. A. : partie de l’otolithe analysée ; R.A. : régime alimentaire ; l : lagon ; o : océan ; n : nucleus ; b : périphérie de l’otolithe ; PCD : petit carnivore diurne ; GCD : grand carnivore diurne ; BI : broutteur d’invertébrés ; H : herbivore.
| Échantillons | Espèce | L.C. | P.A. | R.A. | δ18O | δ13C |
| oto1 | Epinephelus | l | n | GCN | –0,11 | –5,97 |
| oto2 | Epinephelus | l | b | GCN | 0,15 | –2,81 |
| oto11 | Cheilinus | l | n | PCD | 0,11 | –5,78 |
| oto12 | Cheilinus | l | b | PCD | –0,36 | –5,14 |
| oto13 | Cheilinus | l | n | PCD | 0,10 | –6,46 |
| oto14 | Cheilinus | l | b | PCD | –0,13 | –5,54 |
| oto15 | Cheilinus | l | n | PCD | –0,14 | –6,80 |
| oto16 | Cheilinus | l | b | PCD | –0,32 | –5,06 |
| oto17 | Cheilinus | l | n | PCD | –0,19 | –4,74 |
| oto18 | Cheilinus | l | b | PCD | –0,31 | –4,49 |
| oto19 | Cheilinus | l | n | PCD | –0,26 | –5,69 |
| oto20 | Cheilinus | l | b | PCD | –0,20 | –5,24 |
| oto78 | Cheilinus | l | n | PCD | –0,31 | –6,39 |
| oto79 | Cheilinus | l | b | PCD | –0,47 | –4,80 |
| oto80 | Cheilinus | l | n | PCD | –0,15 | –6,57 |
| oto81 | Cheilinus | l | b | PCD | –0,75 | –4,37 |
| oto82 | Cheilinus | l | n | PCD | –0,22 | –4,61 |
| oto83 | Cheilinus | l | b | PCD | –0,56 | –4,01 |
| oto84 | Cheilinus | l | n | PCD | –0,23 | –5,52 |
| oto85 | Cheilinus | l | b | PCD | –0,28 | –4,70 |
| oto86 | Cheilinus | l | n | PCD | –0,15 | –5,97 |
| oto87 | Cheilinus | l | b | PCD | –0,32 | –4,57 |
| oto88 | Cheilinus | l | n | PCD | –0,14 | –5,85 |
| oto89 | Cheilinus | l | b | PCD | –0,26 | –4,42 |
| oto27 | Lethrinus | l | n | GCN | –0,21 | –4,12 |
| oto28 | Lethrinus | l | b | GCN | 0,12 | –3,78 |
| oto29 | Lethrinus | l | n | GCN | –0,12 | –4,17 |
| oto30 | Lethrinus | l | b | GCN | –0,17 | –5,08 |
| oto31 | Chaetodon | l | n | BI | –0,44 | –4,86 |
| oto32 | Chaetodon | l | b | BI | 0,23 | –4,96 |
| oto33 | Chaetodon | l | n | BI | –0,63 | –6,45 |
| oto34 | Chaetodon | l | b | BI | 0,14 | –4,04 |
| oto35 | Chaetodon | l | n | BI | –0,65 | –7,44 |
| oto36 | Chaetodon | l | b | BI | 0,11 | –5,91 |
| oto47 | Acanthurus | l | n | H | –1,11 | –7,58 |
| oto48 | Acanthurus | l | b | H | –0,74 | –5,06 |
| oto49 | Acanthurus | l | n | H | –1,04 | –7,62 |
| oto50 | Acanthurus | l | b | H | –0,24 | –4,59 |
| oto62 | Epinephelus | l | n | GCN | –0,21 | –4,77 |
| oto63 | Epinephelus | l | b | GCN | –0,42 | –4,61 |
| oto64 | Epinephelus | l | n | GCN | –0,27 | –6,20 |
| oto65 | Epinephelus | l | b | GCN | –0,42 | –4,76 |
| oto66 | Epinephelus | l | n | GCN | –0,42 | –6,76 |
| oto67 | Epinephelus | l | b | GCN | 0,19 | –4,02 |
| oto68 | Epinephelus | l | n | GCN | –0,26 | –4,97 |
| oto69 | Epinephelus | l | b | GCN | –0,31 | –3,83 |
| oto70 | Epinephelus | l | n | GCN | –0,29 | –6,47 |
| oto71 | Epinephelus | l | b | GCN | 0,10 | –4,79 |
| oto72 | Epinephelus | l | n | GCN | –0,51 | –3,66 |
| oto73 | Epinephelus | l | b | GCN | 0,25 | –3,65 |
| oto74 | Epinephelus | l | n | GCN | –0,07 | –4,89 |
| oto75 | Epinephelus | l | b | GCN | –0,05 | –3,97 |
| oto76 | Epinephelus | l | n | GCN | –0,16 | –6,24 |
| oto77 | Epinephelus | l | b | GCN | –0,16 | –4,28 |
| oto99 | Pomacentridae | l | n | PCD | –0,38 | –7,42 |
| oto100 | Pomacentridae | l | b | PCD | –0,07 | –7,35 |
| oto3 | Acanthurus | o | n | H | –1,40 | –7,21 |
| oto4 | Acanthurus | o | b | H | –1,52 | –3,28 |
| oto43 | Acanthurus | o | n | H | –1,47 | –7,10 |
| oto44 | Acanthurus | o | b | H | –1,06 | –1,49 |
| oto45 | Acanthurus | o | n | H | –1,32 | –6,47 |
| oto46 | Acanthurus | o | b | H | –0,96 | –0,60 |
| oto21 | Lethrinus | o | n | GCN | –1,01 | –2,78 |
| oto22 | Lethrinus | o | b | GCN | –0,98 | –4,35 |
| oto23 | Lethrinus | o | n | GCN | –1,37 | –1,12 |
| oto24 | Lethrinus | o | b | GCN | –1,06 | –0,47 |
| oto25 | Lethrinus | o | n | GCN | –1,22 | –2,41 |
| oto26 | Lethrinus | o | b | GCN | –1,04 | –1,62 |
| oto51 | Lethrinus | o | n | GCN | –1,23 | –2,88 |
| oto101 | Lethrinus | o | b | GCN | –1,17 | –1,53 |
| oto52 | Lethrinus | o | n | GCN | –1,32 | –3,06 |
| oto102 | Lethrinus | o | b | GCN | –1,14 | –1,45 |
| oto53 | Lethrinus | o | n | GCN | –1,36 | –3,09 |
| oto103 | Lethrinus | o | b | GCN | –1,43 | –1,02 |
| oto39 | Chaetodon | o | n | BI | –1,34 | –7,60 |
| oto40 | Chaetodon | o | b | BI | –1,04 | –5,50 |
| oto41 | Chaetodon | o | n | BI | –1,37 | –6,89 |
| oto42 | Chaetodon | o | b | BI | –1,14 | –5,46 |
| oto5 | Chaetodon | o | b | BI | –0,67 | –4,72 |
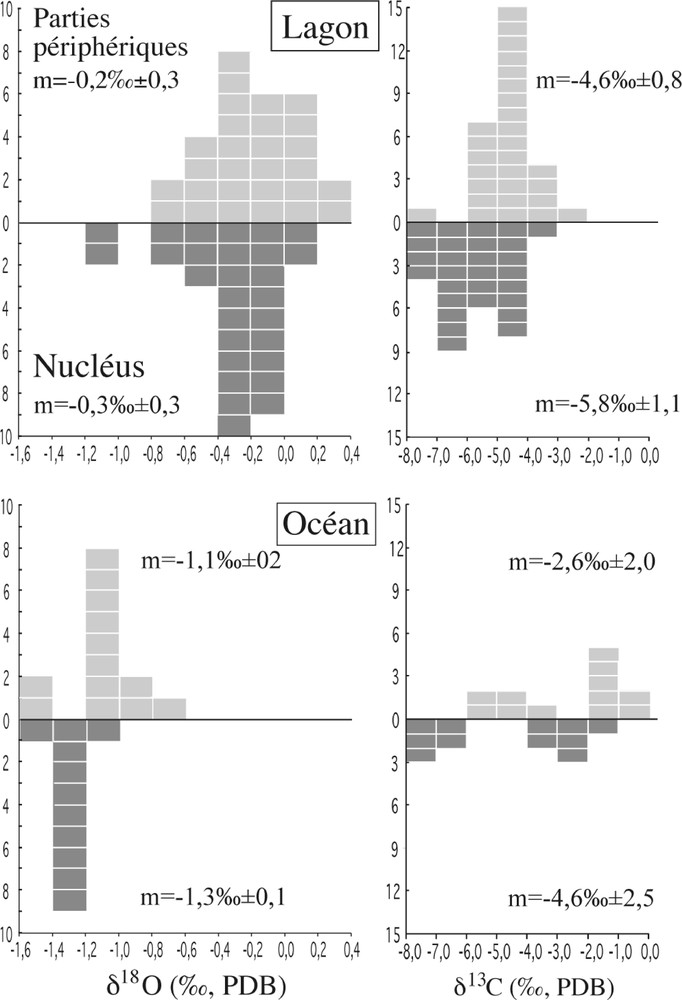
Distribution des valeurs de δ18O et δ13C (‰, PDB) pour les nucleus (gris foncé) et les parties périphériques (gris clair) provenant du lagon de Taiaro et de l'océan.
Les valeurs δ18O et δ13C des otolithes des poissons de la pente externe, donc d’origine océanique, sont respectivement comprises entre –1,5 et –0,7‰ et –7,6 et –0,5‰ (PDB). Leur parties périphériques ont des valeurs de δ18O qui se situent entre –1,5 et 0,7‰ (moyenne = 1,1 ± 0,2‰) et les nucleus des valeurs entre –1,5 et –1,0‰ (moyenne = –1,3 ± 0,1). Les valeurs de δ13C des parties périphériques et des nucleus montrent une plus grande dispersion et sont respectivement comprises entre –5,0 et –0,5‰ et –7,6 et –1,2‰ Les valeurs de δ18O des otolithes des poissons du lagon sont globalement enrichies d’environ 1‰ par rapport aux valeurs isotopiques des otolithes provenant de l’océan. Cette différence isotopique est du même ordre de grandeur que celle observée entre les eaux du lagon et les eaux de l’océan 〚7〛.
4 Discussion
La discrimination des populations de poissons de l’océan et du lagon repose principalement sur les isotopes de l’oxygène mesurés dans les otolithes. En effet, de nombreux auteurs ont mis en évidence que les otolithes se formaient dans des conditions très proches de l’équilibre isotopique. Cependant, dans le cas précis de Taiaro, il convient de caractériser les conditions d’équilibre isotopique dans les otolithes aux stades larvaire et adulte de la population océanique et de celle du lagon. Cette caractérisation doit permettre de déterminer si la population de poissons du lagon a réalisé un cycle biologique complet au sein de ce milieu.
Les nucleus des otolithes (δ18O = –1,3 ± 0,1‰) provenant de l’océan sont à l’équilibre isotopique avec l’eau de mer (δ18O = 0,80‰) pour une température de 29,2 ± 0,5 °C. Cette température calculée correspond, aux erreurs près, à la température mesurée à la surface de l’océan. Par conséquent, lors du stade larvaire, les nucleus des otolithes se forment dans des conditions de quasi-équilibre isotopique pour l’oxygène. En ce qui concerne les parties périphériques, l’écart (δ18O = –1,1‰) entre la température isotopique calculée (28,2 ± 1 °C) et mesurée est de l’ordre de 1 °C. Cette différence est probablement liée au passage du stade larvaire au stade adulte. Cette transition s’accompagne de changements physiologiques importants (changement de nourriture, maturation sexuelle) qui conduiraient à un très léger déséquilibre isotopique de l’ordre de 0,1 à 0,2‰ des parties périphériques par rapport aux nucleus.
Si l’on considère que les espèces du lagon ont effectué leur stade larvaire en milieu océanique, alors les compositions isotopiques des nucleus doivent être à l’équilibre isotopique avec l’océan (δ18O = 0,80‰) pour une température de 29 °C. Or, la température isotopique calculée est de 24,2 ± 1,3 °C (Fig. 2). Cette température est, d’une part, en désaccord avec les relevés météorologiques effectués à ces latitudes (cf Météo France, résumé des bulletins météo) et d’autre part avec les mesures effectuées in situ 〚7〛. Une variation des valeurs de δ18O de l’océan à température constante (29 °C) est à exclure, car cela signifierait que l’enregistrement isotopique du stade larvaire s’est effectué lors d’un enrichissement de 1‰ du milieu océanique.

Comparaison des températures mesurées et calculée par les isotopes de l'oxygène. T (°C) océan et T (°C) lagon correspondent aux gammes de températures mesurées respectivement pour l'océan et le lagon. T1 est la température isotopique calculée à partir des valeurs de δ18O des nucleus des otolithes des poissons de l'océan et de la valeur de δ18O des eaux de l'océan. T2 correspond à la gamme de température isotopique calculée en utilisant les valeurs de δ18O des nucleus du lagon et de la valeur de δ18O des eaux de l'océan. T3 représente la gamme de température calculée à partir des valeurs de δ18O des nucleus du lagon et de la valeur de δ18O des eaux du lagon.
Si la population de poissons du lagon a effectué son stade larvaire dans ce milieu fermé, alors, comme pour les nucleus de l’océan, l’équilibre isotopique doit être atteint. La température isotopique calculée à partir des valeurs δ18O des nucleus et de la valeur δ18O des eaux du lagon est de 29,2 ± 1,5 °C. Cette température est quasi identique à celle mesurée in situ. Par conséquent il convient de conclure que les différentes espèces du lagon étudiées ici ont réalisé leur cycle biologique sans passer par un stade pélagique dans l’océan Pacifique environnant.
Toutes les valeurs de δ13C des otolithes (nucleus et zones périphériques) provenant de l’océan ou du lagon sont systématiquement trop négatives pour être à l’équilibre isotopique. Ce déséquilibre peut atteindre 6 à 7‰ et ne peut-être expliqué, ni par une variation de température, ni par une variation des valeurs de δ13C (CO2) des eaux de surface. D’une part, les fractionnements isotopiques du carbone sont peu sensibles à la température ; d’autre part, il faudrait envisager une diminution moyenne d’au moins 4‰ des valeurs de δ13C (CO2), ce qui est bien supérieur aux variations observées. La possibilité d’une percolation par des eaux souterraines au sein du lagon doit aussi être écartée. Un simple bilan de masse indique qu’au moins un quart de l’eau du lagon devrait avoir une origine souterraine, ce qui serait en contradiction avec les valeurs de salinité et de composition isotopique du lagon.
Les travaux expérimentaux dédiés à l’influence du métabolisme sur les valeurs de δ13C du carbonate de calcium biogénique 〚16〛 indiquent clairement une relation entre l’activité métabolique et les valeurs de compositions isotopiques du carbone. Plus spécifiquement, 〚17〛 a déterminé que la proportion de carbone dérivée du métabolisme (–15 > δ13C > –25‰), était principalement fonction de la consommation d’oxygène et du régime alimentaire des poissons. Plus le métabolisme est actif, comme dans le cas des poissons tropicaux étudiés, plus les valeurs de δ13C sont négatives. Au stade larvaire, cet effet est amplifié par le régime alimentaire à base de phytoplancton, dont les compositions isotopiques sont comprises entre –20 et –25‰. Les valeurs les plus négatives de δ13C correspondent au nucleus, donc au stade larvaire lorsque l’activité métabolique du poisson est maximale. Au stade adulte, l’activité métabolique tend à diminuer et le régime alimentaire devient plus spécifique (herbivore, « brouteur » d’invertébrés, carnassier). Ce changement de métabolisme est enregistré dans la partie périphérique des otolithes par une augmentation notable des valeurs de δ13C. Par conséquent, les fractionnements isotopiques vitaux diffèrent entre le stade larvaire et adulte. L’influence du métabolisme et celle du régime alimentaire peuvent donc expliquer les valeurs de δ13C obtenues pour les otolithes de l’océan, mais aussi pour ceux du lagon.
5 Conclusion
L’analyse isotopique du carbone et de l’oxygène des otolithes des populations de poissons récifaux provenant du lagon fermé de Taiaro et de l’océan adjacent discrimine clairement ces deux populations. Les valeurs de δ18O de la population du lagon est enrichie d’environ 1‰ par rapport à celle de l’océan, ce qui correspond à la différence de composition isotopique entre les eaux du lagon et celles de l’océan. Les nucleus (stade larvaire) des otolithes des poissons provenant du lagon et de l’océan se forment à l’équilibre isotopique pour l’oxygène avec leur milieu ambiant respectif. Ceci permet d’établir que la population de poissons du lagon a effectué son ontogenèse dans ce milieu, sans migration dans l’océan ouvert. Les parties périphériques des otolithes (stade adulte) montrent un très léger déséquilibre isotopique (< 0,2‰), probablement à mettre en relation avec le changement de métabolisme.
Les isotopes du carbone des otolithes montrent un fort déséquilibre isotopique qui se caractérise par des valeurs de δ13C très négatives de plusieurs pour-mille par rapport à l’équilibre. Ce déséquilibre est plus important pour les nucleus que pour les parties périphériques à mettre en relation avec le changement de métabolisme chez les poissons lors de la transition du stade larvaire au stade adulte.
Cette étude démontre que la population de poissons du lagon est l’expression d’une adaptation en milieu fermé et que les nucleus des otolithes constituent un des rares exemples d’équilibre isotopique de carbonate biogénique.
Remerciements
Nous remercions R. Galzin et V. Dufour (laboratoire d’ichtyoécologie tropicale et méditerranéenne, EPHE Perpignan), qui ont mis à notre disposition les otolithes récoltés lors de l’expédition internationale franco-australienne de 1994.
Abridged version
1 Introduction
Otoliths are aragonitic concretions of the Teleosts internal ear. They are formed from the early stages of the ontogenesis and are present at hatching. The central part (nucleus) records the environmental conditions at the larval stage, the outer parts those of the adult stage 〚1,2〛. At Taiaro, a closed atoll of the Tuamotu Archipelago (French Polynesia), 31 families of coral reef fishes, representing 125 species 〚3〛, are present. Normally, these fishes spend their larval stage in the open ocean 〚4,5〛 and lived in the lagoon at the adult stage. However, numerous eggs and larvae have been found in the lagoon 〚6〛. To explain this feature, two hypotheses can be proposed:
- • (i) this fauna results in a renewal of the species by input of eggs and larvae during extreme meteorological phenomena;
- • (ii) this fauna represents a complete biological cycle by adaptation in a closed system.
Since the physico-chemical properties of the ocean water and of the lagoon water are different, it can be possible, from the stable isotope (C–O) compositions of nuclei and outer parts of the otoliths, to identify the habitat during the larval stage. A preliminary stable isotopes study 〚7〛 on pieces of the outer parts of the otoliths, as well as a genetic study 〚8〛, favours the second hypothesis.
In this study, we focus on the stable isotope compositions of the nuclei (larval stage) and of the outer parts (adult stage) of five species, in order to discriminate their growth environment.
2 Materials and methods
Otoliths (Sagittae) are coming from fishes caught in the lagoon and in the open ocean. The Taiaro atoll (15°44’S ; 144°10’W) is 5 km in diameter, with a maximum depth of 29.4 m 〚9〛. The lagoon is completely isolated from the open ocean. The temperature of the lagoon water is 30.4 °C at the surface and 29.7°C at 29.4 m depth. The salinity of the lagoon water is 42.6 ± 0.2 (‰). Ocean waters are less saline 36.6 ± 0.2 (‰) 〚9〛, which is in agreement with the tropical ocean salinity data 〚10〛. δ18O values of the lagoon waters (∼1.8‰ SMOW) are enriched by around 1‰ compared to the ocean surface water 〚7〛. δ13C values (DIC, dissolved inorganic carbon) of the ocean waters (δ13C = +1.4‰ (PDB)) are enriched by around 1.2‰ compared to the lagoon water 〚7〛.
For the stable isotope measurements, cleaned otoliths have been fixed on a thin section. The nucleus and the outer parts of the otoliths have been sampled using a dental drill (0.8 mm in diameter). In order to avoid contamination by the organic matter (< 1 wt%) the samples have been roasted at 380 °C for 45 min. Around 100 micrograms of carbonate are needed for the isotopic measurements performed on an Optima-VG mass spectrometer. The results are given in the conventional (δ ‰) notation, expressed in per mil against the V-PDB standard (Vienna Pee Dee Belemnite) 〚11〛, where:
Reproducibility is 0.04‰ and 0.05‰ respectively for the carbon and the oxygen.
C and O isotopic equilibrium have been calculated using the equation given in 〚12〛 and 〚13〛 for oxygen and carbon. For oxygen, the isotopic fractionation values or the temperatures derived from these two equations are in good agreement with those of 〚14〛 and 〚15〛.
The temperature of isotopic equilibrium can be calculated from the following equations respectively for O and C:
where δ ar and δ w represent the isotopic composition for the C or the O of the aragonite or the water.
3 Results
Stable isotopic compositions of the otoliths are given in Table 1 and shown in Fig. 1. δ18O and δ18C values of the otoliths coming from the lagoon range from –1.1 to 0.4‰ and from –7.6 to –2.8‰ (PDB) respectively. Outer parts have δ18O values between –0.8 and 0.3‰ (mean value at –0.2 ± 0.3 ‰). Nuclei have δ18O values between –1.1 and 0.1‰ (mean value at –0.3 ± 0.3‰). δ13C values of the outer parts show variation (6‰) ranging from –7.4 to –2.8‰, corresponding to a mean value of –4.6‰ (±0.8). As observed for the δ18O values, C isotopic compositions of the nuclei are slightly depleted compared with the outer parts and are in between –7.6 and –3.6‰ (mean value at –5.8‰ ± 1.1).
δ18O and δ13C of the otoliths coming from the open ocean range from –1.5 to –0.7‰ and from –7.6 to –0.5‰ (PDB) respectively. Their outer parts have δ18O values in the range of –1.5 and 0.7‰ – (mean value at 1.1 ± 0.2‰), the nuclei range from–1.5 to –1.0‰ (mean value at –1.3 ± 0.1). δ13C values of the outer parts as well as nuclei show a larger isotopic variation ranging from –5.0 to –0.5‰ and from –7.6 to –1.2‰. The difference between the δ18O values of the otoliths coming from the lagoon and from the open ocean (1‰) is similar to the difference between the lagoon water and the open seawater.
4 Discussion
Numerous authors have suggested that the otoliths reached O-isotope equilibrium during their formation. Nuclei of the otoliths (δ18O = –1.3 ± 0.1‰) from the ocean are at the O-isotopic equilibrium with ocean water at a calculated temperature of 29.2 ± 0.5 °C. This temperature corresponds, within the analytical errors, to the measured temperature at the ocean surface (Fig. 2) and implies that at least O-isotopic equilibrium is reached during the larval stage. Using the δ18O values of the outer parts of the otoliths, a slightly lower temperature is found (28.2 ± 1 °C). This temperature shift corresponds to a departure from equilibrium, of less than 0.2‰, which is interpreted in term of physiological changes between the larval and adult stage.
If we consider that the fishes of the lagoon have spent their larval stage in the open ocean, than the O-isotopic composition of the nuclei must be at the equilibrium with ocean water for a temperature of around 29 °C. Combining the δ18O values of the nuclei and the δ18O value of the ocean water, a temperature of 24.2 ± 1.3 °C (Fig. 2) is derived. This temperature is too low to be in agreement with the measured ones 〚7〛 and with the meteorological data for this area. A variation of the δ18O values of the ocean seems to be unlikely, because this would implies an enrichment of around 1‰ of the ocean water during the larval stage.
Combining the δ18O values of the nuclei of otoliths coming from the lagoon with the δ18O of the lagoon water, a temperature of 29.2 ± 1.5 °C is found. This temperature is indistinguishable from the temperature measured in the lagoon 〚7〛 and implies that the fishes found actually in the lagoon have spent the larval stage in the lagoon.
All the δ13C values of the otoliths (nuclei or outer parts) coming either from the ocean or from the lagoon show too depleted values to be at the isotopic equilibrium. This disequilibrium can reach 6 to 7‰ and cannot be explained by a variation of the temperature during the formation of the otoliths or a change in the δ13C values of the surface waters. Experimental studies 〚16〛 suggest a link between the metabolic activity and the δ13C values of the carbonates. More specifically, 〚17〛 determined that the proportion of carbon derived from the metabolism (–15 > δ13C > –25‰) is mainly function of the dietary regime and the oxygen consumption. High metabolitic activity, like in the case of reef fishes, induced depleted δ13C values of the carbonates. This can be amplified by the food source that changes from phytoplanckton (δ13C at –20 to –25‰) at the larval stage to a specific dietary regime at the adult stage. These changes are probably recorded in the δ13C values of the otoliths.
5 Conclusions
Based on the O-stable isotope compositions of otoliths, the environmental conditions, where the reef fishes have lived, can be approached. Nuclei (larval stage) of fish otoliths coming from the lagoon or the ocean are at the O-isotopic equilibrium with the surrounding waters. The δ18O values of reef fish otoliths of the lagoon are enriched by 1‰ compared to the otoliths coming from the ocean. This difference corresponds also to the O-isotopic variation between lagoon and ocean water. This demonstrates that the lagoonal population have realised a complete biological cycle without migration at the larval stage in the open ocean. The outer parts of the fish otoliths coming from the two populations show a slight departure (< 0.2‰) from the O-equilibrium, which can be related to changes between larval and adult stages.
C-isotope compositions show a strong disequilibrium either for the nuclei or the outer parts of the otoliths. The nuclei are more 13C depleted than the outer parts probably associated with changes in the metabolitic activity between larval and adult stages. This study shows that the lagoonal population is the expression of an adaptation in a closed system.



